Обзор новостей биофармы за 2023 год
29 декабря 2023
Обзор новостей биофармы за 2023 год
- 1901
- 0
- 6
В наши времена инноваций в фарме и биотехе появляется всё больше, и каждый год одобряются десятки новых препаратов, многие из которых трансформируют медицину и поражают научной изобретательностью.
Рисунок в полном размере.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редакторы
-
Иллюстратор
2023 год стал рекордным по количеству новых препаратов, одобренных FDA. Помимо одобрений, год ознаменовался множеством новостей в области клинических исследований и открытий в фундаментальной науке. Расскажем о самых ярких одобрениях, новостях клиники и биофармацевтической науки. Знаменитые обзоры биофармацевтического рынка Ильи Ясного, долгое время выходившие на портале «XX2 век», теперь перебрались на «Биомолекулу» — в спецпроект «Современные лекарства»!
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Впервые обзор полугодовых новостей фармацевтической отрасли я написал в конце 2014 года. Дело было так: в комментарии на «Фейсбуке» я покритиковал излишний оптимизм тогдашнего главного редактора «XX2 века» Дениса Яцутко — как сейчас помню, по поводу новости об очередной противораковой вакцине (кстати, спустя 11 лет ни одной раковой вакцины так и одобрено, хотя компания Moderna делает шаги в этом направлении). В ответ Денис предложил мне написать свои собственные новости, чем и взял меня «на слабо». С тех пор каждые полгода эти новости выходили на «XX2 веке», и теперь я рад представить их аудитории «Биомолекулы».
Упомянутый в тексте «Фейсбук» принадлежит компании Meta, которая признана экстремистской организацией 🤔. Деятельность запрещена на территории РФ.
Для начала пройдемся по препаратам, одобренным в этом году FDA, и по статистике этих одобрений.
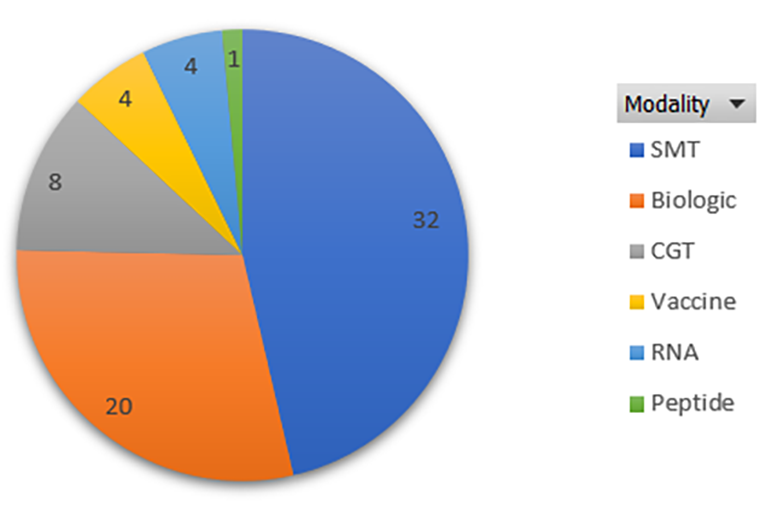
В 2023 году FDA (Управление по лекарствам и пищевым продуктам США) установило абсолютный рекорд по одобрениям новых лекарств (рис. 1) [1] — 69 (на 25 декабря 2023), из которых 8 — препараты генной и клеточной терапии (о которых «Биомолекула» пишет в особом спецпроекте: см., например, статью «Генная терапия: познакомьтесь с лекарствами будущего» [2]). Из них почти половина (34 препарата) — для лечения редких (орфанных) заболеваний (и им у нас тоже посвящен спецпроект: «Редко, но метко: орфанные заболевания как вызов современной медицине» [3]). Треть препаратов — первые в классе, то есть ранее такой механизм действия не одобрялся. 32 препарата (46%) поданы на одобрение не бигфармами, а относительно небольшими биотех-компаниями. Разбивка новых препаратов по категориям приведена на рис. 2. Как видно из рисунка, доминируют препараты для лечения редких генетических заболеваний, на втором месте онкология, на третьем — препараты для лечения воспалительных и аутоиммунных заболеваний.
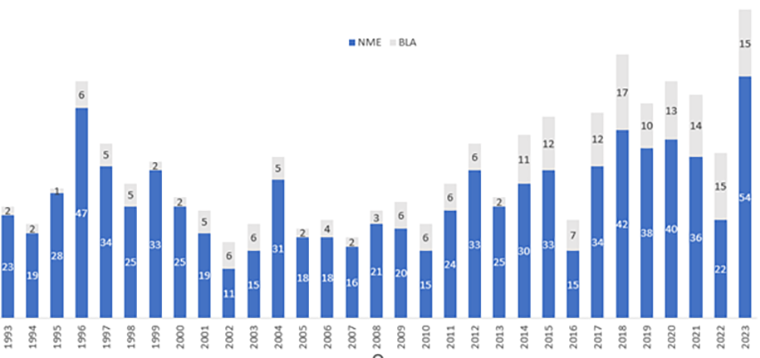
Рисунок 1. График одобрений FDA по годам с 1993 по 2023 год, который стал рекордным.
NME — new molecular entities, включающие низкомолекулярные вещества, биопрепараты (ферменты, антитела), пептиды, РНК-препараты.
BLA — biological license application, включающие клеточные и генные терапии и вакцины.
На рисунке 3 показана разбивка препаратов по типам. Больше всего одобрено низкомолекулярных лекарств, за ними следуют биопрепараты (антитела и другие белки), на третьем месте — генная и клеточная терапия. Чтобы разобраться, откуда взялась такая классификация, приглашаем прочитать нашу статью «Три поколения лекарств» [4].
Пройдемся по самым заметным одобренным препаратам, которые обещают в наибольшей степени трансформировать медицину и здравоохранение.
Препараты от ожирения
Несомненно, наиболее яркие новости года были связаны с препаратами для лечения диабета 2 типа и ожирения, которым прочат мегаблокбастерное будущее. Журнал Science назвал их научным прорывом года [5] — что нашло отражение и в итоговом дайджесте «Биомолекулы» с итогами года [6]. Ожирением страдает большинство людей в развитых странах, оно же является фактором риска для таких заболеваний, как инсульты, инфаркты, рак, диабет 2 типа и ряда других. Долгое время достаточно безопасные препараты для лечения ожирения не удавалось создать, и ситуация изменилась только в 2014, когда препарат для лечения диабета 2 типа лираглутид (Novo Nordisk) был одобрен FDA также против ожирения. Однако настоящая революция началась в 2021, когда FDA одобрило против ожирения улучшенную версию лираглутида — семаглутид. Он показал впечатляющие 15% снижения массы тела у участников исследования в среднем на протяжении 16 месяцев. Спрос на препарат возрос настолько, что у Novo Nordisk возник дефицит лекарства, и компании пришлось открывать новые производственные мощности, а ее рыночная капитализации превысила ВВП Дании (откуда компания родом) [5].
Продажи более $10 млрд в год.
В 2023 году вышли результаты исследования на 17 000 пациентах с избыточным весом и сердечно-сосудистыми осложнениями [7], которое показало снижение главных нежелательных сердечно-сосудистых явлений (major adverse cardiac events, MACE — инфаркты, инсульты, смерти от сердечно-сосудистых причин) на 20% у пациентов, принимавших семаглутид, по сравнению с плацебо. Это вполне на уровне других сердечно-сосудистых препаратов. Можно было бы предположить, что такой эффект связан исключительно со снижением веса, но другие исследования указывают на то, что препараты подобного класса также снижают давление, уровень триглицеридов и «плохого» холестерина (LDL-C) [8] — то есть, возможно, действуют независимо от снижения веса.
Семаглутид является синтетическим агонистом рецепторов GLP-1 [9] — это пептид, влияющий на усвоение пищи, метаболизм, ощущение голода. Компания Eli Lilly разработала препарат тирзепатид, который действует как на рецепторы GLP-1, так и на рецепторы еще одного пептида — GIP. Такое двойное действие позволило добиться еще большего снижения веса [10] — в среднем на 20%. Тирзепатид, ранее одобренный по диабету 2 типа, в 2023 году получил одобрение и по ожирению.
Есть предпосылки, что препараты этого класса могут оказывать влияние и на другие органы — почки, печень и т. д. (рис. 3) [11], вплоть до потенциального лечения алкогольной зависимости [12].
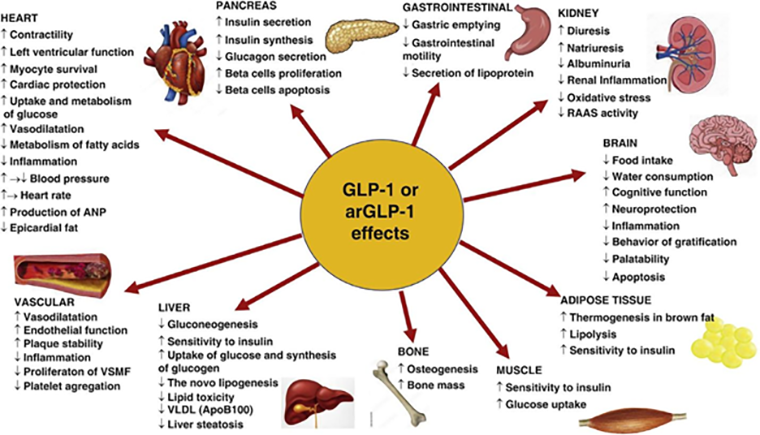
Рисунок 3. Влияние агонистов GLP-1 на различные органы.
В разработке находятся тройные ингибиторы (затрагивающие еще один аналогичный рецептор, GCGR) [13] и пероральные аналоги, которые удобнее, чем существующие подкожные.
Однако в бочке меда есть и ложка дегтя: часть пациентов не переносит препарат, у них развиваются нежелательные явления в виде тошноты, диареи и других эффектов со стороны ЖКТ. Есть опасения по поводу долговременной безопасности — у животных наблюдались случаи рака щитовидной железы, возможно развитие панкреатита, есть опасения по поводу суицидальных наклонностей, но врачи и регуляторные агентства постоянно собирают информацию и проводят дополнительную оценку соотношения пользы и риска. Препараты пока довольно дороги — более $1000 за месячный курс, и показаны только пациентам с индексом массы тела более 30. Хотя они должны назначаться врачом, известно, что многие люди, желающие похудеть, колют их себе сами. Еще один недостаток препаратов этого класса — необходимость пожизненного применения. Так, через год после отмены препарата пациенты набрали обратно в среднем две трети потерянного веса, а сердечно-сосудистые показатели вернулись к уровню до начала лечения [14].
Тем не менее, несмотря на все сложности, прогнозируемый объем рынка препаратов этого класса — почти $80 млрд к 2030 году. Пока непонятно, как системы здравоохранения и страховые справятся с покрытием этих расходов, однако нужно также учитывать, что эти затраты, скорее всего, будут оправданы. Так, было посчитано, что только в США избыточные расходы на лечение болезней, связанных с ожирением, составили $170 млрд в 2019 г [15].
Альцгеймер: успех или пустая надежда?
Болезнь Альцгеймера — страшный недуг, поражающий в основном пожилых людей и приводящий к быстрой деградации умственных способностей, памяти и в итоге — к преждевременной смерти [16]. Причины болезни пока непонятны, а механизм развития изучен недостаточно, чтобы создавать мало-мальски эффективные лекарства. Уже давно — в начале 1990-х годов — было замечено, что в мозгу многих больных накапливаются бляшки, состоящие из пептидов, — так называемые амилоидные бляшки. Началась разработка лекарств, направленных на их снижение. Однако целый ряд таких препаратов потерпел провал в клинических исследованиях — даже если удавалось снизить содержание бляшек в мозге, это не приводило к улучшению когнитивных способностей пациентов. В 2021 году ускоренное одобрение FDA получило антитело Адухельм (адуканумаб) компании Biogen — несмотря на то, что в обоих регистрационных исследованиях оно не смогло показать значимого улучшения состояния больных, а независимая комиссия проголосовала против его одобрения. Американская государственная организация Centers for Medicare and Medicaid Services (CMS), отвечающая за покрытие лекарств страховкой, отказалась оплачивать лечение адуканумабом, и в итоге он сейчас не применяется.
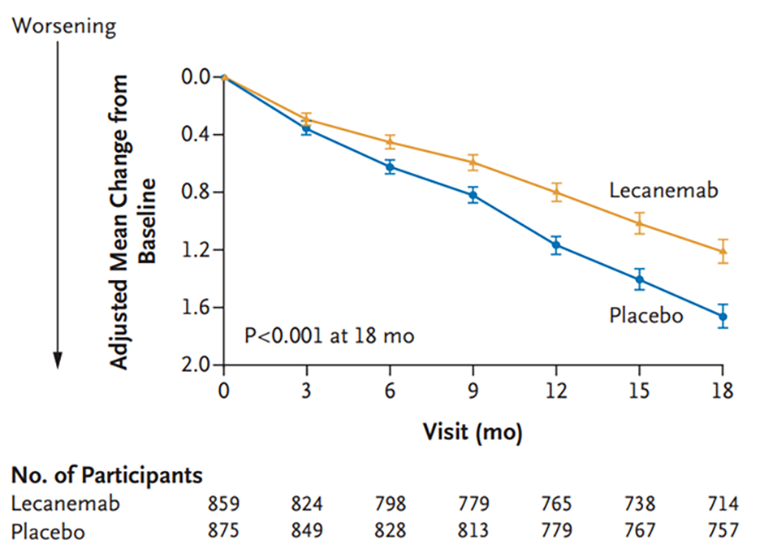
Рисунок 4. Изменения по шкале CDR-SB в группах леканемаба и плацебо.
Неясно, почему исследователи изначально установили такой низкий порог клинической значимости, ведь предыдущие исследования показывали, что различия должны быть не менее 1–2 баллов [18]. В реальных условиях 0,45 балла могут превратиться в совершенно незначимое преимущество, и, будь препарат совершенно безопасным, это было бы полбеды. Но применение всех анти-амилоидных антител ассоциировано с редкими случаями отека мозга, которые иногда приводят к смерти.
На пятки леканемабу наступает донанемаб компании Eli Lilly, который показал снижение на 0,7 баллов по той же шкале по сравнению с плацебо [19]. В январе FDA отклонило заявку компании на ускоренную регистрацию на основании данных фазы 2, ссылаясь на недостаточное количество пациентов. Компания собрала нужные данные, подала документы на регистрацию, и решение FDA ожидается в начале 2024 года.
Некоторые аналитики считают, что к 2028 году эти два препарата будут продаваться на $12,9 млрд. Насколько они действительно окажутся успешными в реальном применении — покажет время, но это в любом случае важный шаг, который помогает продвинуться в понимании патогенеза болезни.
Вакцины против RSV
Респираторный синцитиальный вирус (RSV) вызывает обычную простуду у взрослых здоровых людей, но может быть смертельно опасным для новорожденных и пожилых. По подсчетам ВОЗ, от него умирает около 160 000 человек каждый год. Еще в 1960-х годах пытались разработать вакцину против RSV, но она только ухудшала течение заболевания и привела к смерти двоих детей [20]. После десятков провалов к 2010-м годам научный прогресс позволил создать безопасные и эффективные вакцины, которые были одобрены в 2023 году [21].
Успеха удалось добиться сразу двум компаниям: GlaxoSmithKline с препаратом Arexvy, одобренным для людей старше 60 лет, и Pfizer, который для своей вакцины Abrysvo добился одобрения и у пожилых, и у беременных — для профилактики RSV у новорожденных. Эффективность обеих вакцин довольно высока: риск развития тяжелого респираторного заболевания снижается на 94% для Arexvy, на 86% для Abrysvo у пожилых и на 82% у новорожденных после иммунизации беременных. Moderna создала свою вакцину против RSV на той же платформе, что ковидная вакцина, и продемонстрировала в клиническом исследовании эффективность 83,7% и высокую безопасность (в отличие от двух других вакцин, в исследовании не было случаев энцефаломиелита и синдрома Гийена—Барре). Ее одобрение ожидается в 2024 году.
Для новорожденных вакцинация недоступна, потому что у них еще не вырабатывается достаточный иммунный ответ, но у них уже много лет есть опция пассивной иммунизации с помощью антитела Синагис (паливизумаб, AstraZeneca). В 2022 году в ЕС, а в 2023 — в США одобрена его улучшенная версия Beyfortus (nirsevimab), разработанная AstraZeneca совместно с Sanofi. В отличие от Синагиса, который должен вводиться ежемесячно, одной инъекции нового препарата достаточно для защиты от инфекции на уровне 70–75%, поэтому в США его уже рекомендуют всем детям до 8 месяцев.
Череда успехов генной и клеточной терапии
2023 год продолжил тенденцию 2022-го и ознаменовался рядом одобрений в области генной и клеточной терапии — нового типа лекарств, с которыми связывают надежды на излечение многих редких и не столь редких заболеваний.
Первое одобрение генного редактирования
Наиболее значимым стало одобрение терапии серповидно-клеточной анемии компаний CRISPR/Vertex — это первый препарат, полученный с помощью геномного редактирования методом CRISPR/Cas9 (о нем подробно рассказывается в статье «Как болезни крови генной терапией лечили» [24]). Препарат был одобрен сначала в Великобритании 16 ноября, а затем в США 8 декабря. Поразительно, что с момента открытия CRISPR/Cas9 до регистрации препарата на основе технологии прошло всего 11 лет.
В США одновременно с CRISPR/Vertex была одобрена генная терапия всё той же серповидно-клеточной анемии от компании Bluebird bio (одного из пионеров в области генной терапии). Интересно, что CRISPR/Vertex установили цену на препарат в размере $2,2 млн за инъекцию, тогда как Bluebird — в $3,1 млн, при том, что негосударственный институт ICER, который занимается фармакоэкономическим анализом [25] в США, подсчитал, что с точки зрения соотношения затрат и эффективности оправданная цена на оба препарата лежит в диапазоне $1,35—$2,05 млн. Как препараты будут делить рынок — пока непонятно, у каждого из них есть преимущества и недостатки. Так, у Bluebird дольше период наблюдения за пациентами и есть опыт коммерциализации продукта по бета-талассемии, но вместе с одобрением компанию ждал неприятный сюрприз: продукт получил black box warning («предупреждение в черной рамке») об опасности развития вторичных онкогематологических заболеваний. Действительно, в ходе клинических исследований два пациента заболели острым миелоидным лейкозом, хотя потом эти случаи были сочтены несвязанными с терапией. У CRISPR тоже существует теоретический риск нецелевого редактирования генома, хотя на практике такого пока не наблюдалось. Согласно опросам, 60–80% врачей не видят практической разницы между двумя терапиями.
Как бы то ни было, эти одобрения — важная веха и для пациентов с серповидно-клеточной анемией, которые получают возможность отказаться от постоянных переливаний крови и болезненных приступов благодаря всего одному уколу, и для области генной терапии в целом. Серповидно-клеточная анемия — гораздо более распространенное заболевание, чем предыдущие болезни, против которых регистрировались генные терапии, так что речь идет о расширении возможностей нового подхода.
В марте 2024 ожидается решение FDA по поводу терапии CRISPR/Vertex по схожему показанию — бета-талассемии. Препарат Bluebird уже получил одобрение по нему в 2022 году.
Гель с генной терапией
Интересный случай применения генной терапии — топический продукт компании Krystal Biotech для лечения буллезного эпидермолиза [27]. Во-первых, это первая одобренная генная терапия, которая представляет собой гель, а не инъекцию. Во-вторых, в отличие от других генотерапевтических продуктов, которые преимущественно используют аденоассоциированные вирусы для доставки генетических конструкций в клетки человека, продукт Krystal использует вирус герпеса (рис. 6). Остроумное решение, учитывая патогенез буллезного эпидермолиза: при этой болезни в клетках кожи дефектен ген коллагена-7, а ведь вирус герпеса как раз «заточен» на то, чтобы заражать клетки кожи. Отсутствие коллагена-7 приводит к отслаиванию и повреждению кожи при малейшем трении (поэтому буллезный эпидермолиз также называют «болезнь бабочки»), что грозит постоянными инфекциями, повышает вероятность развития рака кожи и преждевременной смерти.
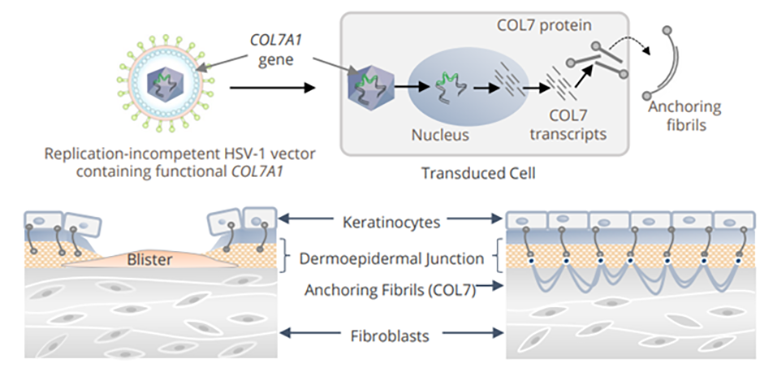
Рисунок 6. Вектор на основе вируса герпеса попадает в клетку, начинает выработку коллагена-7, который образует фибриллы, связывающие внешние слои кожи с внутренними.
Терапия Krystal, в отличие от других генных терапий, не одноразовая, а требует постоянного введения раз в неделю, потому что вирус герпеса там не способен размножаться — он лишь доставляет работающую копию гена коллагена-7 в клетки. В исследовании на 31 пациенте раны закрылись у 65% пациентов по сравнению с 26% в группе плацебо. Компания сообщила, что терапия будет стоить $631 000 в год.
Генный препарат против миодистрофии Дюшенна
Миодистрофия Дюшенна — крепкий орешек для фармкомпаний [28]. Она вызывается мутациями в белке дистрофине — а это самый большой белок в организме человека, отвечающий за функционирование мышц. Его дефекты приводят к прогрессирующей мышечной слабости, больные редко доживают до 40 лет. Начиная с 2016 года появляются препараты для лечения этой болезни, но пока ни одному из них не удалось добиться серьезной задержки развития болезни.
Компания Sarepta в июне 2023 года получила ускоренное одобрение FDA первой генной терапии миодистрофии Дюшенна. Такое одобрение выдается на условиях продолжения исследований, и при получении положительных результатов в контролируемом исследовании может быть превращено в полное. Если же результаты получатся отрицательными — одобрение могут отозвать. В октябре компания опубликовала результаты исследования, где первичная конечная точка исследования (разница в баллах с плацебо по шкале моторных функций) не достигла статистической значимости. То есть формально исследование провалилось, но все вторичные точки указывают на некоторое превосходство препарата над плацебо. Компания планирует подать эти данные в FDA и получить полное одобрение. Впрочем, даже с ускоренным одобрением компания имеет право продавать лекарство, а цена на него установлена немаленькая — $3,2 млн.
Для Sarepta подобная стратегия становится обычным делом — свое первое, очень противоречивое, одобрение компания получила в 2016 году для препарата eteplirsen. Механизм его действия очень интересен — это молекула РНК, которая заставляет рибосому пропускать дефектный участок мРНК, соответствующий мутации в гене дистрофина. Однако исследование было проведено всего лишь на 12 пациентах и показало весьма скромные результаты. Тем не менее, во многом под давлением пациентских организаций, FDA выдало препарату ускоренное одобрение. Хотя компания должна была провести подтверждающее исследование к 2020 году, она так этого и не сделала, и его результаты будут доступны не ранее 2024 года [29]. При этом продажи препарата стоимостью $300 000 в год приносят компании немалые доходы. В 2019 и 2021 году по той же схеме было зарегистрировано еще два препарата.
Первый микробиомный препарат
В последние годы много говорят о микробиоме человека как о важной составляющей в здоровом и больном состоянии. Появляются исследования о влиянии кишечного микробиома буквально на всё: от рака до аутизма [31]. Однако несмотря на обилие информации, в большинстве случаев пока неясно, как устроена причинно-следственная связь и как воздействовать на микробиом, чтобы улучшить состояние больных. За одним исключением — рекуррентная инфекция Clostridioides difficile. Это условно-патогенная бактерия, которая в норме живет в кишечнике, не вызывая проблем, но при приеме антибиотиков, особенно в больничных условиях, когда человек принимает сразу несколько препаратов, бактерия может активизироваться, размножиться и вызвать тяжелую диарею и воспаление кишечника вплоть до смерти. Только в США от этой инфекции умирает 20 000 человек в год. В 2013 году в небольшом исследовании была показана эффективность фекальной трансплантации (пересадки кала) для лечения рекуррентной инфекции C. diff. Фекальная трансплантация — давно известный метод (впервые описанный аж в IV веке в Китае) [32]. Но он не слишком технологичен, хотя в США и Европе созданы целые хранилища кала, куда его могут сдать здоровые добровольцы. FDA выпускало несколько предупреждений, касающихся передачи устойчивых к антибиотикам бактерий через донорский кал. В ноябре 2022 года компания Ferring получила одобрение своего продукта по пересадке кала.
Компания Seres пошла по более технологичному пути (рис. 7): их продукт представляет собой очищенные бактерии, выделенные из кала здоровых доноров, в капсуле для перорального применения — в отличие от фекальной трансплантации, которая, как правило, производится ректально. Несмотря на первые неудачи в клинических исследованиях, компания не растерялась, увеличила дозу препарата и провела исследование фазы 3, которое оказалось успешным. Среди пациентов, принимавших препарат, через 8 недель только у 12% инфекция C. diff рецидивировала, тогда как в плацебо-группе таких было 40%. Безопасность лечения не отличалась от плацебо.
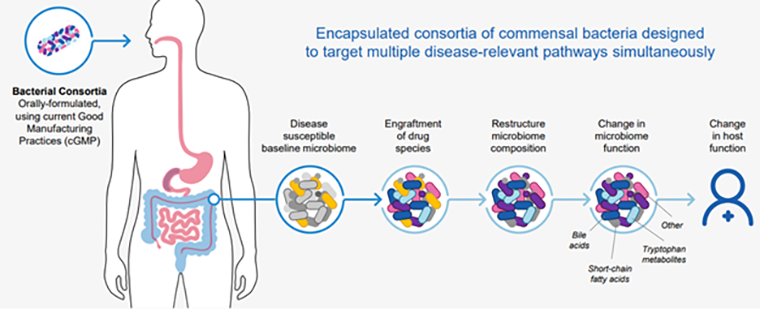
Рисунок 7. Общая идея компании Seres — подселить в кишечник больного с нарушенным микробиомом бактерии здорового человека, чтобы они там размножились и оказали воздействие на течение заболевания.
Продукт Seres был одобрен в 2023 году. Для коммерциализации Seres вступила в сотрудничество со швейцарским пищевым гигантом Nestlé, который уже продает пробиотики и пищевые волокна.
К сожалению, другие микробиомные препараты пока не показали достаточной эффективности, хотя их пытались исследовать по воспалительным заболеваниям кишечника, аутизму и ожирению. Но попытки продолжаются, исследований микробиома всё больше, и, возможно, новые препараты этого типа не за горами.
Географическая атрофия
На время отвлечемся от передовой терапии и переключимся на более «обычный» препарат — pegcetacoplan компании Apellis, одобренный в 2021 году по редкому заболеванию крови, пароксизмальной ночной гемоглобинурии; а в 2023 — по глазному заболеванию географической атрофии. Он стал первым одобренным лекарством, действующим на патогенез географической атрофии — глазного заболевания, при котором отмирают клетки участка сетчатки — желтого пятна, которое отвечает за центральное зрение. Географической она называется потому, что картина сетчатки начинает напоминать географическую карту (рис. 8).
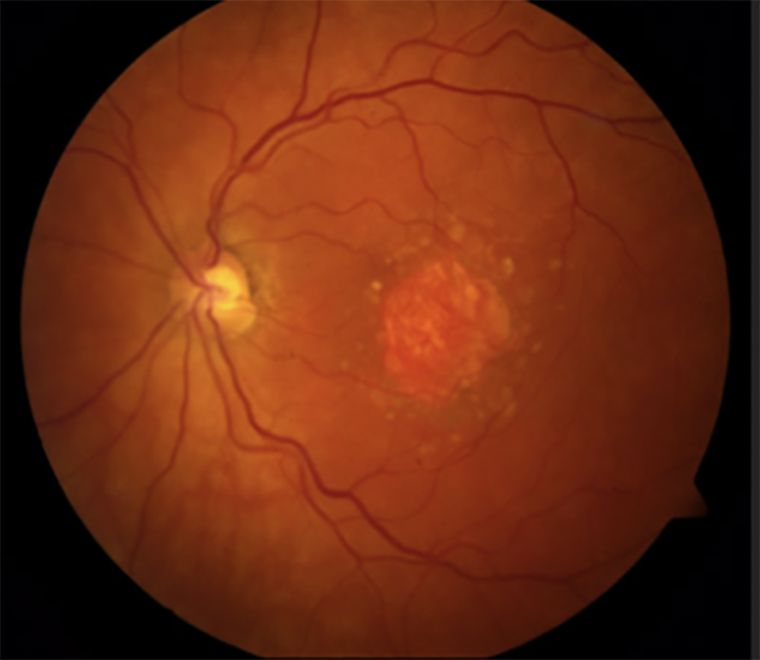
Рисунок 8. Картина поражения сетчатки при географической атрофии.
Как же так получилось, что при столь различных заболеваниях помогает один и тот же препарат? Дело в том, что в обоих случаях в патогенезе заболевания ключевую роль играет система комплемента, чья избыточная активация приводит к гибели клеток (в норме система комплемента играет важную роль в защите организма от патогенов). Pegcetacoplan связывает один из основных белков системы комплемента С3 и представляет собой два идентичных пептида, соединенных мостиком из полиэтиленгликоля. В клинических исследованиях препарат показал способность затормаживать рост поврежденной зоны сетчатки на 36%. Это, к сожалению, пока что не способно вернуть людям зрение, но в такой сложной области любой успех имеет большую ценность. Аналитики предсказывают продажи препарата в $2,6 млрд к 2028 году.
Механизм действия препарата позволяет надеяться, что он поможет и при других болезнях, где наблюдается избыточная активация комплемента, таких как боковой амиотрофический склероз, гломерулонефриты и другие.
Спустя буквально несколько месяцев был одобрен второй препарат против географической атрофии — РНК-аптамер avacincaptad pegol (Astellas/Iveric), действующий на другой белок системы комплемента — С5. Avacincaptad стал вторым препаратом класса РНК-аптамеров, одобренным FDA. Предыдущий — pegaptanib (Pfizer/Eyetech) — был одобрен 19 лет назад, в 2004 году [33], по влажной форме возрастной макулярной дегенерации (глазное заболевание, для которого характерно прорастание сосудов в сетчатке), но не смог завоевать значительную долю рынка. Аптамеры считались перспективным классом препаратов в начале 2000-х благодаря кажущейся простоте разработки — они представляют собой одноцепочечную ДНК или РНК, которую с помощью скрининга подбирают таким образом, чтобы она избирательно связывалась с мишенью и, например, блокировала взаимодействие двух белков. Однако в целом они проиграли конкуренцию антителам, которых на рынке уже почти 200. Время покажет, удастся ли новому аптамеру переломить эту тенденцию.
С5 — известная мишень: антитело Солирис (экулизумаб) против белка комплемента С5 компании Alexion (приобретена AstraZeneca в 2020 за $39 млрд) было одобрено еще в 2007 по пароксизмальной ночной гемоглобинурии и стало блокбастером, потом получило несколько одобрений по другим показаниям (однако именно при географической атрофии не показало эффективности [34]). Позже Alexion выпустил улучшенный аналог Солириса — Ультомирис (равулизумаб). Компания ChemoCentryx (приобретена Amgen в 2022 году за $3,7 млрд) выпустила avacopan — низкомолекулярный ингибитор рецептора C5aR против редкой болезни сосудов: АНЦА-ассоциированных васкулитов.

Рисунок 9. Лекарства, воздействующие на систему комплемента. APL-2 — pegcetacoplan, LNP023 — iptacopan.
2023 год ознаменовался одобрением еще нескольких лекарств против комплемента (рис. 9) [35]: было одобрено еще одно антитело против C5 — pozelimab (Regeneron) против редкого генетического синдрома CHAPLE, который приводит к гиперактивации комплемента [36]. А компания UCB добилась одобрения циклического пептида Zilucoplan, который также связывается с С5, по показанию миастении гравис (аутоиммунное заболевание, приводящее к развитию мышечной слабости).
Также в 2023 году FDA одобрило еще одно лекарство против пароксизмальной ночной гемоглобинурии, тоже подавляющее комплемент — iptacopan компании Novartis, действующий против фактора В, который отвечает за расщепление C3.
Теперь от новостей об одобрениях перейдем к клиническим и научным новостям.
CAR-T в аутоиммунных заболеваниях
Под конец года на одной из крупнейших конференций в США — ASH (American Society of Hematology) — наделали шуму новости из области клеточной терапии аутоиммунных заболеваний. CAR-T уже стали стандартной терапией в третьей линии лечения (то есть после неуспешной химиотерапии и последующей неуспешной трансплантации костного мозга) ряда лейкемий, лимфом и множественной миеломы, и даже показали преимущество перед трансплантацией костного мозга при В-клеточной лимфоме; однако в онкологии за пределами онкогематологии пока не проявили достаточной эффективности и безопасности. Их применение при аутоиммунных заболеваниях оправданно, потому что они способны эффективно уничтожать В-клетки, которые производят антитела, нападающие на собственные ткани человека (рис. 10) [37].
Chimeric Antigen Receptor T-cell — Т-клетки с химерным антигенным рецептором. Их получают путем отбора у пациента Т-клеток и их генетической модификации с целью экспрессии на поверхности CAR-рецептора против раковых клеток. После введения в организм пациента эти Т-клетки избирательно уничтожают раковые.
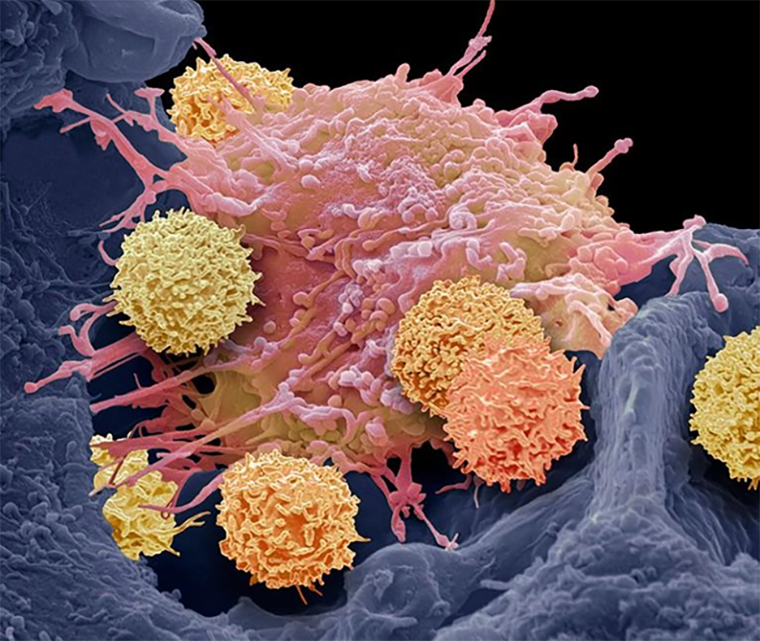
Рисунок 10. Раскрашенная сканирующая электронная микрофотография Т-клеток (маленькие шарики), атакующих большую опухолевую клетку.
В исследовании участвовало 15 пациентов с не поддающимися лечению аутоиммунными заболеваниями: системной красной волчанкой [38] (8 человек), идиопатической воспалительной миопатией (3 человека) и системным склерозом [39] (4 человека). После единственной процедуры введения CAR-T у всех наступило улучшение или полное исчезновение симптомов болезни. Все пациенты смогли перестать принимать иммуносупрессорные препараты. При этом половина пациентов прошли процедуру уже 1–2 года назад. О единичных случаях лечения аутоиммунных заболеваний с помощью CAR-T сообщали и раньше [37], но это первое такое длинное и большое исследование. Результаты впечатляют: пациенты, которые едва могли ходить, теперь бегают каждый день.
Впереди еще длинный путь: предстоит доказать эффективность и безопасность такого метода на больших когортах пациентов при длительном наблюдении. Кроме того, перед введением CAR-Т пациенты проходят довольно тяжелую процедуру химиотерапии, чтобы обеспечить «приживление» новых клеток. Некоторые исследователи считают, что по крайней мере часть эффективности может объясняться тем, что при этом погибают аутоиммунные В-клетки. Тем временем многие CAR-T компании, до этого работавшие в области онкологии, запускают клинические программы по аутоиммунным заболеваниям.
Теперь расскажем о более фундаментальных исследованиях, которые пока не привели к появлению новых лекарств, но закладывают основу для этого в будущем.
Самая подробная карта мозга
Человеческий мозг — не только самый сложный орган в нашем организме, но и самый сложный объект из известных нам во вселенной. Мало того, что он состоит из 86 миллиардов нейронов (и такого же количества вспомогательных клеток), так они еще связаны друг с другом десятками, иногда сотнями и тысячами связей, которые к тому же постоянно появляются и исчезают. Именно такая сложность затрудняет разработку лекарств против расстройств высшей нервной деятельности, не говоря уже о том, что нам пока недоступно понимание проблемы сознания.
Для сравнения, в нашей галактике 100–400 миллиардов звезд, то есть порядок примерно такой же.
Для того, чтобы как-то подобраться к этим проблемам, учеными в США и ЕС в 2017 был запущен проект по «переписи» и картированию всех клеток мозга. В 2023 году в журналах группы Science вышла 21 публикация о промежуточных результатах этих амбициозных усилий. Проект ставит перед собой несколько целей — картирование мозга человека и обезьян, анализ различий между ними, классификация нейронов по форме и функциям у человека и грызунов, изучение траекторий развития клеток на уровне отдельных нейронов. Такой проект стал возможным только благодаря развитию современных методов работы с отдельными клетками, анализа ДНК и РНК, визуализации и, конечно, вычислительных методов.
Для определения типов клеток из 106 областей мозга было выделено более 3 млн клеток, их РНК отсеквенирована (то есть определена последовательность нуклеотидов мРНК). Результатом стало выделение аж 3313 типов нейронов, отнесенных к 461 категории (рис. 11) [40]. Для ученых стало сюрпризом то, что особенное разнообразие нейронов наблюдается в глубоких, эволюционно древних структурах мозга — среднем мозге, стволе — а вовсе не в передних долях, которые отвечают за высшую нервную деятельность.

Рисунок 11. Трехмерная реконструкция нейронов, полученных из живых срезов мозга. Разнообразие форм и условных цветов иллюстрирует широкий диапазон типов нейронов.
Отдельная группа занимается динамикой развития мозга, картируя мозги людей разных возрастов — от еще нерожденного плода до пожилых. Важную информацию также дает сравнение мозгов здоровых и больных людей. Определенные типы клеток и профили экспрессии белков в них ассоциированы с нейропсихиатрическими заболеваниями, такими как биполярное расстройство, депрессии, аутизм, шизофрения. Возможно, в будущем благодаря этой информации удастся подобраться к рациональной разработке лекарств против этих заболеваний.
Работа продолжается — так, у мышей обнаружено уже 5000 типов клеток; предположительно, у людей должно быть не меньше [42]. Ученые подчеркивают, что это только начало, и сравнивают проект с «Геномом человека» — тот тоже не привел к немедленной трансформации медицины, но заложил важную основу, без которой теперь не обходится ни один проект по разработке лекарств.
Искусственные эмбрионы приоткрывают тайны раннего развития
Ученые сразу двух коллективов сообщили в 2023 году о похожих достижениях: им удалось из взрослых клеток человеческой кожи получить искусственные эмбрионоподобные структуры, которые во многих аспектах воспроизводят настоящий человеческий эмбрион. Пока что эти модели неспособны имплантироваться и превращаться в настоящие, но являются полезным инструментом для изучения раннего эмбрионального развития, тестирования лекарств, а в будущем, возможно, смогут стать источником органов для трансплантации. Ближайшая задача исследователей — разобраться в деталях, по какой причине происходит отторжение имплантации эмбрионов при выкидыше.
Первая группа ученых из института Вейцмана (Реховот, Израиль) ранее уже провела похожие эксперименты с мышиными аналогами эмбрионов [43], а теперь опубликовала результаты исследований с человеческими клетками [44]. Сначала ученые получили плюрипотентные клетки (они пробовали как брать клеточные линии, так и получать клетки из тканей взрослых людей). Затем были подготовлены клетки трех типов, соответствующие трем типам клеток в эмбрионе (эпибласт, гипобласт, трофобласт). Самое интересное, что клетки после смешивания безо всяких внешних воздействий и без дополнительной модификации к 14 дню образовали структуры, которые наблюдаются у обычных эмбрионов — амниотическую полость, желточный мешок и плаценту (рис. 12).
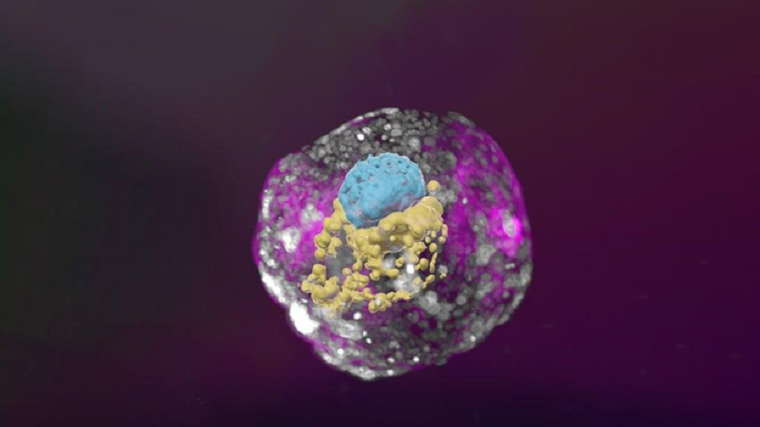
Рисунок 12. Трехмерное изображение эмбрионоподобной структуры, полученной группой института Вейцмана. Возраст — 14 дней. Голубой цвет — эмбриональный диск, желтый — желточный мешок, розовый — амниотическая полость.
Эти клетки даже стали выделять гормон хорионический гонадотропин, по которому обычно диагностируют беременность [45]. Правда, эффективность протокола всё еще довольно низка — только в 1–1,5% случаев из клеток удалось получить развивающиеся эмбрионоподобные структуры.
Другой коллектив исследователей из университета Питтсбурга (Пенсильвания, США) также использовал взрослые клетки кожи, однако сначала из них получили индуцированные плюрипотентные стволовые клетки (ИПСК) по технологии, за которую в 2012 году была вручена Нобелевская премия [46]. Затем эти ИПСК были модифицированы генетически. Исследователи говорят, что они не ставили своей целью воспроизвести органы настоящего эмбриона, поэтому их структуры не содержат плаценты и закрытого желточного мешка. Зато у них получилось создать в эмбриональных структурах островки гемопоэза (кроветворения), которые начали порождать предшественники клеток костного мозга, эритроцитов и лимфоцитов. Такая модель позволит тестировать лекарства, изучать токсичность в отношении эмбрионального развития и отвечать на фундаментальные вопросы в области эритропоэза.
Искусственные эмбрионы — единственный способ «рассмотреть» ранее развитие эмбрионов. Исследования абортивного материала затруднены, так как тут возникают вопросы согласия, доступности и свежести материала. С другой стороны, очевидно, что получение полноценных эмбрионов из клеток — вопрос времени, поэтому получение искусственных эмбрионов ставит еще более сложные этические вопросы. В настоящий момент в США Национальные институты здоровья не финансируют разработки в области человеческих эмбрионов.
Клетки, управляемые электричеством
Ученым из Швейцарии удалось совместить разные миры — микроэлектронику и живую клетку — для решения важной практической задачи. В качестве переключателей работы генов давно научились использовать химические вещества и свет, но попытки создать надежный электрогенетический интерфейс наталкивались на сложности: ненадежность, токсичность для клеток и сложность в реализации.
В новой работе ученые добились того, что простой источник постоянного тока вызывал в человеческих клетках экспрессию инсулина, причем для устойчивой экспрессии в течение 4 часов было достаточно стимуляции источником тока 5 В (три батарейки ААА или две плоские CR2032) в течение 15–20 секунд [47]. Принцип стимуляции заключается в выработке свободных форм кислорода (АФК) в ходе электрической стимуляции клеток. В качестве сенсора АФК используется белок KEAP1, который в отсутствие АФК находится в комплексе с транскрипционным фактором Nrf2, а под действием АФК отделяется от него. Nrf2 переходит в ядро и связывается со своим промотором, запуская экспрессию нужного белка (рис. 13).

Рисунок 13. Схема работы электрогенетического интерфейса. PDART — промотор, активируемый Nrf2. GOI — gene of interest, в данном случае ген инсулина. Звездочки — секретируемый инсулин.
Исследователи имплантировали мышам с моделью диабета 1 типа генно-инженерные клетки, способные продуцировать инсулин в ответ на электростимуляцию. Затем каждый день в течение 5–20 секунд стимулировали клетки электрическим током от батареек и наблюдали нормализацию уровня инсулина и глюкозы в крови. При этом стимуляция не вызывала никаких нежелательных эффектов в окружающих тканях.
Разумеется, это только демонстрация принципа, и помимо инсулина такой подход можно распространить на продукцию широкого спектра белков в организме.
Нанопоровое секвенирование белков
Секвенирование ДНК с помощью нанопор стало уже обычным делом — компания Oxford Nanopore продает компактные устройства, которые можно использовать для секвенирования длинных участков ДНК [48]. Основная особенность метода — то, что при этом не требуется амплифицировать ДНК: определение нуклеотидов происходит «напрямую». Однако если более традиционное секвенирование ДНК с амплификацией уже давно обеспечивает достаточно надежное определение последовательности практически любой ДНК (за редкими исключениями), то в случае белков ситуация гораздо более сложная и в общем случае не решена [49] — для этого требуется сочетание масс-спектрометрии, гель-электрофореза и других трудоемких и плохо автоматизируемых методов. ДНК заряжена отрицательно, и заряд распределен равномерно по всей длине цепи; белковая цепь же может быть заряжена как угодно и норовит свернуться в трехмерную структуру. В 2023 году была опубликована работа ученых, которым удалось протащить белковую цепь через нанопору, создав направленный электроосмотический поток [50].
Для этого они использовали порообразующий бактериальный токсин CytK, введя внутри поры дополнительные отрицательные заряды и удалив положительные. Ученые рассчитали, что внутри поры необходимо создать как минимум три отрицательно заряженных кольца на расстоянии не менее 5 нм друг от друга. Они протащили сквозь нанопору полностью денатурированные в мочевине линеаризованные модельные полипептиды, а также мальтоза-связывающий белок и глюкоза-связывающий белок. Задача детекции отдельных аминокислот пока не решена — 20 остатков и их посттрансляционные модификации — это тоже намного сложнее, чем 4 основания в ДНК.
Одновременно другой группе ученых также удалось добиться линеаризации белков и их транслокации через нанопору стафилококкового альфа-гемолизина [51]. Им даже удалось продемонстрировать детекцию посттрансляционных модификаций (рис. 14) [52].

Рисунок 14. Пропускание белка через нанопору с детекцией посттрансляционных модификаций.
Когда технология нанопорового секвенирования белков будет отточена, это может намного упростить протеомный анализ белковых смесей и открыть новые возможности изучения белкового разнообразия живых организмов.
Биологическая камера хранит информацию в ДНК
Еще один интересный пример интеграции между цифровым и биологическим миром — работа ученых по записи изображений в ДНК. Посредником тут послужила светочувствительная рекомбиназа, которая в ответ на облучение синим цветом редактирует цепь ДНК.
В каждой лунке 96-луночного планшета находятся бактерии E. coli с последовательностями LoxP. Если лунку облучить синим цветом, бактерия потеряет сайт LoxP, и позже с помощью ПЦР можно понять, была лунка облучена или нет. Таким образом, каждая лунка представляет собой один бит, или пиксель. Для сохранения пространственной информации применили систему ДНК-баркодинга, которая при последующем секвенировании позволяет извлечь информацию о местонахождении пикселя и о его состоянии (0 или 1) с точностью около 90%. Компьютерные методы обработки полученной информации позволяют довести точность декодирования почти до 100%.
Благодаря баркодингу, можно смешать содержимое всех лунок в пробирке и даже содержимое нескольких планшетов, если их предварительно по-разному пометить (рис. 15) [54].
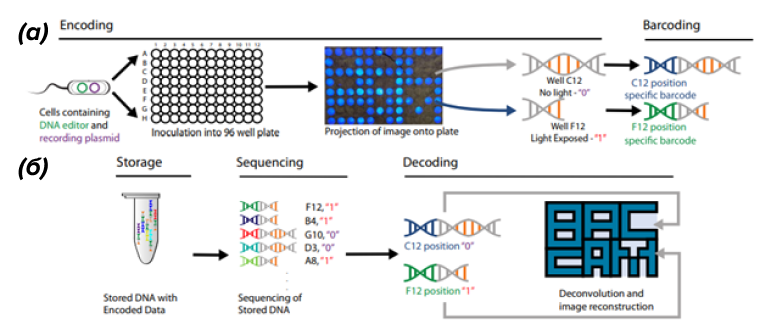
Рисунок 15. (а) — кодирование световой информации внутри бактерии и баркодирование лунок для сохранения пространственной информации. (б) — секвенирование ДНК и декодирование первоначального рисунка.
Для записи двух изображений одновременно применяли систему, чувствительную к красному цвету. Была показана устойчивость системы к разбавлению до 50 000 раз, высушиванию, нагреванию и ультрафиолету.
Очевидно, это только первая демонстрация принципа подобной возможности информации в ДНК — далее можно увеличивать количество лунок в планшете, мультиплексировать планшеты еще сильнее и увеличивать размерность хранимых данных.
Литература
- Asher Mullard. (2023). 2022 FDA approvals. Nat Rev Drug Discov. 22, 83-88;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Три поколения лекарств;
- Science’s 2023 Breakthrough of the Year: Weight loss drugs with a real shot at fighting obesity — American Association for the Advancement of Science (AAAS);
- SciNat за декабрь 2023 #4: подводим итоги года — самые удивительные открытия и талантливые ученые;
- A. Michael Lincoff, Kirstine Brown-Frandsen, Helen M. Colhoun, John Deanfield, Scott S. Emerson, et. al.. (2023). Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 389, 2221-2232;
- Хороший, плохой, злой холестерин;
- Оземпик: больше, чем средство для похудения;
- Ania M. Jastreboff, Louis J. Aronne, Nadia N. Ahmad, Sean Wharton, Lisa Connery, et. al.. (2022). Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med. 387, 205-216;
- Aleix Cases. (2023). Glucagon-like peptide 1(GLP-1) receptor agonists in the management of the patient with type 2diabetes mellitus and chronic kidney disease: an approach for the nephrologist. Nefrología (English Edition). 43, 399-412;
- Elisabet Jerlhag. (2023). The therapeutic potential of glucagon-like peptide-1 for persons with addictions based on findings from preclinical and clinical studies. Front. Pharmacol.. 14;
- Ania M. Jastreboff, Lee M. Kaplan, Juan P. Frías, Qiwei Wu, Yu Du, et. al.. (2023). Triple–Hormone-Receptor Agonist Retatrutide for Obesity — A Phase 2 Trial. N Engl J Med. 389, 514-526;
- John P. H. Wilding, Rachel L. Batterham, Melanie Davies, Luc F. Van Gaal, Kristian Kandler, et. al.. (2022). Weight regain and cardiometabolic effects after withdrawal of semaglutide: The
STEP 1 trial extension. Diabetes Obesity Metabolism. 24, 1553-1564; - Jiwoo Lee, Sakari Jukarainen, Antti Karvanen, Padraig Dixon, Neil M. Davies, et. al.. (2023). Quantifying the causal impact of biological risk factors on healthcare costs. Nat Commun. 14;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Christopher H. van Dyck, Chad J. Swanson, Paul Aisen, Randall J. Bateman, Christopher Chen, et. al.. (2023). Lecanemab in Early Alzheimer’s Disease. N Engl J Med. 388, 9-21;
- J. Scott Andrews, Urvi Desai, Noam Y. Kirson, Miriam L. Zichlin, Daniel E. Ball, Brandy R. Matthews. (2019). Disease severity and minimal clinically important differences in clinical outcome assessments for Alzheimer's disease clinical trials. A&D Transl Res & Clin Interv. 5, 354-363;
- John R. Sims, Jennifer A. Zimmer, Cynthia D. Evans, Ming Lu, Paul Ardayfio, et. al.. (2023). Donanemab in Early Symptomatic Alzheimer Disease. JAMA. 330, 512;
- Priya Venkatesan. (2023). First RSV vaccine approvals. The Lancet Microbe. 4, e577;
- Julia L Hurwitz. (2011). Respiratory syncytial virus vaccine development. Expert Review of Vaccines. 10, 1415-1433;
- Maria Florencia Delgado, Silvina Coviello, A Clara Monsalvo, Guillermina A Melendi, Johanna Zea Hernandez, et. al.. (2009). Lack of antibody affinity maturation due to poor Toll-like receptor stimulation leads to enhanced respiratory syncytial virus disease. Nat Med. 15, 34-41;
- Charlene M.C. Rodrigues, Marta V. Pinto, Manish Sadarangani, Stanley A. Plotkin. (2017). Whither vaccines?. Journal of Infection. 74, S2-S9;
- Как болезни крови генной терапией лечили;
- Фармакоэкономика: лечить или экономить?;
- Фетальная генная терапия: от теории — к практике;
- Помочь тем, кого нельзя обнять;
- Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна;
- Liam Bendicksen, Diana M. Zuckerman, Jerry Avorn, Sophia Phillips, Aaron S. Kesselheim. (2023). The Regulatory Repercussions of Approving Muscular Dystrophy Medications on the Basis of Limited Evidence. Ann Intern Med. 176, 1251-1256;
- Генная терапия нейромоторных болезней;
- Зоопарк в моем животе;
- Микробы из глубинки. Стоит ли нам трансплантировать себе фекалии дикарей, чтобы вернуть былое здоровье;
- Asher Mullard. (2023). FDA approves second RNA aptamer. Nat Rev Drug Discov. 22, 774-774;
- Zohar Yehoshua, Carlos Alexandre de Amorim Garcia Filho, Renata Portella Nunes, Giovanni Gregori, Fernando M. Penha, et. al.. (2014). Systemic Complement Inhibition with Eculizumab for Geographic Atrophy in Age-Related Macular Degeneration. Ophthalmology. 121, 693-701;
- Felix Poppelaars, Joshua M. Thurman. (2020). Complement-mediated kidney diseases. Molecular Immunology. 128, 175-187;
- Sheridan M. Hoy. (2023). Pozelimab: First Approval. Drugs. 83, 1551-1557;
- Heidi Ledford. (2023). ‘It’s all gone’: CAR-T therapy forces autoimmune diseases into remission. Nature. 624, 483-484;
- Системная красная волчанка: болезнь с тысячью лиц;
- Рассеянный склероз: иммунная система против мозга;
- Mattia Maroso. (2023). A quest into the human brain. Science. 382, 166-167;
- Miryam Naddaf. (2023). Europe spent €600 million to recreate the human brain in a computer. How did it go?. Nature. 620, 718-720;
- Gemma Conroy. (2023). This is the largest map of the human brain ever made. Nature. 622, 679-680;
- Shadi Tarazi, Alejandro Aguilera-Castrejon, Carine Joubran, Nadir Ghanem, Shahd Ashouokhi, et. al.. (2022). Post-gastrulation synthetic embryos generated ex utero from mouse naive ESCs. Cell. 185, 3290-3306.e25;
- Bernardo Oldak, Emilie Wildschutz, Vladyslav Bondarenko, Mehmet-Yunus Comar, Cheng Zhao, et. al.. (2023). Complete human day 14 post-implantation embryo models from naive ES cells. Nature. 622, 562-573;
- Bernardo Oldak, Emilie Wildschutz, Vladyslav Bondarenko, Mehmet-Yunus Comar, Cheng Zhao, et. al.. (2023). Complete human day 14 post-implantation embryo models from naive ES cells. Nature. 622, 562-573;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Jinbo Huang, Shuai Xue, Peter Buchmann, Ana Palma Teixeira, Martin Fussenegger. (2023). An electrogenetic interface to program mammalian gene expression by direct current. Nat Metab. 5, 1395-1407;
- Нанопоровое секвенирование: на пороге третьей геномной революции;
- 12 методов в картинках: протеомика;
- Adina Sauciuc, Blasco Morozzo della Rocca, Matthijs Jonathan Tadema, Mauro Chinappi, Giovanni Maglia. (2023). Translocation of linearized full-length proteins through an engineered nanopore under opposing electrophoretic force. Nat Biotechnol;
- Pablo Martin-Baniandres, Wei-Hsuan Lan, Stephanie Board, Mercedes Romero-Ruiz, Sergi Garcia-Manyes, et. al.. (2023). Enzyme-less nanopore detection of post-translational modifications within long polypeptides. Nat. Nanotechnol.. 18, 1335-1340;
- Adam Dorey, Stefan Howorka. (2023). Unfolding the path to nanopore protein sequencing. Nat. Nanotechnol.. 18, 1259-1260;
- Michael B. Sheets, Wilson W. Wong, Mary J. Dunlop. (2020). Light-Inducible Recombinases for Bacterial Optogenetics. ACS Synth. Biol.. 9, 227-235;
- Cheng Kai Lim, Jing Wui Yeoh, Aurelius Andrew Kunartama, Wen Shan Yew, Chueh Loo Poh. (2023). A biological camera that captures and stores images directly into DNA. Nat Commun. 14.