
SciNat за декабрь 2023 #4: подводим итоги года — самые удивительные открытия и талантливые ученые
24 декабря 2023
SciNat за декабрь 2023 #4: подводим итоги года — самые удивительные открытия и талантливые ученые
- 730
- 1
- 1
Обложка одного из последних в этом году номеров журнала Science посвящена агонистам глюкагоноподобного пептида 1 (GLP1), которые перевернули представления современной медицины о лечении ожирения и сахарного диабета 2-го типа, а также в целом были в центре общественного внимания в течение уходящего 2023 года. — Obesity meets its match.
-
Автор
-
Редактор
Темы
Об открытиях уходящего года, а также об ученых, которые сделали эти достижения возможными, читайте в нашем предновогоднем дайджесте! А в конце подведем итоги года на «Биомолекуле» и познакомимся со списком самых читаемых статей.
Science-2023: Breakthrough of the year
Прорывом года по версии журнала Science стали препараты на основе агонистов глюкагоноподобного пептида (GLP1) для лечения ожирения, известность которых вышла далеко за пределы кабинетов эндокринологов.
Ожирение в последние десятилетия представляет собой глобальную проблему для здравоохранения многих стран и уже давно считается настоящей «эпидемией» XXI века. В США 70% населения испытывают проблемы с лишним весом, тогда как в странах Европы количество таких людей переваливает за 50%. Общепринято, что достижение человеком индекса массы тела равного 30 (индекс массы тела рассчитывается как масса тела в килограммах, деленная на квадрат роста в метрах) создает большой риск развития сахарного диабета 2-го типа, болезней сердца, артрита, жирового гепатоза и некоторых видов рака. Однако до сих пор лечение ожирения и порождаемых им метаболических нарушений заключалось в применении широкого диапазона методов и лекарственных препаратов. При этом часть из них, хоть и имеет выраженную эффективность, сопровождается развитием побочных эффектов, тогда как другие средства представляют собой весьма сомнительные БАДы и лекарства с недоказанной эффективностью.
Новая группа препаратов представляет из себя производное гормона кишечника глюкагоноподобного пептида 1 (GLP1), который стимулирует повышение уровня инсулина в крови, оказывающего сахароснижающий эффект, а также понижает уровень глюкагона. Контроль уровня глюкозы с помощью GLP1 и его производных приводит к значительной потере веса, ведь глюкоза в таком случае активнее окисляется, а не откладывается в виде жировых отложений. Рецепторы к GLP1 находятся в самых разных органах и тканях. Основная их локализация — клетки поджелудочной железы, секретирующие инсулин и глюкагон. Также большое количество рецепторов обнаружено в кардиомиоцитах, клетках сердечной мышцы. Оказалось, что GLP1, как и его аналоги, способен снижать симптомы сердечной недостаточности и предотвращать инфаркт миокарда, что является преимуществом помимо влияния на снижение массы тела.
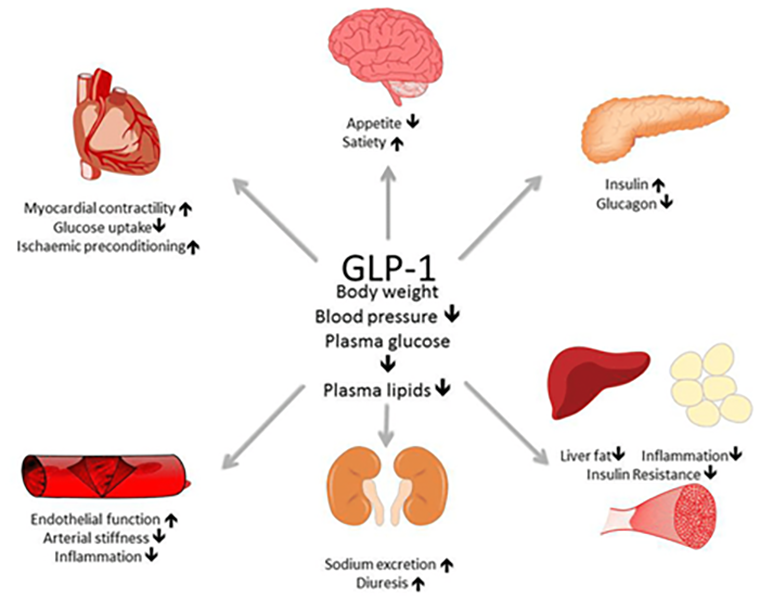
На схеме: основные эффекты на организм глюкагоноподобного пептида 1 (GLP1).
схема из обзора Boyle et al., 2018
Исследование эффектов GLP1 — пример того, что от открытия функции белка до ее использования в медицине может пройти несколько десятилетий. Вокруг обнаруженного в начале 1980-х гг. пептида GLP1 постепенно стало формироваться ядро исследователей, понимающих значение этого гормона, о котором широкой общественности до сих пор известно довольно немного. Об одном из исследователей GLP1 речь пойдет в следующем разделе нашего дайджеста, Nature’s 10, посвященном ученым, которые внесли свой весомый вклад в науку. Исследования GLP1 развивались от экспериментов на клетках, затем — к влиянию гормона на пищевое поведение крыс, первым испытаниям на людях, когда исследование 20 здоровых добровольцев показало, что люди, получавшие инъекции GLP1 после завтрака, были менее склонны засиживаться за столом в обед.
Первым препаратом GLP1 был эксенатид (Byetta), одобренный в 2005 году для лечения диабета 2 типа. Вместо человеческого гормона был взят аналогичный пептид из яда гигантской ящерицы, монстра Гила. Почти пять лет спустя Novo Nordisk выпустила лираглутид (Victoza), основанный на человеческом GLP1. Это тоже было лекарство от диабета, но в конце 2014 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило его для лечения ожирения.
Но настоящую славу снискал препарат семаглутид той же Novo Nordisk, который получил «зеленый свет» два года назад под названием Оземпик (Ozempic) для лечения диабета, и Вегови (Wegovy) для лечения ожирения. В отличие от своих предшественников, семаглутид вводится в виде одной инъекции в неделю, а не один или два раза в день, как препараты прошлого поколения. И в ходе ключевого исследования люди, принимавшие его, потеряли беспрецедентные 15% своего веса примерно за 16 месяцев. Многие, принимавшие препарат, также описывают изменение пищевого поведения, которое выражалось в подавлении желания постоянно продолжать что-то есть.
С момента появления препарата на рынке Оземпик или Вегови прописали 1,7% населения США, а рыночная стоимость Novo Nordisk превышает ВВП Дании, родины этой европейской фармкомпании. В этом году появился целый ряд работ о том, что семаглутид действительно является очень эффективным препаратом, в том числе масштабное исследование Novo Nordisk с участием 17 000 человек, которое показало, что прием препарата снижает риск несмертельных сердечных приступов и инсультов на 20%. Кроме того, успешными были признаны исследование по изучению того, замедляет ли семаглутид прогрессирование заболевания почек у пациентов с диабетом. Область применения препаратов GLP1 в настоящее время расширяется так, как не могли себе представить их создатели. В настоящее время проводятся испытания лекарственной зависимости после того, как люди с ожирением и сахарным диабетом сообщили об уменьшении тяги к вину и сигаретам во время лечения. Исследователи предполагают, что GLP1, регулируя пищевое поведение, может также влиять на другие компоненты системы подкрепления. Также проходят клинические испытания препаратов GLP1 для лечения болезней Альцгеймера и Паркинсона, частично основываясь на доказательствах того, что они могут влиять на процессы воспаления в головном мозге, которые сопровождают нейродегенеративные заболевания.
Но медицинские прорывы редко бывают однозначными, а энтузиазм вокруг агонистов GLP1 окрашен неуверенностью и даже некоторыми нехорошими предчувствиями. Как практически все лекарства, агонисты GLP1 имеют побочные эффекты и неизвестные осложнения, включая тошноту и другие проблемы с желудочно-кишечным трактом. В сентябре регулирующие органы США обновили инструкцию к Оземпику, указав на потенциальный риск кишечной непроходимости, а в октябре канадская группа сообщила о повышении вероятности этого осложнения, а также панкреатита.
Врачи также беспокоятся о том, что люди, у которых нет избыточного веса или ожирения, обращаются к лечению, чтобы похудеть. Исследование 2022 года, сообщающее, что семаглутид способствовал снижению массы тела на 16% у подростков с ожирением, было встречено с надеждой, но также породило вопрос: как долго пациенты могут принимать этот препарат и стоит ли использовать его в течение всей жизни, ведь месяц приема препарата стоит около 1000 долларов. Усиливают тревогу сообщения о том, что две трети пациентов, прекративших прием препарата, уже через год вернули потерянную массу.
На этом фоне уже разворачивается следующая глава истории: методы лечения, имитирующие действие сразу нескольких метаболических гормонов и способствующие еще большему похудению. Один из них, Тирзепатид (tirzepatide) компании Eli Lilly & Co., был одобрен в США в ноябре для снижения веса после того, как в прошлом году был одобрен препарат для лечения диабета. К подобному решению привело крупное клиническое исследование, которое показало, что те, кто принимал этот препарат, потеряли до 21% массы тела.
Таким образом, открытие нового способа лечения не только дает надежду пациентам, но и порождает большое количество вопросов, которые должны быть решены в будущем. А более подробно о GLP1 и новых препаратах можно прочитать в новой статье «Биомолекулы»: «Оземпик: больше, чем средство для похудения», вышедшей в рамках конкурса «Био/мол/текст 2023–2024».
Новая надежда в борьбе с малярией
Уходящий 2023 год оказался знаковым в противостоянии человечества и малярии, которое ежегодно уносит сотни тысяч жизней. Первым событием стала оценка эффективности первой в мире вакцины против малярии RTS,S, которая выпускается под торговой маркой Mosquirix компанией GSK. Исследования показали, что Mosquirix значительно снижает смертность среди маленьких детей, которые погибают от малярии чаще всего. В странах Африки к югу от Сахары из-за малярии ежегодно погибает около 470 000 человек. Также в 2023 году ВОЗ одобрила к применению вторую вакцину, R21, под торговым названием MatrixM. В отличие от RTS,S, новая вакцина дешевле и проще в производстве, что дает возможность производить гораздо большее количество доз в год. Вакцина R21 должна помочь сократить разрыв между огромным спросом на антималярийные вакцины со скромным предложением на рынке.
На фото: в родильное отделение окружной больницы Килифи в Кении поступает много детей с симптомами малярии. В городе состоялось клиническое испытание новой вакцины R21.
Вакцина RTS,S обладает умеренной эффективностью — ее защита ослабевает вскоре после вакцинации, из-за чего было принято решение допустить ее использование только после крайне тщательного изучения. В 2019 году началась многолетняя пилотная фаза испытаний, в ходе которой вакцину получили почти 2 миллиона младенцев и детей раннего возраста в Гане, Кении и Малави. К 2021 году предварительные результаты убедили чиновников, что препарат достаточно безопасен и эффективен, чтобы его можно было одобрить для более широкого использования. В октябре 2023 года, сравнив регионы, в которых использовалась вакцина с областями, где население не прививалось, исследователям удалось установить, что количество тяжелых случаев малярии снизилось на 22% на фоне использования RTS,S. При этом детская смертность снизилась на 13%. Это стало убедительным доказательством эффективности вакцины в борьбе с малярией.
Однако ложкой дегтя в этой истории является то, что компания GSK может произвести только 18 миллионов доз в период до конца 2025 года, что будет достаточно для полной вакцинации только 4,5 из 40 миллионов детей в регионах, затронутых эпидемией, каждый год.
Вакцина R21, разработанная в Оксфордском университете, может восполнить этот пробел. В настоящее время новая вакцина прошла лицензирование в Индийском институте вакцин и сывороток, который готов выпускать 100 миллионов доз в год по цене от 2 до 4 долларов за дозу, что вполовину дешевле, чем Mosquirix компании GSK. В сентябре 2023 года был опубликован препринт третьей стадии испытания R21 с участием 4800 детей в четырех странах. Результаты показывают, что в течение первых 18 месяцев вакцина по крайней мере столь же эффективна, как RTS,S, и, возможно, немного более эффективна, хотя прямых сравнений двух вакцин не проводилось. ВОЗ заявляет, что R21 должна стать доступной для широкого использования к середине 2024 года. В следующем разделе нашего дайджеста, Nature’s 10, вы можете подробнее почитать об институте в Буркина-Фасо и его руководителе, проводивших клинические испытания этой вакцины. — «Биомолекула»: «Малярия. 15 фактов о болотной лихорадке», «Малярия. „Болотная лихорадка“ тогда и сейчас».
Наконец достигнут скромный прогресс в лечении Альцгеймера
Болезнь Альцгеймера, которой подвержены десятки миллионов людей во всем мире, до сих пор не имела эффективных способов лечения, кроме симптоматической терапии, исключающей значительного улучшения состояния пациента. Развитие болезни связано с накоплением в головном мозге бета-амилоида, белка, который образует бляшки, нарушающие связи между нейронами, что приводит к их гибели и развитию нейродегенерации. Нейробиологи много десятилетий находятся в поиске эффективного лечения болезни, но убедительных успехов до этого года достигнуто не было.
На фото: новая терапия антителами может замедлить нейродегенерацию в мозге людей с болезнью Альцгеймера.
В этом году регулирующие органы США и Японии одобрили новый препарат Леканемаб (Lecanemab), представляющий собой моноклональное антитело к бета-амилоиду. Применение препарата замедляло потерю когнитивных функций на 27%. По результатам испытаний, проведенных этим летом, еще один антиамилоидный препарат под названием Донанемаб замедлил снижение когнитивных функций на целых 35% по сравнению с плацебо, поэтому ученые с энтузиазмом смотрят на перспективы одобрения этого метода лечения со стороны FDA.
Несмотря на очевидные подвижки в лечении болезни Альцгеймера, существует ряд пока неразрешенных проблем. Прежде всего, одним из серьезных побочных эффектов терапии является развитие отека головного мозга и кровоизлияния в мозг, которые в редких случаях приводили к смерти пациента. При этом пациенты с аллелем гена APOE4, которые генетически предрасположены к более вероятному развитию болезни, оказались также более склонны к развитию подобных побочных эффектов. Также в потенциальную группу риска попадают люди, принимающие тромболитики как поддерживающую терапию на фоне сердечно-сосудистых заболеваний.
В настоящее время основные вопросы, на которые предстоит дать ответ исследователям, — насколько эффективной будет длительная терапия Леканемабом и возможно ли использовать этот препарат для предотвращения развития болезни Альцгеймера при ее выявлении на ранней стадии. — «Биомолекула»: «Болезнь Альцгеймера: ген, от которого я без ума», «На руинах памяти: настоящее и будущее болезни Альцгеймера».
Новые факты о раннем заселении Америки
В 2021 году ученые, работающие в национальном парке Уайт Сендс (White Sands) в Нью-Мексико, объявили об открытии, которое ставит под сомнение прежние сроки появления человека на Американском континенте. Ранее считалось, что первые переселенцы прибыли в Северную Америку через перешеек, пересекавший в то время Берингов пролив около 16 тысяч лет назад. Исследователям из парка Уайт Сендс удалось обнаружить следы человека на дне высохшего озера, которые можно датировать 21–33 тысяч лет назад. Команда исследователей основывала эти даты на семенах водных растений, которые были обнаружены в тех же слоях, что и следы человека. Радиоуглеродный анализ позволил датировать примерное время возникновение этих следов. Однако у ученых все равно оставались сомнения в этих датах, ведь растения могли поглотить из отложений более «древний», углерод, что могло «состарить» найденные отложения в глазах исследователей.

На фото: следы вдоль древнего озера в Нью-Мексико, возможно, оставили за 5000 лет до общепринятой даты появления людей в Америке.
Для того, чтобы убедиться в справедливости своих заключений, исследователи скорректировали данные, используя образцы пыльцы и зерен кварца, которые они находили между следами. Полученные данные идеально совпали с результатами анализа семян, о чем они сообщили в своей статье в октябре 2023 года. Если даты верны, то отпечатки появились на пике последнего ледникового периода, когда ледники покрывали Канаду, а это позволяет предположить, что люди совершили путешествие в Америку до того, как сформировались ледниковые щиты. Однако скептики до сих пор задаются вопросом, могли ли ветер или эрозия привести к появлению более старых отложений поверх человеческих следов, из-за чего они кажутся более древними, чем есть на самом деле. Также ученые надеются обнаружить орудия труда или другие предметы повседневного обихода, которые позволят пролить свет на происхождение их культуры. Тем не менее, изменение датировки следов человека в этом году может спровоцировать переоценку других спорных мест и, скорее всего, заставит археологов начать раскапывать другие отложения ледникового периода в поисках подтверждения — или даже новых сюрпризов.
Мировая углеродная помпа замедляется

На фото: плотные соленые воды моря Уэдделла способствуют глубокой циркуляции Южного океана. Однако талая вода Антарктики, похоже, замедляет это течение.
Воды Южного океана, омывающего Антарктиду, выполняют важную климатическую функцию, поддерживая теплообмен между водами Мирового океана и регулируя уровень углекислого газа в атмосфере. Это становится возможным благодаря тому, что более тяжелая соленая вода Южного океана опускается на большую глубину, утягивая за собой излишнее тепло и избыток углекислого газа из атмосферы. Затем течение медленно распространяется на север, образуя таким образом единую систему циркуляции, которую климатологи называют углеродной помпой. В этом году несколько исследований показали, что помпа находится в большой опасности. Первым тревожным звонком было обнаружение еще много лет назад потепления и сокращения объемов придонных вод Антарктиды, показанное роботизированными зондами Deep Argo, опускавшимся на глубину до 4000 метров. Это свидетельствовало о замедлении циркуляции, стимулированной углеродной помпой. В марте этого года появились прямые доказательства, опубликованные группой американских ученых в журнале Communications Earth & Environment. Они проанализировали данные, полученные с корабельных измерительных приборов в этом регионе 1970-х годов и показали замедления циркуляции углеродной помпы на 20%. Затем, в мае, в журнале Nature Climate Change было опубликовано исследование, авторы которого использовали данные с кораблей и буев и показали, что поток глубинных вод замедлился почти на 30% с 1992 по 2017 год. Пока мало что известно о том, почему произошло это замедление, насколько сильно на него повлияла деятельность человека или как оно может сказаться на климате. Но основной причиной, вероятно, будет увеличение количества пресной воды, поступающей из Антарктиды из-за таяния ледяных щитов, что делает окружающие воды более пресными и затрудняет их циркуляцию. — «Биомолекула»: «Кто на самом деле крутит углеродное колесо».
Молодые ученые отстаивают свои права
И напоследок новость, после прочтения которой российские аспиранты, ординаторы и другие молодые ученые могут смахнуть скупую бюджетную слезу и почувствовать, что они не одиноки в этом мире. Прошлой зимой 48 000 сотрудников Калифорнийского университета устроили крупнейшую в академических кругах США забастовку, требуя улучшения оплаты и условий труда. Молодым ученым удалось добиться значительного повышения оплаты труда, а их пример вдохновил коллег из Канады и стран Европы также побороться за свои права.

Начинающие ученые также оказывают давление на университеты, чтобы они приняли изменения, голосуя ногами и полностью покидая академические круги. Все большая часть после окончания учебы направляется на более прибыльные рабочие места в отрасли, из-за чего многие профессора в последние годы изо всех сил пытаются заполнить вакантные должности постдоков.
Многие руководители факультетов и университетов согласны с необходимостью изменений. Но это создает дополнительную нагрузку на бюджеты. Профессора, которые часто выплачивают зарплату молодым ученым из своих грантов, могут быть вынуждены нанимать меньше аспирантов и постдоков.
Еще неизвестно, будут ли финансирующие агентства увеличивать грантовую поддержку для оплаты повышения зарплат молодым ученым. Тем временем некоторые университеты предприняли шаги, чтобы помочь преподавателям приспособиться к растущим затратам на персонал. Исследователи из Калифорнийского университета в Беркли, например, надеются, что сочетание краткосрочных мер, помогающих профессорам организовывать дополнительные выплаты, и долгосрочного стратегического планирования и составления бюджета в конечном итоге приведет к созданию системы, в которой каждый сотрудник может рассчитывать на достойную оплату труда.
Nature’s 10
Журнал Nature в конце каждого года готовит подборку из десяти людей, которые повлияли на ключевые научные события в уходящем году в области науки и не только. Ниже мы представляем ряд ученых из этой «десятки», чьими заслугами являются не только научные достижения, но и активная гражданская позиция, упорство в продвижении своих изысканий и забота о людях, жизни которых зависят от успехов современной науки.
Томас Паулз: онколог, который помог разработать лечение, продлевающее жизнь
Томас Паулз — исследователь рака мочевого пузыря в больнице Святого Варфоломея и Лондонском университете королевы Марии. В течение последних двадцати лет врач искал способы продлить жизнь пациентов с этим видом онкологии. В 2023 году ему удалось добиться впечатляющих результатов, ведь его способ лечения позволил увеличить среднюю продолжительность жизни пациентов с 16 месяцев до 2,5 лет.

Томас Паулз
Причиной подобного прорыва стало использование нового фармакологического подхода, при котором молекула лекарственного препарата образует конъюгат с антителом (antibody—drug conjugate, ADC), специфичным к определенным белкам, характерным для конкретной ткани человека. Подобный ADC позволяет направить лекарство точно «по адресу» и поразить клетки, подвергшиеся злокачественному перерождению, минимизировав при этом побочные эффекты для других клеток и тканей организма. Многообещающие результаты исследований других типов рака также показали, что ADC могут замедлять рост опухоли и увеличивать выживаемость пациентов, получающих лечение. По мнению некоторых онкологов, ADC — это следующий уровень лечения рака.
В исследовании рака мочевого пузыря был протестирован ADC под названием энфортумаб ведотин (enfortumab vedotin), который нацелен на белок нектин-4, в изобилии присутствующий в раковых клетках мочевого пузыря. Его использовали в сочетании с другим иммунотерапевтическим препаратом, пембролизумабом (pembrolizumab), который тормозит иммунные клетки, убивающие рак.
В настоящее время подобный способ лечения одобрили только для тех пациентов, которым не подходит тип химиотерапии под названием цисплатин (cisplatin), а это около половины людей с запущенным раком мочевого пузыря. Одобрение более широкого использования препарата может произойти в начале следующего года.
После медицинского университета доктор Паулз чуть не стал кардиологом. Но он видел, что возможностей для открытий в области рака мочевого пузыря может быть больше. Он провел более 20 рандомизированных клинических исследований, в том числе несколько, посвященных применению современных иммунотерапевтических препаратов при раке почек и мочевого пузыря. Многие испытания не показали улучшения результатов, но Паулз продолжал настаивать на своем, убежденный, что существует способ повысить выживаемость. Паулз делится, что самая большая проблема — убедить спонсоров исследований инвестировать. Но, по словам Паулза, помимо стремления к открытиям, им движут люди, которых он лечит. «Пациенты, принимавшие участие в этих исследованиях, на самом деле являются людьми, которые приносят невероятную жертву», — добавляет он. — Antibody–drug conjugates come of age in oncology, «Биомолекула»: «Как развивалась иммунотерапия рака?», «Рак и его команда. Борьба во имя иммунотерапии».
Халиду Тинто: борец с малярией, проложивший путь к революционной вакцине
Халиду Тинто — ученый-эпидемиолог из Буркина-Фасо, добившийся успехов в разработке вакцины от малярии. Африканский континент больше других страдает от малярии, которой ежегодно заболевает более 200 миллионов человек, из которых около 500 000 погибает.

Халиду Тинто
Тинто получил докторскую степень в Антверпенском университете в Бельгии, изучая устойчивость малярии к различным лекарственным препаратам. В 2006 году, несмотря на возможность получить позицию постдока в США, доктор Тинто предпочел вернуться на родину, в Буркина-Фасо, где организовал институт клинических исследований Наноро (Clinical Research Unit of Nanoro, CRUN), который стал крупнейшей в стране площадкой клинических испытаний вакцин от малярии. В 2007 году у совсем небольшого коллектива сотрудников (всего 10 человек) появился шанс принять участие в последней стадии клинических испытаний первой в мире одобренной ВОЗ вакцины от малярии RTS,S компании GSK. Несмотря на отсутствие значительных ресурсов для исследований, Тинто удалось убедить представителей компании GSK, что они справятся с клиническими исследованиями их вакцины. Благодаря данным, полученным CRUN, удалось получить одобрение RTS,S в Буркина-Фасо. Однако мощности GSK позволяют производить всего несколько миллионов доз вакцины в год, чего совсем недостаточно для эффективной борьбы с эпидемией в Африке.
Работа доктора Тинто и его института, который за полтора десятилетия вырос в крупный научный центр, привела к тому, что в октябре 2023 года вакцина R21, клинические испытания которой проводил институт CRUN, была одобрена ВОЗ. Кроме того, Индийский институт сывороток в Пуне готов выпускать 100 миллионов доз R21 в год, что дает надежду на масштабную вакцинацию людей по всей Африке. Таким образом, вакцина R21 будет более доступной, а по мнению некоторых исследователей — более эффективной, чем RTS,S. В 2023 году ВОЗ заявила, что R21 будет доступна по всей Африке уже в середине 2024 года. Тем временем, доктор Тинто продолжает работать над более чем 30 клиническими испытаниями, включая еще две вакцины против малярии и дополнительными исследованиями R21. — Malaria fighter: this researcher paved the way for a game-changing vaccine.
Светлана Мойсов: пионер препаратов для снижения веса, получившая признание за свою работу
Одним из ученых года по версии журнала Nature признана биохимик Светлана Мойсов (Svetlana Mojsov), американская исследовательница югославского происхождения. Признание доктора Мойсов связано с ее ролью в изучении глюкогоноподобного пептида 1 (GLP1), важного метаболического гормона, чей аналог стал основой прогремевших на весь мир препаратов Оземпик и Вегови. Будучи одним из пионеров в изучении свойств GLP1, доктор Мойсов оказалась незаслуженно обделена признанием ее роли в открытии этого пептида, и ей потребовалось потратить немало сил и даже выиграть судебный процесс, чтобы добиться заслуженного внимания к ее достижениям.

Светлана Мойсов
Пептид GLP1 секретируется клетками кишечника через 15 минут после приема пищи и является производным глюкагона, гормона поджелудочной железы, уровень которого повышается в крови при голодании. Высвобождение GLP1 приводит к усилению секреции инсулина бета-клетками поджелудочной железы — и вместе с тем подавляется секреция глюкагона альфа-клетками. Поскольку заболевания, связанные с диабетом и ожирением, становятся все большей проблемой для современной медицины, GLP1 и его аналоги стали важной мишенью для изучения. Результатом изысканий стала целая группа препаратов, наиболее известными из которых, являются Оземпик и Вегови, которые признаны журналом Science прорывом 2023 года.
Препарат Оземпик стал быстро набирать популярность, которая сопровождалась, с одной стороны, признанием ученых, участвовавших в его разработке, а с другой стороны, — скандалами, связанными с использованием его как препарата для похудения людьми, которые не нуждаются в медикаментозном снижении веса, но имеют финансовые возможности, чтобы купить «чудо-таблетку». На фоне подобной информационной волны стали узнавать об ученых, которые внесли большой вклад в изучение GLP1, однако имени доктора Мойсов среди них не было. Только благодаря ее настойчивости научная общественность узнала о том, что Светлана работала над изучением свойств GLP1 и подобных ему пептидов еще в 1980-е годы в одной из больниц Бостона. Она предсказала, что определенная версия гормона должна существовать в тканях кишечника млекопитающих. Затем Мойсов экспериментально подтвердила это предсказание. Также она показала, что эта биологически активная форма GLP1 может вызывать высвобождение инсулина из поджелудочной железы крысы. Пептиды и антитела, созданные доктором Мойсов, также сыграли важную роль в нескольких других экспериментах с GLP1, проведенных в то время на клеточных линиях, и позволили клиницистам продемонстрировать, что GLP1 может снижать уровень глюкозы в крови в ранних испытаниях на людях. Это исследование подготовило почву для создания таких препаратов, как семаглутид, который содержит аналог GLP1. Он включает лишь незначительные модификации пептида, описанного в оригинальной статье Мойсов; изменения улучшают стабильность и обеспечивают более долгосрочный эффект. Мировые продажи семаглутида сейчас составляют более 1 миллиарда долларов США в месяц, и прогнозируется, что этот класс препаратов станет одним из самых продаваемых лекарств всех времен.
За этим могут последовать премии и престиж, который они приносят, но это не является главным приоритетом для Мойсов, которая продолжает изучать GLP1 и родственные белки в своей лаборатории. В связи с истечением срока давности, Светлана Мойсов не может рассчитывать на прибыль от продажи этих препаратов, но для нее в этой истории важно, чтобы ее заслуги были признаны коллегами. — Weight-loss-drug pioneer: this biochemist finally gained recognition for her work.
Кацухико Хаяси: исследователь механизмов репродукции

Кацухико Хаяси
Кацухико Хаяси (Katsuhiko Hayashi) — эмбриолог из университета Осаки, Япония. В этом году открытие Хаяси и его коллег потрясли мир: им удалось превратить соматическую клетку в яйцеклетку, оплодотворить ее и получить потомство. Обычно яйцеклетки и сперматозоиды несут лишь половину хромосомного набора по сравнению с клетками всего остального организма, в том числе одну из половых хромосом, X или Y (в случае сперматозоидов). Все остальные клетки несут полный (или двойной) набор хромосом, включающий две половых хромосомы — XX или XY. Способность производить гаметы характерна только для специальных линий клеток-предшественников, которые делятся с помощью мейоза. До открытия доктора Хаяси считалось, что получить гаметы из других клеток практически невозможно. Исследователи взяли клетки из хвоста мыши и превратили их в стволовые клетки (клетки, способные превращаться в другие типы клеток). Затем Хаяси и его команде удалось разработать сложную методику по превращению стволовой клетки в яйцеклетку. Далее получившиеся яйцеклетки были оплодотворены и подсажены самкам мышей. В результате 630 переносов удалось получить только семь живых детенышей. Несмотря на скромное количество выживших детенышей, данное исследование открывает новые возможности для биологии развития. Сам Кацухико Хаяси видит значимость своего открытия прежде всего в доскональном изучении механизмов гаметогенеза. «Зародышевая линия — это источник жизни», — говорит он. «И это вечно. Это единственная клеточная линия, которая может выживать неопределенно долго после дифференцировки.» Практическую значимость ученый видит в применении метода для спасения вымирающих видов животных. Так, например, северный белый носорог (Ceratotherium simum Cottoni) считается практически вымершим, поскольку известно только о двух представителях вида, и обе они самки.
Коллеги доктора Хаяси отмечают, что успехи его кропотливой работы связаны с его невероятной работоспособностью. «Он работает как десять человек», — говорит Дайсуке Китамура, иммунолог из Токийского научного университета, который руководил докторской диссертацией Хаяши. — «Биомолекула»: «Такие разные стволовые клетки».






