
Тайная жизнь серотониновых рецепторов
24 января 2023
Тайная жизнь серотониновых рецепторов
- 3720
- 0
- 11
Не только люди создают пары. Парами существуют и серотониновые рецепторы, причем в самых причудливых комбинациях. Об этом мало кто знает за пределом узкого круга специалистов, но такова новая парадигма нейрофармакологии.
Рисунок в полном размере.
коллаж авторов статьи
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Даже несмотря на то, что нейромедиатор серотонин не обделен вниманием, его рецепторы постоянно оказываются в тени. А ведь без них серотонин «как без рук»: именно за счет множества рецепторов он оказывается таким тонким регулятором нервных функций и поведения. Многие плохо себе представляют значимость рецепторов, и еще хуже — как они функционируют. А здесь таится много неожиданного. Взять хотя бы то, что рецепторы физически связаны друг с другом (олигомеризованы), и это, можно сказать, их нормальное состояние. Открытия последних десятилетий, показавшие скрытую доселе сторону рецепторной «жизни», ставят классическую нейрофармакологию буквально с ног на голову. Об этом и пойдет речь в нашей статье.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Нейробиология» конкурса «Био/Мол/Текст»-2022/2023.
Партнер номинации — компания «Сесана»: — один из ведущих поставщиков оборудования и реагентов для полного цикла научного исследования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Для клетки рецептор на ее мембране — это окно в окружающий мир. Многообразие рецепторов и их молекулярное совершенство без зазрения совести можно назвать одним из шедевров матушки-природы. Все многообразие клеточных рецепторов можно грубо разделить на три большие группы: 1) ионотропные рецепторы; 2) рецепторы с внутренней тирозинкиназной активностью и 3) рецепторы, сопряженные с G-белком (рис. 1). Последняя группа является самой многочисленной среди мембранных белков. Они — проводники сигналов от многих нейромедиаторов и мишени для большинства фармакологических препаратов. Скорее всего, вы представляете себе рецепторы как молекулы, одиноко бороздящие просторы клеточной мембраны, — примерно так, для наглядности, их изображают на схемах в статьях и учебниках. Но, разумеется, все намного сложнее.
В дальнейшем для краткости будем использовать англоязычную аббревиатуру GPCR (G protein-coupled receptor). На «Биомолекуле» про них опубликовано множество статей, к которым мы отсылаем самых пытливых читателей.

Рисунок 1. Три типа клеточных рецепторов. Тут, разумеется, представлены собирательные образы соответствующих типов. На упрощенных схемах GPCR кажутся одинаковыми, однако это не так. Существуют разные классификации, но можно выделить по меньшей мере три их основных класса (А, В и С). Класс А (родопсин-подобные) самый многочисленный и охватывает около 85% всех GPCR. Класс В (рецепторы секретина) связываются с пептидными гормонами. И, наконец, класс С — метаботропные глутаматные рецепторы. Рецептор с тирозинкиназной активностью показан на схеме в своем активированном состоянии. Да, это как бы рецептор, состоящий из двух, но в отличие от палочек Twix, по отдельности каждый мономер совершенно не функционален. Только когда два мономера объединяются при взаимодействии с лигандом, их внутриклеточные тирозинкиназные домены могут фосфорилировать друг друга и запустить сигнальный каскад.
Наверное, стоит вкратце рассмотреть, что из себя представляет GPCR. Каждый имеет 7 трансмембранных (ТМ) доменов, представленных α-спиралями (рис. 2) [1]. Каждый из этих доменов связан тремя внеклеточными (ECL) и тремя внутриклеточными (ICL) петлями. Если ТМ-домен практически всех GPCR весьма консервативен, то петли показывают значительную вариабельность и могут сильно различаться по размеру между разными типами рецепторов. Как можно увидеть на схеме с рис. 2, ТМ-спирали не растянуты в цепочку, а собраны в компактный «пучок», в центре которого формируется сайт связывания, улавливающий лиганд. Подробно строение GPCR удобно рассмотреть на родопсине — прототипе всех таких рецепторов: «Зрительный родопсин — рецептор, реагирующий на свет» [2].
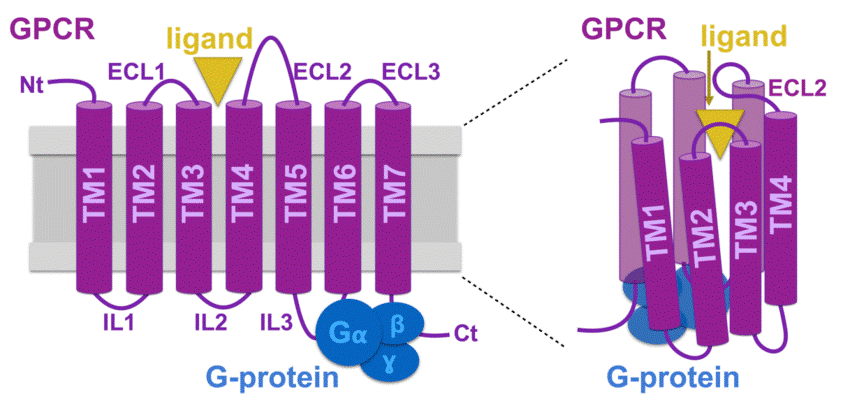
Рисунок 2. Схема строения GPCR. Здесь мы видим внеклеточный N-конец (Nt) и внутриклеточный С-конец (Ct), завершающий «цепь» из семи трансмембранных доменов (ТМ1—7), представляющих собой α-спирали. Домены связаны внеклеточными (ECL1—3) и внутриклеточными петлями (IL1—3). Но в таком развернутом виде можно представить лишь вторичную структуру рецептора. Третичная структура — это «пучок», в котором находится сайт связывания с лигандом, обычно под прикрытием второй внеклеточной петли. Впрочем, у GPCR класса С лиганд может связываться и с длинным N-концом. Хотя на схеме показано, что G-белок присоединен к третьей внутриклеточной петле и С-концу, сайты связывания могут быть также и на второй петле, и на примыкающих участках трансмембранных доменов.
Определенно, большой набор медиаторов и пептидных гормонов, имеющихся в организме, не имел бы смысла в отсутствие GPCR. Каким бы путем они смогли передать сигналы внутрь клетки? Но в этом заключается общебиологическом смысл. Поскольку многие из GPCR являются мишенями для фармакологических препаратов, практически любой аспект в регуляции рецепторной функции будет представлять и чисто практический интерес. В одних случаях это может помочь разобраться, как и почему работают одни препараты и не работают другие. В других — можно узнать, как на функцию рецепторов влияет изменение физиологических условий, и чего от этого можно ожидать. Наконец, понимая тонкую регуляцию рецепторов, можно переосмыслить целые терапевтические стратегии. Скажем, сейчас остро стоит проблема устойчивости к антидепрессантам . Что нужно сделать, чтобы дело сдвинулось с мертвой точки? Возможно, нужно просто лучше разобраться в биологии GPCR.
Достаточно сказать, что 60–70% пациентов не удается достичь устойчивой ремиссии, а 30% вообще не отвечают на лечение [3]. А за другими подробностями отсылаем читателей к «Краткой истории антидепрессантов» [4].
Почему мы решили обратить внимание на взаимодействие рецепторов? Давайте представим, как в оживленной толпе два человека формируют пару, которая распадается и снова формируется (возможно, уже с другим человеком). Примерно то же самое происходит и на клеточной мембране. Но эти встречи, будь они мимолетными или долгими, могут существенно изменить функции рецепторов. При формировании межрецепторного комплекса могут измениться сайты связывания с лигандами, или будет запускаться другой сигнальный путь в ответ на привычный агонист или антагонист , а может, комплекс и вовсе обретет какие-то свойства, которых не было ни у одного из рецепторов по отдельности [5]. Феномен, при котором стремительно и кардинально изменяется рецепторная функция, сам по себе чрезвычайно интересен. И, пожалуй, излишне говорить, что механизмы, стоящие за ним, очень важны для нейрофармакологии.
Просим прощения за избыток терминологии, но без терминов не обойтись. Агонистами называют соединения, которые активируют рецептор, имитируя естественный лиганд. Антагонисты, напротив, ингибируют рецептор и не дают ему посылать сигналы внутрь клетки. А еще бывают аллостерические лиганды: «Аллостерические регуляторы GPCR: ключи от всех замков» [6].
О серотониновых рецепторах в двух словах
В данном обзоре мы не просто так сконцентрировали внимание именно на серотониновых рецепторах [7]. Причина проста (и утилитарна) — потому что серотониновая система является одной из главных мишеней в современной нейрофармакологии. Серотонин (5-НТ) — это классический нейромедиатор. Он синтезируется в специфических клетках (все они компактно собраны в ядра в среднем мозге) и выбрасывается в синаптическую щель, которая может быть очень далеко от синтезирующей клетки. Впрочем, не всегда. Для серотонина характерна и так называемая объемная трансмиссия, когда медиатор выделяется и действует тут же, «не отходя от кассы», активируя рецепторы на дендритах и теле нейрона. Но это не отменяет того, что аксоны серотониновых нейронов «опутывают» буквально весь мозг: их можно найти в каждой структуре. Поэтому серотонин участвует в таком количестве физиологических процессов: от модуляции температуры тела до тонкой регуляции нашего настроения. Вся эта «многозадачность» держится исключительно на обилии рецепторов. Сегодня известно семь типов 5-НТ рецепторов (5-НТ1—7), разделяемых на 14 подтипов. За исключением одного «отщепенца» (5-НТ3) , все они являются классическими GPCR класса А. Трехмерные структуры некоторых из этих рецепторов определены уже десятилетие назад: «Рецептор медиатора настроения» [8].
Этот рецептор представляет собой ионный канал.
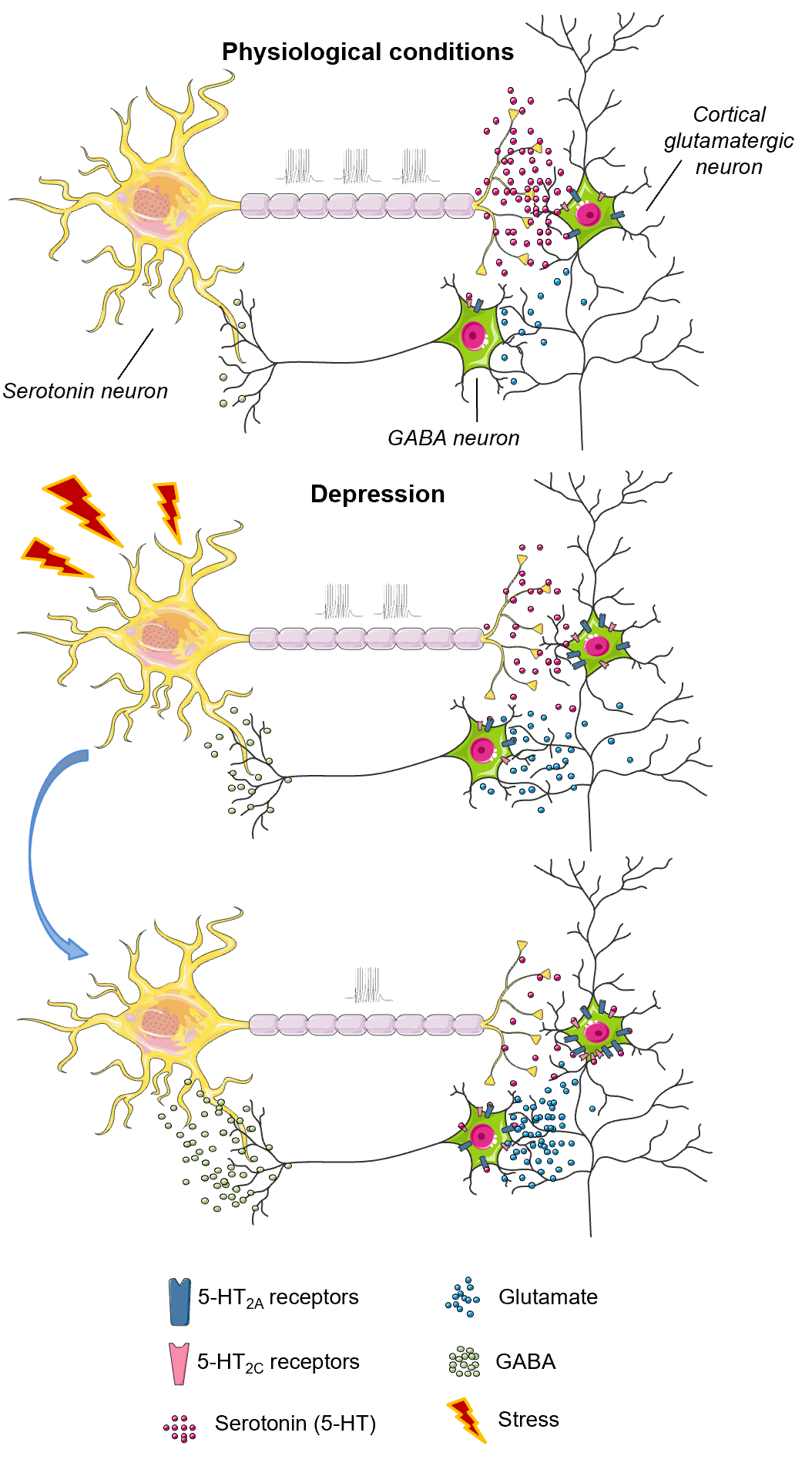
Рисунок 3. Схема механизма, вовлекающего 5-НТ2А и 5-НТ2С рецепторы в патогенез депрессии. При физиологических состояниях постсинаптические 5-НТ2А и 5-НТ2С рецепторы регулируют секрецию глутамата и/или ГАМК. При индуцированном стрессом снижении секреции серотонина, рецепторы сенситизируются, их число увеличивается, и они ингибируют активность серотониновых нейронов через регуляторную петлю глутамат—ГАМК—серотонин, что усугубляет дефицит этого нейромедиатора и провоцирует развитие депрессивного состояния.
В первую очередь, 5-НТ рецепторы интересны своим участием в патогенезе и терапии депрессии. Моноаминергическая теория, постулирующая причиной всех бед недостаток серотонина и норадреналина, была выдвинута одной из первых более полувека назад. Разумеется, на сегодняшний день существуют и другие гипотезы разной степени убедительности [4], но моноаминергическая теория всё еще не сдает своих позиций. Достаточно сказать, что, за редким исключением, все клинически эффективные антидепрессанты действуют на серотониновую систему [10], а 5-НТ рецепторы так или иначе выступают в качестве мишеней [11], [12]. Собственно, и роль рецепторов в патогенезе становится более очевидной. Проиллюстрируем это схемой из одного недавнего обзора , посвященного 5-НТ рецепторам в патологическом поведении (агрессии, депрессии и суициде) [13]. 5-НТ2А и 5-НТ2С рецепторов нет на серотониновых нейронах, однако это не мешает им регулировать секрецию серотонина. Оба подтипа рецепторов локализованы на глутаматных нейронах в коре головного мозга. Выброс серотонина в коре активирует рецепторы, что, в свою очередь, стимулирует выброс глутамата, который активирует ГАМК-нейроны . Последние (по крайней мере, часть из них) имеют очень длинные проекции в средний мозг, где секретируют тормозящую ГАМК на серотониновые нейроны, что и ингибирует их активность. Это сложный, тонкий и, можно сказать, элегантный механизм отрицательной обратной связи. Но его несложно сломать. 5-НТ2А и 5-НТ2С рецепторы очень чувствительны к уровню серотонина, и в ответ на его дефицит происходит сенситизация, т.е. их число на мембране клетки увеличивается (рис. 3). При воздействии стресса уровень серотонина снижается (и чем стресс сильнее, тем меньше секреция), однако вызванное этим увеличение числа 5-НТ2А и 5-НТ2С рецепторов лишь сильнее стимулирует петлю глутамат—ГАМК—серотонин, и серотонина становится еще меньше. Из-за этого рецепторы сенситизируются еще сильнее, и теперь у нас уже вовсю работает механизм положительной обратной связи, который приводит к развитию патологического состояния. Эксперименты на животных, данные нейровизуализации и посмертные исследования мозга пациентов с депрессией показывают, что этот сценарий реален. И сейчас речь шла лишь об одном возможном сценарии развития депрессии и всего о двух подтипах 5-НТ рецепторов из четырнадцати!
В работе над обзором принимал участие один из авторов данной статьи.
Т.е. секретирующих гамма-аминомасляную кислоту (ГАМК) — см. «Спокоен как GABA» [14].
Олигомеризация как она есть
Вначале немного терминов, которые будут часто встречаться в дальнейшем. Формирование комплекса между рецепторами называется димеризацией (если участников два) или олигомеризацией (если их много). Каждый отдельный рецептор в комплексе именуется протомером. Комплексы могут быть гомомерными (когда взаимодействуют два одинаковых рецептора) или гетеромерными (когда рецепторы относятся к двум разным типам и даже классам). Чаще всего комплексы бывают димерными, но бывают и мультимерные (приставки там три-, тетра- и больше). Обещаем, что не будем вольно жонглировать всей этой терминологией!
Так вот, первое предположение о наличии межрецепторных комплексов было сделано еще в середине 1970-х, когда Л. Лимбёрд, П. Мейтс и Р. Лефковиц заподозрили β-адренергические рецепторы в формировании таковых [15]. Долгое время это оставалось не более чем предположением, но уже к концу 1990-х вместе с развитием методик и пониманием структуры рецепторов изменилось и представление об их связях. Так, стало известно, что вкусовые рецепторы, отвечающие за восприятие сладкого и вкуса умами, формируют облигатные (т.е. постоянные) комплексы. Точно так же, исключительно «в паре», работают и GABAB рецепторы , связывающиеся с ГАМК [16]. Указанные рецепторы относятся к классу С GPCR и отличаются внушительным (по молекулярным меркам) внеклеточным доменом, благодаря которому крепко «сцепляются» друг с другом. Скажем сразу, GPCR класса А так себя не ведут.
Это тот самый Роберт Лефковиц, который вместе с Брайаном Кобилкой разделил Нобелевскую премию за исследования GPCR: «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [17].
GABAA рецепторы — это ионные каналы.
Фокус в нашей статье будет смещен на гетеродимеры, так как именно в таких комплексах функция рецепторов меняется сильнее всего. Примечательно, что еще в 2007 году IUPHAR (аналог ИЮПАК в области фармакологии) определил три критерия, по которым гетеродимер официально признается таковым [18]: 1) рецепторы должны быть физически связаны в клетках (in vitro) или нативной ткани (in vivo); 2) формирование комплекса должно иметь какие-то функциональные последствия для сигнализации рецепторов; 3) удаление одного протомера с помощью генетического нокаута или РНК-интерференции должно изменять реакцию, опосредованную гетеродимером in vivo, что является лучшим подтверждением значимости комплекса в живом организме. Сами авторы процитированной выше работы признались, что достаточно выполнения хотя бы двух критериев.
The International Union of Basic and Clinical Pharmacology, в то время как ИЮПАК (IUPAC) — это International Union of Pure and Applied Chemistry.
Сразу скажем, что точный механизм димеризации GPCR класса А (и 5-НТ рецепторов в их числе) неизвестен. Современные данные указывают на по крайней мере три возможных механизма [5]. Первый — это взаимодействие внеклеточными доменами с формированием ковалентных связей. Второй — связывание через ТМ-домены. И, наконец, третий путь — задействовать внутриклеточные участки и С-конец рецептора. Как мы указали ранее, первый вариант больше характерен для GPCR класса С c «раскидистыми» внеклеточными доменами. Вроде бы 5-НТ1А и 5-НТ1D рецепторы тоже могут так взаимодействовать [19], но это не точно. Насчет взаимодействия через ТМ-домены предложены две модели: контактная димеризация (рис. 4а) и модель с обменом доменами (domain swapping; рис. 4б) [20].
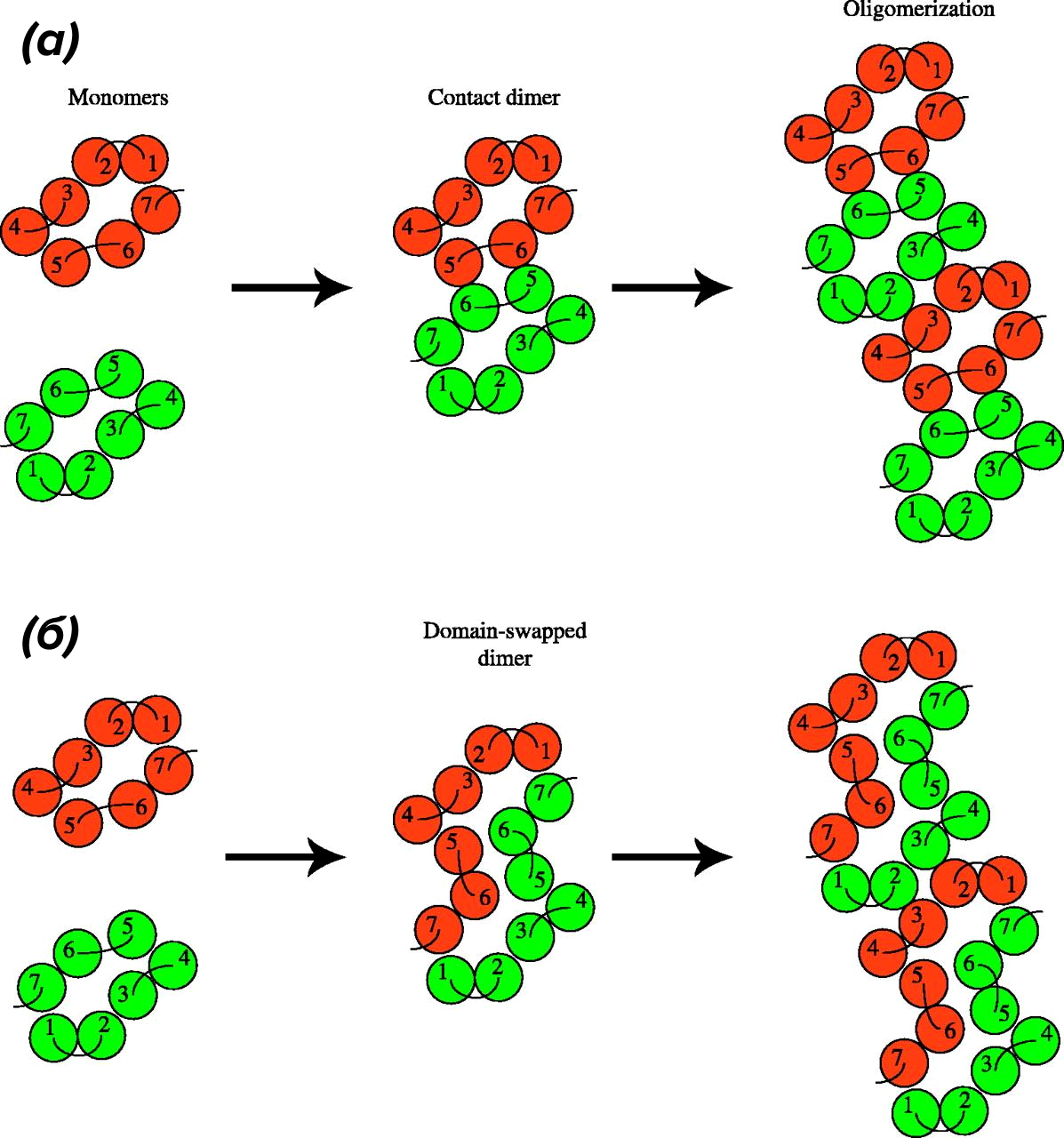
Рисунок 4. Возможный механизм формирования димеров и олигомеров между GPCR (вид на рецепторы «сверху»).
(а) — модель контактной димеризации, когда GPCR напрямую взаимодействуют через внешние аминокислотные основания трансмембранных доменов. Таких участков может быть несколько, что может приводить к образованию олигомера.
(б) — модель с обменом доменами, как и следует из названия, требует изменения целостности каждого участвующего мономера. Допускается, что оба механизма могут быть задействованы при формировании сложноустроенных олигомерных комплексов.
Не будем держать интригу. Обмен между доменами хотя и продемонстрирован экспериментально, энергетически очень затратен и создает трудности для формирования олигомеров более высокого порядка (что уже плохо вяжется с экспериментальными наблюдениями), а потому более простой и эффективный способ контактного взаимодействия между двумя протомерами более вероятен для GPCR [20]. Есть также вероятность, что 5-НТ рецепторы для формирования связи могут использовать и свои С-концы [5].
При каких условиях формируются димеры? Ну, возможно единственным условием является сам факт существования рецепторов. Можно сказать, что аналогия с оживленной толпой, предложенная нами во введении, в свете новых данных не совсем корректна. Димеры могут формироваться уже на ранних этапах синтеза белка в эндоплазматическом ретикулуме (ЭПР) или в процессе созревания в комплексе Гольджи. Предполагается, что таким образом клетка «тестирует» качество получившегося белка. Вероятно, те рецепторы, что не могут связаться с себе подобными, не покидают ЭПР и подвергаются деградации [20], [21]. По крайней мере, для 5-НТ2С рецептора было показано, что на всех этапах своего пути от ЭПР до клеточной мембраны он транспортируется в виде олигомерных комплексов [22]. Несмотря на это, димеры на клеточной мембране, вероятно, формируются на очень короткое время. Вопрос, разумеется, дискуссионный, ведь оценивать стабильность связи нужно индивидуально для каждого гомо-, и уж тем более, гетеромерного комплекса. А еще нужно отдельно рассматривать условия, стабилизирующие/дестабилизирующие димер. Например, для 5-НТ1А рецептора было показано, что холестерол, чем его больше, тем активнее способствует формированию димеров между рецепторами и делает их стабильными [23]. Так что спешить с выводами относительно всех GPCR класса А пока не стоит: данных маловато.
Как уже упоминалось ранее, формирование комплекса между разными рецепторами — гетеродимеризация — может драматически изменить сигналинг обоих протомеров в комплексе вследствие функциональных перекрестных помех (cross talk ): один протомер меняет свой «родной» G-белок на такой же, как у второго (рис. 5а), или у них вообще становится один G-белок на двоих, или три [24]. На рисунке 5б можно увидеть, что дофаминовые рецепторы 1 и 2 подтипа при формировании гетеродимера остаются с одним G-белком, и при этом подсемейство Gα-субъединицы не характерно ни для D1-, ни для D2-рецептора. Естественно, это приводит к изменению фармакологических свойств рецептора. Скажем, когда 5-НТ2А рецептор находится в гетеродимере с канабиноидным рецептором CB1, его блокада антагонистом приводит к автоматической блокаде сигналинга CB1. Тот же D1-рецептор в норме никогда не стимулирует выброс кальция, но в гетеродимере его активация как раз к этому и приводит. В дальнейшем мы еще не раз увидим фармакологические странности гетродимеров.
Адекватного перевода данного термина на русский язык нет. Вместе с тем, в зарубежной литературе он широко употребим: в PubMed можно найти более 26 000 его упоминаний.
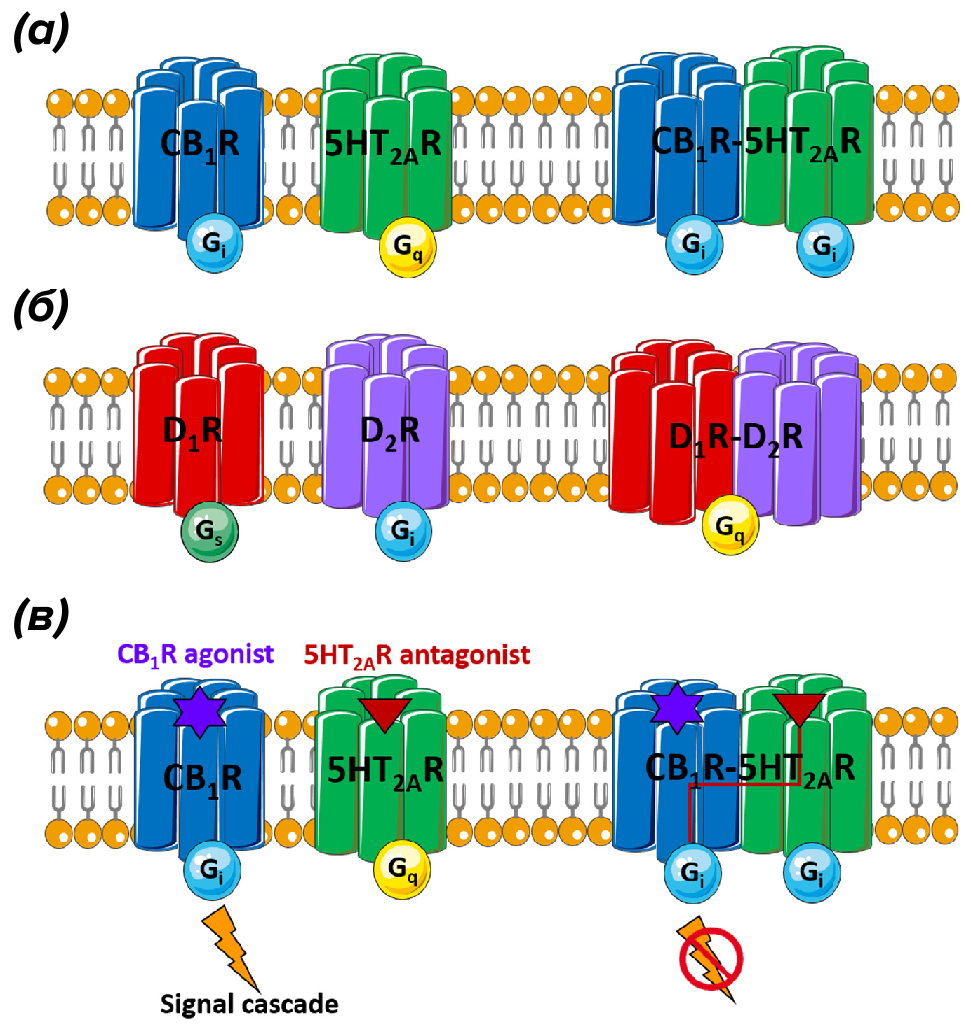
Рисунок 5. Примеры функциональных взаимодействий между различными GPCR.
(а) — на схеме видно, что мономеры 5-НТ2А и канабиноидного СВ1 рецептора связаны с разными G-белками (Gi и Gq, соответственно), однако при димеризации 5-НТ2А «переключается» на связывание с Gi-белком.
(б) — другой пример, когда дофаминовые D1- и D2-рецепторы, в мономерном состоянии связанные с Gs или Gi-белком, при димеризации «выбирают» Gq-белок (причем один на двоих).
(в) — на схеме можно увидеть функциональное значение подобных пертурбаций. Антагонист 5-НТ2А связывается со своим рецептором, но блокирует и сигналинг СВ1 рецептора. Здесь, кстати, имеется один интересный аспект. Тетрагидроканнабинол является прекрасным обезболивающим, но с неприятным побочным эффектом в виде ухудшения памяти и внимания. Как выяснилось, этот эффект обусловлен именно димеризацией 5-НТ2А и СВ1-рецепторов. Но прямая блокада 5-НТ2А рецепторов не способна помочь, так как отменяет обезболивающий эффект от активации СВ1.
Гетеродимеры 5-НТ рецепторов
Вот мы и подобрались к обзору наглядных примеров межрецепторных взаимодействий. Одним из ярких экземпляров здесь являются гетеромеры между 5-НТ1А и 5-НТ7 рецепторами. Чем же они так интересны? А вот чем. 5-НТ1А рецепторы сопряжены с Gαi/o-белками, поэтому их активация приводит к ингибированию аденилатциклазы и снижению цАМФ. Вдобавок, Gβγ-субъединица ингибирует кальциевые токи и активирует калиевые каналы. Всё это неминуемо ведет к подавлению электрической активности нейрона. 5-НТ1А рецепторы располагаются на телах и дендритах 5-НТ нейронов (тогда они именуются ауторецепторами), благодаря чему могут регулировать секрецию серотонина. По сути, 5-НТ1А рецептор — это своеобразная «узда», которая притормаживает активность 5-НТ нейронов, когда они начинают производить слишком много серотонина. Ну, так должно быть в идеале. В реальности количество 5-НТ1А рецепторов может возрасти, и тогда случится хронический дефицит серотонина, который может привести к развитию депрессии. Такой сценарий был продемонстрирован во многих экспериментах на животных и, что самое главное, у пациентов с депрессией [25], [26]. Прямо противоположно действуют 5-НТ7 рецепторы, которые сопряжены с Gαs-белками и при активации стимулируют цАМФ. А кроме того, 5-НТ7 рецепторы активируют малые ГТФазы, за счет чего регулируют синаптогенез и рост нейритов [27]. Обычно при активации рецептора он интернализуется, то есть уходит с клеточной мембраны внутрь клетки (хотя бы временно). Проблема в том, что 5-НТ1А рецепторы крайне устойчивы к интернализации. Вероятно, в этом кроется одна из причин медленного действия антидепрессантов (а то и полного отсутствия эффекта).
Но также большие популяции 5-НТ1А рецепторов существуют и на постсинаптических окончаниях в проекционных областях 5-НТ нейронов.
Однако, когда в 2012 году исследователи из Германии установили существование гетеродимеров между 5-НТ1А и 5-НТ7 рецепторами, они обнаружили, что в таком комплексе кинетика интернализации 5-НТ1А значительно возрастает [28]. Можно сказать, что при активации 5-НТ7 интернализуется и утягивает вместе с собой 5-НТ1А рецептор. Но и это не всё. Те же исследователи показали, что гетеродимеризация приводит к ингибированию калиевых каналов в нейронах гиппокампа [28]. То есть и в этом случае функция 5-НТ1А рецепторов подавляется. Если считать 5-НТ1А рецептор поводком, накинутым на серотониновую систему, то получается, что 5-НТ7 — уже поводок для поводка. Неудивительно, что была предложена гипотеза, в соответствии с которой в основе депрессивных расстройств может лежать дисбаланс между 5-НТ1А—5-НТ1А гомодимерами и 5-НТ1А—5-НТ7 гетеродимерами [27]. Когда первых становится больше, а вторых — меньше, развивается патология (рис. 6). Недавно было получено косвенное (но очень существенное) подтверждение этой гипотезы. Коллектив авторов из новосибирского Института цитологии и генетики СО РАН опубликовал статью, в которой показано, что при индукции сверхэкспрессии 5-НТ7 рецепторов в ядрах шва среднего мозга как у «нормальных» мышей С57Bl6, так и у мышей «депрессивной» линии ASC , происходит снижение количества 5-НТ1А рецепторов, и вместе с этим усиливается обмен серотонина, а в поведении наблюдается антидепрессант-подобный эффект [29]. Если гетеродимеризация между 5-НТ1А и 5-НТ7 рецепторами и не претендует на звание всеобъемлющего объяснения механизма депрессии, то само это явление может стать многообещающей мишенью для нового поколения антидепрессантов.
Авторы статьи, которую вы читаете, являются сотрудниками лаборатории, в которой провели исследование, а один из авторов — соавтор публикации [29].
Название этой линии расшифровывается как antidepressant sensitive cataleptics. Эти мыши, созданные в ИЦиГ СО РАН, отбирались по признаку высокого уровня пассивно-оборонительной реакции замирания (каталепсии). Вместе с этой реакцией усилился и целый поведенческий комплекс, который можно в полной мере назвать депрессивноподобным. А еще у этих мышей, как и следует из названия, высокая чувствительность к классическим антидепрессантам.
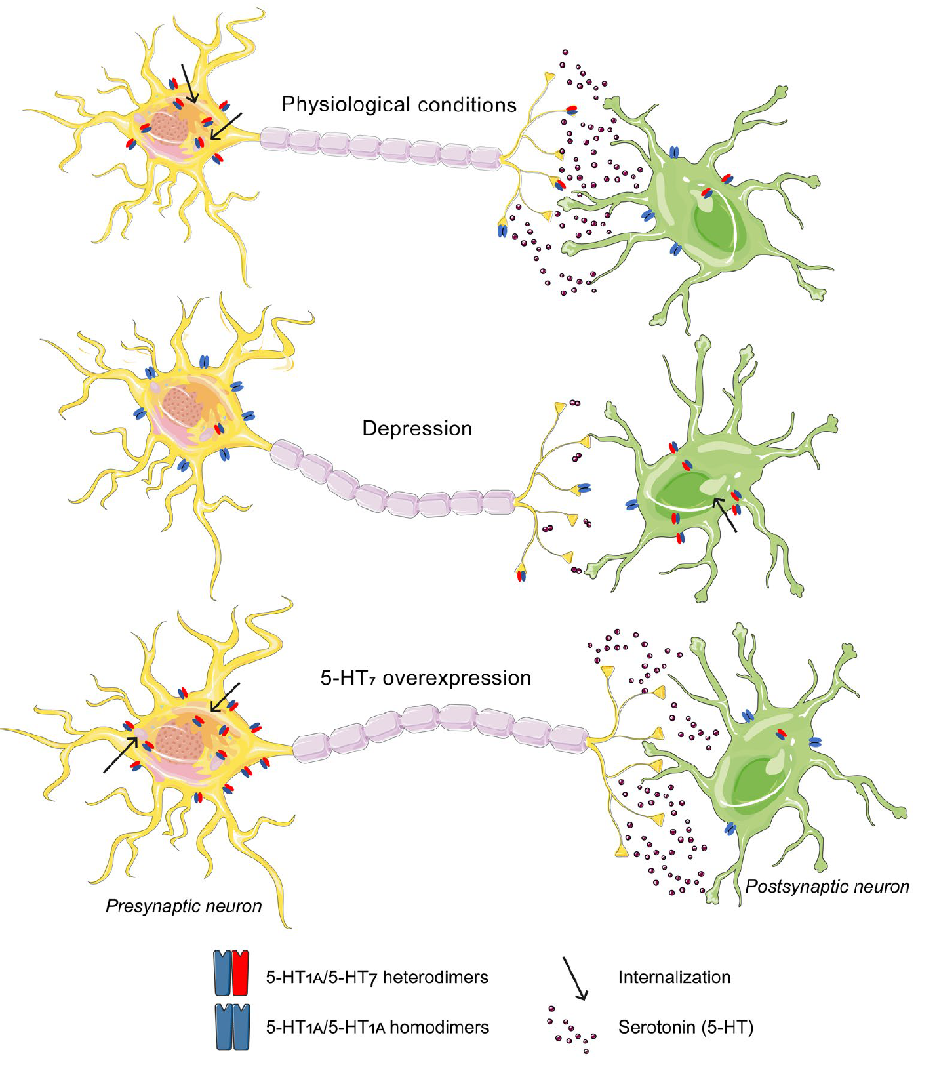
Рисунок 6. Гипотетический механизм, показывающий роль 5-НТ1А—5-НТ7 гетеродимеризации в механизме депрессии и влияние сверхэкспрессии 5-НТ7 рецепторов. При физиологических состояниях количество 5-НТ1А—5-НТ7 гетеродимеров на пресинаптических нейронах выше, чем на постсинаптических. При депрессии баланс смещается в сторону преобладания 5-НТ1А гомодимеров, что должно приводить к уменьшению секреции серотонина. Когда мы осуществляем сверхэкспрессию 5-НТ7 рецепторов, баланс смещается обратно — в сторону преобладания 5-НТ1А—5-НТ7 гетеродимеров, благодаря чему активность 5-НТ1А снижается, а уровень серотонина восстанавливается.
Гетеродимеры 5-НТ и других GPCR
Серотониновые рецепторы «не желают» оставаться в рамках своей системы и нередко находят себе пару с рецепторами к другим нейромедиаторам. Иногда с плачевными последствиями. Остановимся здесь на примере гетеродимеризации между 5-НТ2А рецепторами и метаботропными глутаматными рецепторами mGlu2. Данные рецепторы кардинально отличаются по своим сигнальным свойствам. mGlu2 по сигналингу похож на уже знакомый нам 5-НТ1А рецептор, в то время как для 5-НТ2А в ответ на активацию характерно повышение внутриклеточного кальция через Gαq-белки. Этот рецептор — активирующий. А еще его много в коре головного мозга — например, в пирамидальных нейронах и вставочных глутаматных интернейронах. Там же обычно можно найти и mGlu2 рецептор. Интригует то, что в мозге пациентов, страдавших шизофренией и не получавших лечения, повышен уровень 5-НТ2А рецепторов и снижен уровень mGlu2. На этот дисбаланс обратили внимание исследователи, впервые обнаружившие 5-НТ2А—mGlu2 гетеродимеры [30]. А потом эти гетеродимеры были обнаружены в коре пациентов с шизофренией [31]. Но как шизофрения и гетерокомплексы могут быть связаны? Всё дело, разумеется, в нарушении сигналинга.
В сформировавшемся гетеромерном комплексе устанавливается оптимальный баланс Gαi-Gαq сигналинга в ответ на серотонин или глутамат (преобладает передача сигналов через Gαi- и в меньшей степени — через Gαq-белки). Когда употребляют психоделики (например, LSD или псилоцибин), являющиеся агонистами 5-НТ2А рецепторов, баланс резко изменяется в сторону Gαq-сигналинга (рис. 7а). Получается, что 5-НТ2А рецепторы как бы выхватывают у mGlu2 «вожжи», что приводит к развитию психоза. К тому же приводит и нарушение баланса в сигналинге, когда доля Gαq существенно увеличивается (рис. 7б) [32]. Вероятно, именно это и происходит и в мозге больных шизофренией. Из-за дисбаланса в гетеромерных комплексах и смещения сигналинга в сторону 5-НТ2А-опосредованного, несчастные люди испытывают галлюцинации в отсутствие галлюциногенов. Как известно, устранению психоза помогает применение антипсихотических препаратов (например, клозапина и рисперидона), усиливающих сигналинг через Gαi. Полагаем, вы не удивитесь, если узнаете, что антипсихотические препараты являются частичными блокаторами 5-НТ2А рецепторов. Еще раз хочется отметить, что все эти фармакологические «фокусы» возможны только в гетромерных комплексах. Кажется, что один из ключей к пониманию патогенеза шизофрении — в высшей степени удивительного нейропсихического заболевания — лежит в изучении гетеродимеров серотониновых и глутаматных рецепторов. Тут же стоит сказать, что существуют димеры 5-НТ2А и дофаминовых D2-рецепторов, которые, вероятно тоже вовлечены в патогенез шизофрении [5]. Но это уже другая история.

Рисунок 7. Баланс Gαi—Gαq и объяснение действия психоделиков и антипсихотических препаратов через 5-НТ2А—mGlu2 гетеродимеры.
(а) — при формировании рецепторного комплекса устанавливается оптимальный баланс в Gαi—Gαq сигналинге в ответ на глутамат и серотонин (усилен сигналинг через Gi и ослаблен через Gq). Психоделики изменяют баланс и смещают сигналинг сильно в сторону Gq, что провоцирует психоз.
(б) — собственно при психозе, который можно наблюдать у больных шизофренией, баланс Gαi—Gαq изменен в сторону недостаточного сигналинга Gi и выходящего за норму сигналинга Gq. Антипсихотические препараты компенсируют возникший дисбаланс, существенно усиливая Gi сигналинг и ослабляя Gq.
Вот это поворот! Гетеродимеры между 5-НТ рецепторами и не-GPCR
«На закуску» мы оставили нечто еще более любопытное. Уже довольно давно известно, что серотонин и различные нейротрофические факторы модулируют друг друга [33], [34]. Скажем, применение антидепрессантов увеличивает экспрессию нейротрофического фактора мозга (brain-derived neurotrophic factor, BDNF). Но каков механизм? Вероятно, действие серотонина оказывается напрямую, через рецепторы нейротрофических факторов, коими являются рецепторные тирозинкиназы. Первый такой гетеродимерный комплекс был обнаружен между 5-НТ1А рецепторами и рецептором фактора роста фибробластов FGFR1. Такие комплексы обнаружились и в гиппокампе, и в ядрах шва среднего мозга крыс [35]. Причем оба рецептора находятся в антагонистических отношениях. Когда активируется протомер FGFR1, сигналинг протомера 5-НТ1А подавляется. Возможно, именно поэтому инъекции фактора роста фибробластов 2 (естественный лиганд FGFR1) приводят к усилению обмена серотонина в ядрах шва и оказывают антидепрессантный эффект на животных. Но это антагонизм до поры до времени. Если одновременно ввести FGF2 и агонист 5-НТ1А рецепторов, можно добиться более стремительного и впечатляющего антидепрессантного эффекта. При связывании с агонистом конформация 5-НТ1А рецептора изменяется, он связывается с β-аррестином и активнее присоединяет FGFR1, а кроме того, стабилизирует образовавшийся гетеродимер [36]. Правда, этот механизм не работает у «депрессивных» крыс линии FSL (Flinders Sensitive Line), что дало исследователям основания для гипотезы о роли нарушений 5-НТ1А—FGFR1 гетеродимеров в патогенезе депрессии [37].
Это большая и разнообразная группа полипептидов (длиной до 200 аминокислот), которые играют ключевую роль в развитии и сохранении структур как центральной, так и периферической нервных систем, принимают участие в регуляции роста, развития, дифференциации, миграции и выживания клеточных популяций, а также процессах их адаптации к внешним воздействиям. См. также: «Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?» [38].
Авторы статьи, которую вы читаете, тоже внесли свои «пять копеек» в вопрос взаимодействия 5-НТ рецепторов и рецепторных тирозинкиназ. Вместе с коллегами из Высшей медицинской школы Ганновера мы недавно установили, что рецептор TrkB (тот, что связывается с BDNF) и 5-НТ2А формируют гетеродимеры. Нам удалось обнаружить эти комплексы в мозге мышей [39]: с помощью метода PLA (proximity ligation assay) мы посчитали их количество и убедились, что количество гетеродимеров в гиппокампе наибольшее. Самое неожиданное то, что в гетеродимерном комплексе 5-НТ2А рецептор блокирует сигналинг TrkB. Как и любая рецепторная тирозинкиназа, TrkB — это фактически гомодимер: только в таком состоянии может произойти аутофосфорилирование внутриклеточного тирозинкиназного домена. Так вот, 5-НТ2А даже в самой маленькой концентрации (1:15) уже снижает аутофосфорилирование, а когда соотношение вырастает до 1:4, то и фосфорилирование TrkB в ответ на лиганд начинает снижаться, вплоть до полного отсутствия (рис. 8). Восстановить аутофосфорилирование получалось только при блокаде 5-НТ2А рецепторов агонистом (мы использовали кетансерин). Интересно, но применение кетансерина усиливало фосфорилирование TrkB и в мозге мышей. Тут есть над чем задуматься. Было неоднократно продемонстрировано, что в гиппокампе жертв суицида наблюдался сниженный уровень как самих TrkB рецепторов, так и их фосфорилирования. Вместе с этим, имелись сообщения о повышенном уровне 5-НТ2А рецепторов. Если мы вспомним рис. 3 и примем во внимание, что антагонисты 5-НТ2А рецепторов широко используются в клинической практике и улучшают эффекты от приема классических антидепрессантов, закрадывается подозрение, что 5-НТ2А рецепторы, формируя гетерокомплексы с TrkB, нарушают их функцию, что может стать еще одной из причин развития депрессии. Конечно, тут требуется больше доказательств, но совершенно очевидно, что 5-НТ2А—TrkB гетеродимеры заслуживают самого пристального изучения.
В качестве такового использовался селективный агонист TrkB рецепторов 7,8-дигидроксифлавон (7,8-DHF), который имитирует участок связывания естественного лиганда — молекулы BDNF.

Рисунок 8. Влияние гетродимеризации 5-НТ2А–TrkB на сигналинг TrkB. На схеме видно, что сам факт взаимодействия между рецепторами приводит к полной блокаде аутофосфорилирования TrkB. Точно так же гетеродимеризация не дает агонисту 7,8-DHF индуцировать фосфорилирование TrkB при его активации. Если 5-НТ2А рецептор заблокировать антагонистом — кетансерином, — то по крайней мере можно восстановить аутофосфорилирование TrkB. Увы, одного этого недостаточно для восстановления ответа на агонист 7,8-DHF.
[39], адаптировано
Заключение
Несмотря на то, что мы лишь в общих чертах познакомились с феноменом олигомеризации рецепторов, некоторые важные выводы напрашиваются сами собой. Во-первых, механизмы некоторых нейропатологий становятся понятнее лишь когда мы смотрим на них под углом олигомеризации. Возможно, это те самые недостающие кусочки пазла, которые могут связать воедино разные, казалось бы, регуляторы нейропластичности — например, нейротрофические факторы и нейромедиаторы. Во-вторых, изучение олигомеризации способствует осмыслению механизмов действия существующих препаратов, доказавших свою эффективность. Тут показателен пример атипичных антипсихотических препаратов, упоминавшихся ранее в статье. В-третьих, с учетом новых данных об олигомеризации, можно осуществить редизайн существующих препаратов, доказавших свою эффективность. И наконец, вооружившись новым знанием, мы можем создать новые препараты, избирательно действующие на несколько мишеней или разрушающих олигомерные комплексы. Сейчас, например, полным ходом идет разработка проникающих в мозг трансмембранных пептидов, которые могли бы разрушать гетерокомплексы 5-НТ2А и СВ1-рецепторов (см. рис. 4), что обещает стать прорывом в лечении хронических болей [24]. Сегодня мы становимся свидетелями сдвига парадигмы в изучении рецепторов, и уже нет никаких сомнений, что нейрофармакология никогда не будет прежней.
Литература
- Jakob Schneider, Ksenia Korshunova, Francesco Musiani, Mercedes Alfonso-Prieto, Alejandro Giorgetti, Paolo Carloni. (2018). Predicting ligand binding poses for low-resolution membrane protein models: Perspectives from multiscale simulations. Biochemical and Biophysical Research Communications. 498, 366-374;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Mariusz Papp, Wiesław Jerzy Cubała, Lukasz Swiecicki, Adrian Newman‐Tancredi, Paul Willner. (2022). Perspectives for therapy of treatment‐resistant depression. British J Pharmacology. 179, 4181-4200;
- Краткая история антидепрессантов;
- Urjita Shah, Hanna Pincas, Stuart C. Sealfon, Javier González-Maeso. (2020). Structure and function of serotonin GPCR heteromers. Handbook of Behavioral Neuroscience. 217-238;
- Аллостерические регуляторы GPCR: ключи от всех замков;
- Серотониновые сети;
- Рецептор медиатора настроения;
- David E. Nichols, Charles D. Nichols. (2008). Serotonin Receptors. Chem. Rev.. 108, 1614-1641;
- T. E. Schwasinger-Schmidt, M. Macaluso. (2018). Other Antidepressants. Antidepressants. 325-355;
- Christine N. Yohn, Mark M. Gergues, Benjamin Adam Samuels. (2017). The role of 5-HT receptors in depression. Mol Brain. 10;
- Grzegorz Ślifirski, Marek Król, Jadwiga Turło. (2021). 5-HT Receptors and the Development of New Antidepressants. IJMS. 22, 9015;
- Nina K. Popova, Anton S. Tsybko, Vladimir S. Naumenko. (2022). The Implication of 5-HT Receptor Family Members in Aggression, Depression and Suicide: Similarity and Difference. IJMS. 23, 8814;
- Спокоен как GABA;
- Lee E. Limbird, Pierre De Meyts, Robert J. Lefkowitz. (1975). β-Adrenergic receptors: Evidence for negative cooperativity. Biochemical and Biophysical Research Communications. 64, 1160-1168;
- Supriya A Gaitonde, Javier González-Maeso. (2017). Contribution of heteromerization to G protein-coupled receptor function. Current Opinion in Pharmacology. 32, 23-31;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Jean-Philippe Pin, Richard Neubig, Michel Bouvier, Lakshmi Devi, Marta Filizola, et. al.. (2007). International Union of Basic and Clinical Pharmacology. LXVII. Recommendations for the Recognition and Nomenclature of G Protein-Coupled Receptor Heteromultimers. Pharmacol Rev. 59, 5-13;
- Kamran Salim, Tim Fenton, Jamil Bacha, Hector Urien-Rodriguez, Tim Bonnert, et. al.. (2002). Oligomerization of G-protein-coupled Receptors Shown by Selective Co-immunoprecipitation. Journal of Biological Chemistry. 277, 15482-15485;
- László Szidonya, Miklós Cserző, László Hunyady. (2008). Dimerization and oligomerization of G-protein-coupled receptors: debated structures with established and emerging functions. Journal of Endocrinology. 196, 435-453;
- Sébastien Bulenger, Stefano Marullo, Michel Bouvier. (2005). Emerging role of homo- and heterodimerization in G-protein-coupled receptor biosynthesis and maturation. Trends in Pharmacological Sciences. 26, 131-137;
- Katharine Herrick-Davis, Barbara A. Weaver, Ellinor Grinde, Joseph E. Mazurkiewicz. (2006). Serotonin 5-HT2C Receptor Homodimer Biogenesis in the Endoplasmic Reticulum. Journal of Biological Chemistry. 281, 27109-27116;
- Xavier Prasanna, Durba Sengupta, Amitabha Chattopadhyay. (2016). Cholesterol-dependent Conformational Plasticity in GPCR Dimers. Sci Rep. 6;
- Maria Gallo, Sira Defaus, David Andreu. (2022). Disrupting GPCR Complexes with Smart Drug-like Peptides. Pharmaceutics. 14, 161;
- Faranak Vahid-Ansari, Min Zhang, Amin Zahrai, Paul R. Albert. (2019). Overcoming Resistance to Selective Serotonin Reuptake Inhibitors: Targeting Serotonin, Serotonin-1A Receptors and Adult Neuroplasticity. Front. Neurosci.. 13;
- Paul R. Albert, Brice Le François, Faranak Vahid-Ansari. (2019). Genetic, epigenetic and posttranscriptional mechanisms for treatment of major depression: the 5-HT1A receptor gene as a paradigm. jpn. 44, 164-176;
- Vladimir S. Naumenko, Nina K. Popova, Enza Lacivita, Marcello Leopoldo, Evgeni G. Ponimaskin. (2014). Interplay between Serotonin 5-HT1Aand 5-HT7Receptors in Depressive Disorders. CNS Neurosci Ther. 20, 582-590;
- Ute Renner, Andre Zeug, Andrew Woehler, Markus Niebert, Alexander Dityatev, et. al.. (2012). Heterodimerization of serotonin receptors 5-HT1A and 5-HT7 differentially regulates receptor signalling and trafficking. Journal of Cell Science;
- Alexander Ya. Rodnyy, Elena M. Kondaurova, Darya V. Bazovkina, Elisabeth A. Kulikova, Tatiana V. Ilchibaeva, et. al.. (2022). Serotonin 5‐HT 7 receptor overexpression in the raphe nuclei area produces antidepressive effect and affects brain serotonin system in male mice. J of Neuroscience Research. 100, 1506-1523;
- Javier González-Maeso, Rosalind L. Ang, Tony Yuen, Pokman Chan, Noelia V. Weisstaub, et. al.. (2008). Identification of a serotonin/glutamate receptor complex implicated in psychosis. Nature. 452, 93-97;
- José L. Moreno, Carolina Muguruza, Adrienne Umali, Steven Mortillo, Terrell Holloway, et. al.. (2012). Identification of Three Residues Essential for 5-Hydroxytryptamine 2A-Metabotropic Glutamate 2 (5-HT2A·mGlu2) Receptor Heteromerization and Its Psychoactive Behavioral Function. Journal of Biological Chemistry. 287, 44301-44319;
- Miguel Fribourg, José L. Moreno, Terrell Holloway, Davide Provasi, Lia Baki, et. al.. (2011). Decoding the Signaling of a GPCR Heteromeric Complex Reveals a Unifying Mechanism of Action of Antipsychotic Drugs. Cell. 147, 1011-1023;
- Anton S. Tsybko, Tatiana V. Ilchibaeva, Nina K. Popova. (2017). Role of glial cell line-derived neurotrophic factor in the pathogenesis and treatment of mood disorders. Reviews in the Neurosciences. 28;
- Nina K. Popova, Vladimir S. Naumenko. (2019). Neuronal and behavioral plasticity: the role of serotonin and BDNF systems tandem. Expert Opinion on Therapeutic Targets. 23, 227-239;
- Dasiel O. Borroto-Escuela, Alexander O. Tarakanov, Kjell Fuxe. (2016). FGFR1–5-HT1A Heteroreceptor Complexes: Implications for Understanding and Treating Major Depression. Trends in Neurosciences. 39, 5-15;
- Dasiel O. Borroto-Escuela, Fidel Corrales, Manuel Narvaez, Julia Oflijan, Luigi F. Agnati, et. al.. (2013). Dynamic modulation of FGFR1–5-HT1A heteroreceptor complexes. Agonist treatment enhances participation of FGFR1 and 5-HT1A homodimers and recruitment of β-arrestin2. Biochemical and Biophysical Research Communications. 441, 387-392;
- Dasiel O. Borroto-Escuela, Patrizia Ambrogini, Barbara Chruścicka, Maria Lindskog, Minerva Crespo-Ramirez, et. al.. (2021). The Role of Central Serotonin Neurons and 5-HT Heteroreceptor Complexes in the Pathophysiology of Depression: A Historical Perspective and Future Prospects. IJMS. 22, 1927;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Tatiana Ilchibaeva, Anton Tsybko, Andre Zeug, Franziska E. Müller, Daria Guseva, et. al.. (2022). Serotonin Receptor 5-HT2A Regulates TrkB Receptor Function in Heteroreceptor Complexes. Cells. 11, 2384.







