
Биопленки. Как живется в бактериальных многоэтажках?
20 января 2023
Биопленки. Как живется в бактериальных многоэтажках?
- 3154
- 0
- 11
Бактериальные многоэтажки в представлении художника
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Бактерии редко живут поодиночке, однако совместное проживание для них — та еще задача. Чтобы успешно сосуществовать, бактерии формируют биопленки, внутри которых травят себя, едят своих сородичей и в результате получают колоссальное преимущество перед человеком в борьбе за его организм.
Конкурс «Био/Мол/Текст»-2022/2023
 Эта работа заняла второе место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.
Эта работа заняла второе место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Если вы думаете, что это нашему виду живется тесно в густонаселенном городе, то вы никогда не рассматривали под микроскопом биопленку. Бактерии внутри биопленок живут в куда более стесненных условиях, образуя многие десятки и сотни плотных слоев, с которыми не сравнится ни один небоскреб.
Биопленки — это самая распространенная форма существования бактерий в природе. Согласно определению 2002 года, предложенному Биллом Костертоном [1], это бактериальное сообщество, состоящее из клеток, прикрепленных к поверхности или друг к другу и встроенных в матрикс из внеклеточных полимеров. Кроме того, клетки внутри биопленок растут со скоростью, отличной от свободноживущих форм, и у них иначе работают целые кластеры генов [1]. Это говорит о том, что биопленки — не просто скопления бактерий, а другая форма их существования.
Сам термин «биопленка» был предложен в 1978 году, но четко сформулировать, что же это такое, удалось лишь в 2002 году. Зеленые обрастания на камнях в ручье — это одна из редких видимых глазом биопленок, поэтому долгое время считалось, что немногие бактерии образуют такие структуры. Но время шло, и невидимые глазом биопленки начали обнаруживать во всё новых местах обитания: в осадках, в почве, на поверхности воды и медицинских приборов. Однако настоящий интерес биопленки вызвали после того, как их начали обнаруживать внутри человеческого тела.
Но с какой целью бактерии образовывают подобные сообщества? Скопление большого количества микроорганизмов в одном месте — это всегда риск быть убитым конкурентами в борьбе за питание, а бактерии не гнушаются никаких средств в войне друг с другом.
Кроме того, бактерии тоже болеют вирусами — бактериофагами, так что образование биопленки — это всегда повышение вероятности фаговых инфекций. И, в отличие от распространения фагов среди разреженных клеток не прикрепленной к субстрату (планктонной) формы, фаги внутри тесных биопленок вызывают быстрое вымирание сообщества. И это не говоря о том, что клетки внутри биопленки зачастую вынуждены выполнять общественно полезные функции и не могут свободно размножаться.
Однако повсеместное образование биопленок явно указывает на то, что у такого образа жизни есть большие преимущества. Одно из них — это высокая устойчивость клеток внутри подобного конгломерата. В биопленке клетки защищены от высокой температуры, недостатка питания и даже от антибиотиков. Уничтожить их очень сложно. Для того чтобы сделать это, требуется концентрация антибиотика в 10–1000 раз выше, чем для уничтожения планктонной формы [3]. Но что обеспечивает такую устойчивость?
Из чего строятся многоэтажки?
Биопленки могут быть очень разнообразны в зависимости от видов, которые входят в их состав. До сих пор речь шла про бактерий, однако на данный момент известно, что в состав биопленки могут входить и другие микроорганизмы: археи, грибы и водоросли [4].
Все биопленки объединяет способность к образованию внеклеточного матрикса. Его пористость, способность поглощать различные вещества, содержание воды и заряд также влияют на свойства биопленки: это не просто «слизь», это сложная система, которая наделяет биопленку разнообразными особенностями. Формирование матрикса — это динамичный процесс, который зависит от доступности питательных веществ и конкуренции между микроорганизмами [5]. Синтез этой структуры энергозатратен, но он же и обеспечивает множество преимуществ — сохранение влаги, экономию ресурсов, эффективное переваривание субстратов за счет общих внеклеточных ферментов (рис. 1).
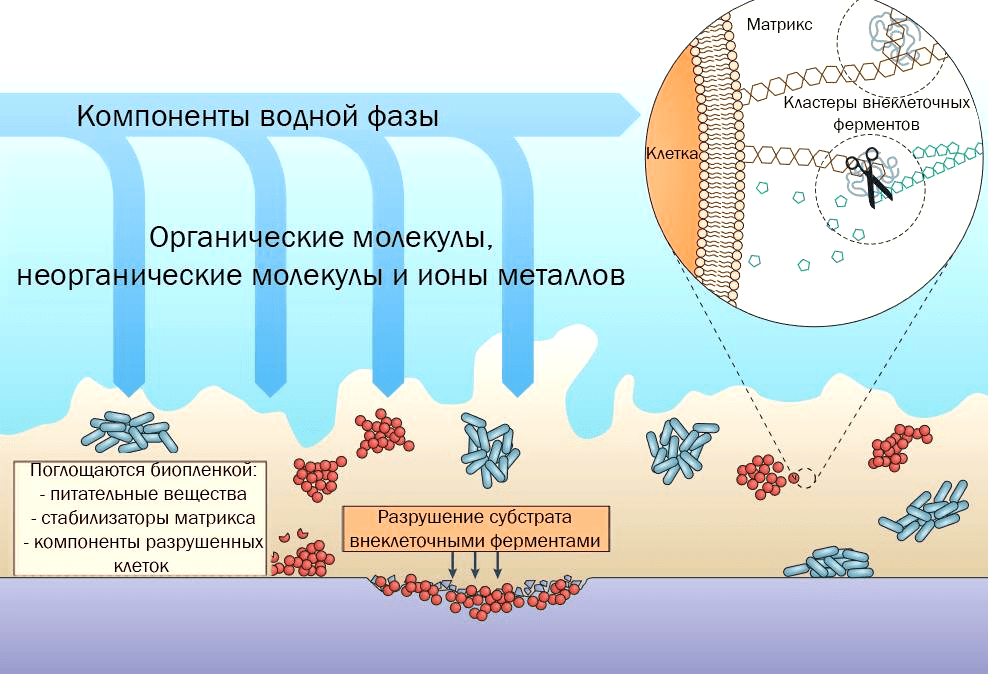
Рисунок 1. Биопленка обеспечивает поверхность для поглощения питательных веществ, а матрикс сохраняет и стабилизирует внеклеточные ферменты, что позволяет клеткам использовать питательные вещества не только с внешней, но и с внутренней, прикрепленной стороны биопленки.
Как правило, основной компонент матрикса — полисахариды. Гидрофобные полимеры в составе биопленки позволяют удерживать воду внутри и избегать пересыхания [6]. Эти же структуры позволяют сохранять в матриксе и внеклеточные ферменты, которые служат для более эффективного переваривания субстратов. Таким образом, матрикс с высоким содержанием в нем ферментов фактически служит внешней системой пищеварения для бактерий [7]. Однако матрикс может содержать в качестве основного компонента не только полисахариды. Например, за некоторыми стафилококками замечено образование матрикса, состоящего в основном из белков [8], хотя это, по всей видимости, исключение.
Кроме полисахаридов, в состав матрикса в незначительных количествах входят белки и липиды, а также удивительно большое количество внеклеточной ДНК. Но какую функцию там может выполнять такая дорогостоящая молекула? В одном из исследований было показано, что в биопленках Pseudomonas aeruginosa внеклеточная ДНК формировала сеткообразные конструкции, что навело авторов эксперимента на мысль о структурной роли [9]. Совсем недавно было обнаружено, что большое количество внеклеточной ДНК в биопленках находится в редкой Z-форме. Специальные белки стабилизируют эту молекулу, делая ее более прочной; кроме того авторы исследования предположили, что присутствие Z-формы ДНК помогает биопленке избежать уничтожения дезоксирибонуклеазами иммунной системы, если биопленка развивается в живом организме [10].
Расселение по домам
Как уже было упомянуто, бактериальные популяции существуют в виде двух субпопуляций: планктонной и прикрепленной. Эти субпопуляции находятся в равновесии, которое поддерживается разными факторами, поступающими как от других бактерий, так и от окружающей среды. От своих собратьев бактерии могут получать как небольшие сигнальные молекулы [11], так и электрические сигналы, причем оба этих фактора влияют на экспрессию генов и могут способствовать прикреплению планктонной формы на субстрат [12]. В последнем случае биопленка испускает ионы калия, которые меняют мембранный потенциал клеток в планктонной форме, что влияет на их подвижность. Это неспецифическая регуляция, которая не требует сложных сигнальных путей, и такое электрически-опосредованное притяжение является общим для большого числа видов бактерий. Как было показано в этом же исследовании, сигнал, испускаемый биопленками Bacillus subtilis, привлекал также планктонные клетки P. aeruginosa.
Микроорганизмы также формируют биопленки как ответ на факторы внешней среды, такие как сигналы о наличии питательного субстрата или воздействие на планктонные клетки сублетальных концентраций антибиотиков [13], [14]. Клетка, которая перешла к формированию биопленки, претерпевает множество изменений. Большие наборы генов меняют свою экспрессию [15]. Субпопуляции клеток внутри биопленки дифференцируются для выполнения разных задач: производства матрикса, питания и размножения [16]. Но с чего начинается образование такой сложной системы? Формирование биопленки обычно разделяют на пять стадий (рис. 2).

Рисунок 2. Формирование биопленки. Стадия 1 — первоначальное прикрепление; стадия 2 — необратимое прикрепление; стадия 3 и 4 — два этапа созревания; стадия 5 — рассеивание. Каждая стадия развития на диаграмме сопряжена с электронной микрофотографией развивающейся биопленки P. aeruginosa.
Все начинается с закрепления клеток на поверхности. Первые бактерии прикрепляются к субстрату за счет вандерваальсовых сил или гидрофобных взаимодействий [17], чтобы затем укрепиться прочнее при помощи пилей — многофункциональных белковых структур на поверхности клетки. Некоторые виды бактерий не способны самостоятельно держаться за поверхность, но они все еще могут прикрепиться к уже созданной матрице или непосредственно к другим бактериям.
После прикрепления клетки начинают активно делиться, формируя микроколонии и вырабатывая внеклеточный матрикс. В процессе созревания в биопленке образуются каналы, необходимые для того, чтобы питательные вещества достигали даже ее глубоких слоев. Это зачастую приводит к разделению биопленки на кластеры, что способствует ее расширению [18]. Если биопленка находится в живом организме, это может привести к развитию острой инфекции [19].
После того, как биопленка сформировалась, она должна колонизировать больше субстратов, и тогда наступает последняя стадия, которая касается лишь некоторых клеток в биопленке. Бактерии, которые покидают биопленку, образуют ферменты (диспергсин В и ДНКазу), разрушающие внеклеточный матрикс [20], [21]. Однако даже покидая биопленку, диспергированные клетки не переходят в нормальную планктонную форму. К примеру, физиология таких клеток P. aeruginosa сильно отличается и от планктонных клеток, и от клеток биопленки. Как выяснилось в одном из исследований, диспергированные клетки более вирулентны — то есть чаще вызывают инфекцию, чем планктонная форма. Уничтожение расселяющихся бактерий макрофагами было почти в 100 раз менее эффективно, более того, клетки были и сами не прочь уничтожить макрофаги [22], [23]. Такие результаты были получены для макрофагов круглого червя Caenorhabditis elegans, так что говорить о важности этого процесса для человека пока рано. Однако уже сейчас понятно, что процесс рассеивания является уникальной стадией при переходе бактерий от биопленки к планктонному образу жизни.
Эти стадии образования биопленок являются общими для огромного числа микроорганизмов и различаются лишь в деталях.
Общение с жильцами
Внутри биопленок сосуществуют разные бактерии, а значит, им всем необходимо как-то общаться и координировать свои действия. И делают они это с помощью чувства кворума. Это явление, при котором бактерии выделяют и обнаруживают в окружающей среде небольшие молекулы различной природы, известные как аутоиндукторы. Система чувства кворума включает в себя сигнальную молекулу (аутоиндуктор), рецептор, фактор транскрипции, а также фермент, катализирующий синтез аутоиндукторов. У одной и той же бактерии способны одновременно сосуществовать несколько систем чувства кворума, которые могут предназначаться для выполнения различных задач — общения с сородичами или бактериями других видов, а также для коммуникации с клетками эукариот [24], [25].
Считается, что бактерии определяют плотность популяции по концентрации аутоиндукторов в среде. Они могут регулировать экспрессию генов в зависимости от количества сородичей рядом — если вокруг никого нет, а питательных веществ в избытке, самое время ускорить метаболизм. Возможно, бактерии используют чувство кворума даже для восприятия потоков жидкостей [26]. Мутантные штаммы, неспособные воспринимать аутоиндукторы, иногда не могут образовывать биопленки [27] или, напротив, образовывают чрезмерно крупные биопленки [28]. В любом случае, в отсутствие аутоиндукторов мы наблюдаем явное нарушение нормального формирования биопленок.
Возникает вопрос: если бактерии находятся в таком тесном сообществе и у них нет жесткой системы регуляции поведения, то как такая система может оставаться стабильной? В биопленках всегда есть микроорганизмы «альтруисты», которые секретируют различные вещества (аутоиндукторы, матрикс, ферменты), тратя свои ресурсы и энергию на помощь сообществу. Однако стоит появиться одному мутанту-«эгоисту», который не будет вкладываться в общее дело — и он получит существенное преимущество, будет активнее размножаться и, в конце концов, выиграет эволюционную гонку. Это доказывает эксперимент с бактерией P. aeruginosa [29]. Для связывания железа, которое необходимо для жизнедеятельности клетки, эти бактерии используют специальное вещество — пиовердин, пигмент, реагируя с которым, ионы металла становятся легко усваиваемыми. Синтез пиовердина затратен для клетки, и поэтому мутантный штамм P. aeruginosa, не производящий это вещество, при попадании в сообщество нормальных клеток начинает паразитировать на своих «альтруистичных» собратьях, активно размножаясь и доминируя в сообществе за счет секретируемого ими пиовердина.
Как же можно защититься от бактерий-«эгоистов»? Один из способов — использование «альтруистических генов» в механизме, необходимом для выживания. Например, у Chromobacterium violaceum молекулы чувства кворума запускают мембранный насос, ответственный за транспорт протеазы во внешнюю среду. Этот насос также отвечает за выкачивание антибиотиков из клетки. Мутанты-«эгоисты», не чувствительные к кворуму, не будут вырабатывать общественно полезную протеазу, но при этом их мембранный насос остается неактивированным. Это значит, что если культура встретится с антибиотиком, то «эгоисты» попросту вымрут [30].
Другая форма контроля наблюдается у Burkholderia thailandensis, где чувство кворума контролирует систему защиты от бактериального токсина [31]. Чувствительные к кворуму клетки включают у себя секрецию токсина и антитоксина (белка, обеспечивающего защиту от токсина). Токсин переносится клетками к соседям во время прямого контакта. Если обе клетки вырабатывают и то, и другое, проблем не возникает, однако если клетка не чувствительна к кворуму, антитоксина у нее нет и при соприкосновении с сородичами она сразу же погибнет.
Однако не стоит воспринимать биопленку как полноценный организм со сложной системой коммуникации — скорее, она подобна стае птиц или косяку рыб. Коллективное поведение разных групп живых существ не всегда предполагает активное общение и координацию. Так, были сформированы три принципа, позволяющие описать роящихся — то есть самоорганизующихся в трехмерном пространстве групп организмов, — каждый организм удаляется от соседей, которые находятся слишком близко, держится рядом с соседями на промежуточном расстоянии и избегает отделения от группы. Скорее всего, бактерии используют те же принципы в своих сообществах, именно поэтому настоящим многоклеточным организмом биопленка не является [32].
Токсичные соседи
Бактерии могут абсорбировать антибиотики и прочие антимикробные агенты на границе биопленки: хорошим примером такого способа защиты являются патогены, живущие в полости рта человека. Сейчас известно, что ополаскиватели для рта с хлоргекседином, убивающие «99% бактерий», на самом деле проникают только в поверхностные слои биопленок [33]. Через несколько часов верхние слои мертвых бактерий исчезают [34]. Но куда они пропадают? Дело в том, что погибшие бактерии могут являться хорошим источником питательных веществ.
Такой микробиологический каннибализм был назван некротрофическим ростом. Например, клетки B. subtilis могут вырабатывать токсины, убивающие родственные бактерии для получения питания [35]. Благодаря этому B. subtilis может выжить в условиях пищевого стресса и избежать споруляции (образования спор), для которой нужно много энергии. А патогенная Legionella pneumophila может использовать мертвые бактерии в качестве источника питания, чтобы сохраняться в воде [36].
Получается, используя ополаскиватель для рта, мы убиваем бактерии, но гибель этих клеток является одновременно защитой и источником питательных ресурсов для популяций внутри биопленок, которые используют их для некротрофического роста. Более того, присутствие в среде мертвых бактерий способно активировать у живых гены вирулентности, отвечающие за разложение пептидов [37], адгезию и инвазию в ткани хозяина и ингибирование его иммунного ответа [38]. Такое повышение вирулентности получило название некровируленции [39].
Нежелательное соседство внутри человека
Звучит жутко? Верно, способность бактерий образовывать биопленки причиняет человечеству массу неудобств. Они формируются во рту [40], на костях [41], внутри легких пациентов с муковисцидозом [42], внутри мочевыводящих путей [43] и мочевого пузыря [44], а также на медицинских приборах [45]. Как уже упоминалось ранее, бактерии в таких сообществах гораздо более устойчивы к антибиотикам, чем планктонные формы. Кроме того, биопленка не позволяет иммунной системе человека обеспечить адекватный ответ на инфекцию [46].
Как это работает? Во-первых, матрикс механически препятствует поглощению бактерий клетками иммунитета. Во-вторых, бактериальные клетки внутри биопленки не распознаются, и иммунные клетки просто не понимают, с чем имеют дело. К примеру, Staphylococcus epidermidis не распознается нейтрофилами за счет содержания в биопленке полимера N-ацетил-глюкозамина. Для разрушения этого полимера у нейтрофилов попросту нет нужных ферментов [47].
Чтобы сформировать биопленку, бактериям надо на чем-то осесть. Производители медицинских устройств, таких как катетеры, часто пытаются изменять физические характеристики или химические свойства материалов, например гидрофобность, чтобы затруднить прилипание патогенных первопроходцев. К сожалению, на поверхностях, погруженных в жидкости организма, образуется покрытие из биологического материала, и бактериям все равно есть, где прилипнуть [48].
Некоторые исследователи включают биологически активные вещества в состав медицинских полимеров. Например, некоторые природные белки, такие как лактоферрин, препятствуют адгезии бактерий. Полимеры, пропитанные антибиотиками, могут задерживать рост биопленки, хотя у этого метода есть важный недостаток, заключающийся в распространении антибиотикорезистентности [49].
Может показаться, что проблема с биопленочным обрастанием касается только людей, которым ставят катетеры, кардиостимуляторы или другие импланты, однако это не так — биопленки формируются в результате многих бактериальных инфекций внутри нашего тела [50]. Хронические инфекции, вызванные распространенным повсеместно Staphylococcus aureus, могут годами доставлять человеку проблемы, заставляя его принимать антибиотики, а это уже приводит нас к следующей проблеме [51].
Место, где зреет мировой заговор
Биопленки, как мы уже выяснили, способны вызывать хронические инфекции, что само по себе представляет опасность. Но что, если мы скажем вам, что, помимо всего прочего, биопленки еще и вносят большой вклад в формирование глобальной устойчивости к антибиотикам?
Здесь важно отметить, что клетки внутри биопленки нечувствительны ко многим антибиотикам благодаря непосредственной защите биопленки — то есть в планктонной форме эти бактерии непременно погибли бы. В биопленке же они защищены как матриксом (он заряжен отрицательно, тогда как большинство антибиотиков — положительно), так и особенностями своей физиологии. А кроме того, клетки на границе биопленки способны жертвовать собой, абсорбируя антибиотик. Благодаря иной экспрессии генов у таких клеток могут просто не работать мишени, на которые нацелены некоторые антибиотики. Кроме того, в биопленках у многих клеток повышается активность помп множественной лекарственной устойчивости — это мембранные белки, которые выкачивают антибиотики наружу [52].
Когда же мы говорим о резистентности бактерий, мы имеем в виду совсем другое — это более специфические механизмы, направленные на инактивацию конкретного антибиотика или его мишени. Это приобретенное под давлением естественного отбора на фоне антибиотикотерапии свойство: то есть мутантные бактерии, которые оказываются нечувствительными к антибиотику, получают преимущество. Конечно, со временем клетки внутри биопленки способны приобретать резистентность, а также передавать ее другим клеткам. И делать это они могут сразу несколькими способами.
Во-первых, сами по себе клетки, которые выживают внутри биопленок на фоне антибиотикотерапии, способствуют возникновению устойчивости. Чем дольше существует популяция, тем выше вероятность, что в какой-то момент времени спонтанно возникнет нечувствительный к антибиотику мутант. В условиях антибиотикотерапии он тут же получит преимущество и будет необходимо менять антибиотик.
Во-вторых, биопленки удобны для осуществления горизонтального переноса генов, в том числе генов антибиотикорезистентности, между бактериями, поскольку клетки в них находятся в очень тесном контакте между собой. В биопленках более высокая частота конъюгации, нежели в планктонных формах [53]. То есть достаточно всего одной клетки, которая приобрела ген резистентности, чтобы резистентной стала вся популяция.
И, в-третьих, в биопленках чаще, чем в планктонной форме, образуются специализированные клетки-персистеры (от англ. persist — сохраняться). Эти клетки действительно сохраняются при неблагоприятных условиях. В отличие от спор, которые представляют собой сложные структуры, клетки-персистеры — это обычные бактерии, которые вошли в состояние сниженного метаболизма. Эффективность большинства антибиотиков зависит от физиологического состояния бактерий: обычно они ингибируют важные активные мишени, делая невозможным выполнение изначальной функции. Поэтому медленно растущие бактерии с низкой метаболической активностью к ним невосприимчивы. Таким образом, было сформулировано предположение, что персистеры — это клетки, которые вошли в состояние низкой метаболической активности [54]. О них уже было подробнее написано в статье на «Биомолекуле» [55]. Персистентные клетки могут формировать все изученные на данный момент микроорганизмы, и механизмы их формирования очень разнообразны. Было показано, что большинство бактерий при благоприятных условиях формируют небольшую (1–3%) неделящуюся субпопуляцию персистеров, биологической функцией которых является сохранение популяции в случае изменений условий среды обитания [56], [57]. В биопленках персистентные клетки образуются значительно чаще, поскольку недостаток кислорода и питательных веществ является одним из факторов, приводящих к переходу нормальной клетки в персистентное состояние.
Как бороться с заговорщиками?
Как уже было упомянуто, уничтожение клеток внутри биопленки порой требует в 100–1000 раз более высокой концентрации антибиотиков. Хуже того, благодаря персистентным клеткам, которые переживают даже самую суровую антибиотикотерапию, биопленочные инфекции все равно рецидивируют раз за разом (рис. 3).
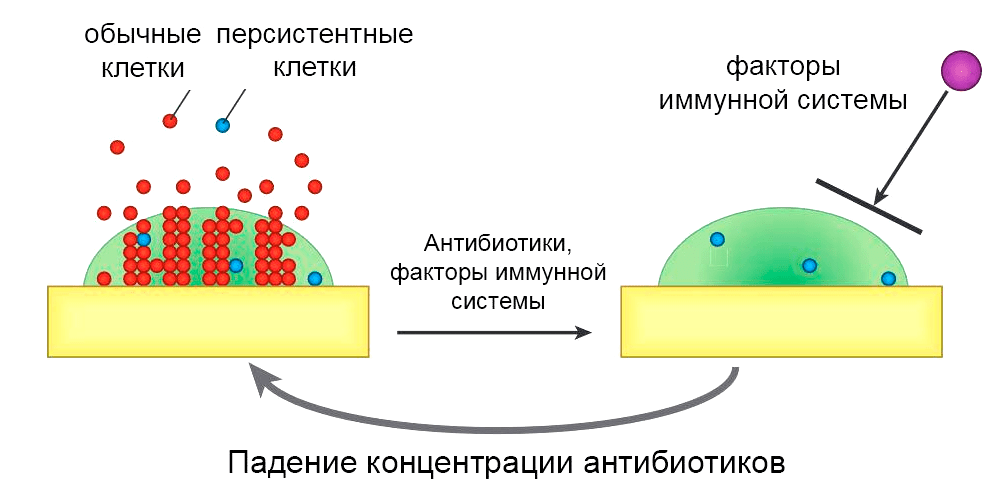
Рисунок 3. Модель рецидивирующей биопленочной инфекции. Обычные клетки и клетки-персистеры образуются в биопленке и попадают в окружающие ткани и кровоток. Антибиотики убивают обычные клетки, а иммунная система устраняет ускользающие клетки-персистеры. Матрикс защищает персистирующие клетки от иммунной системы, и, когда концентрация антибиотика падает, они повторно заселяют биопленку, вызывая рецидив.
Однако нельзя ли побороть эти инфекции иначе, более эффективно? В настоящее время разрабатываются различные препараты, которые смогут разрушить биопленку более хитрым путем, а не в лоб, с применением антибиотиков.
Например, использование ферментов самой биопленки. Для того чтобы колонизировать больше пространства, часть клеток выходит из биопленки, а для этого необходимо разрушить матрикс. В одном исследовании было показано, что диспергсин B, выделяемый бактериями с непроизносимым названием Aggregatibacter actinomycetemcomitans, разрушает биопленки другого микроорганизма — S. epidermidis [58]. Вполне вероятно, что этот диспергсин также может разрушать биопленки других микроорганизмов, но и это само по себе очень обнадеживающее открытие, ведь биопленки S. epidermidis наряду с S. aureus представляют собой огромную проблему в медицине [59].
Кроме того, рассеивание биопленок вызывает и другая молекула — оксид азота (NO). Он широко используется в качестве сигнальной молекулы в биологических системах, а также, как было показано, вызывает рассеивание биопленки P. aeruginosa [60].
Оксид азота обладает потенциалом в качестве средства для лечения пациентов с хроническими инфекциями, вызванными биопленками [61]. В связи с этим было проведено исследование, в котором оксид азота применялся на биопленках различных микроорганизмов. Индуцированное этой молекулой рассеивание наблюдалось во всех исследованных биопленках (образованных грамположительными и грамотрицательными бактериями), и среднее уменьшение общей поверхности биопленки составило целых 63%. Более того, биопленки, подвергшиеся воздействию низких доз NO, оказались более восприимчивы к противомикробной обработке, чем необработанные биопленки [62].
Мы не упомянули также еще об одном способе борьбы с биопленками — их естественных врагах. Речь идет о бактериофагах. К сожалению, как и у антибиотиков, у них есть большой недостаток: бактерии со временем могут приобретать устойчивость к фагам. Кроме того, как правило, фаги очень специфически выбирают своих хозяев, и один и тот же фаг нельзя использовать против разных видов бактерий. Однако в комбинации с антибиотиками фаги показывают хорошие результаты при удалении биопленок P. aeruginosa, особенно при использовании так называемого фагового коктейля — смеси из разных бактериофагов [63]. Подробнее о применении бактериофагов в медицине можете почитать в статье «Биомолекулы» [64]. Но все же стоит помнить, что у фаговой терапии есть много недостатков, таких как нарушение проницаемости кишечника [65] и развитие воспалительного ответа [66].
В последние годы также набирает популярность подход, основанный на подавлении сигналов чувства кворума между бактериями. Для этого используются так называемые гасители кворума. Это могут быть как молекулы, подавляющие синтез аутоиндуктора [67], так и ингибиторы распространения сигнала [68] или ингибиторы рецепции сигнала [69]. Общение бактерий можно прервать на любом этапе, что приведет к нарушению адгезии бактерий к субстрату и уменьшению их вирулентности [70]. Однако пока этот многообещающий подход в медицине не используется, и эффективность большинства препаратов показана лишь in vitro. Больше о гасителях кворума можно прочитать на «Биомолекуле» [71].
Многоликие биопленки
Итак, как вы теперь знаете, биопленки — это неотъемлемая часть нашей жизни. Если познакомиться с этой темой поближе, представление о них переворачивает наш взгляд на сообщества микроорганизмов в природе и показывает, что даже мельчайшие из живых существ способны к сложной координации и совместной работе.
Бактерии во многих аспектах влияют на нашу жизнь, и не только в медицине. Биопленки образуются в нефтепроводах и трубах, они процветают в горячих источниках и могут выдерживать самые разнообразные условия. Кроме того, окаменелые биопленки — строматолиты — одни из древнейших свидетельств жизни на Земле [72].
Литература
- Rodney M. Donlan, J. William Costerton. (2002). Biofilms: Survival Mechanisms of Clinically Relevant Microorganisms. Clin Microbiol Rev. 15, 167-193;
- Kim Lewis. (2010). Persister Cells. Annu. Rev. Microbiol.. 64, 357-372;
- Hong Wu, Claus Moser, Heng-Zhuang Wang, Niels Høiby, Zhi-Jun Song. (2015). Strategies for combating bacterial biofilm infections. Int J Oral Sci. 7, 1-7;
- Hans-Curt Flemming, Thomas R. Neu, Daniel J. Wozniak. (2007). The EPS Matrix: The “House of Biofilm Cells”. J Bacteriol. 189, 7945-7947;
- Thomas R. Neu, John R. Lawrence. (2015). Innovative techniques, sensors, and approaches for imaging biofilms at different scales. Trends in Microbiology. 23, 233-242;
- H.-C. Flemming. (2010). Biodeterioration of synthetic materials - A brief review. Materials and Corrosion. 61, 986-992;
- Hans-Curt Flemming, Jost Wingender, Ulrich Szewzyk, Peter Steinberg, Scott A. Rice, Staffan Kjelleberg. (2016). Biofilms: an emergent form of bacterial life. Nat Rev Microbiol. 14, 563-575;
- Holger Rohde, Christoph Burdelski, Katrin Bartscht, Muzaffar Hussain, Friedrich Buck, et. al.. (2005). Induction ofStaphylococcus epidermidisbiofilm formation via proteolytic processing of the accumulation-associated protein by staphylococcal and host proteases. Molecular Microbiology. 55, 1883-1895;
- Marie Allesen-Holm, Kim Bundvig Barken, Liang Yang, Mikkel Klausen, Jeremy S. Webb, et. al.. (2006). A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms. Mol Microbiol. 59, 1114-1128;
- John R. Buzzo, Aishwarya Devaraj, Erin S. Gloag, Joseph A. Jurcisek, Frank Robledo-Avila, et. al.. (2021). Z-form extracellular DNA is a structural component of the bacterial biofilm matrix. Cell. 184, 5740-5758.e17;
- Sampriti Mukherjee, Bonnie L. Bassler. (2019). Bacterial quorum sensing in complex and dynamically changing environments. Nat Rev Microbiol. 17, 371-382;
- Jacqueline Humphries, Liyang Xiong, Jintao Liu, Arthur Prindle, Fang Yuan, et. al.. (2017). Species-Independent Attraction to Biofilms through Electrical Signaling. Cell. 168, 200-209.e12;
- Ece Karatan, Paula Watnick. (2009). Signals, Regulatory Networks, and Materials That Build and Break Bacterial Biofilms. Microbiol Mol Biol Rev. 73, 310-347;
- Lucas R. Hoffman, David A. D'Argenio, Michael J. MacCoss, Zhaoying Zhang, Roger A. Jones, Samuel I. Miller. (2005). Aminoglycoside antibiotics induce bacterial biofilm formation. Nature. 436, 1171-1175;
- Dingding An, Matthew R Parsek. (2007). The promise and peril of transcriptional profiling in biofilm communities. Current Opinion in Microbiology. 10, 292-296;
- Babak Momeni. (2018). Division of Labor: How Microbes Split Their Responsibility. Current Biology. 28, R697-R699;
- H. Takahashi, T. Suda, Y. Tanaka, B. Kimura. (2010). Cellular hydrophobicity of Listeria monocytogenes involves initial attachment and biofilm formation on the surface of polyvinyl chloride. Letters in Applied Microbiology. 50, 618-625;
- George O'Toole, Heidi B. Kaplan, Roberto Kolter. (2000). Biofilm Formation as Microbial Development. Annu. Rev. Microbiol.. 54, 49-79;
- Michael Otto. (2013). Staphylococcal Infections: Mechanisms of Biofilm Maturation and Detachment as Critical Determinants of Pathogenicity. Annu. Rev. Med.. 64, 175-188;
- Jeffrey B. Kaplan, Chandran Ragunath, Narayanan Ramasubbu, Daniel H. Fine. (2003). Detachment of Actinobacillus actinomycetemcomitans Biofilm Cells by an Endogenous β-Hexosaminidase Activity. J Bacteriol. 185, 4693-4698;
- Era A. Izano, Matthew A. Amarante, William B. Kher, Jeffrey B. Kaplan. (2008). Differential Roles of Poly- N -Acetylglucosamine Surface Polysaccharide and Extracellular DNA in Staphylococcus aureus and Staphylococcus epidermidis Biofilms. Appl Environ Microbiol. 74, 470-476;
- Song Lin Chua, Yang Liu, Joey Kuok Hoong Yam, Yicai Chen, Rebecca Munk Vejborg, et. al.. (2014). Dispersed cells represent a distinct stage in the transition from bacterial biofilm to planktonic lifestyles. Nat Commun. 5;
- Song Lin Chua, Louise D Hultqvist, Mingjun Yuan, Morten Rybtke, Thomas E Nielsen, et. al.. (2015). In vitro and in vivo generation and characterization of Pseudomonas aeruginosa biofilm–dispersed cells via c-di-GMP manipulation. Nat Protoc. 10, 1165-1180;
- Colin A. Lowery, Tobin J. Dickerson, Kim D. Janda. (2008). Interspecies and interkingdom communication mediated by bacterial quorum sensing. Chem. Soc. Rev.. 37, 1337;
- Rhea G. Abisado, Saida Benomar, Jennifer R. Klaus, Ajai A. Dandekar, Josephine R. Chandler. (2018). Bacterial Quorum Sensing and Microbial Community Interactions. mBio. 9;
- Burkhard A. Hense, Christina Kuttler, Johannes Müller, Michael Rothballer, Anton Hartmann, Jan-Ulrich Kreft. (2007). Does efficiency sensing unify diffusion and quorum sensing?. Nat Rev Micro. 5, 230-239;
- Matthew R. Parsek, E.P. Greenberg. (2005). Sociomicrobiology: the connections between quorum sensing and biofilms. Trends in Microbiology. 13, 27-33;
- Brian K. Hammer, Bonnie L. Bassler. (2003). Quorum sensing controls biofilm formation in Vibrio cholerae. Molecular Microbiology. 50, 101-104;
- Ashleigh S. Griffin, Stuart A. West, Angus Buckling. (2004). Cooperation and competition in pathogenic bacteria. Nature. 430, 1024-1027;
- Kara C Evans, Saida Benomar, Lennel A Camuy-Vélez, Ellen B Nasseri, Xiaofei Wang, et. al.. (2018). Quorum-sensing control of antibiotic resistance stabilizes cooperation in Chromobacterium violaceum. ISME J. 12, 1263-1272;
- Charlotte Majerczyk, Emily Schneider, E Peter Greenberg. (2016). Quorum sensing control of Type VI secretion factors restricts the proliferation of quorum-sensing mutants. eLife. 5;
- IAIN D. COUZIN, JENS KRAUSE, RICHARD JAMES, GRAEME D. RUXTON, NIGEL R. FRANKS. (2002). Collective Memory and Spatial Sorting in Animal Groups. Journal of Theoretical Biology. 218, 1-11;
- E. Zaura-Arite, J. van Marle, J.M. ten Cate. (2001). Confocal Microscopy Study of Undisturbed and Chlorhexidine-treated Dental Biofilm. J Dent Res. 80, 1436-1440;
- L Netuschil, E Reich, G Unteregger, A Sculean, M Brecx. (1998). A pilot study of confocal laser scanning microscopy for the assessment of undisturbed dental plaque vitality and topography. Archives of Oral Biology. 43, 277-285;
- Hanna Engelberg-Kulka, Ronen Hazan. (2003). Cannibals Defy Starvation and Avoid Sporulation. Science. 301, 467-468;
- R. Temmerman, H. Vervaeren, B. Noseda, N. Boon, W. Verstraete. (2006). Necrotrophic Growth of Legionella pneumophila. Appl Environ Microbiol. 72, 4323-4328;
- Shaun, M. Sheets. (2008). Gingipain-dependent interactions with the host are important for survival of Porphyromonas gingivalis. Front Biosci. Volume, 3215;
- Hazem Khalaf, Torbjörn Bengtsson. (2012). Altered T-Cell Responses by the Periodontal Pathogen Porphyromonas gingivalis. PLoS ONE. 7, e45192;
- Esteban Rodriguez Herrero, Nico Boon, Martine Pauwels, Kristel Bernaerts, Vera Slomka, et. al.. (2017). Necrotrophic growth of periodontopathogens is a novel virulence factor in oral biofilms. Sci Rep. 7;
- Vincent Zijnge, M. Barbara M. van Leeuwen, John E. Degener, Frank Abbas, Thomas Thurnheer, et. al.. (2010). Oral Biofilm Architecture on Natural Teeth. PLoS ONE. 5, e9321;
- Werner Zimmerli, Parham Sendi. (2017). Orthopaedic biofilm infections. APMIS. 125, 353-364;
- Zheng Pang, Renee Raudonis, Bernard R. Glick, Tong-Jun Lin, Zhenyu Cheng. (2019). Antibiotic resistance in Pseudomonas aeruginosa: mechanisms and alternative therapeutic strategies. Biotechnology Advances. 37, 177-192;
- Peter Tenke, Béla Köves, Károly Nagy, Scott J. Hultgren, Werner Mendling, et. al.. (2012). Update on biofilm infections in the urinary tract. World J Urol. 30, 51-57;
- Sheryl S. Justice, Chia Hung, Julie A. Theriot, Daniel A. Fletcher, Gregory G. Anderson, et. al.. (2004). Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis. Proc. Natl. Acad. Sci. U.S.A.. 101, 1333-1338;
- Rasoul Mirzaei, Rokhsareh Mohammadzadeh, Mohammad Yousef Alikhani, Mohammad Shokri Moghadam, Sajad Karampoor, et. al.. (2020). The biofilm‐associated bacterial infections unrelated to indwelling devices. IUBMB Life. 72, 1271-1285;
- Giovanna Batoni, Luisa Martinez-Pomares, Semih Esin. (2021). Editorial: Immune Response to Biofilms. Front. Immunol.. 12;
- Lisanne Vor, Suzan H. M. Rooijakkers, Jos A. G. Strijp. (2020). Staphylococci evade the innate immune response by disarming neutrophils and forming biofilms. FEBS Lett. 594, 2556-2569;
- Stella Cascioferro, Daniela Carbone, Barbara Parrino, Camilla Pecoraro, Elisa Giovannetti, et. al.. (2021). Therapeutic Strategies To Counteract Antibiotic Resistance in MRSA Biofilm‐Associated Infections. ChemMedChem. 16, 65-80;
- Don Monroe. (2007). Looking for Chinks in the Armor of Bacterial Biofilms. PLoS Biol. 5, e307;
- Kim Lewis. (2001). Riddle of Biofilm Resistance. Antimicrob Agents Chemother. 45, 999-1007;
- Jessica L. Lister, Alexander R. Horswill. (2014). Staphylococcus aureus biofilms: recent developments in biofilm dispersal. Front. Cell. Infect. Microbiol.. 4;
- Nandakumar Venkatesan, Govindaraj Perumal, Mukesh Doble. (2015). Bacterial resistance in biofilm-associated bacteria. Future Microbiology. 10, 1743-1750;
- Martina Hausner, Stefan Wuertz. (1999). High Rates of Conjugation in Bacterial Biofilms as Determined by Quantitative In Situ Analysis. Appl Environ Microbiol. 65, 3710-3713;
- Iris Keren, Niilo Kaldalu, Amy Spoering, Yipeng Wang, Kim Lewis. (2004). Persister cells and tolerance to antimicrobials. FEMS Microbiology Letters. 230, 13-18;
- Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью;
- N. Q. Balaban. (2004). Bacterial Persistence as a Phenotypic Switch. Science. 305, 1622-1625;
- Jeffrey B. Kaplan, Chandran Ragunath, Kabilan Velliyagounder, Daniel H. Fine, Narayanan Ramasubbu. (2004). Enzymatic Detachment of Staphylococcus epidermidis Biofilms. Antimicrob Agents Chemother. 48, 2633-2636;
- Johannes Huebner, MD, Donald A. Goldmann, MD. (1999). Coagulase-Negative Staphylococci: Role as Pathogens. Annu. Rev. Med.. 50, 223-236;
- Nicolas Barraud, Daniel J. Hassett, Sung-Hei Hwang, Scott A. Rice, Staffan Kjelleberg, Jeremy S. Webb. (2006). Involvement of Nitric Oxide in Biofilm Dispersal of Pseudomonas aeruginosa. J Bacteriol. 188, 7344-7353;
- Mingke Yuan, Tao Sun, Jianbing Wu, Yue Fei, Yueqi Yang, et. al.. (2021). The Insights and Perspectives of Nitric Oxide-mediated Biofilm Eradication. CTMC. 21, 2213-2229;
- Nicolas Barraud, Michael V. Storey, Zoe P. Moore, Jeremy S. Webb, Scott A. Rice, Staffan Kjelleberg. (2009). Nitric oxide-mediated dispersal in single- and multi-species biofilms of clinically and industrially relevant microorganisms. Microbial Biotechnology. 2, 370-378;
- Marzanna Łusiak-Szelachowska, Beata Weber-Dąbrowska, Andrzej Górski. (2020). Bacteriophages and Lysins in Biofilm Control. Virol. Sin.. 35, 125-133;
- Zahra Chegini, Amin Khoshbayan, Majid Taati Moghadam, Iman Farahani, Parham Jazireian, Aref Shariati. (2020). Bacteriophage therapy against Pseudomonas aeruginosa biofilms: a review. Ann Clin Microbiol Antimicrob. 19;
- Бактериофаги в медицине;
- George Tetz, Victor Tetz. (2016). Bacteriophage infections of microbiota can lead to leaky gut in an experimental rodent model. Gut Pathog. 8;
- Nathan B. Pincus, Jensen D. Reckhow, Danial Saleem, Momodou L. Jammeh, Sandip K. Datta, Ian A. Myles. (2015). Strain Specific Phage Treatment for Staphylococcus aureus Infection Is Influenced by Host Immunity and Site of Infection. PLoS ONE. 10, e0124280;
- Matthew R. Parsek, Dale L. Val, Brian L. Hanzelka, John E. Cronan, E. P. Greenberg. (1999). Acyl homoserine-lactone quorum-sensing signal generation. Proc. Natl. Acad. Sci. U.S.A.. 96, 4360-4365;
- Yi-Hu Dong, Jin-Ling Xu, Xian-Zhen Li, Lian-Hui Zhang. (2000). AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora. Proc. Natl. Acad. Sci. U.S.A.. 97, 3526-3531;
- Morten Hentzer, Michael Givskov. (2003). Pharmacological inhibition of quorum sensing for the treatment of chronic bacterial infections. J. Clin. Invest.. 112, 1300-1307;
- E. Paluch, J. Rewak-Soroczyńska, I. Jędrusik, E. Mazurkiewicz, K. Jermakow. (2020). Prevention of biofilm formation by quorum quenching. Appl Microbiol Biotechnol. 104, 1871-1881;
- Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение;
- Kevin Lepot, Karim Benzerara, Gordon E. Brown, Pascal Philippot. (2008). Microbially influenced formation of 2,724-million-year-old stromatolites. Nature Geosci. 1, 118-121.







