
Шизофрения и гены: поиск иголки в стоге сена
23 февраля 2023
Шизофрения и гены: поиск иголки в стоге сена
- 4395
- 0
- 9
Наследственная предрасположенность к шизофрении может пугать, если знать только сухие факты и цифры. Рисунок в полном размере.
иллюстрация Александры Куришевой
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Случается, что я пересказываю необычные поступки моих друзей. Однажды мне задали неожиданный вопрос: «А все ли в порядке с головой у друга?» Только врач-психиатр способен подтвердить у пациента психическое отклонение. Но я как биолог хочу лучше понимать биологические процессы шизофрении. Для этого обратимся к последним открытиям в психиатрической генетике.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Шизофрения — это наследственное заболевание. То, что является «распадом личности», в значительной степени обусловлено наследственными факторами. Генетическая предрасположенность к болезни делает человека уязвимым с самого рождения. Окружающая среда — а именно ее неблагоприятное воздействие — способствует ухудшению здоровья. В данном случае, психического здоровья. Если причины шизофрении кроются в геноме человека, то каким образом наследственные факторы приводят к нарушениям психических процессов?
Почему стоит обратить внимание именно на генетику шизофрении? Это расстройство можно считать рекордсменом по сложности изучения. Болезни психики встречаются и у животных. Ветеринары отмечали, что поведение служебных собак, участвующих в боевых действиях, после возвращения домой менялось. Стрессовые факторы способны провоцировать психические отклонения у животных. В случае собак, паттерны поведения напоминали посттравматическое тревожное расстройство. Поэтому даже существует целая научное направление — зоопсихиатрия. Трудно с ходу представить, как зоопсихиатр проводит прием, но пофантазировать можно с помощью рисунка 1.

Рисунок 1. Воображаемый прием у зоопсихиатра. Но если без шуток, поведенческие расстройства животных подробно изучаются и документируются.
иллюстрация Александры Куришевой
Есть и более яркие примеры. Глубоководная пещерная рыба Astyanax mexicanus обладает настолько низкими для позвоночных рыб навыками социального взаимодействия, что ученые выбрали ее как модель изучения аутизма [1].
Но мы говорим про расстройство психики, которое приводит к нарушению единства процессов мышления. Поэтому полноценной животной модели шизофрении не может быть по определению.
Позитивные симптомы шизофрении — галлюцинации и бред — никогда не воспроизведешь in vitro [2]. А физиологические показатели больных шизофренией слишком специфичны, чтобы опираться на них для постановки диагноза.
Так, совокупность представлений о причинах и механизмах развития (этиопатогенез) основных психических расстройств является крайне запутанной. Расстройство аутистического спектра (РАС), синдром дефицита гиперактивности (СДВГ), биполярное расстройство (БР), депрессия и шизофрения характеризуются изменением структур головного мозга, нарушением нейротрансмиссии и обусловлены влиянием генетических факторов.
Чтобы изучить биологический механизм любого заболевания, нужно отталкиваться от чего-то материального. Что, как не гены, могут послужить «отправной точкой» для разгадки одного из самых загадочных заболеваний в истории медицины? У каждого индивида есть определенный набор мутантных вариантов генов. Часть из них передается от родителей, есть редкие мутации, которые возникают случайным образом. Иногда поломки одного гена достаточно, чтобы болезнь проявилась сразу. Например, мутации гена фактора свертывания крови VIII приводят к гемофилии А, а мутации гена фактора свертывания IX — к гемофилии В. Основной симптом гемофилии А и B — повышенная кровоточивость — проявляется с первых месяцев жизни.
Однако психические расстройства по своей природе полигенны: факторы риска разбросаны по всему геному. Это значит, что возможных отклонений от нормы гораздо больше. Они могут быть распределены по всем областям генома и не ограничиваются конкретными генами. Оказываемый эффект таких факторов риска сравнительно небольшой. Однако их суммарный вклад может достичь критического значения, что скажется на состоянии пациента.
Чтобы установить связь между генетической изменчивостью и физиологическими показателями здоровья, сначала нужно получить генетический материал, расшифровать последовательность фрагментов ДНК и потом интерпретировать полученную информацию при помощи существующих баз геномных данных. Если секвенировать ДНК двух случайных людей, получится, что в среднем 99,9% букв будут идентичны. Оставшаяся доля процента определяет индивидуальные особенности человека. Например, внешние признаки: рост, размер ноги или цвет глаз. Но нас интересует другой фенотип — черты личности и особенности поведения.
Образцы ДНК здорового человека и больного шизофренией также будут отличаться на уровне 0,1%. Предстоит разобраться, как разница в виде трех миллионов букв может приводить к галлюцинациям, бреду и апатии (рис. 2).
Рисунок 2. Какой конкретный вопрос задать о генетике шизофрении? И какой ответ возможно получить. Пока что специалистами установлено, что среди родственников больных шизофренией происходит «накопление» случаев заболевания по сравнению с заболеваемостью обычного населения, а риск их заболеваемости прямо пропорционален степени близости родства.
иллюстрация Александры Куришевой
Генетики изучают любые наследуемые изменения ДНК. Генетические изменения называют полиморфизмами. Полиморфизмы бывает разными: это может быть как замена одной буквы, так и перестройка последовательности из большого числа нуклеотидов. Очень редко встречаются вариации копий генов. Это буквально увеличение числа копий одного гена (например, дупликации/удвоение) или наоборот — удаление целых участков (делеции). Все вместе они исполняют роль генетических маркеров. Чаще всего встречаются уникальные варианты в виде единичной замены буквы. Они называются однонуклеотидными полиморфизмами (Single-Nucleotide Polymorphisms, SNP), или снипами. Поскольку снипы имеют высокую частоту встречаемости, они относятся к категории общих вариантов (common variants). Поэтому генетики анализируют их вклад в наследование признаков в первую очередь.
Снипы обладают аддитивными свойствами. Как «песчинки в песочных часах», эффект от каждого снипа накладывается друг на друга и доходит до определенного уровня. Этот индивидуальный показатель называется генетическим риском. Он отражает степень восприимчивости к патологии. В течение жизни к генетическим причинам добавляются факторы окружающей среды. Новые крупицы песка увеличивают размер содержимого сосуда. И теперь оно может достичь порогового значения, что приведет к началу болезни.
В свою очередь, содержание сосуда может быть неоднородным. Для красочности описания крупицы-факторы могут различаться по форме, цвету и даже по своему размеру. В зависимости от вклада, который вносит тот или иной риск-фактор, будет меняться и размер гипотетической крупицы. Хочется добавить, что вряд ли в вашем воображении представится крупица песка размером с булыжник. И так же маловероятно, что оказываемый на целостность личности эффект редких мутаций будет таким же большим.
Но генетическая архитектура — это не груда песка. Недостаточно высыпать все содержимое, чтобы детально под микроскопом разглядеть каждый полиморфизм. Или достаточно (рис. 3)?

Рисунок 3. В последнее десятилетие генетические исследования шизофрении пережили новый расцвет благодаря более совершенным технологическим и статистическим методам. Учитывая стремительный прогресс и присущую молекулярно-генетическим исследованиям сложность (отраженную, например, в обилие терминов), посторонним в этой области может быть трудно понять и оценить результаты исследований генетики шизофрении.
иллюстрация Александры Куришевой
Искать причины психического расстройства на генетическом уровне стало возможно благодаря технологиям высокопроизводительного секвенирования. Раньше для генетического анализа психиатры отбирали пациентов с семейной отягощенностью [3]. Длительные наблюдения установили закономерность: психические расстройства периодически встречаются среди родственников заболевших. Изучая генеалогическое древо семей, генетики находили носителей патогенных вариантов, которые способны приводить к шизофрении. Так, врачи-генетики описали хромосомную перестройку, которая привела к нарушениям в гене DISC1 (Disrupted-in Schizophrenia 1). Генетическое исследование семьи из Шотландии показало, что симптомы шизофрении проявлялись именно среди родственников с данным нарушением [4]. Следующие наблюдения подтвердили, что полиморфизмы в гене DISC1 также могут быть ассоциированы с повышенным риском развития шизофрении [5].
Но такие уникальные пациенты с явной поломкой в гене встречаются крайне редко. В мире же примерно 1% населения болеет шизофренией. Огромное число людей так или иначе имеют предрасположенность к шизофрении, генетическая природа которой гораздо запутанней.
Внедрение методов широкомасштабного сканирования генома (GWAS) упростило поиск полиморфизмов, ассоциированных с развитием шизофрении. С помощью GWAS устанавливают связи между частотами встречаемых аллельных вариантов генов и качественными или количественными фенотипами. В частности, оценивается вклад общих генетических вариантов — снипов. GWAS с использованием методов биоинформатики оценивает совместный эффект этих вариантов (полигенность) и предоставляет доказательства, какие конкретные генетические факторы повышают риск заболеть [6].
Только благодаря Международному консорциуму психиатрической генетики (PGC) были собраны и проанализированы данные секвенирования сотен тысяч пациентов. Научные группы по всему миру объединили усилия, чтобы собрать достаточную по численности выборку из неродственных индивидуумов с диагнозом шизофрения. Полученные данные сравнивают со здоровой контрольной группой. Исследователи проводят полный генетический скрининг и, грубо говоря, ищут отличия между здоровыми и больными людьми. Поэтому изначально не требуется определять цель поиска. Статистический анализ позволяет выявить участки генома (локусы), которые обогащены полиморфизмами, ассоциированными с шизофрений. И среди наблюдаемых отличий на уровне букв есть редкие снипы, имеющие причинно-следственную связь с патологией. Такие варианты называются каузальными.
И если поиск отличий является технически трудной задачей, то интерпретация полученных результатов выглядит гораздо сложнее. Совершенно разные по природе генетические варианты могут комбинироваться друг с другом и приводить к единому результату — проявлению шизофрении. В этом заключается гетерогенность заболевания. Получается, что снипы, ассоциированные с биполярным расстройством или аутизмом, могут быть также связаны с шизофренией. Наблюдаются перекрывания, которые, с точки зрения генетики, делают эти заболевания «родственными» друг другу.
Помимо этого, могут встречаться уже сцепленные между собой снипы. Кандидат в генетические маркеры, возможно, несет с собой в довесок совершенно непонятный снип. И наоборот, без сцепления оба варианта наследовались бы независимо друг от друга. Но в силу, например, близкого расположения, вероятность встретить оба варианта гораздо выше. В идеале, такие парные варианты нужно взять и отделить друг от друга. Для этого требуется приложить дополнительные усилия при анализе частоты встречаемости аллельных вариантов гена.
Допустим, вам удалось разобраться, какой вариант к чему относится. Нельзя быть до конца уверенным, что отобранные снипы отвечают только за развитие шизофрении. Но, благодаря размерам выборок, вероятность этого большая. Следующим шагом вы можете разделить найденные варианты на две группы. Первая группа — это снипы, встречающиеся внутри кодирующей части генов. Наличие таких вариантов может влиять на работу генов. И вторая группа — снипы, расположенные в некодирующих областях. Установить их функциональное значение сложнее.
Вернемся к описанию с песком. Ученые высыпали все содержимое сосуда и смогли детально разглядеть каждую песчинку. Для этого достаточно взять биоматериал пациента, выделить из него ДНК и отправить образцы на секвенирование. Благодаря масштабам проводимых эпидемиологических исследований уже обнаруживаются уникальные случаи. К ним относятся не только носители новых вариаций копий генов. Встречаются редкие мутации в генах, которые напрямую связаны с функционированием центральной нервной системы. Набираются доказательства, что нарушения в определенных нейронах головного мозга служат отправной точкой патогенеза шизофрении и родственных заболеваний. Загадочный генетический пазл шизофрении постепенно собирается. Но что конкретно уже известно исследователям? Какие знания о биологических процессах шизофрении мы с вами можем получить.
В 2022 г. Международный консорциум психиатрической генетки (PGC) провел крупнейший на сегодняшний день GWAS шизофрении. Это третья публикация PGC. В 2008 году первый GWAS шизофрении был проведен на 36 989 пациентах, и контрольная группа состояла из 113 075 человек. В этом году исследователи проанализировали данные GWAS «случай—контроль», которые включали геномы 306 011 человек: 76 755 человек с диагнозом шизофрения и 243 649 здоровых участников. Кроме того, PGC расширила видовое разнообразие групп участников, включив первичную сводную статистику GWAS из девяти выборок, состоящих из испаноязычных участников и контрольной группы афроамериканцев [7].
Один из результатов отдельного GWAS для мужчин и женщин показал, что варианты генетической предрасположенности к шизофрении сходны у обоих полов. Это наблюдение идет вразрез с задокументированными половыми различиями, которые описали психиатры-клиницисты. Считалось, что у мужчин возникновение первого эпизода в более раннем возрасте случается чаще, чем у женщин. Также считалось, что пол влияет на клинический профиль симптомов болезни, ее течение и исход.
Полногеномный поиск ассоциаций выделил 313 снипов, расположенных в 263 различных локусах. Метаанализ предыдущих данных GWAS привел к идентификации 342 независимых снипов, картированных в 287 локусах, которые могут увеличить риск шизофрении. Эти снипы, в основном, являются некодирующими вариантами и связаны лишь с небольшим увеличением риска заболевания. Наличие такого снипа повышает риск шизофрении примерно в 1,1 раза. Чтобы отобрать каузальные варианты с большим эффектом, авторы расставили приоритеты: найти самые значимые варианты, влияющие на работу генов. Комбинируя методы биоинформатического анализа, исследователи выделили три группы генов.
Первая группа включает гены, имеющие по меньшей мере один вариант несинонимичной замены или находящийся в нетранслируемой области (UTR) гена. Такие снипы напрямую затрагивают работу генов. Сюда вошли ген SLC39A8 (содержит каузальный полиморфизм rs13107325), который регулирует захват клетками цинка и марганца, гены регуляторного фактора интерферона 3 (IRF3) и фактора транскрипции KLF6 и не до конца функционально охарактеризованный ген THAP8. Также были затронуты гены, кодирующие убиквитинлигазы E3, PJA1 и CUL9 (Cullin 9). Более ранние исследования подтверждают участие этих генов в патогенезе шизофрении и других психических заболеваний. Например, мутации KLF6 могут приводить к нарушениям метаболизма, из-за которых возникают липидные отложения в нейронах мозолистого тела у пациентов с шизофренией [8].
Ко второй группе относятся гены, в которых снипы влияют на экспрессию генов. Это ген ACE — фермента, регулирующего давление в сосудах, гена даблкортин-подобной киназы 3 (DCLK3), который недостаточно экспрессируется в тканях страдающих шизофренией, и гена синаптосома-ассоциированного белка 91 (SNAP91), который, наоборот, характеризуется повышенной экспрессией. Ранние исследования также обнаружили, что низкий уровень мРНК и снижение белка ACE связаны с повышенным риском шизофрении. В то же время не было установлено причинно-следственной связи между артериальным давлением и риском развития шизофрении. Важно отметить, ACE белок также присутствует на мембранах нейронов и способен расщеплять некоторые нейропептиды, что указывает на его потенциальное участие в патогенезе. Пока что молекулярный механизм, лежащий в основе ассоциации ACE и шизофрении, остается неясным.
Чтобы подробно изучить изменение профиля экспрессии этих генов, нужно провести секвенирование РНК. Данные, полученные от post mortem образцов мозга людей с РАС, БР, шизофренией и контрольной группы показало значительную связь с изменением экспрессии DCLK3 и SNAP91 при диагнозах «шизофрения» и «БР», но не «РАС». SNAP91 кодирует белок сборки оболочки клатрина AP180, который участвует в химической передаче сигналов в синапсах мозга. DCLK3 кодирует серин/треониновую протеинкиназу, которая обладает нейропротекторной функцией. Но еще недостаточно известно о ее потенциальной роли в патогенезе шизофрении.
Третья группа состоит из генов, чьи белки локализованы в синапсах или участвуют в процессе передачи нервных сигналов (рис. 4). Синаптическая дисфункция считается одной из основных причин патофизиологии шизофрении. Гены этой группы кодируют потенциалзависимые кальциевые и хлоридные каналы (CACNA1C и CLCN3), метаботропные рецепторы (глутаматный рецептор GRM1 и рецептор гамма-аминомасляной кислоты GABBR2), а также лиганд-связывающую субъединицу NMDA-рецептора — GRIN2A. Ген SNAP91 также принадлежит к этой группе. Перечень генов, имеющих синаптическое расположение, представлен на рисунке 4.
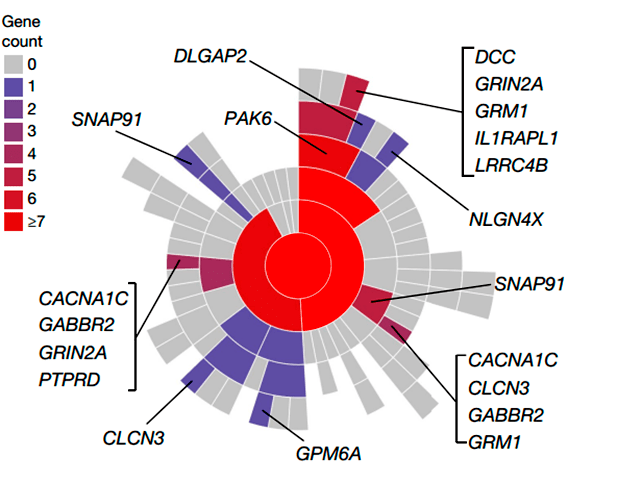
Рисунок 4. Картирование генов. Диаграмма Sunburst отображает расположение синапсов, начиная с синапса (в центре). Пре- и постсинаптическое местоположение — в первом кольце и последующих кольцах. Количество генов в каждом члене обозначены цветовой схемой.
Примечательно, что исследователи обнаружили каузальный полиморфизм rs4766428 в гене ATP2A2. ATP2A2 кодирует белок кальциевого насоса в саркоплазматическом и эндоплазматическом ретикулуме клеток. Связь мутаций в гене ATP2A2 с БР и шизофренией подтверждается и в других работах. Все вместе они свидетельствуют о том, что регуляция цитоплазматического кальция в нейронах через потенциалзависимые кальциевые каналы связана с патогенезом шизофрении. К этой группе также относятся и другие гены, участвующие в организации работы синапсов головного мозга. Допустимо сказать, что генетические факторы риска по оказываемому влиянию сходятся в одном биологическом процессе.
Следует отметить, что большинство приоритетных генов в описанных группах объединяет два факта. Во-первых, они экспрессируются именно в клетках головного мозга. Во-вторых, гены-кандидаты относительно нетерпимы к мутациям с потерей функции белка. Чтобы расширить область поиска потенциальных каузальных вариантов ученые дополнительно секвенируют все белок-кодирующие последовательности генома для поиска ультраредких генетических вариантов [9].
Благодаря данным GWAS ученые заполучили в свой арсенал геномное редактирование (рис. 5).
Рисунок 5. Как в теории выглядит функциональное исследование генетики шизофрении при помощи «молекулярных ножниц». Ученый вырезает каузальный вариант, чтобы убедиться в его значимости.
иллюстрация Александры Куришевой
Для редактирования генома основным этапом является выбор таргетного гена. Многие из генов-кандидатов риска шизофрении или других локусов, идентифицированных PGC-3, являются предметом функциональных исследований на различных моделях, созданных с помощью CRISPR/Cas9 и других технологий редактирования генома. Чтобы установить связь между функцией гена и патогенезом шизофрении достаточно смоделировать соответствующую мутацию с потерей функции путем генетического редактирования в клеточных или животных моделях. Схема эксперимента по генному редактированию представлена на рисунке 6.
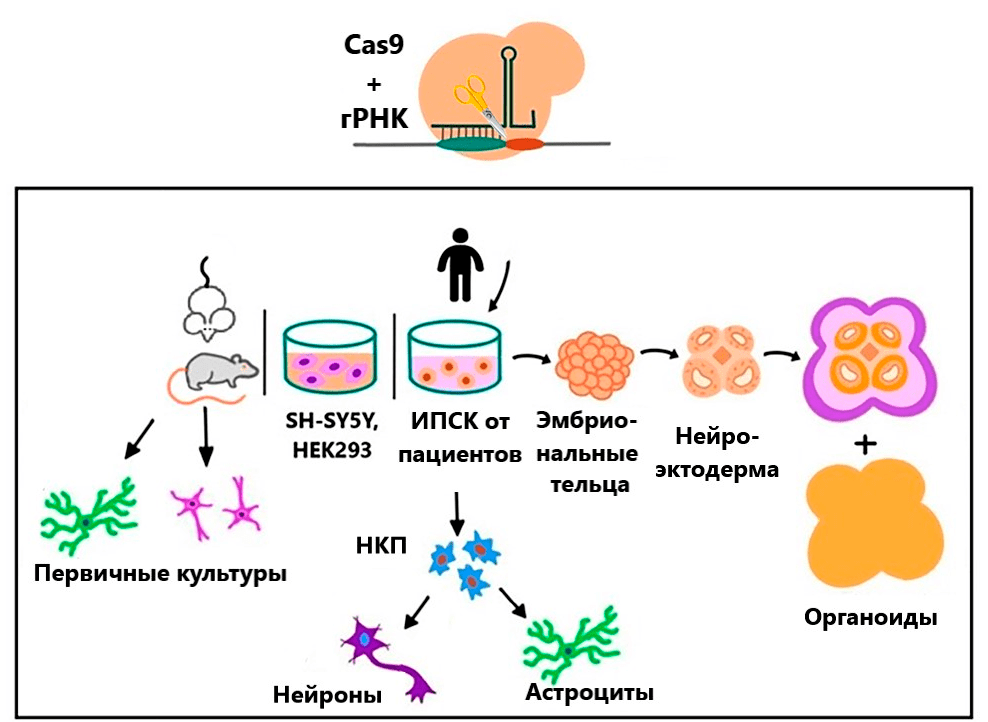
Рисунок 6. Модели, используемые для изучения генетической архитектуры расстройств психики. SH-SY5Y — линия клеток нейробластомы; HEK293 — эмбриональные клетки почки человека; НКП — нейрональные клетки-прогениторы; ИПСК — интродуцированные плюрипотентные стволовые клетки.
[11], рисунок адаптирован
Эти мутации можно изучать как в гомозиготном, так и в гетерозиготном состоянии. Последнее больше относится к заболеваниям человека, потому что у пациентов часто нарушен только один из аллельных вариантов гена. Редактирование генома с помощью систем CRISPR/Cas облегчает создание изогенных клеточных линий. Такая клеточная модель применяется для сравнения контрольной культуры, без редактирования, и соответствующих им клеток с модификацией. Получается, что исходный генетический фон у клеточной модели одинаковый. И поэтому исследователи могут объяснить все изменения в биохимии, физиологии и других параметрах клетки именно с помощью внесенной модификации. Редактирование нейронных клеток-предшественников позволяет наблюдать фенотипические различия не только на клеточном уровне. С помощью клеточных технологий ученые способны в биоинкубаторах культивировать нейронные стволовые клетки до стадии «органоида». А последующее культивирование органоидов друг с другом способно приводить к образованию еще более продвинутых трехмерных структур — ассемблоидов [10].
Экспериментальные работы на клеточных моделях могут подтвердить биологический эффект отобранных мутаций. Поскольку генетики еще до создания PGC изучали потенциальные генетические маркеры шизофрении, функциональные исследования проводились и раньше. Отдельные исследования, изучающие молекулярные механизмы, в которые вовлечены гены риска шизофрении, перечислены в таблице 1 [11].
| Ген/Снип | Геномный редактор / модификация гена | Молекулярные/фенотипические изменения |
|---|---|---|
| ARC | CRISPR-Cas9 / нокаут гена | Изменение экспресии генов, связанных с внеклеточным матриксом и функцией синапсов |
| rs2270363 в 16p13.3 |
CRISPR-Cas9 / делеция в HEK-293T, SH-SY5Y, SK-N-SH, мышиных НСК и кортикальных нейронах крысы | Данный снип снижает экспрессию NMRAL1, что приводит к нарушению пролиферации и дифференцировки НСК и значительно снижает плотность дендритных шипов на нейронах |
| rs796364 и rs281759 в 2q33.1 |
CRISPR-Cas9 / делеция в HEK-293T, SH-SY5Y, SK-N-SH, мышиных НСК и первичных кортикальных нейронах крысы | Было подтверждено, что выбранные снипы регулируют активность TYW5. В свою очередь, нарушение регуляции TYW5 приводит к ухудшению пролиферации и дифференцировки НСК |
| FOXP2 | CRISPR-Cas9 / делеция двух энхансерных последовательностей в 3′-позиции (даунстрим) в SK-N-MC и HEK293 клетках | Делеция участка любого из двух энхансеров снижала экспрессию FOXP2 и его мишеней в SK-N-MC, но существенных изменений в HEK293 не наблюдалось |
| DLG2 | CRISPR-Cas9 / нокаут в эмбриональных стволовых клетках человека | Делеция DGL2 вызвала нарушения регуляции транскрипции, что привело к задержке нейрогенеза. У клеток проявилась аномальная морфология, изменились паттерны миграции и генерации потенциала действия в дифференцированных кортикальных нейронах |
| CUL9 | CRISPR-Cas9 / однонуклеотидные вставки в CUL9, приводящие к мутациям со сдвигом рамки считывания | Делеция гена CUL9 или деплеция белка CUL9 в эмбриональных стволовых клетках человека вызывает образование аберрантных нейронных розеток на раннем этапе нейрогенеза in vitro |
| FURIN | CRISPR-Cas9 / аллельная конверсия снипа rs4702 AA в GG | Индуцированные NGN2 нейроны, несущие вариант rs4702 GG, по сравнению с изогенным контролем имели более короткие нейриты. Также отличалась продолжительность генерации потенциалов действия |
| GRIN2A | CRISPR-Cas9 / A > G точечная мутация, приводящая к замене аминокислоты серина на глицин в полипептидной цепи белка | Гомозиготные и гетерозиготные мутантные мыши отличались измененной формой гиппокампа в возрасте двух недель, но именно гомозиготы погибали от проявления тонико-клонических судорог к середине третьей недели. Гетерозиготные взрослые мыши проявляли склонность к генерализованным приступам, гиперактивности, повторяющемуся и сниженному тревожному поведению |
| Gria3 | CRISPR-Cas9 / ортологическая мутация A647T в мышином гене Gria3 | Мутация приводит к закрытию поры в ионном канале и сбою активации соответствующего глутаматного рецептора. У мутантных мышей наблюдались небольшие изменения в режимах сна и активности, также проявлялась повышенная чувствительность к постоянному освещению |
| KANSL1 | CRISPR-Cas9 / мутация со сдвигом рамки считывания, приводящая к возникновению преждевременного стоп-кодона в экзоне 2 | Дефицит белка KANSL1 связан с повышенным окислительным стрессом и аутофагией в ИПСК и их производных, что ослабляет синаптические связи и снижает активность нейронов как на уровне отдельных клеток, так и на уровне целой сети. Наблюдаемый фенотип нейронов может быть восстановлен антиоксидантом апоцинином |
| SETD1A | CRISPR-Cas9 / гетерозиготная вставка в экзон 7 в культуре глутаматергических и ГАМКергических нейронов, полученных из иПСК | Мутации с потерей функции SETD1A приводят к морфологическому усложнению структуры дендритов и функциональному увеличению их электрофизиологической активности |
| Stag1 и Stag2 |
CRISPR-Cas9 / нокаут генов Stag1 и Stag2 в мЭСК | Инактивация каждого из этих генов приводит к деплеции когезина в хроматине, вследствие чего возникают масштабные нарушения транскрипции генов и снижается пролиферация клеток |
| Bdnf | CRISPR-Cas9 / делеция участка энхансера в мЭСК | Делеция приводила к серьезному уменьшению количества транскриптов Bdnf, содержащих экзоны I, IIc и III |
| FMR1 | CRISPR-Cas9 / нокаут FMR1 | Органоиды с нокаутом FMR1 отличались увеличенным размером и содержали большее количество астроцитов |
| AUTS2 (Autism Susceptibility Gene 2) |
CRISPR-Cas9 / коррекция миссенс-мутации de novo c.1600 A>C | Восстановление пролиферативной активности НКП и улучшение роста церебральных органоидов |
Заключение
Теперь, благодаря работе консорциума по психиатрической генетике, мы знаем, что половая принадлежность никак не влияет на вероятность заболеть шизофренией. Также мы узнали, какие гены представляют повышенный интерес для функционального исследования шизофрении. Научные группы продолжают вести колоссальную работу по скринингу потенциальных мутаций с помощь технологии CRISPR/Cas. И если пока недостаточно данных, чтобы с точностью судить о вкладе снипов GWAS в патогенез шизофрении, возможно предположить, что со временем первые подтвержденные на клеточных моделях каузальные варианты смогут стать биомаркерами шизофрении.
Литература
- Masato Yoshizawa, Alexander Settle, Meredith C. Hermosura, Lillian J. Tuttle, Nicolas Cetraro, et. al.. (2018). The evolution of a series of behavioral traits is associated with autism-risk genes in cavefish. BMC Evol Biol. 18;
- Болезнь потерянных связей;
- Majella Byrne, Esben Agerbo, Preben Bo Mortensen. (2002). Family history of psychiatric disorders and age at first contact in schizophrenia: An epidemiological study. Br J Psychiatry. 181, s19-s25;
- W. Hennah, P. Thomson, L. Peltonen, D. Porteous. (2005). Genes and Schizophrenia: Beyond Schizophrenia: The Role of DISC1 in Major Mental Illness. Schizophrenia Bulletin. 32, 409-416;
- Hong-Yu Wang, Yong Liu, Jun-Wei Yan, Xing-Long Hu, Dao-Min Zhu, et. al.. (2018). Gene polymorphisms of DISC1 is associated with schizophrenia: Evidence from a meta-analysis. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 81, 64-73;
- Chiara Fabbri. (2022). Genetics in psychiatry: Methods, clinical applications and future perspectives. PCN Reports. 1;
- Vassily Trubetskoy, Antonio F. Pardiñas, Ting Qi, Georgia Panagiotaropoulou, Swapnil Awasthi, et. al.. (2022). Mapping genomic loci implicates genes and synaptic biology in schizophrenia. Nature. 604, 502-508;
- Chie Shimamoto-Mitsuyama, Akihiro Nakaya, Kayoko Esaki, Shabeesh Balan, Yoshimi Iwayama, et. al.. (2021). Lipid Pathology of the Corpus Callosum in Schizophrenia and the Potential Role of Abnormal Gene Regulatory Networks with Reduced Microglial Marker Expression. Cerebral Cortex. 31, 448-462;
- Tarjinder Singh, Timothy Poterba, David Curtis, Huda Akil, Mariam Al Eissa, et. al.. (2022). Rare coding variants in ten genes confer substantial risk for schizophrenia. Nature. 604, 509-516;
- Nina Vogt. (2021). Assembloids. Nat Methods. 18, 27-27;
- Artemiy O. Kurishev, Dmitry S. Karpov, Nonna I. Nadolinskaia, Anna V. Goncharenko, Vera E. Golimbet. (2022). CRISPR/Cas-Based Approaches to Study Schizophrenia and Other Neurodevelopmental Disorders. IJMS. 24, 241.







