
Как болезни крови генной терапией лечили
04 августа 2023
Как болезни крови генной терапией лечили
- 1307
- 0
- 3
Кровь издревле ассоциировали с самой жизнью, и теперь-то мы точно знаем: клетки этой таинственной красной жидкости действительно отвечают за жизненно важные процессы. Из-за этого поражающие их болезни могут вызывать самые трагические последствия, но как выяснилось, некоторые из них можно вылечить с помощью генной терапии. Реализовывать все это на практике, впрочем, оказалось делом совсем непростым. Рисунок в полном размере.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Болезни крови — большая и разнообразная группа нозологий, но наследуются лишь некоторые из них, и даже эти генетические отклонения поражают менее 5 из 10 000 человек во всем мире, относясь к категории редких. Однако их «редкость» не умаляет наносимого вреда — эти патологии снижают качество жизни, экономически дорого обходятся, обременяя национальные системы здравоохранения, что во многом связано со способом их лечения. А лечат их в основном дорогостоящей заместительной терапией, причем пожизненной. В последние годы стало ясно, что генетические дефекты, лежащие в основе этих заболеваний, можно скорректировать генной терапией (которой и посвящен этот спецпроект), часто оказывающейся гораздо более эффективной. Недавно это сделалось очевидным и для регуляторов — в 2022 году два препарата этого класса впервые одобрили для лечения гемофилии. Мы обсудим эти и другие генные терапии заболеваний крови, насущные вопросы их эффективности и безопасности, а также огромные финансовые затраты, зачастую затрудняющие их внедрение.
Генная и клеточная терапии

Третий сезон спецпроекта о генной и клеточной терапиях рассказывает о конкретных применениях этих новейших методов для лечения нейромоторных, онкологических, офтальмологических и других заболеваний.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Что за болезни крови и как часто они встречаются?
Во всем мире свыше 20 миллионов человек страдают наследственными патологиями крови — и это разные заболевания: они поражают как отдельные типы клеток крови (форменные элементы), так и ее различные белковые компоненты. К болезням крови можно отнести также нарушения системы кроветворения, патологии сосудов, системы свертывания.
Среди патологий белков плазмы крови преобладают дефициты факторов свертывания (гемофилии), но встречаются и недостаточности некоторых ферментативных ингибиторов — например, α-антитрипсина, компонентов системы комплемента (при наследственном ангионевротическом отеке) и многие другие.
Поражающие клетки крови болезни — следствие ошибок в генах, влияющих на образование или функциональность ее определенных форменных элементов: эритроцитов при гемоглобинопатиях (рис. 1), мононуклеарных фагоцитов при некоторых болезнях накопления; может быть затронут даже весь гемопоэз (процесс кроветворения) — например, при врожденном дискератозе. Эта группа болезней тесно переплетается с наследственными иммунными заболеваниями (например, Х-сцепленный тяжелый комбинированный иммунодефицит), причинами которых также могут быть нарушения гемопоэза.
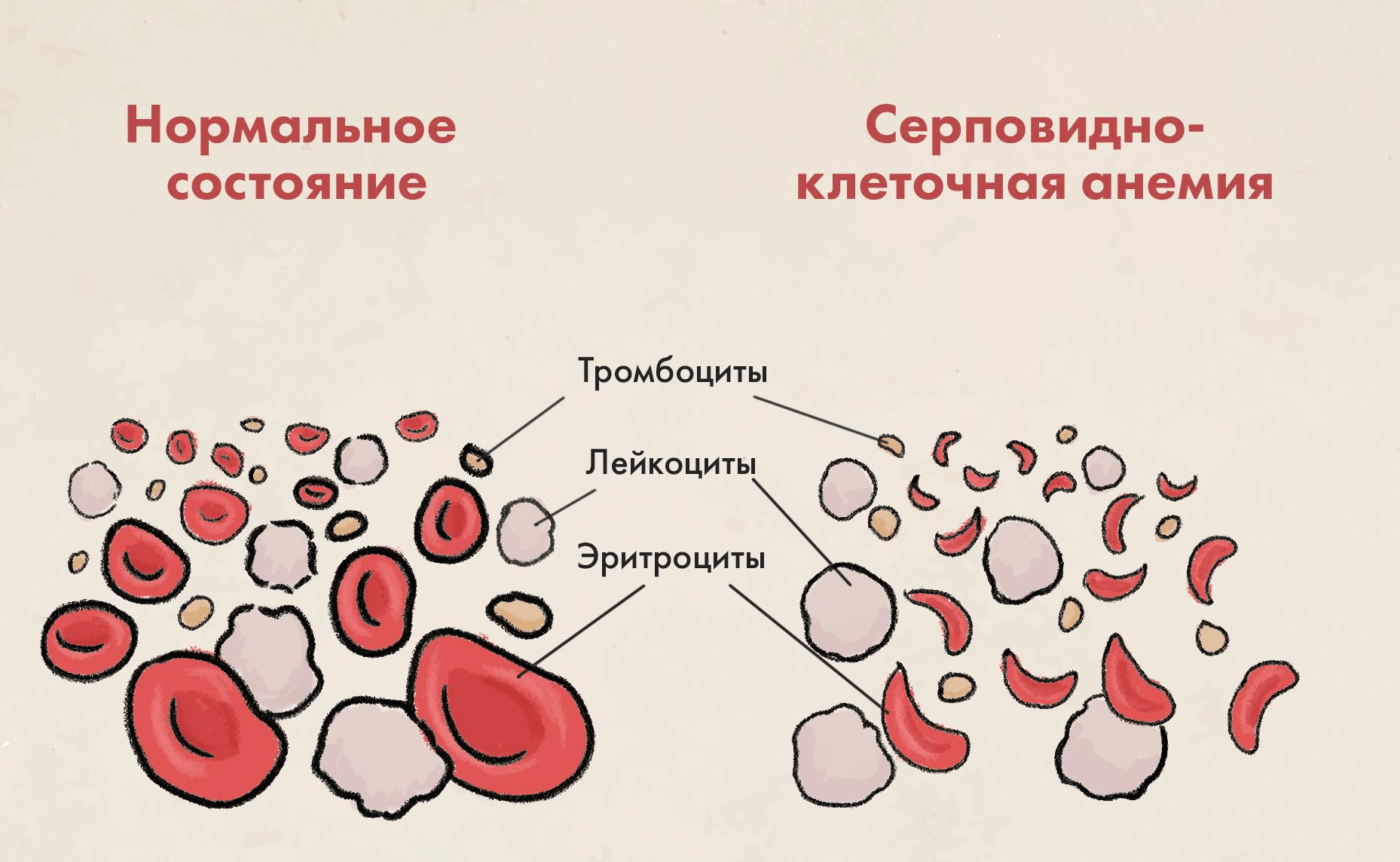
Рисунок 1. При серповидно-клеточной анемии эритроциты деформируются. В отличие от нормы (слева), красные кровяные тельца при этой болезни принимают форму полумесяца или серпа (справа), от этого теряя способность к нормальному переносу кислорода к органам и тканям.
иллюстрация Елены Беловой по Labiotech
Еще одно распространенное и опасное нарушение системы свертывания крови — венозный тромбоэмболизм: образование сгустков крови в венах, мешающих нормальному кровотоку. Мы здесь не будем его касаться, так как четкой генетической причины оно не имеет и слишком многофакторно, чтобы лечить его генной терапией наших дней.
Отдельная группа — злокачественные заболевания крови (гемобластозы): лейкемии, лимфомы и множественная миелома. Это область, где также применяются генотерапевтические подходы, о чем «Биомолекула» уже рассказывала.
Проявления же болезней крови могут быть различными: от анемии и болезненной слабости при бета-талассемии до опасных кровотечений при гемофилии и системных метаболических нарушениях при болезнях накопления — эти и другие патологические состояния разберем далее.
Как лечили раньше и чем лечат сейчас?
Наиболее распространенная тактика лечения большинства наследственных болезней крови — заместительная терапия, при которой «недостающий» белок (или пораженные клетки) пациенты получают вместе с прямой инфузией препарата. Один из ее вариантов: трансплантация гемопоэтических (то есть кроветворных) стволовых клеток костного мозга. Эта практика до сих пор полезна при лечении некоторых заболеваний крови (ниже рассмотрим примеры). Совершенной, правда, ее не назовешь — она достаточно дорогая и небезопасная (чревата смертельными осложнениями), да и совместимого донора найти непросто.
Надо сказать, что долгое время для заместительной терапии использовали донорский материал человека в неизменном виде, что зачастую осложняло лечение. Помимо того, что доноров не всегда хватало, существовал также риск иммунного отторжения и инфицирования реципиента возбудителями из донорской крови. В дальнейшем технология лечения совершенствовалась — при гемотрансфузиях цельную кровь стали разделять на компоненты (плазму и форменные элементы); затем больному переливали только необходимое для лечения (например, эритроцитарную массу при бета-талассемии). Помогло и введение более строгих стандартов качества: скрининга на передаваемые инфекции, тестирования на группы крови и их совместимость — все это само по себе повысило безопасность и эффективность лечения.
Наконец, настоящего прорыва в лечении смогли добиться биотехнологии: были созданы рекомбинантные аналоги «дефектных белков» и внедрено их коммерческое использование в терапевтических целях .
О том, как благодаря развитию научного прогресса генно-инженерные биологические препараты смогли повысить эффективность заместительной терапии при лизосомных болезнях накопления, а также гемофилиях, читайте в статье «Биомолекулы» «Три поколения лекарств» [1].
Тем не менее несмотря на усилия, заместительная терапия и сегодня далека от совершенства: больные все так же нуждаются в пожизненных инфузиях, а их болезни никуда не уходят. Такая терапия во многом поддерживающая — она улучшает состояние за счет снятия симптомов, но не излечивает. Кроме того, при введении чужеродных белков у пациентов иногда развивается на них иммунный ответ, что снижает эффективность лечения и может вызвать серьезные нежелательные явления
Вопрос целесообразности: экономическая эффективность
Сегодня в лечение больных с заболеваниями крови вовлечены немалые ресурсы, а их финансовое покрытие обеспечивается государствами и страховыми компаниями — ведь общие затраты на поддерживающую терапию зачастую просто «неподъемны» для отдельного человека (рис. 2) [2].
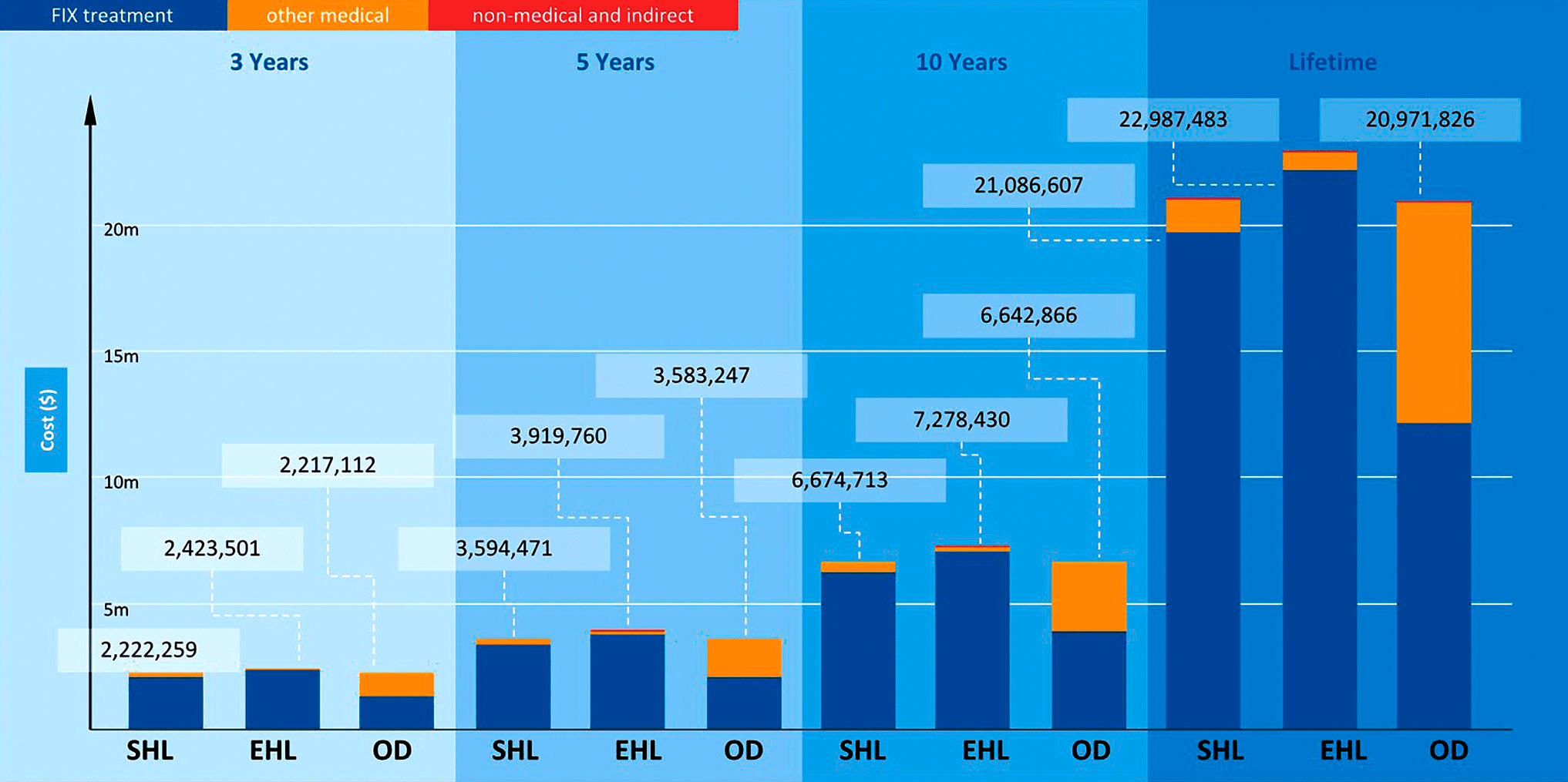
Рисунок 2. Общая стоимость расходов на гемофилию B в США, рассчитанная для различных временных отрезков. Аббревиатуры: EHL — Extended half-life; m — Million; OD — On-demand; SHL — Standard half-life.
Дело в том, что пожизненные инфузии немало стоят сами по себе — это связано не только с дороговизной препаратов. В общую стоимость терапии входят: оплата визитов к врачу или посещений центров инфузионной терапии, расходы на госпитализации, на обслуживание медоборудования для переливаний крови и на прочие дорогостоящие медуслуги.
И хотя в большинстве случаев заместительная терапия замедляет прогрессирование болезней и улучшает состояние, — даже в этом она не всегда достаточно эффективна: у больных с тяжелыми формами заболеваний могут возникать тяжелые (иногда даже летальные) осложнения, проявляющиеся в изнуряющих болях, ухудшениях состояния (порой приводящих к инвалидности), сокращении продолжительности и качества жизни.
Поскольку основной причиной таких болезней являются геномные аномалии, использование генной терапии для их коррекции особо заманчиво — она может «чинить» дефектные гены и теоретически обращать эти патологии вспять. Всё это может значительно улучшить текущий стандарт медицинской помощи с меньшими затратами для общества .
Удивительно, но колоссальная стоимость генной терапии не исключает экономии: такие препараты применяют однократно, потенциально они лечат на всю жизнь и потому могут обходиться дешевле пожизненной заместительной терапии. Например, описанный ниже препарат Hemgenix от гемофилии B получил цену в $3,5 млн, став самым дорогим на рынке, однако при текущих затратах на лечение человека с гемофилией (более $20 млн за жизнь пациента; рис. 2) это лекарство сэкономит значительные средства, снизив общее бремя болезни. Такими расчетами занимается наука фармакоэкономика, о чем мы писали в статье «Фармакоэкономика: лечить или экономить?» [3].
Техники генных манипуляций
Генно-инженерные вирусы — самый популярный инструмент генной терапии. Природа наделила этих крохотных «курьеров» способностью заражать клетки собственным генетическим материалом, что давно используют в медицинских и исследовательских целях [4]. Чтобы получить из обычных вирусов дикого типа рабочие версии генных «доставщиков», их модифицируют: удаляют отвечающие за репродукцию гены, вставляя вместо них гены целевого белка. Измененные таким образом вирусы уже называют векторами (подробнее об этом в предыдущих статьях нашего спецпроекта [5–7]).
Часто дефекты белков крови лечат с помощью генной терапии in vivo — то есть прямым введением пациенту раствора с вирусными векторами: эти носители проникают в клетки, модифицируют их нужными генами, что и дает лечебный эффект. В тоже время для патологий клеток крови имеет преимущество подход ex vivo: клетки человека сначала «изымают», вносят в них необходимые изменения с помощью векторов, после чего такие модифицированные клетки размножают «в неволе» и возвращают в организм, где они и оказывают свое терапевтическое воздействие (рис. 3).
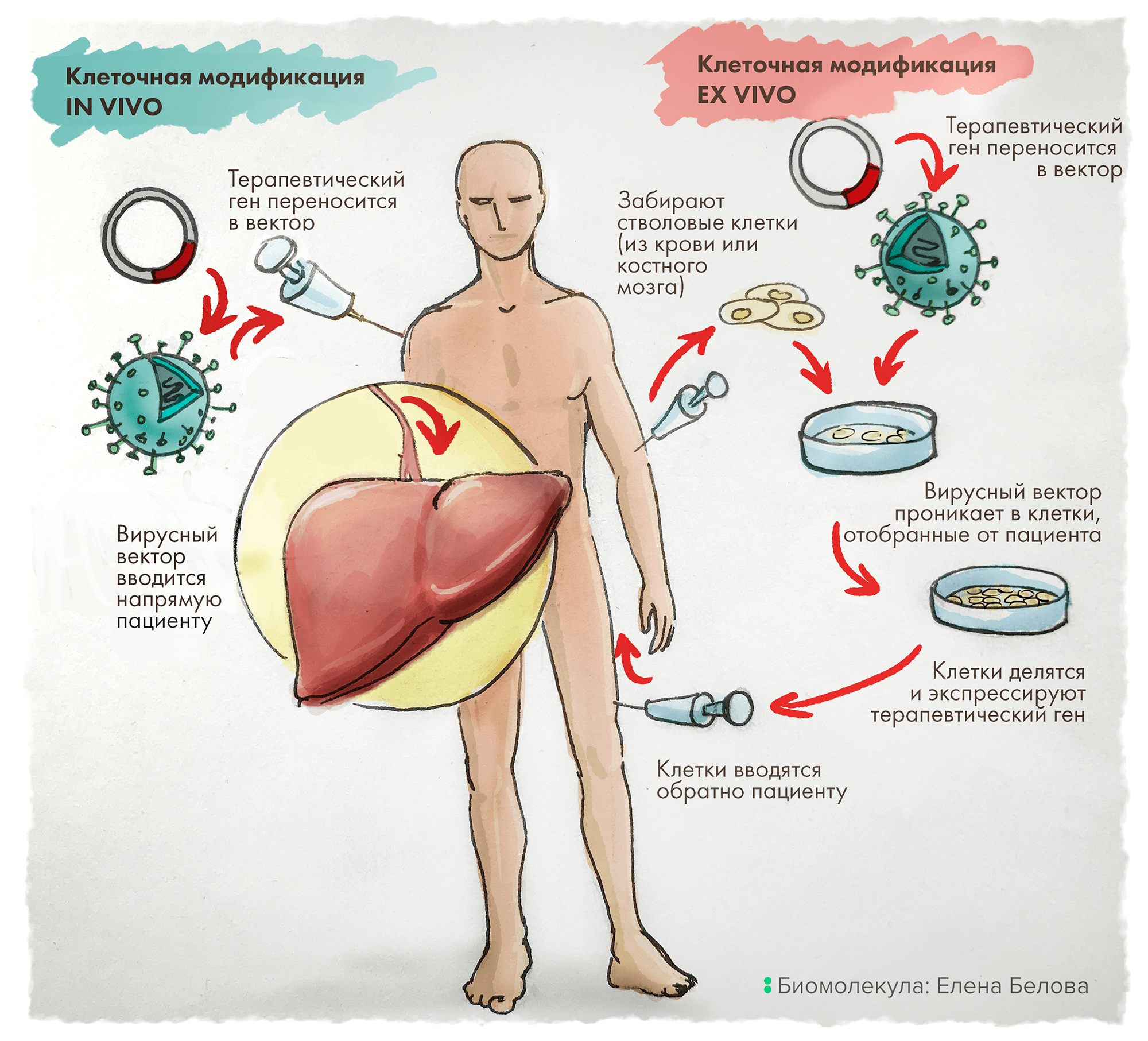
Рисунок 3. Схема двух основных стратегий генной терапии: in vivo и ex vivo.
рисунок Елены Беловой из первой статьи цикла («Генная терапия: познакомьтесь с лекарствами будущего» [4])
Поскольку подходы ex vivo и in vivo принципиально различны, отличаются и используемые для них инструменты, ведь что полезно в одном случае, в другом может быть уже недостатком, и наоборот (рис. 4). Например, при терапии in vivo в основном используют векторы на основе аденоассоциированного вируса (AAV) — они способны к направленному проникновению и длительному сохранению в различных тканях (сетчатке, нейронах, печени, мышцах и др.), обеспечивая специфичность и долгосрочность такой терапии. К тому же AAV почти не интегрируются в геном — это позволяет достичь большей безопасности при введении in vivo [5].

Рисунок 4. Лечебный ген может быть перенесен в клетки вирусными векторами. При этом вирусы, интегрирующиеся в геном (такие как лентивирусы или ретровирусы), используются для переноса генов ex vivo в активно делящиеся клетки (такие как гемопоэтические стволовые клетки и Т-клетки). Вирусы, сохраняющиеся вне клеточного генетического аппарата (в виде эписомальной ДНК), такие как аденоассоциированный вирус, используются для переноса генов in vivo в неделящиеся клетки тканей (гепатоциты, нейроны, мышечные клетки и клетки сетчатки).
иллюстрация Елены Беловой по [8]
В лечении ex vivo используют гамма-ретровирусные и лентивирусные векторы (LV); их преимущество — напротив, возможность интеграции в геном активно делящихся клеток (рис. 4). Такая интеграция позволяет этим клеткам сохранять и стабильно экспрессировать целевой ген уже после их ретрансплантации («обратного введения») человеку , [6], [8].
Чего нельзя сказать о применениях неинтегрирующихся векторов — они довольно быстро элиминируются при делении клетки (вместе с этим теряется и целевой ген)
Примеры лечения заболеваний крови генной терапией
Гемофилия
Очень известное и хорошо изученное заболевание, вызываемое мутацией в одном из двух генов, кодирующих факторы свертывания крови: VIII или IX. В зависимости от природы такой геномной аномалии выделяют два подвида: гемофилию А (при дефекте гена фактора VIII) и гемофилию В — при генетической патологии фактора IX . В обоих случаях патология наследуется как сцепленная с полом (Х-сцепленное наследование), встречаясь примерно у 1 из 5000 (гемофилия А) или 1 из 20 000 – 30 000 (гемофилия В) новорожденных мальчиков во всем мире.
Различают еще гемофилию С (поражается фактор XI), но она встречается значительно реже — в 5% от всех случаев, протекая чаще бессимптомно и выявляясь зачастую только случайно (при анализе свертываемости крови).
Суть патогенеза при этом можно выразить довольно просто: кровь больных гемофилией буквально «отказывается» сворачиваться из-за повреждений в генах, кодирующих факторы свертывания, что приводит к недостаточности соответствующих белков. Такая проблема зачастую влечет за собою каскад связанных с кровотечениями и кровоизлияниями осложнений. Одними из самых серьезных являются поражения суставов, способные приводить даже к инвалидности [9].
Современное лечение заключается как раз в компенсации описанной «недостаточности свертывания»: инвазивных, утомительных и регулярных (около двух–трех раз в неделю) внутривенных инфузиях рекомбинантных факторов VIII или IX. Такое лечение настолько обременительное и дорогое (рис. 2), что пациенты в странах третьего мира часто не могут себе его позволить. Кроме того, оно еще и далеко не универсально: у некоторых пациентов вырабатываются нейтрализующие «антитела-ингибиторы» к введенным факторам свертывания крови, делающие инъекции неэффективными [10].
Как гемофилию генной терапией лечат
Генная терапия очень хорошо подходит для лечения гемофилии по ряду причин:
- Моногенность — гемофилии вызваны нарушением только в одном гене, что позволяет воздействовать на корневую причину этого заболевания, давая действенный лечебный эффект.
- Нарушения в вызывающих гемофилию генах хорошо охарактеризованы, что позволяет уверенно их нивелировать.
- Корректируемые генной терапией изменения производства недостающего фактора свертывания легко измеряются стандартными клиническими анализами.
- Широкий диапазон терапевтически приемлемых уровней факторов свертывания не требует жесткой регуляции экспрессии гена, так как даже низкий уровень (достаточно 12% от нормального уровня фактора [10]) эффективно уменьшает кровотечения и устраняет необходимость постоянных инфузий рекомбинантных факторов.
- Для терапии данной болезни хорошо подходят популярные векторы AAV — они распределяются в печень, производя переносящиеся с кровью по всему организму белки, что в какой-то степени имитирует естественный процесс .
- Печень человека — ткань-мишень с относительно низкой скоростью деления клеток [11], что означает меньшую потерю векторов (а вместе с ними и целевых генов) со временем.
В норме факторы свертывания вырабатываются в основном как раз в печени, также переносясь по организму кровью, — это во многом и обеспечивает гемокоагуляцию при кровотечениях.
Данным «удобством мишени» не преминули воспользоваться ученые: генную терапию гемофилии начали разрабатывать более 20 лет назад (о некоторых экспериментах такого рода «Биомолекула» писала ранее [12]), а уже к 2018 году эти испытания вышли на новый уровень.
Тогда голландская компания uniQure запустила клинические исследования препарата для лечения гемофилии В под кодовым названием AMT-061 — год спустя они показали стойкий терапевтический эффект. Этот промежуточный успех мы подробно описали в статье «АМТ-061 — генная терапия, способная на революцию в лечении гемофилии» [10]. Если немного обобщить, важнейшим достижением стала выдающаяся эффективность: 96% пациентов смогли приостановить заместительную терапию фактором IX, освободившись от регулярных инфузий.
Во время этих клинических испытаний наиболее частыми нежелательными реакциями были повышенные уровни ферментов печени аланинаминотрансферазы и аспартатаминотрансферазы, что ожидаемо, ведь, как уже было сказано, — генное лечение гемофилии именно для клеток печени и специфично. Векторы AAV, активно заражая печень, могут привести к ее воспалению, поэтому исследователям нужно соблюдать осторожность. Кроме того, головная боль, гриппоподобные симптомы, утомляемость и недомогание отмечались более чем у 5% пациентов. Сообщалось, что все эти явления были управляемыми, и ни у одного из пациентов не зарегистрировали связанных с ними долгосрочных последствий.
Был, правда, один по-настоящему тревожный случай: у одного из пациентов развилась злокачественная опухоль (гепатоцеллюлярная карцинома), что потребовало расследования (которое и было проведено), — но по его результатам пришли к выводу о низкой вероятности связи между лечением и этим случаем рака [5].
В дальнейшем АМТ-061 получил коммерческое название Hemgenix и одобрение FDA: 22 ноября 2022 года его зарегистрировали для лечения взрослых пациентов с тяжелой формой заболевания. Самым важным фактором для FDA стало долговременное поддержание активности фактора IX. Если бы уровень его активности начал падать у многих пациентов, ценности в такой терапии было бы гораздо меньше, потому что опыта повторного введения AAV-вектора пациентам пока не было: есть некоторые опасения по поводу его иммуногенности.
Основа этого препарата — вектор AAV5, доставляющий улучшенный генной инженерией ген фактора свертывания IX, известный также как вариант Padua [13]. Эта версия гена с заменой двух нуклеотидов относительно гена дикого типа известна выдающимся — примерно в 5–9 раз — усилением активности кодируемого ею фактора свертывания (что очевидно, является фактором эффективности данной терапии [10]).
Надежды на излечение гемофилии А
Существует еще одна перспективная генная терапия, но уже для лечения гемофилии А — Roctavian. Она была одобрена для лечения тяжелой формы такой гемофилии в Европе в прошлом 2022 году, а совсем недавно — в конце июня 2023-го — получила аналогичное одобрение и в США.
Эта терапия также использует для доставки вектор AAV5, но здесь доставляемый ген представляет собой «усеченную» версию нативного гена фактора VIII (полный ген слишком велик и не влезает в ограниченный по емкости AAV).
Приведшие к одобрению клинические испытания данного однократного инфузионного препарата демонстрировали среднее повышение активности фактора VIII на 41,9% через один год после инфузии Roctavian, однако спустя три года с начала лечения этот уровень снизился уже до 18,8%. Это все еще соответствовало легкому течению заболевания, однако такое снижение, разумеется, привело к снижению и эффективности лечения.
Среднегодовая частота кровотечений в сравнении с результатом первого года лечения стала выше на 20%, количество пациентов, не нуждающихся в плановой заместительной терапии, уменьшилось с 99,6% до 92%.
Наблюдались также нежелательные реакции, аналогичные тем, что были зафиксированы при использовании Hemgenix, особенно в отношении повышения уровня ферментов печени. Однако ни один из пациентов не сообщил о каких-либо долгосрочных нежелательных эффектах.
По Roctavian сейчас уже накоплены данные за самый продолжительный на сегодня период наблюдения у пациентов с гемофилией А — более трех лет; но окончательно долгоиграющая эффективность такой терапии будет понятна лишь со временем.
До одобрения FDA ожидалось, что стоимость этого препарата в США не будет превышать таковую у Hemgenix (как упоминалось, последний стоит $3,5 млн) и будет находиться в диапазоне $2–2,5 млн, но компания-производитель BioMarin смогла даже чуть превысить эту в общем-то колоссальную прогнозную сумму, — заявив о прейскурантной цене в $2,9 млн за свой препарат.
При этом для Roctavian аналитики уже прогнозируют светлое будущее, ожидая, что он может стать потенциальным лекарством-блокбастером, — ведь получающих Roctavian будет больше, чем лечащихся Hemgenix, так как пациентов с гемофилией A в три раза больше, чем пациентов с гемофилией B (и почти половина из них имеет тяжелую форму болезни, при которой показано данное лечение) [14].
Тяжелый комбинированный иммунодефицит (ADA-SCID)
Довольно впечатляющие успехи в лечении моногенных заболеваний достигнуты еще на заре развития генной терапии в 1990-х годах, когда эту технологию впервые применили для лечения одной из разновидностей тяжелого комбинированного иммунодефицита — наследственной болезни, вызванной нехваткой фермента аденозиндезаминазы (ADA).
Тогда такое лечение было сугубо экспериментальным: лейкоциты четырехлетней девочки Ашанти Де Сильва генетически модифицировали, затем ввели обратно в ее кровоток, что, хотя и не излечило полностью, но значительно улучшило ее состояние [15]. Достаточно сказать, что она жива до сих пор, хотя больные этим заболеванием редко переживают детский возраст.
Такой болезнью страдает примерно 1 из 375 000 человек; на нее приходится примерно 15–20% всех врожденных иммунодефицитов [16]. Патогенез же характеризуется поражением нескольких видов иммунных клеток: T- и B-лимфоцитов, а также NK-клеток. Это происходит из-за накопления промежуточных продуктов метаболизма ДНК, не расщепляющихся более ферментом ADA, а это отрицательно сказываются на жизнеспособности, дифференцировке и функциях клеток, особенно лимфоидных. Это приводит к критической недостаточности таких клеток и вызывает крайнее ослабление иммунитета, из-за чего даже довольно слабые инфекции (их еще называют оппортунистическими) могут привести к самым серьезным последствиям — в том числе смертельным.
Так или иначе, для Ашанти Де Сильва — да и для всего медицинского сообщества — лечение этой болезни стало событием: она — первый человек, успешно прошедший генную терапию, а ее история показала принципиальную применимость этого лечения, породив большой оптимизм и последующий запуск аналогичных клинических испытаний [1], [4].
Врожденный дефицит фермента ADA корректируют генным лечением и сегодня, но делают это немного по-другому: трансдуцируют предварительно отобранные у пациента гемопоэтические стволовые клетки (ГСК) γ-ретровирусным вектором, несущим здоровую версию кодирующего ADA гена (рис. 5). Далее эти клетки вводят пациенту обратно, и часть из них дифференцируются в функциональные лимфоциты (а ведь именно эти клетки, как правило, оказываются наиболее пораженными при данной болезни).
Это имеет преимущество долгосрочности, ведь генетически измененные лейкоциты живут лишь несколько месяцев (в отличие от ГСК), затем такое лечение перестает быть столь действенным. Например, в случае Ашанти: даже во время генного лечения она продолжала принимать стандартную заместительную терапию — инъекции PEG-ADA (пегилированной формы этого фермента). Это было нужно, чтобы при неудаче генной терапии ее состояние не ухудшилось слишком быстро. К генному лечению в то время прибегли именно потому, что после двух лет относительно успешной терапии инфузиями PEG-ADA (когда Ашанти еще хорошо реагировала на это лечение, о чем свидетельствовал рост Т-лимфоцитов и некоторое усиление иммунитета), ее организм перестал на нее откликаться. Поначалу генная терапия сработала просто поразительно: за шесть месяцев количество Т-лимфоцитов Ашанти вернулось к нормальному уровню.
В течение следующих двух лет здоровье Ашанти продолжало улучшаться, что позволило ей вести относительно нормальную жизнь. Тем не менее продолжающееся использование PEG-ADA затрудняло установление эффективности генной терапии самой по себе, из-за чего исследователям пришлось ненадолго приостановить ферментную терапию Ашанти, что привело к возвращению симптомов ее болезни. Это означало, что генная терапия имела тогда временный эффект, и полностью ее не вылечила — в дальнейшем лечение заместительной ферментной терапией пришлось продолжать (причем Ашанти делает это до сих пор). Однако после лечения генами оказалось достаточным использовать совсем небольшие дозы PEG-ADA — на уровне четырехлетнего ребенка (хотя обычно чем пациент старше, тем выше дозировка). Это говорит о том, что даже тот еще совсем сырой и несовершенный протокол экспериментальной генной терапии обладал некоторой эффективностью (прямо скажем, для своего времени, революционной).
Такая схема лечения ex vivo реализована в препарате «Стримвелис» (рис. 5), изначально производимом британской фармацевтической компанией GlaxoSmithKline (GSK) и одобренном к использованию еще в 2016 году [4]. Преимущества этого препарата показаны в исследовании с участием 12 пациентов с дефицитом ADA в возрасте от 6 месяцев до 6 лет. У этих пациентов тогда не было подходящего донора костного мозга для трансплантации (что считалось бы предпочтительным [17]), а другое лечение не помогало или было недоступным.
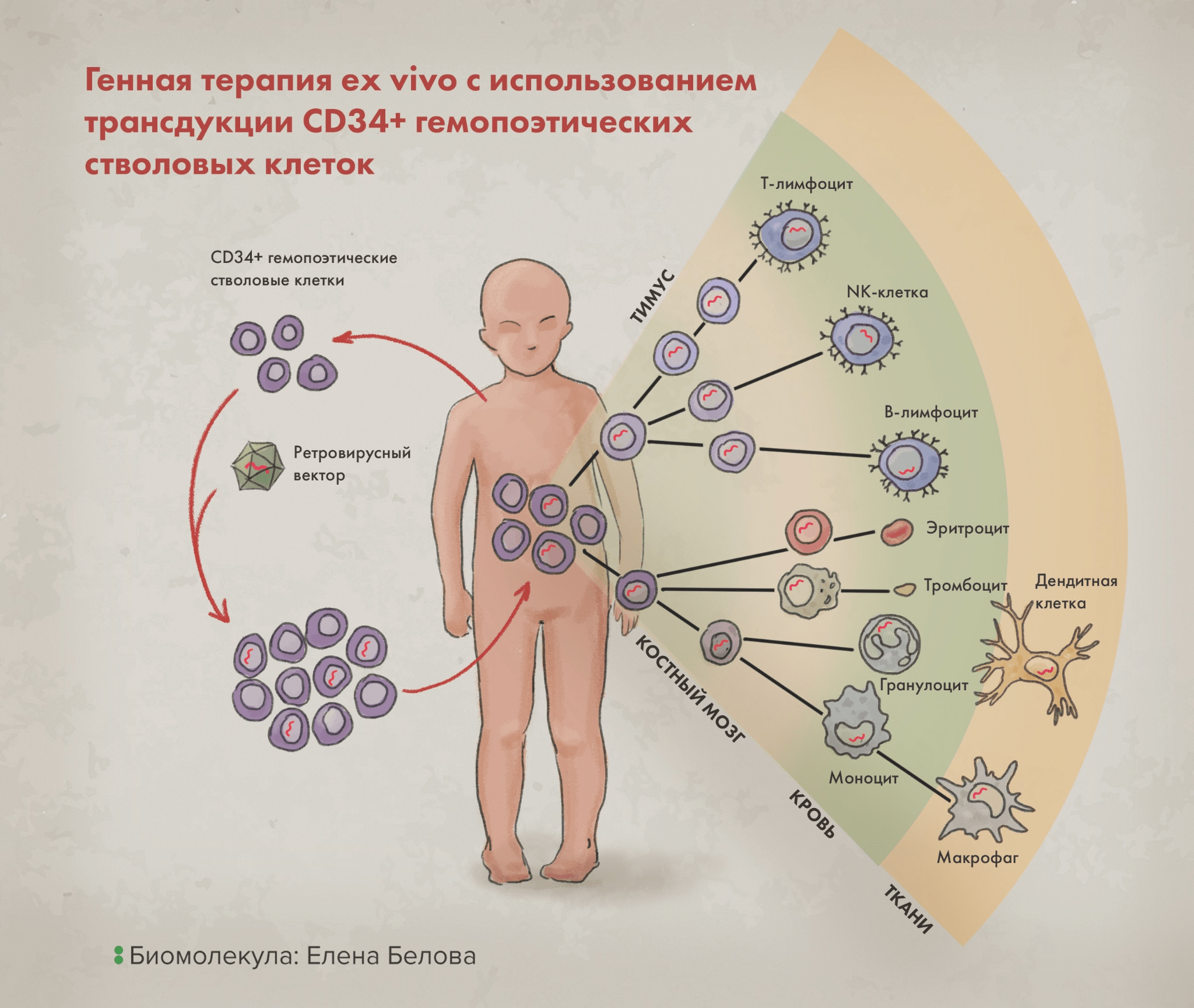
Рисунок 5. Генная терапия ex vivo c использованием трансдукции CD34+ гемопоэтических стволовых клеток: именно этот подход использован в терапии препаратом Strimvelis. Производные от исходно модифицированных клеток, как видно, могут быть различны (для «Cтримвелис» это лимфоциты), но, очевидно, они сами уже являются «лекарством» — несут «встроенный» ген, обеспечивающий терапевтическую функцию.
иллюстрация Елены Беловой по Labiotech
По итогу генного лечения спустя три года все пациенты были живы (выживаемость — 100%), у них понизилась частота тяжелых инфекций, при этом она продолжала снижаться и в дальнейшем. Что же касается безопасности, «Стримвелис» относительно хорошо переносился, хотя уверенно говорить о низких рисках пока сложно, ведь данные ограничены небольшим числом пациентов.
Так как этот препарат производят с использованием γ-ретровируса, его применение потенциально опасно развитием рака, вызванного инсерционным канцерогенезом . Такой процесс — следствие активации протоонкогенов из-за возможной случайной интеграции вируса вблизи этих элементов. Имеется и риск аутоиммунного заболевания, хотя до сих пор таких случаев не наблюдалось.
Относительно инсерционного канцерогенеза все не так однозначно: в октябре 2020 года стало известно, что у пациента, получавшего «Стримвелис», диагностировали Т-клеточный лимфобластный лейкоз, и он проходит лечение от этой болезни. Вполне возможно, что этот диагноз как-то был связан со вставкой вирусного вектора, но чтобы уверенно это утверждать, пока еще недостаточно информации [18]. Тем не менее еще в 2020 году было объявлено, что лечение новых пациентов препаратом приостановлено до получения результатов расследования этого инцидента.
Рентабельность и польза «Стримвелиса», или Кому это выгодно?
Когда GSK анонсировала успех в применении «Стримвелиса», компания была настолько уверена в своем детище, что обещала даже покрыть стоимость лечения, если оно не сработает. При этом стоимость препарата составляла тогда ни много ни мало 594 тысячи евро (648 000 долларов США).
Однако в 2018 году компания продала права на этот и некоторые другие продукты генной терапии компании Orchard Therapeutics, что было частью крупной сделки, в рамках которой GSK стала инвестором Orchard, получив 19,9% ее акций, место в правлении, а также финансовые дивиденды в виде роялти и промежуточных платежей с проданного компанией портфеля. Портфель препаратов генной терапии, приобретенных Orchard, включал тогда собственно «Стримвелис», исследования поздних клинических стадий метахроматической лейкодистрофии (МЛД), синдрома Вискотта—Олдрича, а также одного варианта лечения бета-талассемии.
На данный момент «Стримвелис» точно не ключевой препарат в пакете генного лечения компании Orchard — основным из приобретенных у GSK становится, судя по всему, препарат от МЛД: недавно его одобрили для применения в ЕС (об этом ниже).
Вероятно, из-за нерентабельности «Стримвелиса» и некоторых других программ лечения редких первичных иммунодефицитов в том же 2022 году Orchard заявила о намерении прекратить их финансирование, сосредоточив ресурсы на терапиях нейрометаболических заболеваний и уже запущенных исследованиях лекарств, находящихся на ранних стадиях испытаний. Права на разработку по ADA-SCID возвращены академическим партнерам, а это означает, что доступ к этой генной терапии теперь затруднен.
Гемоглобинопатии
Гемоглобинопатии — наиболее распространенные моногенные заболевания в мире, и с каждым годом их глобальное бремя все увеличивается. Даже в европейских странах, где раньше они встречались редко, их распространенность значительно повысилась после крупномасштабной миграционной волны с Ближнего Востока и из Африки в Евросоюз.
Особое значение в этой группе заболеваний имеют серповидно-клеточная анемия и бета-талассемия: они обусловлены мутациями в гене бета-глобина — белковой субъединицы основного переносчика кислорода гемоглобина. Нарушение его функции в результате таких мутаций вызывает широкий спектр патологических проявлений различной степени тяжести.
Симптомы этих расстройств могут включать собственно анемию (зачастую тяжелую), повышенную утомляемость, желтуху гемолитического типа, приступы боли интенсивностью от достаточно легкой до очень сильной. Такие заболевания серьезно ограничивают ожидаемую продолжительность жизни людей и ее качество, зачастую требуя пожизненной поддерживающей терапии (если конечно излечение не может быть достигнуто с помощью аллогенной трансплантации стволовых клеток, что возможно далеко не всегда) .
Аллогенная трансплантация стволовых клеток костного мозга может вылечить как талассемию, так и серповидно-клеточную анемию, но менее чем для 20% таких пациентов удается подобрать иммунологически подходящего донора [25].
Передаются эти болезни, естественно, по наследству, при этом обычно для проявления недуга оба родителя должны передать потомству дефектный ген (т.н. аутосомно-рецессивное наследование). Когда же такое происходит, возникающие в результате заболевания последствия бывают серьезными, а иногда смертельными.
Бета-талассемия
При бета-талассемии уровень гемоглобина в организме значительно ниже нормы , и это приводит к выраженной анемии; патологические изменения могут также затрагивать различные органы и ткани больного (поражать селезенку, костный мозг и пр.).
Здесь и ниже — речь о тяжелой форме болезни.
Основой лечения этого заболевания является переливание эритроцитарной массы в сочетании с железохелатирующей терапией (связыванием и выведением из организма избытков железа). Это становится совершенно необходимым, поскольку из-за регулярных переливаний этот металл накапливается в организме.
Большинство пациентов при таком правильном подходе к лечению доживают до зрелого возраста, но как качество их жизни, так и ее продолжительность (в среднем 37 лет) серьезно снижаются из-за многочисленных осложнений, связанных с перегрузкой организма железом. Накопление железа проявляется эндокринопатиями, кардиомиопатиями и циррозом печени. Последствием часто становится смерть из-за сердечной недостаточности, вызванной избытком железа в сердце. Поэтому когда находят подходящего донора стволовых клеток, рекомендуют их аллогенную трансплантацию как можно раньше — до того, как разовьются связанные с «передозировкой железом» отклонения.
Экономическое бремя бета-талассемии весьма существенно, особенно в странах с высокой ее распространенностью. Расходы на переливание эритроцитов и железохелатирующую терапию оцениваются более чем в 30 000 евро в год на одного взрослого пациента.
Серповидно-клеточная анемия
При этом заболевании эритроциты становятся жесткими, принимая отраженную в названии болезни характерную форму серпа (рис. 1) [1]. Происходит это из-за описанной выше мутации — гемоглобин в эритроцитах таких больных полимеризуется в длинные жесткие стержни, деформируя клетки. Такие эритроциты отличаются от нормальных — гладких, дисковидных и гибких, по форме напоминающих «пончики без дырочек», легко перемещающихся по кровеносным сосудам. Красные кровяные тельца в форме серпа, напротив, склонны к агрегации и зачастую неспособны к свободной циркуляции в кровеносной системе. Это приводит к нарушению доставки кислорода к органам и тканям организма с развитием анемии (рис. 1). Кроме того, серповидные эритроциты могут блокировать поток крови в снабжающих ткани кровеносных сосудах, что приводит к воспалению и сильной боли, возникающей в любой части тела, — но чаще проявляющейся в спине, груди или конечностях (так называемый вазоокклюзионный криз).
Такие клетки из-за жесткой специфической формы могут закупоривать капилляры в селезенке, повреждая ее — это делает организм более восприимчивым к инфекции (так как в норме селезенка помогает фильтровать и очищать от инфекций кровь).
В отсутствии адекватного лечения большинство пациентов с серповидно-клеточной анемией умирают еще в раннем детстве. Однако благодаря приему антибиотиков, профилактическим прививкам, гемотрансфузиям, использованию гидроксимочевины [26] и другим лечебным мерам (см. врезку ниже), более 95% пациентов достигают зрелого возраста.
Тем не менее качество их жизни серьезно снижается болезненными вазоокклюзионными кризами и хроническим поражением органов. Ожидаемая продолжительность жизни даже при оптимальном уходе сокращается примерно на два десятилетия [29]. Бремя связанных с серповидно-клеточной анемией общих медицинских расходов также оказывается внушительным — более 1,5 миллиона долларов за жизнь пациента [30].
Генное лечение
Одно из самых заметных на сегодня достижений в генном лечении гемоглобинопатий — одобрение препарата Zynteglo: он вышел из тени клинических исследований в начале лета 2019 года, когда Европейское медицинское агентство (EMA) предоставило условное одобрение на лечение трансфузионно-зависимой формы бета-талассемии компании-производителю Bluebird Bio.
Такое лечение тогда было одобрено для пациентов в возрасте от 12 лет и старше, c показанной трансплантацией гемопоэтических стволовых клеток (но подходящего совместимого донора для них при этом нет). В конце марта 2022 года разрешение на продажу в Европе препарата Zynteglo (т.е. его регистрационное удостоверение) отозвали по запросу производителя, так как компания тогда была недовольна коммерческим провалом лекарства, что было связано с высокой стоимостью лечения. Однократная инфузия его стоила внушительные 1,575 миллиона евро (1,77 млн долларов). Правда, одна пятая доля этой суммы могла выплачиваться авансом в первый год, остальная же часть доплачивалась в течение следующих четырех лет, причем только если лечение срабатывало; но компания все равно не смогла договориться с европейскими страховыми системами.
Впрочем, уже в середине августа 2022 года Zynteglo был одобрен FDA, причем уже по более широким показаниям — для лечения как взрослых, так и детей, которым требуются регулярные переливания эритроцитарной массы. Стоимость этого препарата в США, правда, мягко говоря совсем не меньше: астрономические 2,8 млн долларов. Правда, в случае его неэффективности до 80% такой стоимости может быть возвращено.
Как оно работает
Лечение Zynteglo (известным также как бетабеглоген аутотемцел) основано на однократной инфузии препарата, после чего у пролеченного пациента с бета-талассемией появляются немалые шансы навсегда избавиться от необходимости в переливаниях крови. Вводят этот препарат людям в виде гемопоэтических стволовых клеток, предварительно трансдуцированных лентивирусным вектором, несущим ген функционального бета-глобина. Далее уже в организме эти клетки превращаются в функциональные эритроциты, что и помогает в итоге победить болезнь.
Если говорить об эффективности, Zynteglo устранял необходимость в регулярных переливаниях крови для подавляющего большинства пациентов, возвращая при этом гемоглобин к нормальному (или почти нормальному) уровню. Причем до начала такой генной терапии всем этим пациентам дополнительно требовались железосвязывающие (хелатирующие) препараты. Наблюдения одного из самых долгосрочных на сегодня клинических испытаний (LTF-303) показали: 59% пациентов смогли выйти из зависимости от переливания крови и, хотя какое-то время еще нуждались в хелатотерапии, в конце концов смогли отказаться и от нее.
Пока еще сложно предсказать, насколько коммерчески успешным будет Zynteglo. Прогнозы были бы куда оптимистичнее, если бы препарат не «покинул» Европу, где популяция зависимых от переливаний крови пациентов с бета-талассемией составляет от 11 000 до 13 000 человек, причем половина из них проживает в Италии. Коммерческие перспективы в США гораздо скромнее, поскольку пул таких пациентов там составляет всего 1300–1500 человек, а потенциально подходящих для генной терапии еще меньше — около 850 человек. Согласно консервативным отраслевым прогнозам, продажи Zynteglo достигнут ~$391 млн к 2028 году.
CRISPR и новые надежды: лечение гемоглобинопатий
Экзагамглоген аутотемцел (exa-cel)
Exa-cel — экспериментальная терапия аутологичными клетками, модифицированными ex vivo с использованием хорошо известной системы редактирования генов CRISPR/Cas9. Принцип этого лечения заключается в предварительном отборе гемопоэтических стволовых клеток у больных с последующим редактированием в них гена BCL11A — репрессора выработки фетального гемоглобина.
Фетальный гемоглобин — это внутриутробный (или плодный) белок, обеспечивающий у человека доставку кислорода в составе эритроцитов примерно до трехлетнего возраста (после чего включаются механизмы, подавляющие его синтез продуктом гена BCL11A). Ученые придумали, как можно отключать этот ген, чтобы клетки снова смогли вырабатывать фетальный гемоглобин, и люди с гемоглобинопатиями получали его в качестве лекарства (что оказалось очень даже эффективным). Для этого в гене BCL11A делали надрез «генными ножницами» CRISPR-Cas9, что эффективно его разрушало, включая в клетках «подзабытый навык» выработки плодного гемоглобина.

Рисунок 6. Данные с конгресса Европейской гематологической ассоциации в Вене (9–12 июня 2022 г.): 95% пациентов с трансфузионно-зависимой бета-талассемией освободились от необходимости в регулярных гемотрансфузиях.
Отредактированные таким образом клетки вводили обратно больным с бета-талассемией (44 человека) и серповидно-клеточной анемией (31 человек) в рамках клинического испытания данной ex vivo терапии. Затем исследователи наблюдали в обеих группах этих пациентов клинически значимое увеличение фетального гемоглобина: средний его уровень к третьему месяцу лечения составил более 20%, к 4-му месяцу — около 40%, затем стабилизируясь.
Но главное — лечебный эффект: большинство пациентов с трансфузионно-зависимой бета-талассемией (95%) смогли приостановить инфузии эритроцитарной массы, а у двух из них — которым по-прежнему такие переливания требовались, — сократились их необходимые объемы на 75% и 89%. При этом у всех больных серповидно-клеточной анемией тяжелых вазоокклюзионных кризов больше не наблюдалось. Профиль безопасности был как при кондиционировании бусульфаном и аутологичной трансплантации гемопоэтических стволовых клеток.
Перед трансплантацией функциональных ГСК необходимо сначала «освободить место»: убить имеющиеся клетки костного мозга пациента. Это называется кондиционированием, и проводится с использованием химиотерапевтических препаратов, таких как бусульфан.
Этот прорывной успех может позволить Exa-cel, разработанной объединенными усилиями CRISPR Therapeutics и Vertex, стать первой одобренной терапией, использующей систему редактирования CRISPR, причем одобрение ожидается как в США, так и в Европе (соответствующие заявки в FDA и EMA уже поданы и находятся на рассмотрении).
Заключение
В последнее время генная терапия все активнее выходит из тени клинических исследований и становится более доступной для лечения самых разных болезней крови. Для многих этих патологий такое лечение уже сейчас является осязаемой реальностью, дающей пациентам всего мира надежду и побуждающей к дальнейшим исследованиям в этой области. Непрерывные усилия ученых со временем могут помочь улучшить существующие протоколы лечения за счет снижения нежелательных явлений (таких как иммуногенность и гепатотоксичность), снизив риски генной терапии, и сделав ее более доступной для остро нуждающихся больных.
Продвинутый уровень современной медицины и продолжающиеся исследования позволяют предположить, что в будущем можно будет значительно расширить спектр поддающихся терапии лечебными генами заболеваний.
Такие работающие генные терапии могут помочь добиться излечения пациентов с патологиями крови (как видим, успешные примеры уже существуют), снизив финансовую нагрузку на национальные системы здравоохранения (за счет устранения необходимости в дорогостоящих заместительных терапиях многих из этих недугов).
Литература
- Три поколения лекарств;
- Nanxin Li, Eileen K. Sawyer, Konrad Maruszczyk, Greg Guzauskas, Marta T. Slomka, et. al.. (2021). Adult lifetime cost of hemophilia B management in the US: payer and societal perspectives from a decision analytic model. Journal of Medical Economics. 24, 363-372;
- Фармакоэкономика: лечить или экономить?;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- Donald B Kohn. (2019). Gene therapy for blood diseases. Current Opinion in Biotechnology. 60, 39-45;
- Amit C. Nathwani, Edward G.D. Tuddenham, Savita Rangarajan, Cecilia Rosales, Jenny McIntosh, et. al.. (2011). Adenovirus-Associated Virus Vector–Mediated Gene Transfer in Hemophilia B. N Engl J Med. 365, 2357-2365;
- АМТ-061 — генная терапия, способная на революцию в лечении гемофилии;
- Ulrike M. Reiss, Lei Zhang, Tsukasa Ohmori. (2021). Hemophilia gene therapy—New country initiatives. Haemophilia. 27, 132-141;
- Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии;
- Thierry VandenDriessche, Marinee K. Chuah. (2018). Hyperactive Factor IX Padua: A Game-Changer for Hemophilia Gene Therapy. Molecular Therapy. 26, 14-16;
- Peterson J. (2023). Hemophilia gene therapies: are the world’s most expensive drugs really worth it? RemedyOne;
- Gunn S. (2021). The rollercoaster ride of gene therapy. Front Line Genomics;
- Brian Young, Jessica Hendricks, David Foreman, C. Austin Pickens, Candice Hovell, et. al.. (2020). Development of dried blood spot quality control materials for adenosine deaminase severe combined immunodeficiency and an LC-MS/MS method for their characterization. Clinical Mass Spectrometry. 17, 4-11;
- Emily South, Edward Cox, Nick Meader, Nerys Woolacott, Susan Griffin. (2019). Strimvelis® for Treating Severe Combined Immunodeficiency Caused by Adenosine Deaminase Deficiency: An Evidence Review Group Perspective of a NICE Highly Specialised Technology Evaluation. PharmacoEconomics Open. 3, 151-161;
- Jonas Holst Wolff, Jacob Giehm Mikkelsen. (2022). Delivering genes with human immunodeficiency virus-derived vehicles: still state-of-the-art after 25 years. J Biomed Sci. 29;
- Leal A.F., Nieto W.G., Candelo E., Pachajoa H., Alméciga-Díaz C.J. (2022). Hematological findings in lysosomal storage disorders: a perspective from the medical laboratory. EJIFCC. 33, 28–42;
- Болезнь Фабри: частая среди редких;
- Jun Kido, Keishin Sugawara, Kimitoshi Nakamura. (2023). Gene therapy for lysosomal storage diseases: Current clinical trial prospects. Front. Genet.. 14;
- Xiaomo Wu, Xiaorong He, Fahui Liu, Xiaochang Jiang, Ping Wang, et. al.. (2022). Development and clinical translation of ex vivo gene therapy. Computational and Structural Biotechnology Journal. 20, 2986-3003;
- Steven E Hanna, Doreen J Bartlett, Lisa M Rivard, Dianne J Russell. (2008). Reference Curves for the Gross Motor Function Measure: Percentiles for Clinical Description and Tracking Over Time Among Children With Cerebral Palsy. Physical Therapy. 88, 596-607;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- Haydar Frangoul, David Altshuler, M. Domenica Cappellini, Yi-Shan Chen, Jennifer Domm, et. al.. (2021). CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. N Engl J Med. 384, 252-260;
- John J. Strouse, Matthew M. Heeney. (2012). Hydroxyurea for the treatment of sickle cell disease: Efficacy, barriers, toxicity, and management in children. Pediatr. Blood Cancer. 59, 365-371;
- Michael Migotsky, Molly Beestrum, Sherif M. Badawy. (2022). Recent Advances in Sickle-Cell Disease Therapies: A Review of Voxelotor, Crizanlizumab, and L-glutamine. Pharmacy. 10, 123;
- Rohit Kumar Agrawal, Rakesh Kantilal Patel, Varsha shah, Lalit Nainiwal, Bhadra Trivedi. (2014). Hydroxyurea in Sickle Cell Disease: Drug Review. Indian J Hematol Blood Transfus. 30, 91-96;
- Joachim B. Kunz, Andreas E. Kulozik. (2020). Gene Therapy of the Hemoglobinopathies. HemaSphere. 4, e479;
- Kate M. Johnson, Boshen Jiao, Scott D. Ramsey, M. A. Bender, Beth Devine, Anirban Basu. (2023). Lifetime medical costs attributable to sickle cell disease among nonelderly individuals with commercial insurance. Blood Advances. 7, 365-374.







