
«Спутник V» и не только: сказ об аденовирусных вакцинах
13 мая 2022
«Спутник V» и не только: сказ об аденовирусных вакцинах
- 2364
- 0
- 8
Иммунизации боятся многие, что неминуемо снижает и ценность внедрения новых вакцин. Стоит ли бояться вакцин на основе аденовирусной платформы и есть ли факты, говорящие об их безопасности? Да и что это, собственно, за аденовирусы такие? Рассказываем об этом в нашей статье. Иллюстрация в высоком разрешении.
иллюстрация Елены Беловой по Yale Medicine
-
Автор
-
Редакторы
-
Иллюстратор
Темы
Гонки за созданием эффективных вакцин совсем недавно задали новый тренд в фармацевтике, что на наших глазах подстегнуло и всю медицину. Озабоченные поиском скорейшего решения, ученые вспомнили о «старенькой» технологии аденовирусных векторов, ровеснице самой генной терапии (спецпроект о которой вы сейчас продолжаете читать). На основе этой платформы хорошо показала себя вакцина против вируса Эбола, что позволило, немного модифицировав её технологию, оперативно создать и вывести на рынок несколько вакцин против коронавируса — «Спутник V», а также продукты компаний Johnson & Johnson и AstraZeneca. Вакцина «Спутник V», хотя так и не получила одобрения ВОЗ и ЕС, — безусловный прорыв в российской фармацевтике. Рассмотрим в статье, почему аденовирусы стали такой удачной платформой, и какие у них перспективы в создании новых вакцин и не только.
Генная и клеточная терапии

Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Новое начало
Пандемия коронавируса в одночасье изменила привычные устои и правила поведения людей всего мира [1], [2], что вместе с нарастающей нагрузкой на здравоохранение и пугающей статистикой смертности запустило массированные исследования и разработки препаратов, способных остановить COVID-19. Время это определенно было не лучшим, но именно здесь в медицине и фармацевтике возник какой-то новый импульс. Ученые со всего мира пытались найти решение новой и острой проблемы, что, очевидно, подстегнуло и всю науку. Насколько именно подстегнуло — сказать пока трудно. Как минимум, мы уже получили новые лекарства [3], и даже одна новая терапевтическая модальность вышла из многолетней тени клинических исследований к регистрации и практике использования у людей. В будущем не исключено, что появятся и другие инновации, начало которых было заложено именно в этом напряженном поиске спасения от новой инфекции. Ведь в истории так много примеров, когда острая потребность в чем-либо рождала знания, а уже это выводило на новый уровень технологии, и даже могло увлечь за собой весь мировой прогресс.
К сожалению, наше время отмечено не только достижениями, но и недоверием: недооценкой силы и пользы науки, а также опасениями в небезопасности новейших технологий. Эта настороженная предубежденность смешивается порою в причудливый коктейль с самыми абсурдными заблуждениями, что приводит к замедлению внедрения инноваций на уровне простых обывателей. И голос разума, говорящий о пользе вакцинации, в такой обстановке уже не звучит убедительно. Особенно это очевидно, когда вспоминаешь о силе антипрививочного движения: его сторонники тормозят вакцинацию, замедляя формирование коллективного иммунитета. А это значит, что и возможная победа над недугом отдаляется. Ну а он, к сожалению, пока еще никуда не делся .
Сейчас ковид уже не так свирепствует, что во многом связано с доминированием варианта Омикрон, ранее называемого даже «живой вакциной». Учитывая высокую смертность, такая его характеристика вряд ли уместна, но доля правды в ней есть. Данный тип распространялся среди населения с фантастической скоростью и оказался менее опасен, чем предыдущий «доминатор» Дельта. Это, вместе с усиленной вакцинацией, всё же привело к некому подобию коллективного иммунитета. Есть соображения, что дальше — больше, и вскоре новая коронавирусная инфекция достигнет эндемически устойчивого состояния. Это значит, что число инфицированных экспоненциально увеличиваться уже не будет, но напротив — станет предсказуемым. Смертность от этого, конечно, никуда не уйдет, но бремя заболевания сравнится с другими известными и опасными инфекциями, такими как грипп. Это позволит избежать серьезных ограничений, от которых во время предыдущих волн пандемии все так сильно страдали. Сценарий этот пока не гарантирован, ведь на его развитие влияют множество неизвестных. Это и появление новых вариантов, и продолжительность существующего иммунитета (пока точно не установленная), и недоверие к вакцинам, неспроста включенное в список глобальных угроз здоровью населения [4] (что было сделано задолго до наступления коронавирусной эры). Так или иначе, пока что COVID-19 с нами, и необходимость вакцинации против него актуальна.
В этой статье попробуем разобраться, насколько эффективны и безопасны современные аденовирусные вакцины от COVID-19: «Спутник V» и ему подобные. А заодно поговорим и о других препаратах на основе этой платформы. Выясним, что представляют собой сами векторные аденовирусы, в чем их особенность и уникальность. И почему вакцина против нового коронавируса на их основе была одобрена к применению раньше других.
Векторы — это как раз и есть генетически модифицированные вирусные частицы-носители для доставки лечебных генов в клетки человека. Они бывают как аденовирусными, так и основанными на других диких вирусах: лентивирусах [5], ретровирусах, аденоассоциированных вирусах [6] и так далее. В подробностях, чем эти носители различаются и как всё это работает, рассказывает статья «Генная терапия: познакомьтесь с лекарствами будущего» [7] и другие публикации нашего цикла о генной и клеточной терапиях.
Что было раньше?
Ученые начали тестировать первые аденовирусные векторы (рис. 1) в далеких 1980-х, когда создавали неспособные к размножению вирусы, фокусируясь в основном на серотипе 5 (Ad5). Эти исследования подогревались надеждой, что данный вектор станет для генной терапии прорывом, на что немного намекал предшествующий опыт: аденовирусы уже неплохо показывали себя в испытаниях на животных. А в США еще за тридцать лет до создания первых векторов начали применять вакцины на основе живых (!) аденовирусов серотипов 4 и 7. Их тогда давали новобранцам в армии для профилактики респираторных заболеваний, и, что интересно, такое их применение востребовано до сих пор.
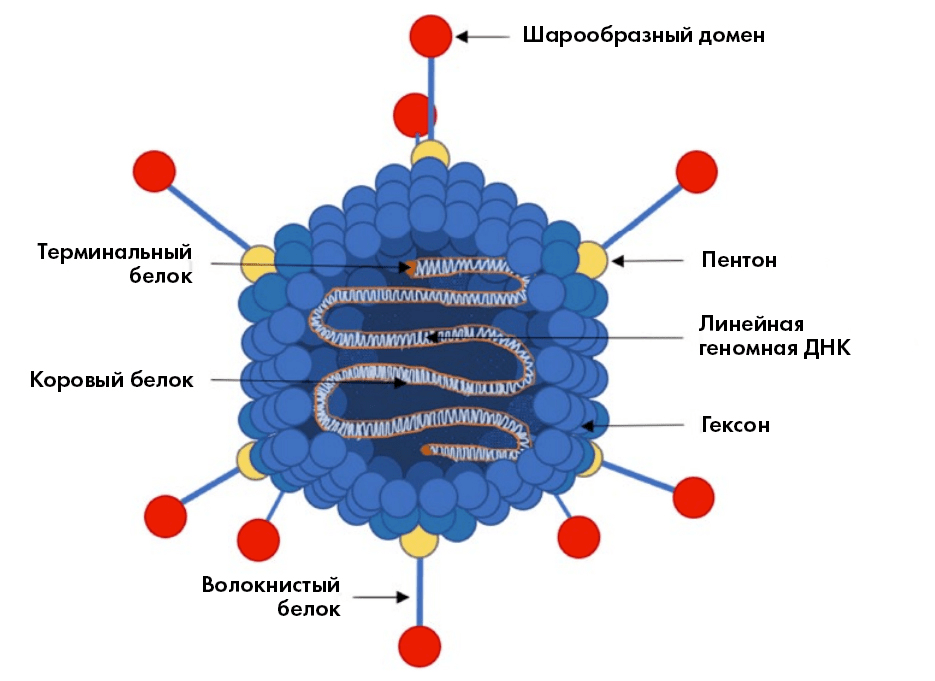
Рисунок 1. Структура аденовирусов: внутри частицы линейная двухцепочечная ДНК длиной от 26 до 45 килобаз (тысяч пар нуклеотидных оснований). Снаружи белковая оболочка (капсид) — многогранник типа икосаэдра со скругленными ребрами, размером приблизительно 100 нанометров [8]. На её поверхности основные структурные белки: гексон, пентон и вырастающий из него «волокнистый» белок. На конце последнего — белковый «набалдашник» (шарообразный домен), связывающийся с клеточным рецептором при проникновении вируса в клетку.
Со временем исследования подвели к идее использования аденовирусных вакцин против ряда опасных возбудителей, таких как вирусы герпеса и лихорадки Эбола, флавовирус, вирус Зика, респираторно-синцитиальный вирус человека и возбудитель малярии. Отдельного упоминания заслуживает вакцина на платформе Ad5 против вируса иммунодефицита человека (ВИЧ). Попытки её применения были весьма многообещающими, но по итогу полностью провалились [9]. Как ни странно, выяснилось, что она может даже повышать риски заражения! И хотя точная причина этого неизвестна, предполагается, что «знакомство» иммунных клеток с вектором Ad5 снижает их эффективность в борьбе с возбудителем ВИЧ [10], [11].
Но в истории был и еще один примечательный эпизод, связанный с 5 серотипом аденовируса, всерьез поставивший под сомнение саму возможность генной терапии [12].
Начали не за здравие
В 1999 году один из первых получивших генное лечение пациентов вскоре скончался . Молодому человеку по имени Джесси Гелсингер едва исполнилось 18 лет, и возможность генной терапии была для него надеждой на нормальную жизнь, — он страдал от тяжелого наследственного заболевания, при котором токсические продукты распада не выводятся из организма. В этой трагедии оказался «замешанным» вектор Ad5 первого поколения, причем несчастному ввели тогда аж 38 триллионов вирусных частиц!
Подробнее об этом случае, а также глобально: о фармацевтической индустрии, появлении новых и самых перспективных терапевтических модальностей узнаете из статьи «Три поколения лекарств» [13].
А ведь уже было известно: большие дозы векторов могут быть опасны. В опытах обезьяны, на которых испытывали Ad5, умерли от нарушения свертываемости крови, сопровождавшегося тяжелым воспалением печени. Причем все они получили исключительно высокую дозу аденовирусного вектора [14], [15].
Последствия
В том самом исследовании помимо Гелсингера принимали участие и другие пациенты. Некоторые из них без серьезных последствий перенесли такие же высокие дозы аденовируса, как и он. И точная причина, почему реакция Джесси столь разительно отличалась, до конца до сих пор не установлена. Основная гипотеза связана с активацией врожденного иммунного ответа на вектор, что вызвало системное воспаление со всеми вытекающими последствиями. При этом более сильный врожденный иммунитет мог быть заложен у пациента, например, генетически. Или же предварительное «знакомство» с аденовирусом при естественном инфицировании настолько сильно увеличило иммунный ответ на него при повторной «встрече». Так или иначе, все эти предположения появлялись уже постфактум, в том числе и на основе предпринятых дополнительных экспериментов на животных [15]. А значит, на момент начала исследования опыта и знаний было еще недостаточно, и ученые действовали без четкого понимания возможных последствий. Кажется, что описанный случай будто предостерегает нас: не надо играть с огнем, генная терапия небезопасна! Но давайте разбираться: может ли история Гелсингера служить уроком, и стоит ли бояться аденовирусов в принципе?
Опасности мнимые и настоящие
С аденовирусами человечество взаимодействует на протяжении всей своей истории — они вызывают в том числе и обычную простуду, которая всем так хорошо известна. Вроде бы уже здесь можно слегка расслабиться — простуды пока еще никто не пугался. Ну а рекомбинантные векторы это даже и не вирусы: их дополнительно «обезвреживают», удаляя ответственные за размножение гены и вставляя вместо них гены чужеродных белков-антигенов опасного патогена. Как бы страшно всё это ни звучало, сильно беспокоиться не стоит и здесь. Антиген — это обычно белок оболочки инфекционного агента — сам по себе размножиться и нанести вред организму никак не сможет. А вот «причинить пользу» в случае иммунизации им — да!
И хотя случай Джесси Гелсингера в плохом смысле беспрецедентен, с современной вакцинацией аденовирусными векторами он имеет мало общего. Этому пациенту векторы вводили в системный кровоток, откуда они вполне закономерно распределялись во все органы и ткани. Учитывая количество аденовирусных частиц и их высокую иммуногенность (которая тогда была не вполне изучена), трагические последствия не так и удивительны.
В случае же вакцинации вектор вводится чаще внутримышечно и в организме распределяется более локально. Да и количество вирусных частиц здесь намного меньше. Для «Спутника V», например, это 1011 на дозу согласно инструкции, то есть — 100 миллиардов векторов в одном уколе. В сравнимых аналогах этой вакцины — западных AstraZeneca и Johnson & Johnson — количество частиц и того меньше: 50 миллиардов в дозе (5×1010) [3]. И хоть числа эти не кажутся маленькими, следует помнить, что клеток в нашем организме на порядки больше: около 30 триллионов (30×1012). А это означает, что заражаемых этими вакцинами клеток будет немного. «Спутник V» при введении дозы заразит максимум одну клетку из 300 (0,3%) [16]. А AstraZeneca и Johnson & Johnson еще меньше: одну из 600 (0,2%). И эффект от этого поначалу будет местным — системным его сделает иммунная система.
Бояться не стоит
Вакцины действуют локальнее многих лекарств — это медицинский факт. В том числе и поэтому про них можно говорить как про одно из безопаснейших медицинских вмешательств. Даже если сравнивать с «безобидными» анальгетиками и противовоспалительными, действие которых гораздо больше напоминает «лобовую атаку». Попадая в организм, они всасываются в кровь, модифицируются ферментами в печени, разносятся по организму, встречаются с молекулами-мишенями, а после «эвакуируются» через систему выделительную. И вот такое «путешествие» может увеличивать риск нежелательных явлений, ведь для достижения эффекта лекарственные молекулы часто вводятся «в избытке». Это приводит к их связи с нецелевыми молекулами, а также к дополнительной нагрузке на выделительную систему. И хоть в теле нашем предусмотрена утилизация всего лишнего, срабатывает это далеко не всегда. При сопутствующих болезнях, а также злоупотреблении даже самыми банальными противовоспалительными препаратами уже могут появиться серьезные проблемы .
Какие последствия может повлечь применение даже самого массового анальгетика, читайте в статье «Биомолекулы» «В чем сила, парацетамол?» [17].
Поэтому, чтобы повысить безопасность и эффективность, исследователям приходится выяснять детали «приключений» лекарственных молекул в каждом конкретном случае: изучать их фармакокинетику [18]. Касается это большинства лекарств, но не вакцин, для которых такие исследования малополезны и обычно не проводятся. Это связано с тем, что дозы здесь слишком малы, и как они там распределяются, всерьез на их эффективность не влияет. Зато биораспределение компонентов вакцин может повлиять на их токсичность, в связи с чем регуляторы выдвигают требования тестировать его на животных, чтобы выявить все побочные реакции и последствия [19], [20].
Куда же распределяются вирусы?
Данные доклинических исследований векторов серотипов Ad5 и Ad26 показали похожую картину биораспределения. После инъекции аденовирусные частицы в основном остаются в месте введения, ограниченно попадая только в печень (Ad5) [21], лимфатические узлы и селезенку (Ad5 и Ad26) [21], [22]. Это согласуется с гипотезой о том, что векторы сами по себе не распределяются (или почти не распределяются), а перемещаются по телу вместе с зараженными клетками [21].
И хотя попадание в органы (особенно в печень) потенциально может нанести вред, ничего подобного в исследованиях на животных обнаружено не было (только обычные обратимые легкие местные и системные реакции). Дело в том, что процессы в организме после введения вакцины не так сильно отличаются от выработки иммунитета при инфицировании природными патогенами, а это зачастую бывает довольно «не сладко». Но именно в этом вся суть иммунизации: «провокация» естественных защитных сил организма приводит их в полную боевую готовность, что и вызывает похожие на заболевание симптомы. Нужные механизмы по умолчанию «вшиты» в каждого из нас.
Иммунитет и вакцина
Задача любой вакцины — ознакомить иммунные клетки с антигеном, заставив «поверить» в наличие патогена, чтобы выработать на него защитный иммунный ответ. Это позволит организму немного потренироваться, чтобы в случае настоящей инфекции быть во всеоружии. При вакцинации — например, «Спутником V» — зараженные аденовирусным вектором клетки начинают производить шиповидный белок (S-белок) оболочки коронавируса, который в этом случае антигеном и будет.
Попадая в организм (рис. 2), аденовирус запускает обе ветви клеточной обороны: врожденный и приобретенный (адаптивный) иммунитет [23]. Его оболочка дополнительно усилит иммунный ответ, работая как адъювант. Это означает, что еще до запуска адаптивного иммунного ответа вектор активирует иммунитет врожденный. И для этого не требуется размножение вируса или экспрессия его генов.
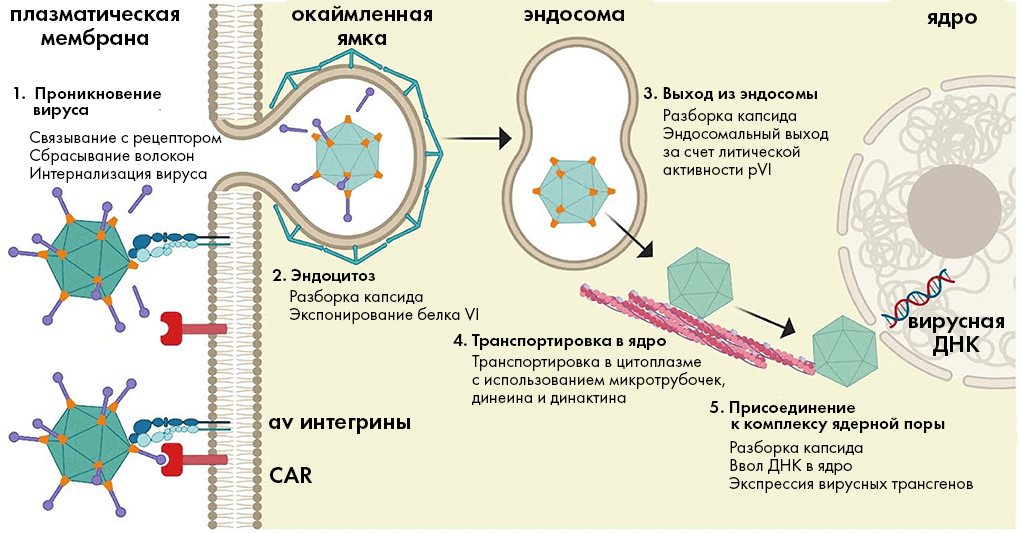
Рисунок 2. Классический путь проникновения аденовирусов в клетку. (1) Белковый «набалдашник» на конце «волокнистого» белка аденовируса связывается с белком CAR на поверхности клетки. Далее вирусный белок пентон своим мотивом RGD взаимодействует с клеточными рецепторами-интегринами, что отчасти разбирает капсид вируса, отщепляя «волокнистые» белки. (2) Рецепторы-интегрины на поверхности клетки запускают эндоцитоз вируса в клетку. (3) Литическая активность белка pVI (находятся под каждым белком-гексоном) способствует высвобождению капсида из эндосомы — мембранного пузырька, в котором вектор перемещается внутрь клетки. (4) Частично разобранные капсиды перемещаются к ядру по «дорогам»-микротрубочкам, подбираясь к комплексу ядерной поры. (5) Вирусная ДНК проникает в ядро, и начинается экспрессия внедренного в вектор целевого гена.
адаптация Елены Беловой из [23]
Аденовирус — адъювант
На аденовирусе есть множество молекулярных паттернов (известных как PAMP), помогающих иммунным клеткам узнать в нем «чужака». При приближении вируса к клетке её специальные патоген-распознающие рецепторы опознают эти PAMP (рис. 3), что активирует уже внутри клетки сигнальные пути, «оповещающие» о необходимости сложного и многостороннего иммунного ответа [24]. Он реализуется через включение генов, кодирующих определенные иммунные и воспалительные молекулы, биосинтез которых и усилит защиту от патогена.
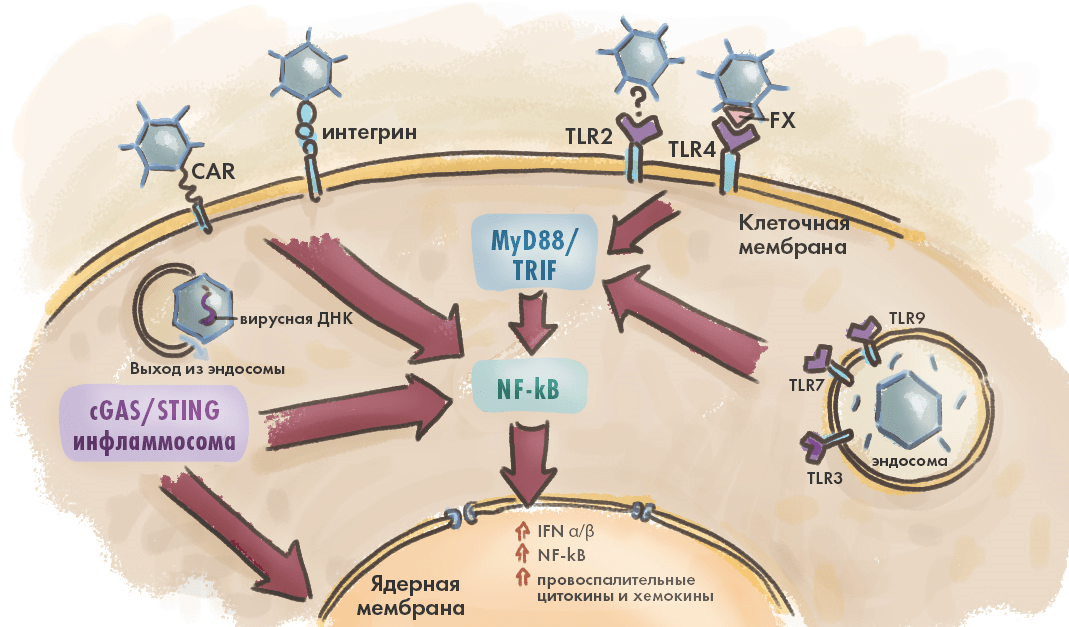
Рисунок 3. Врожденный иммунный ответ запускается при активации патоген-распознающих рецепторов клетки молекулярными паттернами вируса (PAMP). Главные «распознаватели» вируса — белок CAR, рецепторы-интегрины, а также Toll-подобные рецепторы (TLR2–4, 7 и 9) [25]. Последние присутствуют не только на поверхности клеток, но и на эндосомах. Так или иначе, распознавание вирусных РАМР-паттернов приводит к запуску множества сигнальных каскадов (cGAS/STING, MyD88- и TRIF-зависимые TLR сигнальные пути), доносящих до ядра клетки информацию о необходимости активации антивирусных генов и биосинтеза белков иммунитета.
иллюстрация Елены Беловой по [24]
Речь в основном о цитокинах — молекулах-мессенджерах, помогающих иммунным клеткам между собой «договориться» и скоординировать действия «в борьбе с врагом». Они провоцируют в организме самые разные реакции, среди которых есть особо принципиальные для иммунного ответа. Например, интерферон-гамма стимулирует как CD4+, так и CD8+ Т-клетки [26]. Первые — вспомогательные клетки-помощники, активирующие другие иммунные клетки (также через секрецию цитокинов). Ну а вторые (почувствуйте разницу) напрямую убивают инфицированные клетки путем их биохимического расщепления (лизиса) или запуска запрограммированной гибели (апоптоза) .
Апоптоз — это процесс клеточного самоуничтожения, помогающий регулировать численность и постоянство клеточных популяций, а также играющий важную роль в управляемом развитии организма. На «Биомолекуле» есть про это отдельная статья: «Апоптоз, или Путь самурая» [27].
Усиление иммунного ответа происходит и за счет созревания под воздействием воспалительных цитокинов дендритных иммунных клеток. Эти клетки известны своей отростчатой формой и умением «профессионально» представлять другим иммунным клеткам частицы-антигены. Последнее активирует основные ветви клеточной обороны организма, связывая врожденные и приобретенные иммунные ответы.
Как это работает?
Укол аденовекторной вакцины в мышцы приводит к локальному распределению вирусных частиц в месте инъекции (рис. 4). Они активно проникают в находящиеся там миоциты (мышечные клетки), клетки соединительной ткани — фибробласты — и выстилающие внутреннюю поверхность сосудов клетки-эндотелиоциты, а еще в особые антигенпрезентирующие клетки. К последним как раз относят дендритные клетки, заточенные на поглощение и переваривание бактерий, клеток и других частиц макрофаги и в меньшей степени B-клетки (ответственные также за производство антител). Поглощение чужеродных частиц и демонстрация их элементов на клеточной поверхности позволяет организму выработать на них иммунную реакцию, чтобы затем уже уничтожить несущих такие чужеродные белки-антигены «врагов». Тут-то на первый план дендритные клетки и выходят. Подвергаясь действию цитокинов, они начинают антиген синтезировать и выставлять его на свою поверхность. При этом сами они мигрируют в лимфатические узлы, и уже там обучают ни разу не сталкивавшихся с антигеном «бойцов иммунного фронта».
А это наивные B- и T-клетки, которые «узнают» здесь про антиген, что потом позволяет им «вычислять чужаков». Получив эти «знания», они начинают патрулировать организм в поисках «врага», и, узнавая его, активируют иммунитет. Чтобы вот так обучиться и стать основой «личного состава» оборонительных сил организма, эти живые бойцы проходят, можно сказать, «индивидуальную программу развития». Например, B-клетки перерождаются в плазматические клетки и вырабатывают антитела для связывания и уничтожения патогена. Ну а CD8+ Т-клетки, узнавая фрагмент патогена, обучаются уничтожать его напрямую. При этом и B- и T-клетки способны стать иммунными клетками памяти: можно сказать, «накрепко запомнить» столкновение с антигеном. При реальном инфицировании это поможет быстро узнать «врага» и выработать на него защитную реакцию как раз за счет антител и «убийства» CD8+ Т-клетками.

Рисунок 4. Судьба чужеродного белка-антигена в организме после введения аденовирусной вакцины в мышцы. (1) Прямая презентация: аденовирусная вакцина инфицирует находящиеся в месте инъекции антигенпрезентирующие клетки (АПК). Они синтезируют антиген и мигрируют в лимфоузлы, где презентируют его Т-клеткам. (2) Кросс-презентация: АПК фагоцитируют (поглощают) другие находящиеся в месте инъекции инфицированные аденовирусным вектором клетки, получая вместе с ними и антиген. Затем точно так же перемещаются в лимфатические узлы и демонстрируют там антиген наивным B- и T-клеткам. (3) Кроссдрессинг: еще незнакомая с антигеном АПК «откусывает» находящийся на поверхности другой такой же (только уже инфицированной) клетки антиген — этот процесс известен как трогоцитоз. Далее всё «как по накатанной» — перемещение в лимфоузлы для представления антигена Т-клеткам. (4) Локальная презентация: АПК могут презентировать антиген Т-клеткам и в месте инъекции; ведь с одной стороны некоторое количество последних там уже присутствует — это так называемые резидентные Т-клетки; а с другой — они также будут мигрировать туда, привлекаемые выделяющимися в процессе воспаления цитокинами. (5) Презентация антигена Т-клеткам по месту инъекции возможна не только профессиональными антигенпрезентирующими клетками, но и непрофессиональными. К последним относят все имеющие ядро клетки организма (на рисунке в качестве примера показаны мышечные клетки), но как ясно из названия — они менее эффективно поглощают и представляют антиген.
адаптация Елены Беловой из [23]
Путь к иммунной защите
Здесь может возникнуть вопрос: а не слишком ли много инфицированных аденовирусом клеток умрет из-за атаки на них CD8+ клеток? Не будет ли это опасно? Путь попадания вектора ведь отличается от естественного проникновения вируса... Как с этим справляется организм? Тут надо, прежде всего, понять что значит «много», и что иметь в виду под опасностью. Пока что никто специально не считал, сколько уничтожается клеток после инъекции аденовирусной вакцины, но, очевидно, что их будет не больше заражаемых вектором. А на деле даже меньше приведенных выше максимальных цифр в 0,2–0,3%. Это связано с тем, что из-за множества рецепторов для связывания аденовирусов на одной клетке, заразить её смогут одновременно несколько таких частиц. Кроме того, часть векторов еще нейтрализуется специфичными к их белковой оболочке антителами, что также уменьшит их число. Но даже если считать, что одну клетку заразит лишь один вектор, общее количество «инфицированных» не превысит числа клеток, ежедневно погибающих при естественном самообновлении организма. Ведь только при апоптозе ежедневно погибает 1010–1011 клеток. Это число примерно соответствует количеству вводимых в одной дозе вакцины векторов. Но дело тут даже не в количестве, а в механизме происходящего после вакцинации. В устройстве организма, который не только умеет удалять из себя всё лишнее, но и восстанавливаться.
При вакцинации повреждение в месте инъекции провоцирует клеточный стресс, что вместе с адъювантными свойствами векторов вызывает локальное воспаление. Это активирует иммунную систему, привлекая не только «клеточных убийц», но и «санитаров леса» (таких как макрофаги), устраняющих остатки погибших клеток. Очистка от ненужного помогает поддерживать постоянство внутренней среды — тканевый гомеостаз. Дефектные (здесь читай зараженные) клетки из организма будут удаляться. Ну а на их место заступят «новобранцы» из числа клеток-предшественников — резерва, который в организме всегда имеется. (Причем как раз-таки для таких случаев — необходимости замещения поврежденных или инфицированных клеток.)
И всё это абсолютно естественные процессы, и без того постоянно протекающие в организме. В случае же иммунизации они помогают вывести из организма вакцину, оставив после неё лишь клетки памяти и антитела к антигену (для готовности к будущим встречам с «врагом»). Причем постепенно из организма «выйдут» как вирусные частицы, так и зараженные ими клетки, чему активно поспособствуют как CD8+ клетки, так и макрофаги. Как показали исследования на животных, при внутримышечной инъекции аденовирусов в дозах порядка 1011 вирусных частиц, большая их часть выводится из организма уже через девять дней. Ну а через три месяца в большинстве случаев векторы и вовсе обнаружить в организме не удается [21].
Эти данные получены на кроликах, достаточно крупный размер которых позволяет вводить большую дозу векторов и экстраполировать результаты на человека. Данные же клинических исследований подтверждают, что у людей происходит примерно то же самое [21]. В основном это обычные и вполне ожидаемые при введении вакцин симптомы, такие как лихорадка, усталость и мышечная боль (это показатель иммунного ответа и воспаления, которые проходят сами собой). И хоть ощущения при этом не из приятных, зато мы понимаем, что иммунитет здесь «сработал», и испытывающий эти симптомы, скорее всего, окажется под его защитой. Ну а безопасность применения доказывается как в клинических, так и в пострегистрационных исследованиях таких лекарств.
Три поколения аденовирусных векторов
Ради продвижения вперед и создания нового ученые порою готовы пойти на многое. Это верно и в отношении аденовирусных векторов, для которых исследователи вот уже четыре десятилетия улучшают безопасность и эффективность, подарив нам три поколения таких частиц (рис. 5) [28].

Рисунок 5. Получение аденовирусных векторов. а — Целевой ген помещают во вспомогательный вектор, который содержит также последовательности 5′-ITR, упаковочный сигнал и участок для гомологичной рекомбинации. Затем вспомогательный и основной вектор линеаризируют («распрямляют») и заражают ими клетки HEK-293, в которых между ними происходит рекомбинация генов. Результат этого — векторы первого поколения. б — В рекомбинации между вспомогательным и основным вектором могут также помочь клеточные линии HEK293 CRE, которые производят фермент Cre-рекомбиназу. Здесь в оба вектора (вспомогательный и основной) помимо перечисленного нужно «впихнуть» еще последовательность LoxP; а затем уже заразить ими HEK293 CRE. После рекомбинации можно получить векторы первого или второго поколений. в — Другой вариант — «впихнуть» во вспомогательный вектор не LoxP, а дающую устойчивость к канамицину бактериальную последовательность (а в основной вектор — последовательность устойчивости к ампициллину), после чего заразить ими кишечные палочки штамма BJ5183, и вырастить их на среде с этими антибиотиками. Это поможет отобрать те частицы, в которых рекомбинация состоялась. После этого получившиеся векторы выделяют из бактерий, линеаризируют и заражают ими HEK-293 для получения требуемых количеств вирусных частиц. г — Третье поколение векторов получают внедрением целевого гена в вектор переноса, содержащий только ITR и упаковочный сигнал. Здесь используют также вирусы-помощники, несущие недостающие в векторе переноса гены. Этими двумя частицами заражают модифицированные HEK-293, в которых в конечные вирионы (векторы третьего поколения) упаковываются только последовательности из вектора переноса.
иллюстрация Елены Беловой по [28]
Для адаптации к генной терапии геном аденовируса подвергли множеству изменений. Например, удалили из него гены E1 и E3, что позволило создать векторы первого поколения. Эти частицы уже не размножаются, не провоцируют онкогенез и могут доставить в клетку ген размером до 8 килобаз. Помимо этого, они сильно иммуногенны, слабо и прерывисто синтезируют собственные белки, а также могут «перерождаться» в способные к размножению вирусы. Чтобы обойти все эти минусы, из них стали удалять гены и дальше. Вслед за E1 и E3 «в топку» пошли E2A, E2B и E4, дав векторы второго поколения. Но и они оказались не очень удачными: сложные в производстве, они по-прежнему синтезировали вирусные белки, да еще и теряли внедренный в них ген. Так что пришлось работать дальше.
В векторах третьего поколения удалили уже вообще все вирусные гены, кроме пси-последовательности (известной также как упаковочный сигнал), и обрамляющих внедренный ген инвертированных терминальных повторов (ITR). Эти частицы вызвали больший резонанс: будучи вполне безопасными и менее иммуногенными, они могут нести гены размером уже до 37 килобаз и длительно их экспрессировать.
И каков же итог?
Инженерия аденовируса сыграла решающую роль в разработке препаратов с этими носителями, но именно в вакцинах она востребована в меньшей мере. Дело в том, что снижение иммуногенности, над которым все так долго бились, здесь в зачет не идет. Наоборот, провоцируемый вирусными белками иммунный ответ оказывается для вакцин преимуществом. Кроме того, лишенные собственных генов вирусные векторы, требуют для репродукции вспомогательных вирусов-помощников, что также сильно усложняет производство. Поэтому в современных аденовирусных вакцинах в основном используют векторы первого поколения. Они обеспечивают баланс между эффективностью, простотой производства и требуемой иммуногенностью.
Современные аденовирусные вакцины
Хотя использование аденовирусной технологии и лежит у самых истоков генной терапии, никогда раньше так широко она не использовалась, как в период пандемии COVID-19. Дело в том, что база этой технологии уже была заложена и отточена в предыдущих эпизодах этого сериала — в частности, в эпопее по созданию вакцины от лихорадки Эбола, — и нужно было лишь взять эту технологию и пустить в дело.
От вируса Эбола к коронавирусу
Лихорадка Эбола ошеломила ученых и широкую общественность задолго до нового коронавируса. Еще в 1976 году болезнь обнаружили в государстве Заир, ныне известном как Демократическая Республика Конго, неподалеку от реки Эбола (что и дало имя болезни и патогену). Самая крупная вспышка заболеваемости переросла в эпидемию 2014–2016 годов и унесла жизни более 11 000 человек. При этом на тот момент в мире не было зарегистрировано ни профилактических, ни терапевтических средств против этой болезни , [29]. Поиск возможностей удовлетворить эту потребность и созданные препараты как раз и наметили вектор движения в создании аденовирусных вакцин против COVID-19. Ведь вакцины эти не только работают по схожему принципу, но еще и используют аналогичные технологии. В частности, и там, и там используют прайм-бустинг : вакцинацию проводят дважды, при этом вторая «порция» как бы «подпинывает» иммунитет, дополнительно стимулируя и улучшая защиту от патогена.
На «Биомолекуле» есть исчерпывающая статья, описывающая историю создания вакцины от вируса Эбола и как на ее основе позже появился «Спутник V», к которой мы и отправляем читателя: «Смертельная зараза: за что мы благодарны лихорадке Эбола и при чем тут “Спутник V”» [30]. А помимо вакцины, от лихорадки Эбола недавно создали также и лекарство: «Инмазеб. Новая страница в истории лечения Эболы» [31].
Различают гомологичный и гетерологичный прайм-бустинг. В первом случае обе «порции» вакцины представляют собой один и тот же компонент, а вот во втором случае — компоненты в «порциях» уже разные. И есть данные, что гетерологичный прайм-бустинг может приводить к более устойчивому иммунитету, чем гомологичный [32].
Janssen vs «ГамЭвак-Комби»
Гетерологичный прайм-бустинг используют против вируса Эбола в схеме вакцинации от компании Janssen и в российской вакцине «ГамЭвак-Комби», разработанной в институте им. Н.Ф. Гамалеи. В первом случае людям сначала вводят векторный аденовирус типа 26 (Ad26), синтезирующий поверхностный гликопротеин вируса. Примерно через восемь недель наступает время второго компонента — генетически модифицированного вируса оспы, несущего гены уже нескольких белков-антигенов от различных вариантов возбудителя лихорадки Эбола.
В вакцине «ГамЭвак-Комби» все реализовано немножко по-другому. Здесь люди вначале получают генетически измененные для экспрессии гена гликопротеина вирусы везикулярного стоматита, а затем уже (как минимум через 21 день) несущие в геноме код того же антигена векторы Ad5. И все это немного напоминает вакцинацию от нового коронавируса, не так ли? Ведь иммунизация Ad5 и Ad26 используется и против этого патогена. Вот только здесь уже в качестве антигена эти векторы производят белок S.
«Спутник V» / «Спутник Лайт»
На данный момент «Спутник V» (разработанный в Центре эпидемиологии и микробиологии имени Н.Ф. Гамалеи) [33] — единственная векторная вакцина от нового коронавируса, в которой реализован режим гетерологичного прайм-бустинга [3]. Интервал дозирования здесь составляет 21 день: первой дозой вводится вектор Ad26, а второй — уже Ad5. Использование вектора Ad26 изначально было продиктовано необходимостью преодоления предсуществующего иммунитета. Дело в том, что наиболее широко использующийся аденовирус 5 серотипа по совместительству является одним из самых распространенных в европейской популяции. Это означает, что в процессе естественного инфицирования множество людей уже сталкивались с ним и потому имеют антитела, выработанные против его белковой оболочки (капсида). Предполагалось, что введение вакцины тем, кто ранее сталкивался с вирусом, будет менее эффективным. Его частицы облепятся специфичными антителами, их входа в клетки не произойдет, антиген не будет синтезироваться, и иммунитет против патогена выработаться не успеет. Однако широкое использование векторных вакцин показало, что специфический иммунитет против целевого антигена все же вырабатывается даже у ранее сталкивавшихся с Ad5-серотипом людей. В этом случае специфичные к капсиду антитела, по всей видимости, просто не успевают нейтрализовывать часть вводимых векторов, — они все же попадают в дендритные клетки, а вместе с ними и в лимфоузлы. Это приводит к тому, что даже повторное введение вакцины вызывает выработку антител и защиту организма от инфекции.
Тем не менее на момент создания первых векторных вакцин, разработчики оглядывались на возможное влияние предсуществующего иммунитета, и искали способы его обойти. Здесь-то привлекательным решением и стал имеющий низкую распространенность серотип Ad26, что, как считалось, может делать его более иммуногенным.
Для проверки эффективности «Спутника V» в Москве проводили клинические испытания III фазы с участием более 20 000 взрослых добровольцев старше 18 лет . Эти исследования показали общую эффективность препарата в 91,6% против инфекции COVID-19. Впоследствии в НИИ им. Гамалеи запустили «новую версию» препарата: «Спутник Лайт». Эта вакцина уже однодозовая с использованием генетически измененного Ad26 в качестве вектора. Опубликованные результаты исследования показали её общую эффективность в 79,4% через 28 дней после иммунизации. При этом вырабатывались как нейтрализующие антитела, так и клеточные ответы [3].
Подробно мы писали о нашумевших в свое время результатах I/II фазы: «Результаты 1/2 фаз испытания российской вакцины от COVID-19: разбираем статью в The Lancet» [34].
Вакцина от Johnson & Johnson
Однокомпонентная вакцина от Johnson & Johnson использует генетически модифицированный Ad26 против COVID-19. Но, в отличие от «Спутника V» и других подобных препаратов, здесь в геноме вектора заложена конструкция, кодирующая так называемую стабилизированную префузионную форму белка S (рис. 6) [3].
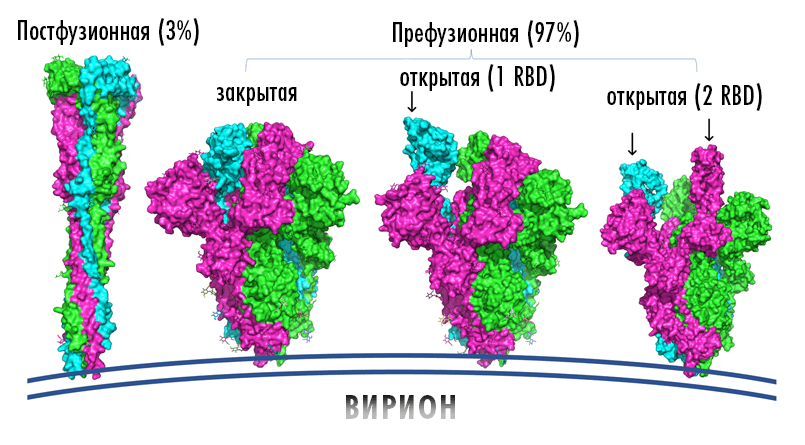
Рисунок 6. S-белки изменяют свою конформацию при связи с мишенью. Форму до взаимодействия называют префузионной (справа), а после взаимодействия и слияния вирусной и клеточной мембран — постфузионной (слева).
адаптация Елены Беловой из [41]
В исследованиях на животных показана индукция более высоких уровней нейтрализующих антител на данную конформацию, чем на белок S в его нативной форме [35]. Возможно, это-то и обеспечивает достаточность однократной дозы для эффективности препарата, которая, как показали исследования, вполне удовлетворительна. Через 42 дня после иммунизации эффективность вакцины составляла 92,4%, при этом стойкость иммунных реакций наблюдалась и через 8 месяцев после прививки [3].
Оксфордская вакцина
Вакцина, производимая компанией AstraZeneca и разработанная в стенах Оксфордского университета, использует протокол гомологичного прайм-бустинга с интервалом между дозами в 28 дней. И в первой, и во второй инъекции здесь вводят вектор ChAdOx1 на основе аденовируса шимпанзе Y25-серотипа (выбор вектора продиктован обходом возможного иммунитета к Ad5) [36]. ChAdOx1 экспрессирует ген S-белка и имеет ряд модификаций относительно своего «дикого собрата» Y25. За счет удаления генов E1/E3 он лишен возможности размножаться, а замена участков гена E4 природного вируса на аналогичные от Ad5-серотипа позволяет при производстве получать больше таких частиц. При этом этот вектор уже проходил испытания в составе вакцины против ближневосточного респираторного синдрома, когда разразилась пандемия COVID-19.
Ну а в апреле 2020 года в Соединенном Королевстве начались клинические испытания I фазы препарата уже и против нового коронавируса на его основе. Затем исследования расширили до испытаний фазы III в Бразилии и Южной Африке, в которых участвовали здоровые взрослые в возрасте 18–55 лет, пожилые люди (≥56 лет), медицинские работники и другие лица. Результаты, полученные в четырех независимых клинических испытаниях, продемонстрировали общую эффективность 70,4% (после двух доз) и 64,1% (после одной дозы) [36]. Позднее общая эффективность была скорректирована до 76% (и до 85% у лиц старше 65 лет). Новые данные относятся к исследованию фазы III NCT04516746, в котором приняли участие более 30 тысяч участников.
«Конвидеция» (Convidecia)
Вакцина «Конвидеция» от CanSino Biologics (Тяньцзинь, Китай), также основанная на человеческом Ad5, синтезирующем белок S, была протестирована в Ухане, в рамках II фазы клинических испытаний. В общей сложности 508 взрослых старше 18 лет были иммунизированы однократной дозой в различных концентрациях векторов. Выработка специфических антител была зависимой от дозы, и ее частота составляла 96% при более высокой дозе и 97% при более низкой. Результаты исследования фазы III (NCT04526990) еще не были опубликованы, когда вакцину уже одобрили для использования в Китае [36]. Данный препарат проходил испытания и для одобрения в России, чем занималась компания «Петровакс». По данным пресс-релиза эффективность вакцинации здесь составила 90,6% при хорошей переносимости и высоком профиле безопасности. На этом основании была подана заявка на регистрацию в Минздрав в августе 2021 года и даже предварительно запланировано производство препарата на мощностях компании. Однако с тех пор новостей не было, и текущий статус по этому вопросу неясен.
Загвоздка качества
На бумаге «Спутник V» и его западные аналоги очень схожи: демонстрируют примерно равную эффективность и применяются как на отечественных для производителей рынках, так и в других странах. Но есть между ними одно радикальное различие, ведь «Спутник V» пока не был одобрен для применения ни в США, ни в Евросоюзе.
У них и у нас
Стоит сказать, что препаратам, разработанным на Западе в целом вообще легче пройти «горнило» регуляторного одобрения в США и Европе, и для этого есть вполне объективные причины. Дело в том, что там внедрены и активно используются нормативные стандарты, подразумевающие более высокие требования к качеству и производству, чем те, на которые опираются нынче в России. Ну а поскольку данную улучшенную систему качества стали внедрять более 30 лет назад, то и создание вписывающихся в нее лекарств отработано уже неплохо. В частности, при производстве вакцин Johnson & Johnson и AstraZeneca контролируется буквально всё (как и для продуктов генной и клеточной терапии) [37]: исходное и промежуточное сырье и материалы, банки клеток, каждый этап производства, соответствие конечной субстанции спецификации и т.д. (рис. 7) [22], [38].
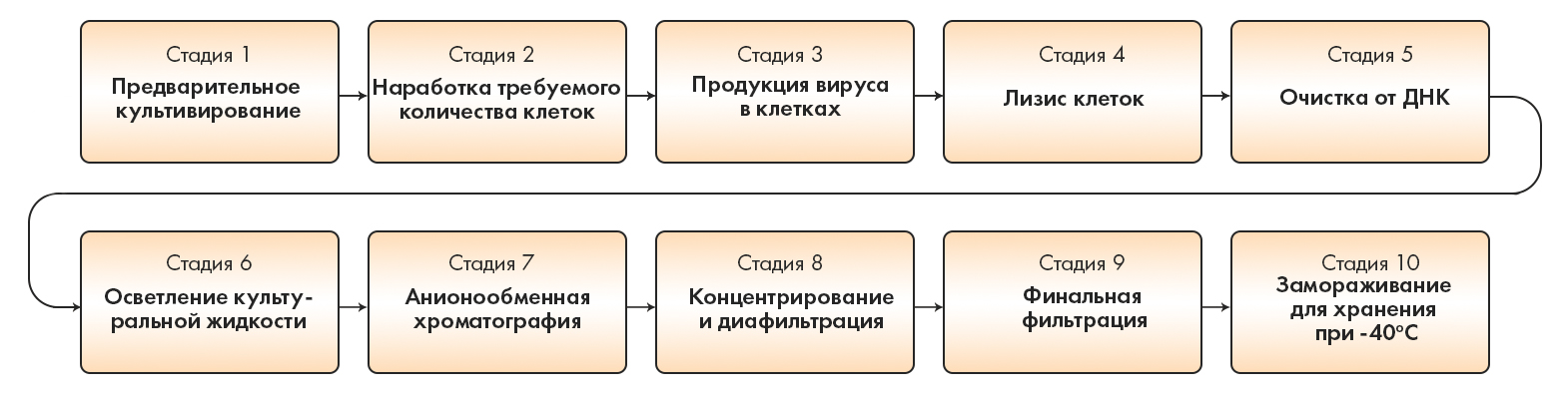
Рисунок 7. Основные стадии производства вакцины Johnson & Johnson. Производство аденовирусных частиц состоит из 10 этапов: 1) предварительное культивирование; 2) наработка требуемого количества клеток; 3) продукция вируса в клетках; 4) лизис клеток; 5) очистка от ДНК; 6) осветление культуральной жидкости; 7) анионообменная хроматография; 8) концентрирование и диафильтрация; 9) финальная фильтрация (через мембрану с размером пор 0,22 мкм) и разлив фильтрата в емкости из поликарбоната; 10) замораживание для хранения при температуре −40 °C.
При этом любое отклонение производственных параметров от строгих критериев приемлемости расследуется, а все данные по контролю качества предоставляются по запросу регуляторам. То есть система производства и контроля качества не только очень здорово отработана, но и прозрачна для внутреннего и внешнего контроля. Это делает процесс одобрения лекарств более эффективным, а ведь и регулирующие органы имеют там более сложные регламенты утверждения. Они могут требовать от заявителей предоставления подробностей об эффективности, безопасности, деталях производства препаратов, а также запрашивать дополнительные данные для научных и регуляторных обзоров — всё это затормозило международное признание «Спутника».
Конечно, нельзя сказать, чтобы российское производство сегодня было совсем чуждо всей этой «кухни», но некоторые проблемы, с которыми сталкивались российские площадки, говорят о том, что не всё ладно в датском королевстве. В частности, после визитов аудиторов ВОЗ и ЕМА в Россию был высказан ряд замечаний, после устранения которых планировались повторные аудиты. В связи с началом специальной военной операции и международной изоляцией России неясно, произойдут ли эти аудиты вообще.
Проблемы и решения
Топ-менеджеры компаний производителей «Спутника V» и инсайдеры отмечали производственные сложности, из-за которых приходилось выбраковывать целые серии препарата. Это, например, перекрестная контаминация серотипов Ad5 и Ad26 и появление в вакцине размножающихся вирусов. Первое было связано с неполным разделением производственных потоков, что разные компании решали по-разному. Например, распределением производств серотипов между разными помещениями с отдельными входами для персонала, или вовсе перемещением их на разные заводы, отдаленные друг от друга на сотни километров.
Вторая проблема была более специфична и связана с обменом генетическим материалом между клетками-продуцентами вируса HEK293 и неспособными к размножению вирусами. Их случайная рекомбинация приводила к тому, что в вектор из клеток «возвращался» удаленный из него ген E1, и утраченная способность вируса размножаться вновь восстанавливалась. Такие проблемы вряд ли возможны, например, при производстве вакцины Johnson & Johnson, так как она содержит только один компонент, который производится в специально созданной для этого клеточной линии PER.C6. В таких клетках также присутствует ген E1, но интегрированный фрагмент генома вируса здесь уже меньшего размера, и для восстановления «репродуктивной способности» в нем недостает ключевых элементов. При использовании правильно сконструированных векторов это делает невозможным появление размножающихся вирусов [22], [39], [40]. Что, впрочем, совсем не означает, что западные вакцины не проверяют на их содержание. Более того, такой контроль, наряду с контролем примесей и микробиологической чистоты, «интегрирован» в производство препаратов в соответствии с требованиями американской и европейской фармакопей [22], [38].
Насколько всё плохо?
Как ни странно, ничего смертельного в наличии размножающихся вирусов в вакцинах нет. Более того, они лежат в основе создания некоторых вакцин, так как зачастую имеют преимущество более сильного и продолжительного иммунного ответа. Примерно то же можно сказать и о перекрестной контаминации: реакция на такие препараты, скорее всего, будет немного отличаться профилем иммунного ответа, не более. Это, конечно, если исходить из чисто теоретических соображений, но и из практики применения можно судить о многом. Ведь ныне «Спутником V» вакцинированы уже миллионы людей, причем как в России, так и в других странах, и очевидно, что если бы какие-либо серьезные последствия этого имелись, они бы не остались незамеченными.
В тоже время, нельзя просто так взять и прописать в вакцине отсутствие размножающихся вирусов, если они там есть. Это идет вразрез с принципами, изложенными в руководствах международного совета по гармонизации (ICH), на которые опираются регуляторные органы США и Европы. В них описаны основные требования к разработке, производству и регистрации фармацевтических продуктов. В частности, что характеристики любого лекарственного средства должны быть четко определены и прописаны. То есть если заявлено, что вакцина размножающихся вирусов не содержит, то именно так оно и должно быть. В противном случае нужно не только предоставить данные о количестве таких вирусов, но и об их влиянии на здоровье человека, которое должно быть оценено в соответствующих исследованиях. Нарушение этого правила ставит под вопрос возможное использование «Спутника V» в США и Европе, где такие аспекты для регуляторного одобрения имеют очень большое значение.
И все же в целом всё не так уж плохо, даже если оглядываться на возможности западного применения. По результатам проверки инспекторов ВОЗ и EMA пока что строго можно говорить о недочете лишь на одной площадке. Это завод компании «Фармстандарт» в Уфе, на котором обнаружили нарушения мер по снижению рисков перекрестной контаминации и контроля асептического разлива, что привело к приостановке регистрации «Спутника V» в ВОЗ. Проверка же инспекторами EMA площадок компании «Р-Фарм» на данный момент не завершена. По данным инсайдеров, в 2022 году ожидался второй визит (который, вероятно, уже не состоится — ред.), что, по всей видимости, и определит решение о выдаче регистрационного удостоверения, открывающего путь препарату на европейский рынок. Если учитывать все особенности российской фармы, можно сказать, что это не самый худший результат. В отличие от стран Запада, мы пока что только «робко вступаем» на путь строжайшего методического контроля фармпроизводств, зачастую не хватает опыта и обеспеченности всеми необходимыми ресурсами. Поэтому было бы странно думать, что в продиктованных пандемией условиях ускоренной работы над вакциной конечный продукт сразу будет соответствовать высоким стандартам, и его одобрение на международной арене пройдет гладко и без изъянов. Тем не менее пока еще этот путь не закрыт (может быть, только где-то в далеком необозримом будущем — ред.), и, возможно, «Спутник V» станет первым российским лекарством, одобренным на территории стран ОЭСР , .
EMA — Европейское агентство лекарственных средств — один из основных мировых регуляторов использования лекарств, определяющий их одобрение для применения на территории стран Евросоюза.
ОЭСР — организация экономического сотрудничества и развития — международная организация экономически развитых стран, признающих принципы представительной демократии и свободной рыночной экономики.
В связи с началом специальной военной операции и международной изоляцией России подобные прогнозы, к сожалению, выглядят более чем фантастичными. — Ред.
Эта статья заканчивает большую серию из семи публикаций о генной и клеточной терапии. В этом сериале мы постарались осветить историю отрасли, ее современное состояние и будущие перспективы. Надеемся, читателю стало понятно, что в ней достигнуты впечатляющие успехи, однако она всё еще находится в колыбели. Созданы технологии, способные лечить ранее неизлечимые заболевания, спасшие миллионы людей от коронавируса, но потенциал технологии неизмеримо больше: у генных и клеточных технологий есть возможность в ближайшие десятилетия снизить смертность от сердечно-сосудистых заболеваний, рака, аутоиммунных болезней, редких болезней — и лучшие умы человечества работают над решением этих проблем.
Литература
- Хроника распространения SARS-CoV-2;
- COVID-19: что мы знаем и чего не знаем;
- Danielle Soares de Oliveira Daian e Silva, Flávio Guimarães da Fonseca. (2021). The Rise of Vectored Vaccines: A Legacy of the COVID-19 Global Crisis. Vaccines. 9, 1101;
- Charumilind S., Craven M., Lamb J., Sabow A., Singhal S., Wilson M. (2022). When will the COVID-19 pandemic end? McKinsey & Company;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Reena Goswami, Gayatri Subramanian, Liliya Silayeva, Isabelle Newkirk, Deborah Doctor, et. al.. (2019). Gene Therapy Leaves a Vicious Cycle. Front. Oncol.. 9;
- Susan P Buchbinder, Devan V Mehrotra, Ann Duerr, Daniel W Fitzgerald, Robin Mogg, et. al.. (2008). Efficacy assessment of a cell-mediated immunity HIV-1 vaccine (the Step Study): a double-blind, randomised, placebo-controlled, test-of-concept trial. The Lancet. 372, 1881-1893;
- Rosenberg J. (2022). Update to 2020 story on HIV and adenovirus Type-5 COVID-19 vaccine. AJMC;
- Susan P Buchbinder, M Juliana McElrath, Carl Dieffenbach, Lawrence Corey. (2022). COVID-19 vaccination and HIV-1 acquisition – Authors’ reply. The Lancet. 399, e36;
- Cross R. (2019). The redemption of James Wilson, gene therapy pioneer. C&EN;
- Три поколения лекарств;
- Buntz B. (2021). A quick history of the tech behind J&J, AstraZeneca’s COVID-19 vaccines. Drug Discovery & Development;
- James M. Wilson. (2009). Lessons learned from the gene therapy trial for ornithine transcarbamylase deficiency. Molecular Genetics and Metabolism. 96, 151-157;
- Нетесов С. (2021). Вакцинация без мифов. «Наука из первых рук». 1–2;
- В чем сила, парацетамол?;
- Лекарство в пробирке: доклинические исследования in vitro;
- Development and licensure of vaccines to prevent COVID-19. Guidance for industry. (2020). FDA;
- Guideline on quality, non-clinical and clinical aspects of live recombinant viral vectored vaccines. (2010). EMA;
- Rebecca L. Sheets, Judith Stein, Robert T. Bailer, Richard A. Koup, Charla Andrews, et. al.. (2008). Biodistribution and Toxicological Safety of Adenovirus Type 5 and Type 35 Vectored Vaccines Against Human Immunodeficiency Virus-1 (HIV-1), Ebola, or Marburg Are Similar Despite Differing Adenovirus Serotype Vector, Manufacturer's Construct, or Gene Inserts. Journal of Immunotoxicology. 5, 315-335;
- COVID-19 vaccine Janssen. (2021). EMA;
- Lynda Coughlan. (2020). Factors Which Contribute to the Immunogenicity of Non-replicating Adenoviral Vectored Vaccines. Front. Immunol.. 11;
- Ahmed Elkashif, Marwa Alhashimi, Ekramy E Sayedahmed, Suryaprakash Sambhara, Suresh K Mittal. (2021). Adenoviral vector‐based platforms for developing effective vaccines to combat respiratory viral infections. Clin Transl Immunol. 10;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Ann M. Leen, Anne Christin, Mariam Khalil, Heidi Weiss, Adrian P. Gee, et. al.. (2008). Identification of Hexon-Specific CD4 and CD8 T-Cell Epitopes for Vaccine and Immunotherapy. J Virol. 82, 546-554;
- Апоптоз, или Путь самурая;
- Shakti Singh, Rakesh Kumar, Babita Agrawal. (2019). Adenoviral Vector-Based Vaccines and Gene Therapies: Current Status and Future Prospects. Adenoviruses;
- I. V. Dolzhikova, E. A. Tokarskaya, A. S. Dzharullaeva, A. I. Tukhvatulin, D. V. Shcheblyakov, et. al.. (2017). Virus-Vectored Ebola Vaccines. Acta Naturae. 9, 4-11;
- Смертельная зараза: за что мы благодарны лихорадке Эбола и при чем тут «Спутник V»;
- Инмазеб. Новая страница в истории лечения Эболы;
- Georgi Shukarev, Benoit Callendret, Kerstin Luhn, Macaya Douoguih, the EBOVAC1 consortium. (2017). A two-dose heterologous prime-boost vaccine regimen eliciting sustained immune responses to Ebola Zaire could support a preventive strategy for future outbreaks. Human Vaccines & Immunotherapeutics. 13, 266-270;
- «Спутник V», «ЭпиВакКорону», «Модерну» делать будем? Ликбез по вакцинам против коронавируса;
- Результаты 1/2 фаз испытания российской вакцины от COVID-19: разбираем статью в The Lancet;
- Rinke Bos, Lucy Rutten, Joan E. M. van der Lubbe, Mark J. G. Bakkers, Gijs Hardenberg, et. al.. (2020). Ad26 vector-based COVID-19 vaccine encoding a prefusion-stabilized SARS-CoV-2 Spike immunogen induces potent humoral and cellular immune responses. npj Vaccines. 5;
- Kimberly A. Hofmeyer, Katherine M. Bianchi, Daniel N. Wolfe. (2022). Utilization of Viral Vector Vaccines in Preparing for Future Pandemics. Vaccines. 10, 436;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- COVID-19 vaccine AstraZeneca. (2021). EMA;
- Imre Kovesdi, Susan J. Hedley. (2010). Adenoviral Producer Cells. Viruses. 2, 1681-1703;
- Рейтер С. и Малкова И. (2022). Не колу разливаем. Meduza;
- Alaa M. Ismail, Abdo A. Elfiky. (2020). SARS-CoV-2 spike behavior in situ: a Cryo-EM images for a better understanding of the COVID-19 pandemic. Sig Transduct Target Ther. 5.







