Результаты 1/2 фаз испытания российской вакцины от COVID-19: разбираем статью в The Lancet
03 ноября 2020
Результаты 1/2 фаз испытания российской вакцины от COVID-19: разбираем статью в The Lancet
- 7094
- 4
- 4
Логотип одного из самых престижных медицинских журналов на фоне изображения российской вакцины от COVID-19
коллаж автора статьи, «Википедия»
-
Автор
-
Редакторы
Темы
Статья на конкурс «Био/Мол/Текст»: 4 сентября 2020 года случилось во многом долгожданное событие в сфере разработки российской вакцины от коронавируса SARS-CoV-2. Группа под руководством Дениса Логунова опубликовала в журнале The Lancet результаты первой и второй фаз испытания вакцины «Гам-КОВИД-Вак», она же «Спутник-V». Разработчики вакцины в заявлении для СМИ отметили, что публикация в таком серьезном журнале доказала безопасность и эффективность вакцины. Действительно ли все сомнения развеяны? Читаем статью и разбираемся вместе!
Конкурс «Био/Мол/Текст»-2020/2021
 Эта работа заняла второе место в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Эта работа заняла второе место в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Новый коронавирус, появившийся на рубеже 2019–2020 годов, застал человечество врасплох — под рукой не оказалось ни эффективных лекарств, ни вакцин. С первых дней их необходимость была очевидна. На момент написания нашей статьи в журнале «Природа», перепубликованной «Биомолекулой» с изменениями [1], [2], в мире испытывалось около 100 прототипов вакцин от коронавируса . Три из них — российские.
В июне на «Биомолекуле» вышел подробный обзор подходов к разработке вакцин от SARS-CoV-2 [3], переведенный из блога Дерека Лоу In the pipeline (что переводится как «В разработке» или «На конвейере»).
Последние месяцы внимание было приковано к одной из них — вакцине НИЦЭМ им. Н.Ф. Гамалеи, называемой «ГАМ-Ковид-Вак» (для внутреннего рынка) или «Спутник-V» (для рынка внешнего). Разрабатывала эту вакцину группа ученых под руководством Дениса Логунова.
Для создания вакцины российские ученые использовали аденовирус, вставив в него ген S-белка коронавируса. Аденовирусы — это возбудители сезонного ОРВИ или кишечной инфекции — то есть сами по себе они относительно безобидны по сравнению с тем же коронавирусом. А чтобы вакцинируемые не заболели даже этим, в вакцинах используются аденовирусы с дефектной репликацией (replication-defective adenovirus), сокращенно rAd. (В противоположность им, дикие типы соответствующих аденовирусов называются hAd — сокращение от human adenovirus — «человеческий аденовирус»).
В данном случае смысл дефектной репликации — чтобы при попадании в человеческую клетку репликация вируса была минимальной [4], и он не мог нанести вреда, но сохранял способность заставлять клетки пациента экспрессировать белки, закодированные в его генах. Это обычное явление для вируса. Но здесь внутри относительно безобидного аденовируса есть и ген от какого-нибудь «монстра» — филовируса Эбола, ВИЧ или SARS-CoV-2. Он тоже экспрессируется клетками, в которые проник вакцинный вирус, и его продукт вызывает иммунный ответ. Теперь иммунитет хозяина знаком с вирусом-«монстром».
Это далеко не новая методика. Более того, аденовирусные векторы — некоторая классика жанра: и в генной терапии, и в разработке вакцин [5]. На основе аденовируса ранее даже пытались создать вакцину от ВИЧ [4]. Но препятствием стало то, что у населения по всему миру высокая серопревалентность (встречаемость антител) к аденовирусам — конкретно к аденовирусу hAd5, который использовали для создания вакцины. А как может быть иначе, если они вызывают сезонные ОРВИ и гастроэнтериты? Именно это стало препятствием на пути создания анти-ВИЧ-вакцины — иммунитет добровольцев разрывал в клочья аденовирус-носитель, не успев даже рассмотреть кодируемый им белок опасного патогена.
В 2011 году группа ученых из США и Нидерландов открыла [6], что проблема существующего в популяции иммунитета к hAd5 может быть решена с помощью подтипов rAd26 и rAd35, «обходящих» иммунитет к rAd5 — так как они меньше всего на него похожи. Именно это решение (с некоторой модификацией) взяла на вооружение группа Дениса Логунова — она использовала два вектора сразу (рис. 1)! Первый основан на rAd26, второй — на rAd5. Вводятся они с интервалом в 21 день.
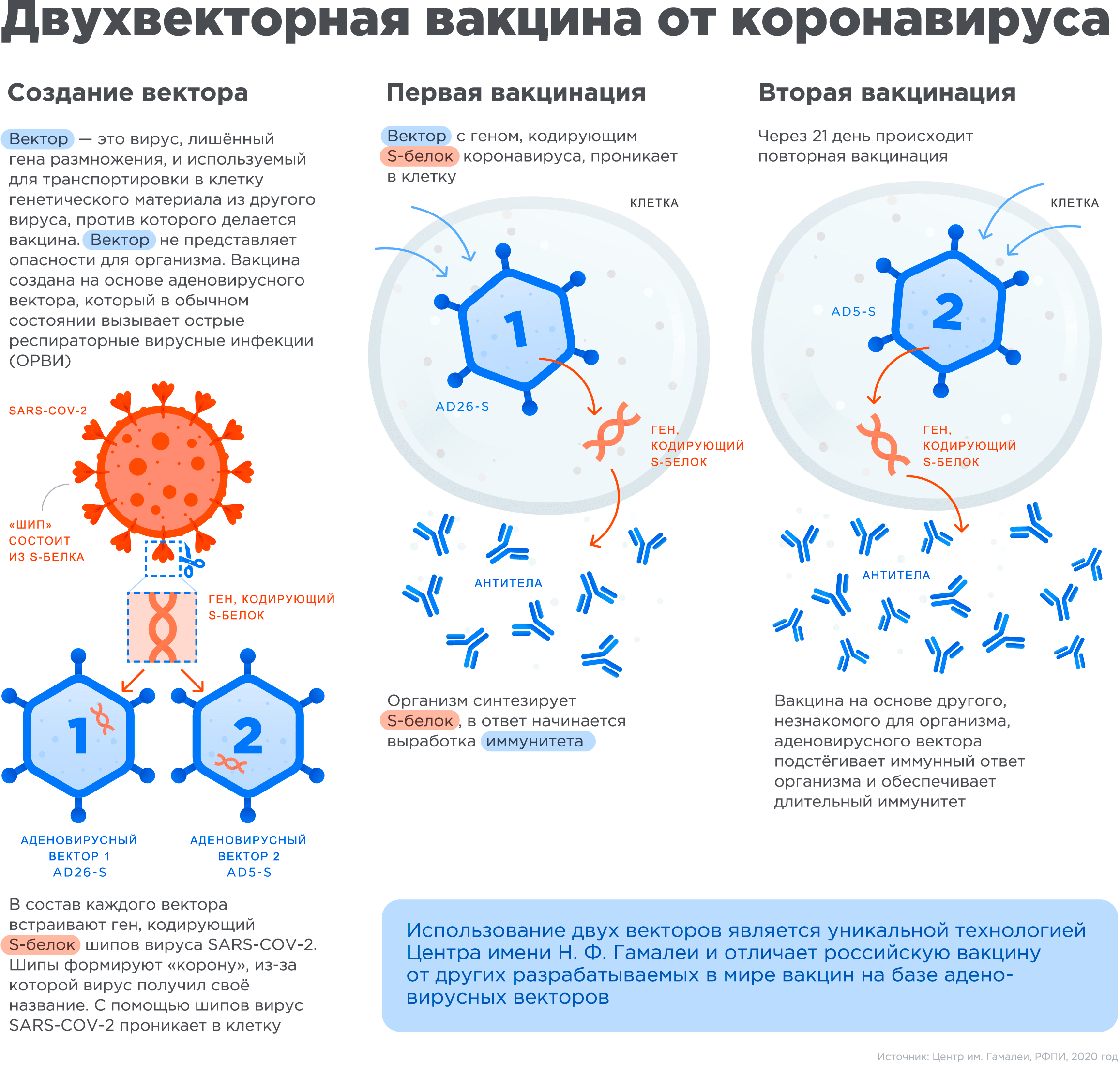
Рисунок 1. Принцип создания вакцины от SARS-CoV-2 учеными из НИЦЭМ им. Н.Ф. Гамалеи
Таким образом, методика создания вакцины путем вставки в аденовирус генов чего-нибудь-страшного используется в мире давно. В НИЦЭМ им. Н.Ф. Гамалеи эта методология тоже налажена. Но это касается только принципа постройки вакцины. Если сравнить вакцину с автомобилем, то мы знаем, что «автомобиль» на основе аденовируса не развалится сразу же. Но поедет ли он и не врежется ли в ближайшее дерево — об этом проверенность методики нам ничего не говорит.
Более того, попытки создать вакцину от какого-нибудь нового опасного патогена на основе аденовируса регулярно проваливались [7]. Зарегистрированных вакцин на их основе мало, и все они — от лихорадки Эбола. Испытать эти вакцины широкомасштабно не представлялось возможным — к счастью, пандемии Эболы так и не случилось (не сглазить бы...). Приходится признать, что мы ничего не знаем о том, помогают аденовирусные вакцины или нет. Схема сборки автомобиля есть, но он ни разу пока не заводился.
Абзацем выше под «поедет» имелась в виду эффективность, а под «врезаться в дерево» — серьезные нежелательные реакции и осложнения. И в случае вакцины от нового коронавируса особенно много вопросов именно к последнему пункту.
В нашей статье по разработке лекарств [2] мы уже обозначали этическую проблему. Летальность (отношение числа умерших к общему числу заразившихся) COVID-19 оказалась довольно низкой, а большинство заразившихся переносят его в легкой форме. Поэтому требования к лекарствам от новой инфекции особенно жесткие: опасность осложнений и серьезных нежелательных реакций должна быть сведена к минимуму, чтобы случайно не превысить опасность самого вируса.
Если препарат для лечения заболевания не должен быть хуже болезни, то что говорить о препарате для профилактики? Здесь мы сталкиваемся с новой этической дилеммой. Лекарство дается больному человеку с целью сделать из него здорового — и нежелательные реакции могут выглядеть для пациента платой за улучшение самочувствия в дальнейшем. Но вакцина вводится здоровым людям — и будет крайне неловко, если при этом из здорового человека получится больной в результате развития нежелательной реакции. Этот тонкий этический момент повышает планку требований к переносимости и безопасности вакцин.
Летом разгорелась серьезная общественная дискуссия по поводу ускоренных испытаний вакцины. Их критиковали такие авторитетные ученые, как академики РАН Виталий Зверев (автор учебников по микробиологии, по которым учатся студенты-медики во всей стране) и Александр Чучалин (один из основоположников российской школы пульмонологии) [8]. Общество ждало публикации российскими учеными своих результатов в рецензируемых международных журналах — ожидалось, что она добавит объективности в жаркий спор. Долгожданная публикация случилась 4 сентября 2020 года в журнале The Lancet [9].
Так можно ли теперь спокойно идти на укол? Разберем подробно, какие выкладки привели российские вирусологи в статье — и что из них следует.
В опубликованной статье авторы излагали результаты испытаний вакцины на безопасность и иммуногенность [9]. Первый параметр измерялся числом нежелательных реакций, а второй — уровнем антител после вакцинации и силой T-клеточного иммунного ответа. Измерение последнего важно: ведь не антителами едиными держится иммунитет к любому вирусу. Наоборот, T-лимфоциты принимают большое участие в борьбе с вирусами, разрушая зараженные клетки или командуя спецоперацией по уничтожению возбудителя. В последнее время даже предполагается, что у переболевших уровень антител отражает не защиту от вируса, а тяжесть поражения [10]. Это связано с особенностями иммунного ответа на вирус — все-таки он пришел из летучих мышей, существ с другой иммунной системой, и наш иммунитет реагирует на него неадекватно.
Вакцина разработана в двух видах — в виде раствора и лиофилизата. В испытаниях каждого участвовало 38 добровольцев... Стоп, а добровольцев ли? Ведь в испытаниях участвовали военнослужащие. Это резко критиковалось, в том числе, уже упоминавшимся академиком Александром Чучалиным (в интервью журналу «Наука и жизнь» [8]). Но здесь есть одна юридическая тонкость. Статья 43 Федерального закона от 12.04.2010 №61-ФЗ (ред. от 13.07.2020) «Об обращении лекарственных средств» своим пунктом 6 запрещает испытания препаратов на военнослужащих, за исключением случаев:
...проведения клинического исследования лекарственного препарата, специально разработанного для применения в условиях <...> чрезвычайных ситуаций, профилактики и лечения заболеваний и поражений, полученных в результате воздействия неблагоприятных <...> биологических факторов.
Следует заметить, что вакцина прошла регистрацию именно для применения в условиях ЧС. Поэтому юридически ее можно считать препаратом, разработанным для условий ЧС (на данном этапе), и исключением из данного правила. То есть формально закон разрешает здесь привлекать военнослужащих, причем именно служащих по контракту (о чем и было сказано в статье группы Дениса Логунова), но с соблюдением принципа добровольности.
В статистике побочных эффектов у добровольцев лидирует повышение температуры. Авторы делят его на «легкое» (mild) и «умеренное» (moderate). Но... диапазон «легкое повышение температуры» у них простирается от 37 до 38,4 ⁰C, а «умеренное» — от 38,5 до 38,9 ⁰C. То есть среди 38 испытуемых в каждом из двух исследований были случаи повышения температуры в пределах 39 градусов.
При этом классификация повышения до 38,4 как «легкого» вызывает вопросы — при такой температуре субъективное самочувствие человека вряд ли можно описать словом «легкое». В России аналогом «легкого» повышения температуры является термин «субфебрильная» — но она означает повышение до 38 ⁰C, а все значения выше считаются показанием для применения жаропонижающих средств. Но в американских рекомендациях CTCAE (Common Terminology Criteria for Adverse Events — «Общие терминологические критерии для нежелательных явлений») пятого пересмотра критерии еще жестче: температура до 38 градусов вообще не считается нежелательным явлением, а первая, «легкая», степень простирается до 39 градусов. Стандарты есть стандарты, но вряд ли кто-то из обычных получателей препарата согласится с тем, что 38,8 — это «легкий» побочный эффект. Впрочем, и 38,1 вряд ли покажется легким. И остается непонятным принцип, по которому группа Дениса Логунова делила побочные реакции на стадии — они расходятся как с нашими «национальными» представлениями, так и с международными рекомендациями по номенклатуре нежелательных реакций. В итоге сложно оценить вакцину как «хорошо переносимую» (по утверждению группы Дениса Логунова) с точки зрения повышения температуры.
Здесь разрешить сомнения могла бы демонстрация распределения уровня повышения температуры внутри упомянутой «легкой» группы — например, в виде графика. Но таких данных приведено не было — большинство графиков касаются только иммуногенности. Так что вопрос с лихорадкой после вакцинации остается висеть в воздухе. Кстати, это «легкое» повышение температуры отмечалось примерно у 90% испытуемых — при таких неоднозначных пороговых цифрах это довольно много. Академик Виталий Зверев в своем интервью изданию «Бизнес Online» прямо сомневается в соответствии такой вакцины современному уровню безопасности:
У нас в центре прививают обычными вакцинами, и это редкий случай, когда фиксируется повышение температуры до 38, я даже не помню, чтобы у нас такое было. А тут вроде подобное как одно из осложнений.
Набор остальных побочных эффектов был довольно широк — тут и головная боль, и потеря аппетита, и боль в горле, и астения. За полным перечнем отсылаю читателя к самой статье в The Lancet. Здесь лишь отмечу, что, по действующим нормам клинических исследований, хорошо переносимым считается препарат, который не приводит испытуемых к «сходу с дистанции» — к отказу от дальнейшего участия в испытаниях. Авторы отмечают, что таких случаев не было. Но, как мы (и авторы статьи) уже писали выше, в исследовании участвовали военнослужащие, по определению занимающие подчиненное положение и более подготовленные к возможным тяготам, чем гражданское население. Не исключена такая ситуация, что они могли «перетерпеть» эффекты, которые вынудили бы «гражданского» испытуемого выйти из испытаний.
Что касается иммуногенности, то группа Дениса Логунова сделала попытку доказать с помощью корреляционного анализа, что антитела к аденовирусу не помешают выработке антител к шипам (S-белку) коронавируса. Авторы сделали вывод: не помешают. Правда, выборка мала, и вполне могло оказаться, что процент серонегативности по аденовирусам в ней больше среднего по популяции — в результате случайного «дрейфа» показателя. Также неясно, почему у вектора оказалась такая низкая иммуногенность при высокой иммуногенности протективного антигена. Поэтому рапортовать об успешности «аденовирусного» подхода на основе результатов НИЦЭМ им. Н.Ф. Гамалеи пока рано.
Авторы статьи измерили у испытуемых уровни антител к коронавирусу: «просто» антител, связывающих антигены вируса, и вирус-нейтрализующих антител. Первый показатель оказался у вакцинированных выше, чем у переболевших COVID-19. Казалось бы, это потрясающая новость! В таком виде она и была растиражирована в СМИ. Есть только одно важное «но»: уровни вирус-нейтрализующих антител были одинаковы у переболевших и вакцинированных. Сыворотка вакцинированных нейтрализует вирус так же, как сыворотка переболевших, а не лучше.
К тому же, авторы исследовали только переболевших в легкой и среднетяжелой формах. Есть основания полагать, что у тяжело переболевших было бы больше антител, чем у вакцинированных, — я уже упоминал возможную корреляцию с тяжестью перенесенного заболевания. И «на закуску» — авторы указывали, что по титрам антител сыворотка их испытуемых «проигрывает» испытуемым компаний Moderna [11] и Оксфордского университета [12] — создателей зарубежных вакцин-аналогов. Но тут же отмечали, что сравнить данные невозможно из-за разных концентраций вируса, используемых российскими учеными и их зарубежными коллегами. Так что не все так однозначно с уровнями антител. Несколько меньше неожиданностей с клеточным иммунным ответом — он был зафиксирован у 100% испытуемых. Правда, мы не знаем, какова должна быть его выраженность для полноценной защиты от коронавирусной инфекции — здесь точек отсчета нет вообще.
Вдобавок авторы ссылаются на свои неопубликованные данные, по которым вакцина защищала от заражения SARS-CoV-2 100% подопытных хомяков. Здесь даже сложно что-то комментировать: в науке неопубликованные данные не принято считать доказательством.
В довершение всего данные по иммуногенности вакцины вызвали сомнение у группы итальянских ученых, подписавших открытое письмо. В нем они обратили внимание, что некоторые данные на диаграммах, характеризующих иммунный ответ на вакцину, просто повторялись — как будто были бы скопированы из одного места в другое (рис. 2). Итальянские ученые не имели возможности утверждать, что данные действительно были обработаны недобросовестно, но сочли такое совпадение при корректной обработке статистически маловероятным. В своем открытом письме они обратились к группе Дениса Логунова с предложением представить научной общественности исходные данные измерений по каждому испытуемому. В ответ руководитель группы разработчиков вакцины заявил:
Опубликованные данные являются достоверными и точными и прошли экспертизу у пяти рецензентов The Lancet, полноразмерный клинический протокол предоставлялся в редакцию журнала. Мы представили именно те данные, которые получили, а не те, которые должны нравиться итальянским экспертам.
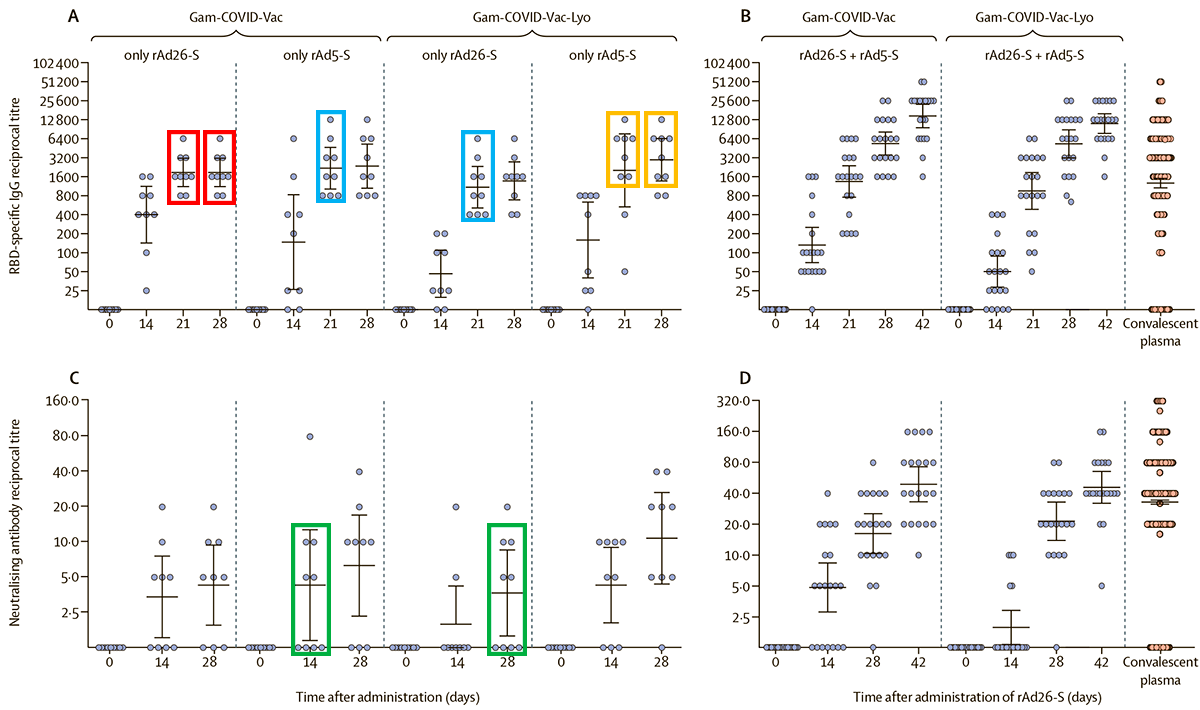
Рисунок 2. Графики из статьи группы Дениса Логунова с цветовыми выделениями итальянских ученых. Одинаковым цветом выделены совпадающие паттерны данных, дающие повод для подозрений, что картинка «отфотошопена».
Позже редакция The Lancet попросила разработчиков «Спутника V» ответить на письмо итальянских коллег. В связи с этим группа Дениса Логунова опубликовала развернутый ответ на замечания [13] в том же журнале. Повторяющиеся паттерны данных были объяснены тем, что используемая методика определения антител дает дискретные величины, а не непрерывный спектр. Это на самом деле так — используемая авторами методика иммуноферментного анализа предполагает титрование образца, как в использовавшихся ранее реакциях агглютинации (реакции гемагглютинации — РГА, реакции непрямой гемаглютинации — РНГА, реакции пассивной гемагглютинации — РПГА), что приводит к значениям, кратным определенным целым числам. Но такой дискретности следует ожидать только на малых выборках — об этом как о сопутствующей причине повторов группа Дениса Логунова заявляла в СМИ.
Этот пункт отсутствовал в официальном ответе итальянским исследователям в The Lancet, но малый размер выборки группа Дениса Логунова сама отмечала в своей первичной публикации как «ограничение» (читай — недостаток) исследования. Согласно их же статье, выборка была не только малой, но и недостаточно репрезентативной — из-за того, что состояла в основном из молодых мужчин (вспомним, что среди участников исследования значительную долю составляли военнослужащие). Здесь следует вернуться к вопросу о переносимости — безопасность и переносимость вакцины у здоровых молодых мужчин может быть совсем не такой, как у людей из групп риска (пожилых и лиц с хроническими заболеваниями), для которых вакцина необходима прежде всего.
Надо отметить, что выборку дополнительно «уменьшает» то обстоятельство, что лишь 20 (а не 38!) испытуемых в каждом исследовании получили вакцину согласно запланированной схеме — два препарата с разницей в три недели. Остальные получили только один из них. И даже за такой выборкой наблюдали очень мало — около полутора месяцев. Это не позволяет заметить отдаленные последствия, если бы они наступили. На это группа Дениса Логунова также обращает внимание читателей в своей статье. Таким образом, российские исследователи подробно описали свои результаты, но честно отметили довольно серьезные изъяны работы.
В заключение авторы указывают на необходимость дальнейших тщательных исследований. Но акценты в статье расставлены все же оптимистично. В еще более оптимистичном духе Российский фонд прямых инвестиций (РФПИ) и НИЦЭМ им. Н.Ф. Гамалеи высказались в совместном заявлении, цитируемом по агентству «Интерфакс»:
Научная публикация в The Lancet доказывает высокую безопасность и эффективность российской вакцины, а также приводит подробные данные о результатах клинических исследований.
Также генеральный директор РФПИ Кирилл Дмитриев заявил:
Публикация в одном из самых авторитетных в мире медицинских журналов The Lancet подтверждает высокую безопасность и эффективность российской вакцины “Спутник V” и демонстрирует признание российских ученых со стороны мирового научного сообщества... Публикация в The Lancet показала открытость и готовность России к диалогу, а также стала ответом скептикам, которые необоснованно критиковали российскую вакцину.
Однако при внимательном прочтении статьи российских ученых (даже без привлечения дополнительных источников) становится ясно, что до победы пока далеко, и еще сняты не все вопросы к разработке. Публикация результатов 1/2 фаз еще не означает безопасности и эффективности — это лишь повод для дальнейших изысканий и обсуждений.
Два месяца, прошедшие с момента публикации, позволили увидеть, насколько обсуждение было жарким. Ряд авторитетных зарубежных исследователей резко выразился о разработке российских коллег. В журнале The Lancet Respiratory Medicine 4 сентября вышел популярный синопсис по поводу российской вакцины [14]. В нем профессор экспериментальной медицины Имперского колледжа Лондона Питер Опеншоу (Peter Openshaw) усомнился в предположении, что высокий уровень иммунного ответа сам по себе гарантирует защиту от инфекции:
Иммунный ответ может не быть прямо пропорционален степени защиты — это можно установить только в крупномасштабных исследованиях.
Декан Школы общественного здоровья Университета Брауна Ашиш Джа (Ashish Jha) выразился более резко:
Мы понятия не имеем, безопасна ли эта вакцина и работает ли она.
Так что в итоге?
Публикация статьи российскими исследователями в любом случае интересна с научной точки зрения — как вклад в «общую копилку». Но это — та самая первая снежинка, которая еще не снег. «Когда-нибудь, но не теперь», новые исследования покажут перспективность или ошибочность подхода НИЦЭМ им. Н. Ф. Гамалеи. Остается надеяться на большое число разрабатываемых в мире вакцин от коронавируса и не менее 11 таких разработок (включая «Спутник-V») в России (согласно списку, опубликованному ВОЗ) .
Отслеживать разработку вакцин от COVID-19 в реальном времени и знакомиться с информацией о них можно также здесь.
Весьма вероятно, что хотя бы один из этих подходов себя оправдает. С оговоркой: в том случае, если нам повезет и вакцину действительно можно будет разработать. Длительность и напряженность иммунитета после перенесенной коронавирусной инфекции до сих пор точно не известны. Будет ли он прочным после хотя бы одной из нескольких десятков вакцин? Время покажет. А пока все вакцины, что есть в мире — лишь экспериментальные прототипы оружия против пандемии.
Литература
- Маджидов Т.И. и Куракин Г.Ф. (2020). Компьютерные технологии против коронавируса: первые результаты. «Природа». 3, 3–15;
- Компьютерные технологии против коронавируса: первые результаты;
- Вакцины против коронавируса: последние новости;
- Richard A. Koup, Laurie Lamoreaux, David Zarkowsky, Robert T. Bailer, C. Richter King, et. al.. (2009). Replication-Defective Adenovirus Vectors with Multiple Deletions Do Not Induce Measurable Vector-Specific T Cells in Human Trials. JVI. 83, 6318-6322;
- Shakti Singh, Rakesh Kumar, Babita Agrawal. (2019). Adenoviral Vector-Based Vaccines and Gene Therapies: Current Status and Future Prospects. Adenoviruses;
- T. W. Geisbert, M. Bailey, L. Hensley, C. Asiedu, J. Geisbert, et. al.. (2011). Recombinant Adenovirus Serotype 26 (Ad26) and Ad35 Vaccine Vectors Bypass Immunity to Ad5 and Protect Nonhuman Primates against Ebolavirus Challenge. Journal of Virology. 85, 4222-4233;
- Ясный И. (2020). Почему с прививкой от коронавируса не стоит спешить. «Проект»;
- Лескова Н. (2020). «Мы должны сделать лекарство, а не бомбу замедленного действия». «Наука и жизнь»;
- Denis Y Logunov, Inna V Dolzhikova, Olga V Zubkova, Amir I Tukhvatullin, Dmitry V Shcheblyakov, et. al.. (2020). Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. The Lancet;
- Кондратова М. (2020). Не «просто грипп», или Особенности иммунного ответа при COVID-19. «Природа». 6, 3–7;
- Lisa A. Jackson, Evan J. Anderson, Nadine G. Rouphael, Paul C. Roberts, Mamodikoe Makhene, et. al.. (2020). An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. N Engl J Med;
- Pedro M Folegatti, Katie J Ewer, Parvinder K Aley, Brian Angus, Stephan Becker, et. al.. (2020). Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 396, 467-478;
- Denis Y Logunov, Inna V Dolzhikova, Amir I Tukhvatullin, Dmitry V Shcheblyakov. (2020). Safety and efficacy of the Russian COVID-19 vaccine: more information needed – Authors’ reply. The Lancet. 396, e54-e55;
- Talha Khan Burki. (2020). The Russian vaccine for COVID-19. The Lancet Respiratory Medicine. 8, e85-e86;
- Feng-Cai Zhu, Xu-Hua Guan, Yu-Hua Li, Jian-Ying Huang, Tao Jiang, et. al.. (2020). Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. The Lancet. 396, 479-488.