
Терапевтический аферез. Как и для чего очищают кровь вне тела пациента
05 ноября 2021
Терапевтический аферез. Как и для чего очищают кровь вне тела пациента
- 4125
- 0
- 4
Состав крови чрезвычайно многообразен, и когда в ней появляются патогены и вредные вещества — помочь могут технологии терапевтического афереза.
Рисунок в оригинальном разрешении.
-
Автор
-
Редакторы
-
Иллюстратор
Кровь — главная жидкость организма. В течение жизни под влиянием различных факторов, включая заболевания, в крови человека накапливаются патогенные вещества. Один из способов очищения крови от патогенов — терапевтический аферез. С помощью этой технологии из крови удаляют патогенные вещества для лечения тяжелых заболеваний, когда другие методы не помогают или их просто нет. В этой статье, которая открывает спецпроект по терапевтическому аферезу, мы расскажем об истоках технологии, ее видах и применении для лечения пациентов.

Аферез

Партнер спецпроекта — научно-производственная фирма «ПОКАРД», которая занимается разработкой и производством сорбционных колонок, а также внедрением в клиническую практику технологий терапевтического афереза.
В ходе разных болезней опасные молекулы распространяются по организму, заполоняя собой кровь. Избыток транспортных частиц с холестерином, белки-провокаторы иммуной системы, токсины патогенных бактерий... Против одних препараты есть, но подходят не всем, против других — ещё не выведены на рынок. Третьи — важное звено в развитии многих болезней, против которых нет специальных средств борьбы. В любом из этих случаев очищение крови от опасных соединений может сократить ущерб здоровью до минимума: спасти жизнь или значительно ее продлить.
Аферез — именно такой способ извлечь из крови только один тип биомолекул. В медицине с помощью терапевтического афереза из крови пациентов удаляют опасные для здоровья элементы, сохраняя все остальное. Очищают кровь, точнее, плазму крови, очень по-разному: с помощью антител к опасным молекулам, фильтруя через пористые мембраны, разделяя компоненты на центрифуге... Каким он только не бывает!
В спецпроекте мы расскажем, какие сложные проблемы решает терапевтический аферез: простой, но незаменимый во многих ситуациях.
Кровь — главная жидкость организма
Кровь — жидкая соединительная ткань внутренней среды организма, циркулирующая по сосудам: венам, артериям, капиллярам. Объем крови у взрослого человека — 4,5–5 литров: это около 8% массы тела. Несмотря на вроде бы небольшой объем по отношению ко всему организму, потеря хотя бы 30% крови (1–1,5 литров) считается смертельной.
У здоровых людей состав крови отличается постоянством: форменные элементы (эритроциты, лейкоциты, тромбоциты) составляют 45% объема крови, а 55% приходится на плазму — жидкое межклеточное вещество. Плазма — однородная жидкость, в которой растворены органические и минеральные вещества: белки, липопротеины, минеральные соли, гормоны, а еще — питательные вещества вроде глюкозы и других соединений.
В «Большой медицинской энциклопедии» их называют также липопротеидами. Это синонимы, и мы в этой статье будем все же называть эти молекулы, как принято в биохимии: липопротеинами.
Зачем нужна кровь
Кровь обеспечивает правильную работу всех органов и систем тела (таблица 1). Даже незначительное нарушение ее состава или появление патогенных компонентов может нарушить сбалансированную работу организма. При большой кровопотере (травме, родах) проводят переливание (донорство) крови от человека к человеку (см. врезку). Часто риск развития и тяжести заболевания связаны с конкретными патогенами — это может быть как один «плохой» компонент, так и группа веществ. Нарушение состава крови может происходить при острых состояниях — например, значительной кровопотере или заражении крови, а также развиваться постепенно под влиянием образа жизни, наследственности и окружающей среды. Если такие изменения накапливаются плавно, человек может даже не ощущать симптомов заболевания и вести обычную «здоровую» жизнь до тех пор, пока уровень патогенов в его крови не достигнет критического уровня. В этом случае необходимо прицельно воздействовать на «плохие» компоненты, а именно — «убрать» их из крови.
| Функции плазмы | Функции форменных элементов крови |
|---|---|
|
|
История очищения крови: от кровопускания до терапевтического афереза
На протяжении нескольких веков, начиная с античности и до конца XIX века, в медицине было широко распространено кровопускание — метод, основанный на гуморальной теории Гиппократа. В ее основе — концепция четырех жидкостей, циркулирующих в теле человека: крови, флегмы, желтой и черной желчи. Считалось, что их соотношение определяет характер человека, и поддержание этого соотношения и было главной идеей теории Гиппократа. Лечение медлительности или грубости заключалось в удалении конкретной жидкости, избыток которой влияет на определенную черту характера. Для этого античные врачи прибегали к кровопусканию — удалению «лишней» крови через прокол вены. Только к концу XIX века на смену кровопусканию пришел новый метод, который стал впоследствии называться «терапевтический аферез» (рис. 2). Методика нашла применение при лечении многих тяжелых заболеваний, и далее в этой статье мы расскажем, каких и как именно.
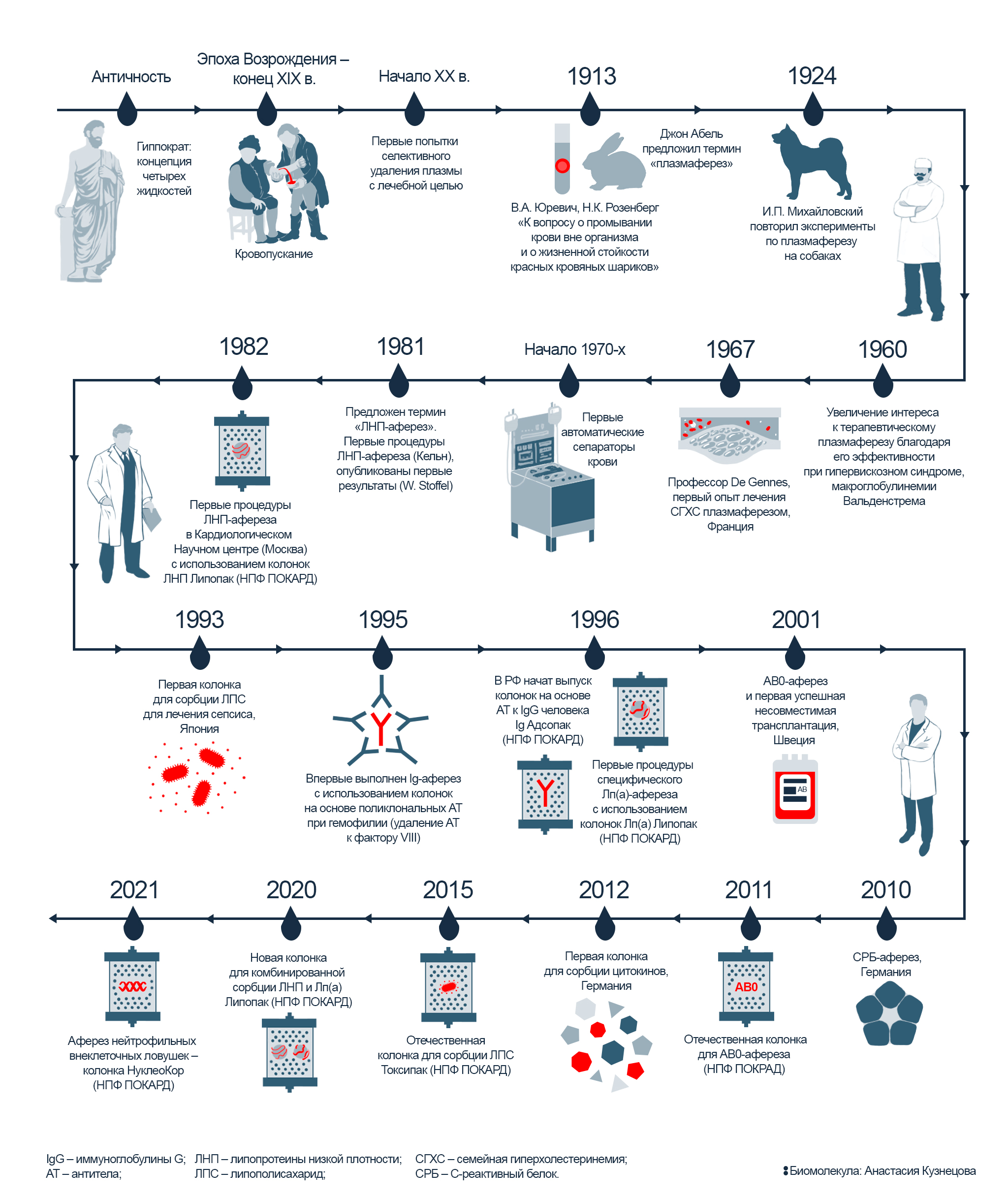
Рисунок 2. История метода: от первых экспериментов по кровопусканию до современного терапевтического афереза. С античности и до конца XIX века врачи широко применяли кровопускание. И лишь в начале XX века исследователи начали применять другой метод: не просто выпускать у пациентов кровь, а забирать плазму, очищать ее — и затем возвращать обратно в организм. На сегодняшний день для плазмосорбции используют специальные сорбционные колонки — с их помощью становится возможным точечно удалять определенные патогены, не влияя на состав остальной крови пациента.
иллюстрация Анастасии Кузнецовой
Суть афереза заключается в удалении вредных компонентов из системного кровотока пациента, для чего из вены забирают цельную кровь, которую разделяют на клетки (эритроциты, тромбоциты, лейкоциты) и плазму. Затем плазма либо удаляется безвозвратно (плазмаферез), либо пропускается через специальное устройство (плазмосорбция), в котором происходит необратимое связывание только вредных веществ. Очищенную плазму вместе с клетками возвращают обратно в системный кровоток пациента. Процедура идет непрерывно, то есть забор и возврат крови осуществляют одновременно и с постоянной скоростью. Таким образом можно сказать, что на несколько часов пациенту создают искусственный внешний контур кровотока, в котором кровь по силиконовым сосудам прокачивают насосы, играющие роль второго сердца. Этот метод получил название терапевтический (то есть лечебный) аферез (от греч. удаление).
В ХХ веке аферез начинают использовать на практике. Первые попытки очищения крови сводились к удалению небольших порций плазмы объемом около 300 мл (примерно 1,5 стакана). Недостаток метода заключался в том, что экспериментаторы действовали «на глаз»: вместе с патогенами из крови удаляли и важные вещества, участвующие в нормальном обмене веществ.
Отечественными основоположниками плазмафереза стали сотрудники кафедры инфекционных болезней Военно-медицинской академии — В.А. Юревич и Н.К. Розенберг (рис. 3А). В 1913 году они провели операцию по «очищению» плазмы на кроликах и назвали ее «промыванием крови» [4]. Заключалась она во временном извлечении и обработке крови вне организма. Чтобы испытуемые кролики не погибли от кровопотери, кровь замещали буферным раствором. После необходимых манипуляций очищенную кровь возвращали в организм, а разницу по объему восполняли цитратным буфером (рис. 4). Пионерские работы отечественных ученых закончились хорошо — все кролики выжили! Опыты по извлечению и очищению крови удалось успешно повторить в 1924 году И.П. Михайловскому на собаках.

Рисунок 4. Протокол первого успешного «отмывания крови» в эксперименте на кроликах, датированный 2 февраля 1913 года.
Параллельно с российскими учеными работал американский исследователь Джон Абель (рис. 3Б) — именно он ввел термин «плазмаферез» и считается «крестным отцом» этого метода [5-7]. Новый толчок в развитии методов очищения крови произошел в 1960-е годы, когда удалось подтвердить эффективность плазмафереза для лечения макроглобулинемии Вальденстрема — заболевания, при котором в кровь секретируется вязкий патогенный белок. В 1970-х были созданы первые автоматические сепараторы крови — и за 10 лет, прошедших с момента их первого применения, количество процедур терапевтического афереза в США возросло с 6 тысяч до 60 тысяч!
К концу ХХ века широкое распространение получила иммуносорбция — метод, при котором для специфического связывания патогенов крови используют сорбенты на основе антител. В отличие от пионерской, но порядком устаревшей технологии плазмафереза, плазма крови не удаляется насовсем, а очищается в искусственном контуре, содержащем сорбционную колонку, а потом возвращается обратно в кровоток. Преимущество иммуносорбции дают антитела, прицельно узнающие конкретные патогены и помогающие извлечь их из плазмы крови. При этом сорбенты на основе антител могут отличаются узкой специфичностью и уже доказали свою безопасность и эффективность для развития сорбционных технологий. В дальнейшем термин «аферез» стали использовать в названии других специфичных процедур: Лп(а)- и ЛНП-афереза, Ig-афереза, СРБ-афереза, а термин «иммуносорбция» распространился на все методы, использующие принцип аффинного взаимодействия «антиген—антитело».
Огромный вклад в развитие терапевтического афереза в России внесли сотрудники Всесоюзного Кардиологического Научного Центра (ВКНЦ, 1975–1996). В 1986 году в группе аффинных сорбентов под руководством С.Н. Покровского был создан первый отечественный сорбент на основе антител для сорбции липопротеинов низкой плотности (ЛНП). Колонки на основе этого сорбента были с успехом применены для лечения пациентов с тяжелыми формами атеросклероза и семейной гиперхолестеринемии (СГХС) в лаборатории гемодиализа и плазмафереза ВКНЦ (руководитель проф. Кухарчук В.В.). В 1986 году там был создан уникальный сорбент для удаления из плазмы крови человека липопротеина (а), колонки на основе которого до сих пор не имеют аналогов в мире. Были созданы и другие сорбенты: с антителами к иммуноглобулинам человека (для удаления аутоантител и иммунных комплексов), с антиидиотипическими антителами, эффективно связывающими антигены из плазмы крови человека, и ряд других.
Позже в качестве аффинных сорбентов помимо антител стали использовать и другие синтетические молекулы. Этот метод получил название плазмосорбция — когда плазму пропускают через специальный сорбент в замкнутом контуре (через сорбционные колонки). В результате патогены плазмы селективно связываются с сорбентом прямо внутри колонки, а все остальные вещества плазмы просто проходят сквозь контур — и их возвращают обратно пациенту [8-10].
Большим достижением стало изобретение сорбционных колонок для цельной крови, что позволило исключить сложный этап предварительного разделения крови на плазму и клетки. Такая технология за счет своей простоты нашла применение в отделениях интенсивной терапии, где на счету каждая минута. К сожалению, далеко не каждую колонку возможно сделать гемосовместимой из-за особенностей лигандов.
В следующих разделах статьи мы разберем самые распространенные случаи применения терапевтического афереза и выясним, как они работают.
Серьезный подход к серьезным заболеваниям
Терапевтический аферез используют в качестве вспомогательного или основного метода лечения почти во всех областях медицины — от трансплантологии до лечения наследственных заболеваний. Современные технологии позволяют удалять патогены из кровотока вне тела пациента, т.е. экстракорпорально (лат. extra — вне- + corporate — относящийся к телу), что особенно актуально в критических ситуациях (при кризах), поскольку воздействие оказывается на кровь напрямую, увеличивая эффективность медикаментозного лечения и прочих лечебных мероприятий. Терапевтический аферез часто становится лечением выбора — вместо лекарств, когда заболевания не поддаются традиционной медикаментозной терапии, либо ее эффекта недостаточно. Часто аферез назначают пациентам, у которых ограничения к медикаментозной терапии вызваны индивидуальной устойчивостью к определенным лекарствам или непереносимостью конкретных веществ.
Однако не стоит считать терапевтический аферез панацей от всех болезней. В первую очередь это вспомогательный метод, поддерживающий основное лечение. Его применение помогает поддержать самостоятельное восстановление организма и интенсивность воздействия лекарственной терапии. Давайте познакомимся с тем, как это происходит, на конкретных примерах.
Смертоносный холестерин
Начать нужно именно отсюда, потому что терапевтический аферез берет начало в истории лечения наследственной семейной гиперхолистеринемии (СГХС). В 1981 году профессор В. Стоффель и доктор Х. Борберг опубликовали статью об использовании аффинной хроматографии для лечения больных СГХС [11].
СГХС — наследственное заболевание, которое можно назвать созданной природой моделью атеросклероза. У больных наблюдается дефицит функционально активных рецепторов, удаляющих из организма липопротеины низкой плотности (ЛНП). Накопление ЛНП (более 5 мМ/л) ведет к повышению уровня холестерина, его отложению на стенках сосудов и раннему развитию атеросклероза. Больные СГХС умирают от инфаркта миокарда еще в детском возрасте. Самая частая генетическая причина СГХС — мутация в гене ЛНП-рецептора (LDLR), который расположен главным образом на поверхности гепатоцитов и играет ключевую роль в связывании и выведении из кровотока циркулирующих ЛНП-частиц. На сегодняшний день известно более 1600 мутаций LDLR, способных нарушить функцию рецептора и вызывать развитие этой болезни.
Вторая по частоте причина — мутация в гене аполипопротеина В100 (ApoB), входящего в состав ЛНП-частиц и ответственного за связывание ЛНП с рецептором. В результате изменений в гене половина ЛНП-частиц не способна связаться с ЛНП-рецептором.
СГХС — классический пример заболевания, при котором лекарственная терапия известна, но неэффективна. Поэтому терапевтический аферез липопротеинов — это лечение выбора при гомозиготной СГХС. Доказательством высокой эффективности терапевтического афереза можно считать тот факт, что одна из первых пациенток с гомозиготной формой этого заболевания до сих пор продолжает лечение, начатое в 1986!
Ошибка системы: когда чужой среди своих...
Аутоиммунные заболевания возникают вследствие сбоя иммунной системы, которая начинает атаковать собственный организм, производя большое количество аутоантител против собственных органов и тканей. Для более подробного знакомства с этим феноменом предлагаем прочитать статью «Биомолекулы» «Иммунитет: борьба с чужими и… своими» из цикла «Аутоиммунные заболевания» [12].
Лечить эти заболевания сложно: наиболее распространенная тактика основана на устранении клинических проявлений или симптомов болезни. Еще одной стратегией можно считать гормональную терапию, но она всего лишь снижает реакцию на аутоантитела, не удаляя их из организма [13].
Как еще можно помочь пациентам с аутоиммунными заболеваниями и сделать их жизнь лучше? В некоторых случаях, когда заболевание сильно запущено или когда пациент не получал должную терапию, самая правильная стратегия — замедлить прогрессирование болезни (например, при рассеянном склерозе) [14]. И здесь на помощь приходит терапевтический аферез — вместо долгого устранения симптомов можно взять и удалить из крови «виновников» патологии — аутоантитела. В случае системных аутоиммунных заболеваний (ревматоидный артрит [15], системная красная волчанка [16], васкулит) регулярные курсы плазмафереза или плазмосорбции способны длительное время удерживать пациентов в состоянии ремиссии, когда течение болезни ослаблено. Главная задача такой терапии — предотвратить накопление аутоантител и иммунных комплексов, чтобы не дать аутоиммунному заболеванию обостриться.
Человеческий конструктор
Чтобы познакомиться с еще одним случаем применения афереза, давайте вспомним о первой в истории трансплантации органа, которую провел советский хирург Юрий Вороной в 1933 году (рис. 6; подробнее читайте во врезке). При этом почти за 90 лет, прошедших с момента первой трансплантации, врачам до сих пор сложно найти орган, подходящий по антигенной совместимости тканей. В случаях, когда пациентам требуется пересадка органов, может произойти реакция отторжения трансплантата. Это связано с гуморальным ответом реципиента на пересадку чужеродного органа или ткани, который сопровождается выработкой антител [19].

Рисунок 6. Три основоположника трансплантологии: Николай Иванович Пирогов (слева), Юрий Юрьевич Вороной (в центре) и Владимир Петрович Демихов (справа).
Почему же происходит отторжение донорских органов? Причин две:
- несовместимость групп крови (антигены на поверхности эритроцитов);
- различные трансплантационные антигены, или антигены гистосовместимости (Human Leukocyte Antigens, HLA), расположенные на поверхности клеток.
HLA-комплексы могут отличаться даже у родственников [23]. Дело в том, что в клетках человека присутствует два HLA-антигена, наследуемые от разных родителей. Возникающее при таком наследовании огромное количество вариаций HLA-антигенов приводит к низкой вероятности того, что два человека будут иметь одинаковые HLA-антигены [24-26]. Как правило, абсолютное сходство антигенов (крови и HLA) возможно лишь у однояйцевых близнецов, поэтому у них практически не наблюдается отторжение трансплантата. В остальных случаях для успеха операции необходимо применять иммуносупрессанты — препараты для искусственного угнетения иммунитета.
Реакция отторжения трансплантата схожа с иммунным ответом и направлена на уничтожение иммунной системой чужеродных тканей [19]. В результате происходит либо отторжение органа, либо пожизненное назначение пациенту медикаментозных препаратов. Чтобы расширить возможности трансплантации органов от родственников, применяют иммуносорбцию — селективное удаление антител, которые вырабатываются у реципиента в ответ на трансплантацию донорского органа [27].
Опасность! Шок! Заражение крови!
Сепсис (от греч. гниение) — системное заражение крови, которое чаще всего вызывают грамотрицательные бактерии и их эндотоксины. Триггером обычно являются липополисахариды — кусочки клеточной стенки бактерий: проникнув в кровь, эти эндотоксины запускают воспаление и повреждают клетки. Следом за гипервоспалением происходит массовый выброс цитокинов, что в дальнейшем приводит к цитокиновому шторму. Особо тяжелый сепсис со снижением перфузии тканей и нарушением доставки кислорода и других веществ называется септическим шоком. Инфекцию во время сепсиса вылечить практически невозможно [29], [30].
Сепсис крайней опасен: он грозит полиорганной недостаточностью и даже смертью [31]. Несмотря на доступность антибиотиков широкого спектра действия, сепсис остается лидирующей причиной смертности в отделениях реанимации и интенсивной терапии некардиологического профиля: ежегодно он уносит жизни около 11 миллионов человек, среди которых большую долю составляют дети. Больше всего от сепсиса страдают пациенты в высокоразвитых странах [31], [32].
Лечить сепсис очень тяжело. Один из эффективных методов лечения — экстракорпоральное очищение крови, при котором из нее удаляются бактериальные токсины и медиаторы воспаления, повреждающие организм [33]. Очищение крови от липополисахаридов активно применяют на ранних стадиях сепсиса — наибольшая эффективность достигается в первые 24 часа. На более поздних стадиях или при септическом шоке требуется удалить уже избыток цитокинов, с чем также успешно справляется аферез, но уже с использованием других колонок — специфичных к цитокинам.
Среди клинических форм сепсиса лидирует абдоминальный сепсис (источник сепсиса располагается в органах живота), который поддается успешной терапии с применением селективной гемосорбции эндотоксинов, если успеть провести процедуру на ранних этапах [34]. При этом очищение крови является патогенетической терапией — после устранения кризисного состояния врачи приступают к лечению основной причины болезни [29], [35-37].
Терапевтический аферез в борьбе с COVID-19
COVID-19 сопровождается агрессивным воспалительным ответом организма на вирус и массированным выбросом цитокинов в кровоток. Иммунный ответ пациента приобретает гиперактивный характер — это приводит к чрезмерной воспалительной реакции и в итоге — к цитокиновому шторму. В результате наблюдаются повреждения легких, полиорганная недостаточность, микротромбозы — и эти явления можно предупредить при помощи терапевтического афереза [38-40].
Цитокиновый шторм (гиперцитокинемия) — это массовая выработка медиаторов воспаления, активирующих иммунные клетки. Последние выбрасывают новую порцию цитокинов — и цикл запускается по новой. В результате происходит разрушение тканей и постепенное распространение воспаления по всему организму. Неконтролируемое поступление цитокинов в организм вызывает воспаление дыхательных путей; больным грозит смерть от сердечной и легочной недостаточности [41]. Справиться с заболеванием можно, удалив цитокины из крови при помощи специальной сорбционной колонки [42].
Первое предположение, что технологии афереза можно применять при лечении COVID-19, основано на идее, что причина смертности от сепсиса — не сам патоген, а чрезмерный патологический ответ организма [43]. Если устранить причину — удалить чужеродные агенты из плазмы крови, — можно избавиться и от сепсиса. Для удаления цитокинов применяют гемосорбцию — кровь пациента пропускают через специальный сорбент, связывающий цитокины. При этом у пациентов с COVID-19 улучшается клиническая картина при пневмонии, септическим шоке, полиорганной недостаточности и поражении почек [43-43]. Удаление цитокинов из кровотока стабилизирует состояние пациентов и сдерживает воспалительный ответ, предотвращая развитие цитокинового шторма [46].
«У товарища Дынина вся кровь испорчена!» Как скорректировать состав крови
Напомним: суть терапевтического афереза заключается в удалении патогенных веществ из крови и последующем возвращении очищенной плазмы или цельной крови обратно в кровоток пациента.
Проведение процедуры: вернем всё в лучшем виде
Аферез проводят по следующей схеме: кровь пациента пропускают через сорбционную колонку, где из нее удаляются патогенные вещества (рис. 9) [47]. Не стоит путать донорство и переливание крови с терапевтическим аферезом! В аферезе участвует кровь одного и того же человека, которую сначала «извлекают» из организма, очищают от патогенов, а затем возвращают обратно. Если бы во времена съемок фильма «Посторонним вход воспрещен» был доступен этот метод, товарищу Дынину не потребовалось бы переливание: достаточно было бы прогнать его редкую кровь 33-й группы через сорбционную колонку.
Для того, чтобы в процессе плазмосорбции кровь не сворачивалась, перед проведением процедуры пациенту вводят антикоагулянт. Кровь забирают при помощи специального медицинского аппарата, обеспечивающего длительный, дозированный и контролируемый поток нашей главной жидкости. После этого кровь поступает в плазмосепаратор: здесь кровь разделяется на плазму и форменные элементы. Существует два типа плазмосепараторов: мембранные и центрифужные. Первый делит клетки по размеру по принципу «сита»; второй — при помощи центрифугирования, когда более тяжелые клетки осаждаются, а жидкая фракция плазмы оказывается на поверхности — оттуда ее и забирают для дальнейшей обработки.
Для очищения плазмы (плазмосорбция) используют сорбционные колонки: проходя через них, плазма освобождается от патогенов, которые специфически связываются на лигандах сорбента. Очищенная плазма вновь соединяется с форменными элементами крови и возвращается обратно в кровоток пациента (рис. 9Б). В случае гемосорбции кровь поступает в колонку без разделения на плазму и форменные элементы, проходит через колонку и возвращается обратно в уже очищенном виде (рис. 9А).
В ходе терапевтического афереза забор и возврат крови идет в непрерывном цикле (обычно процедура длится 3–6 часов). При этом происходит как бы расширение кровеносной системы за счет введения трубок (искусственных сосудов), по которым кровь бежит до сорбционной колонки вне тела пациента и обратно. Процедура безопасна и хорошо переносится пациентом.
Сорбционные колонки: разделяй и властвуй
Теперь разберемся с принципом работы сорбционных колонок . Это высокотехнологичное устройство, специфически связывающее и удаляющее из крови определенные патогенные компоненты (рис. 10). Корпус колонки наполнен активным веществом — обычно это сорбент из инертной матрицы и иммобилизованного на ней лиганда, уникального для каждого вида колонки. Это могут быть антитела, ферменты, пептиды, химические соединения, олигосахариды, аптамеры и др. В ходе экстракорпорального очищения крови патогены специфично связываются с лигандом колонки. При этом колонки могут быть как одно-, так и многоразовыми — регенерация позволяет проводить процедуру без остановки.
Базовая методика — хроматография — подробно описана в статье «12 методов в картинках: очистка молекул и разделение смесей» [48].
Существуют и НЕспецифически связывающие сорбенты для экстракорпоральной терапии. Например, селективные ДНК-содержащие углеродные сорбенты, которые применяют при красной волчанке.
Кто не работает, тот... регенерирует!
При очищении крови часто применяют сразу две регенерируемые колонки — такой подход называют tween-технологией. Пока одна сорбционная колонка очищает кровь, другая очищается от накопленного в ней патогена — регенерирует. Эти две колонки можно чередовать: переключать из «рабочего» режима в «регенерирующий» нужное количество раз. Tween-технология позволяет очистить неограниченный объем плазмы крови без остановки процедуры и потери сорбционной емкости. А каждую из таких колонок можно использовать до 50 раз для одного пациента.

Рисунок 10. Сорбционная колонка. Внутри — гранулы инертной матрицы, на которую пришиты лиганды (выделены темно-синим цветом). В процессе пропускания крови через колонку патогены (выделены красным) «приклеиваются» к сорбенту и остаются в колонке, тем самым удаляясь из кровотока.
иллюстрация Анастасии Кузнецовой
Каждой болезни — своя колонка
При очищении крови необходимо «выловить» из кровотока определенные патогены, а потому под конкретные заболевания создают свои колонки. Хорошо, если заранее известно, какой именно патоген вызывает болезнь: в этом случае можно смело применять колонку, специфичную к конкретному лиганду — цитокину, иммуноглобулину, липопротеину и т.д. Однако все осложняется, если патоген — возбудитель заболевания — заранее неизвестен: подобрать подходящую колонку не получится.
Давайте разберемся с некоторыми методами и разновидностями сорбционных колонок, которые применяют для лечения конкретных заболеваний.
ЛНП-аферез
Это метод очищения крови, в основе которого — удаление из кровотока липопротеинов низкой плотности (ЛНП) и снижение концентрации «плохого» холестерина. Чем же именно «плох» холестерин и какой именно, рассказывается в статье «Хороший, плохой, злой холестерин» [49], ну а подробнее о борьбе с ним методами афереза мы расскажем в следующей публикации этого спецпроекта. ЛНП-аферез применяют для лечения людей с семейной гиперхолестеринемией — это генетическое заболевание, приводящее к развитию атеросклероза уже в детском возрасте. В процессе плазму крови пропускают через колонку, где апоВ-содержащие липопротеины связываются с сорбентом по аффинному принципу. На колонке остаются только ЛНП — носители «плохого» холестерина, который образует атеросклеротические бляшки в стенках сосудов.
Помимо лечения семейной гиперхолестеринемии, ЛНП-аферез широко используют:
- при гиперхолестеринемии, резистентной к лекарственной терапии;
- для профилактики образования бляшек на сосудах после операций реваскуляризации миокарда;
- при наличии у пациента противопоказаний к применению гиполипидемической терапии.
Лп(а)-аферез
Это частный случай афереза липопротеинов, при котором с сорбентом связывается липопротеин (а), а показание к применению — также сердечно-сосудистые заболевания. Лп(а) имеет схожую структуру с ЛНП, но обладает большей атерогенностью, чем ЛНП, а также имеет сродство к фибриногену. Эти свойства Лп(а) повышают риск образования тромбов, и, как следствие, инфаркта миокарда. В 1986 году во Всесоюзном Кардиологическом Научном Центре был создан уникальный сорбент для удаления липопротеина (а) из плазмы крови человека. Колонки на основе сорбента, специфичного к Лп(а), до сих пор не имеют аналогов в мире.
Ig-аферез
Вслед за ЛНП-аферезом возник аферез иммуноглобулинов, или Ig-аферез. Этот метод основан на удалении из плазмы иммуноглобулинов классов G и M, а также иммунных комплексов на их основе [50]. Ig-аферез применяется для терапии пациентов с миастенией, рассеянным склерозом [14], системной красной волчанкой [16], хронической демиелинизирующей полиневропатией [51], гемофилией [52], [53], ревматоидным артритом [15], а также при подготовке к процедуре трансплантации и при синдроме отторжения, вызванного образованием антител. Наиболее активно в Ig-аферезе используются сорбенты с иммобилизованным бактериальным белком А и поликлональными антителами против IgG человека.
AB0-аферез
После создания Ig-афереза ученые взялись за решение главной проблемы донорства — создание «универсальной» крови, которая не будет восприниматься организмом реципиента как чужеродная. Однако воплощение на практике простой идеи удаления антител из крови и из организма оказалось весьма затруднительным — ни плазмообмен, ни каскадная плазмофильтрация, ни Ig-аферез не подходили под требования трансплантологии. Вопросом создания специфических сорбентов против антител к АВО антигенам занялись в Институте биоорганической химии имени М.М. Шемякина и Ю.А. Овчинникова. Однако сорбенты «Аллотран-А» и «Аллотран-В», хотя и обладали высокой связывающей аффинностью к антигенам групп крови, не нашли применения.
В настоящее время при AB0-аферезе применяют анти-A/B-специфические колонки для удаления анти-АВ0-антител — без побочных эффектов, присущих плазмаферезу. Проходя через колонку, анти-А/В антитела связываются с сорбентом, и в кровоток пациента поступает подходящая «универсальная» кровь, которая не будет восприниматься организмом как чужеродная. Используя данную технологию с 1996 года, более чем 5000 пациентам проведена трансплантация несовместимой почки.
Еще одна область применения AB0-афереза — терапия красноклеточной аплазии после пересадки костного мозга у пациентов с острым миелобластным лейкозом [1]. [54].
Аферез: технология, которая не стоит на месте
Методы терапевтического афереза не только оправданы, но и необходимы в тех случаях, когда для лечения недостаточно медикаментозной терапии, либо пациенты невосприимчивы к лекарствам или даже не переносят их. В настоящее время аферез широко применяют для лечения сердечно-сосудистых и аутоиммунных заболеваний, в акушерстве и гинекологии, при трансплантации органов, в ревматологии, при острой интоксикации и в отделениях интенсивной терапии для лечения сепсиса, септического шока, острой почечной и печеной недостаточности, цитокинового шторма. Терапевтический аферез помогает улучшить качество жизни неизлечимо больных и спасти пациентов при тяжелых осложнениях в ходе лечения.
Развитие методов терапевтического афереза прошло длинный путь: технология последовательно улучшалась, что повышало уровень жизни больных. На этом прогресс не останавливается: исследователи ведут постоянный поиск новых терапевтических мишеней для афереза. Благодаря развитию технологии было спасено уже множество жизней. Технология терапевтического афереза улучшает и продлевает жизнь неизлечимо больных, помогает справиться с сепсисом и имеет множество перспектив для развития.
В следующих частях спецпроекта мы подробно расскажем об использовании афереза для лечения гиперхолестеринемии, а также осветим его применение для новой терапевтической мишени — внеклеточных ДНК.
Литература
- «Кровавая» работа врачей, ученых и природы;
- Jones H.W., Mackmull G. (1928). The influence of James Blundell on the development of blood transfusion. Annals of Medical History. 10, 242–248;
- Waller C. et al. (1825). Case of uterine hemorrhage, in which the operation of transfusion was successfully performed. The London medical and physical journal. 54, 380–386;
- Юревич В.А., Розенберг Н.К. (1914). К вопросу о промывании крови вне организма и о жизненной стойкости красных кровяных шариков. Русский врач. 13, 637–639;
- Abel J.J., Rowntree L.G., Turner B.B. (1914). On the removal of diffusible substances from the circulating blood of living animals by dialysis. Journal of Pharmacology and Experimental Therapeutics. <5, 275–316;
- Abel J.J., Rowntree L.G., Turner B.B. (1914). On the removal of diffusible substances from the circulating blood of living animals by dialysis II. Some constituents of the blood. Journal of Pharmacology and Experimental Therapeutics. 5, 611–623;
- Abel J.J., Rowntree L.G., Turner B.B. (1914). Plasma removal with return of corpuscles (plasmaphaeresis). Journal of Pharmacology and Experimental Therapeutics. 5, 625–641;
- Соколов А.А., Соловьев А.Г. (2013). Русские пионеры терапевтического гемафереза и экстракорпоральной гемокоррекции. К 100-летию первого в мире плазмафереза. Эфферентная терапия. <19, 3–9;
- Бельских А.Н. (2013). Новейший этап развития экстракорпоральной гемокоррекции и терапевтического афереза в военно-медицинской академии - клинический центр экстракорпоральной детоксикации (1988–2013). Эфферентная терапия. 19, 10–17;
- Чечеткин А.В, Попова Н.Н. (2013). Вклад профессора С.В. Рыжкова в развитие методов экстракорпоральной гемокоррекции. Эфферентная терапия. <19, 18–21;
- W. Stoffel, H. Borberg, V. Greve. (1981). APPLICATION OF SPECIFIC EXTRACORPOREAL REMOVAL OF LOW DENSITY LIPOPROTEIN IN FAMILIAL HYPERCHOLESTEROLAEMIA. The Lancet. 318, 1005-1007;
- Иммунитет: борьба с чужими и… своими;
- Лебедев К. А. Иммунология в клинической практике. М., Медицинская электронная библиотека, 1996. — 260 с.;
- Рассеянный склероз: иммунная система против мозга;
- Ревматоидный артрит: изменить состав суставов;
- Системная красная волчанка: болезнь с тысячью лиц;
- Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America, A. Jaretzki, R.J. Barohn, R.M. Ernstoff, H.J. Kaminski, et. al.. (2000). Myasthenia gravis. Neurology. 55, 16-23;
- Bianca M. Conti-Fine, Monica Milani, Henry J. Kaminski. (2006). Myasthenia gravis: past, present, and future. J. Clin. Invest.. 116, 2843-2854;
- Будчанов Ю.И. Трансплантационная иммунология. Тверь, 2012. — 36 с.;
- Пирогов Н.И. О пластических операциях вообще, о ринопластике в особенности. Собрание сочинений, 1957. — 101 с.;
- K. Landsteiner, A. S. Wiener. (1940). An Agglutinable Factor in Human Blood Recognized by Immune Sera for Rhesus Blood. Experimental Biology and Medicine. 43, 223-223;
- Тема песни для Цоя: Карл Ландштейнер;
- Ribas G. Neville M., Wixon J.L., Cheng J., Campbell R. D. (1999). Genes encoding three new members of the leukocyte antigen 6 superfamily and a novel member of Ig superfamily, together with genes encoding the regulatory nuclear chloride ion channel protein (hRNCC) and an N omega-N omega-dimethylarginine dimethylaminohydrolase homologue, are found in a 30-kb segment of the MHC class III region. J Immunol. 163, 278–287;
- Хаитов P.M., Алексеев Л.П. (2003). Геномика НLА: новые возможности молекулярной генетики человека в диагностике и терапии. Молекулярная медицина. 1, 17–31;
- James Robinson, Jason A. Halliwell, Hamish McWilliam, Rodrigo Lopez, Peter Parham, Steven G. E. Marsh. (2012). The IMGT/HLA database. Nucleic Acids Research. 41, D1222-D1227;
- Mary C. Nakamura, Robert M. Nakamura. (1992). Contemporary concepts of autoimmunity and autoimmune diseases. J. Clin. Lab. Anal.. 6, 275-289;
- Афанасьева О., Адамова И.Ю., Покровский С.Н. (2013). Опыт и перспективы применения иммуносорбентов для процедур терапевтического афереза. Эфферентная терапия. 19, 22–28;
- M.O. Gesinde, L.B. Tan, H.C. Gooi. (2007). Plasma exchange treatment to reduce anti-beta1-adrenergic receptor antibody in a patient with dilated cardiomyopathy. J. Clin. Apheresis. 22, 241-242;
- V. O. Bitsadze, T. A. Sukontseva, S. V. Akinshina, Ya. Yu. Sulina, J. Kh. Khizroeva, et. al.. (2020). Septic shock. Akušerstvo, ginekologiâ i reprodukciâ. 14, 314-326;
- R. Phillip Dellinger, Mitchell M. Levy, Andrew Rhodes, Djillali Annane, Herwig Gerlach, et. al.. (2013). Surviving Sepsis Campaign. Critical Care Medicine. 41, 580-637;
- Gagan Kumar, Nilay Kumar, Amit Taneja, Thomas Kaleekal, Sergey Tarima, et. al.. (2011). Nationwide Trends of Severe Sepsis in the 21st Century (2000–2007). Chest. 140, 1223-1231;
- Corinne Alberti, Christian Brun-Buisson, Hilmar Burchardi, Claudio Martin, Sergey Goodman, et. al.. (2002). Epidemiology of sepsis and infection in ICU patients from an international multicentre cohort study. Intensive Care Med. 28, 108-121;
- HP Shum, Department of Intensive Care, Pamela Youde Nethersole Eastern Hospital, Chai Wan, Hong Kong, WW Yan, TM Chan. (2016). Extracorporeal blood purification for sepsis. Hong Kong Med J;
- S. Ye. Khoroshilov, N. A. Karpun, S. G. Polovnikov, A. V. Nikulin, A. N. Kuzovlev. (2009). Selective Hemosorption of Endotoxin in the Treatment of Abdominal Sepsis. rmt. 5, 83;
- Chaosheng He, Li Zhang, Wei Shi, Xinling Liang, Zhiming Ye, et. al.. (2013). Coupled Plasma Filtration Adsorption Combined With Continuous Veno-venous Hemofiltration Treatment in Patients With Severe Acute Pancreatitis. Journal of Clinical Gastroenterology. 47, 62-68;
- Edmundo Kreisner, Mauricio Lutzky, Jorge L. Gross. (2010). Charcoal Hemoperfusion in the Treatment of Levothyroxine Intoxication. Thyroid. 20, 209-212;
- Zaporozhchenko B.S, Korytna H.Iu., Muravĭov P.T., Sharapov I.V. (2013). Influence of membrane plasmapheresis on the course of endotoxemia in acute destructive pancreatitis. Klin Khir. 9, 26–28;
- Qiurong Ruan, Kun Yang, Wenxia Wang, Lingyu Jiang, Jianxin Song. (2020). Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 46, 846-848;
- Jie Ma, Peng Xia, Yangzhong Zhou, Zhengyin Liu, Xiang Zhou, et. al.. (2020). Potential effect of blood purification therapy in reducing cytokine storm as a late complication of critically ill COVID-19. Clinical Immunology. 214, 108408;
- Ronco C., Bellomo R., Lonneman G. (2003). Sepsis — Theory and Therapies. N Engl J Med. 348, 1600-1602;
- Jonathan P Wong, Satya Viswanathan, Ming Wang, Lun-Quan Sun, Graeme C Clark, Riccardo V D'Elia. (2017). Current and future developments in the treatment of virus-induced hypercytokinemia. Future Medicinal Chemistry. 9, 169-178;
- Thomas J. Braciale, Young S. Hahn. (2013). Immunity to viruses. Immunol Rev. 255, 5-12;
- Philip Keith, Matthew Day, Linda Perkins, Lou Moyer, Kristi Hewitt, Adam Wells. (2020). A novel treatment approach to the novel coronavirus: an argument for the use of therapeutic plasma exchange for fulminant COVID-19. Crit Care. 24;
- Lerzan Dogan, Dilaver Kaya, Tugce Sarikaya, Rehile Zengin, Alp Dincer, et. al.. (2020). Plasmapheresis treatment in COVID-19–related autoimmune meningoencephalitis: Case series. Brain, Behavior, and Immunity. 87, 155-158;
- Luo S., Yang L., Wang C., Liu C., Li D. (2020). Clinical observation of 6 severe COVID-19 patients treated with plasma exchange or tocilizumab. Zhejiang Da Xue Xue Bao Yi Xue Ban. 49, 227–231;
- Berthold Bein, Martin Bachmann, Susanne Huggett, Petra Wegermann. (2020). SARS-CoV-2/COVID-19: Empfehlungen zu Diagnostik und Therapie. Anästhesiol Intensivmed Notfallmed Schmerzther. 55, 257-265;
- Diyor Shukurullaevich Abdurakhmanov, Samarkand State Medical Institute, Jasur Zafarovich Shamsiev, Samarkand State Medical Institute. (2018). MODERN STATE OF THE PROBLEM OF DIAGNOSIS OF THYROID NODULES (LITERATURE REVIEW). ER. 43;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Хороший, плохой, злой холестерин;
- Иммуноглобулины и вирусы. Война в миллионы лет;
- Как толщина миелина и эпигенетика помогают устойчивости к стрессу;
- АМТ-061 — генная терапия, способная на революцию в лечении гемофилии;
- Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии;
- «...Сообразно с моими силами и моим разумением» — донорство костного мозга — вклад в здоровое будущее.










