
Сириус — двойная звезда науки: Биотехнология и Генная терапия
08 июля 2022
Сириус — двойная звезда науки: Биотехнология и Генная терапия
- 1034
- 0
- 2
Два научных направления Университета «Сириус»: Биотехнология и Генная терапия.
Рисунок в максимальном разрешении.
иллюстрация Лили Матвеевой
-
Автор
-
Редакторы
-
Иллюстратор
Еще в середине XIX века науке стало известно, что Сириус — двойная звезда, состоящая из двух компаньонов, вращающихся вокруг общего центра масс. Во второй статье спецпроекта «Если звезды зажигают» мы познакомимся с увлекательной работой двух лабораторий Научно-технологического университета «Сириус», прекрасно иллюстрирующей аллегорию сияния ярчайшей звезды ночного неба. Встречайте научные направления «Биотехнология» и «Генная терапия»!
Если звезды зажигают

«Биомолекула» продолжает рассказывать о том, как и где можно получать биологическое образование и работать по научной специальности в России. В этом спецпроекте мы объединились с Университетом «Сириус», расположенным на одноименной федеральной территории на берегу Черного моря. За три публикации мы познакомим читателей с тем, какие исследования в нем ведутся, какие программы магистратуры и аспирантуры уже открыты и какие планы по развитию «Сириуса» есть у руководства университета. Чтобы разобраться во всех этих вопросах, авторы проекта пообщаются с российскими учеными, которые выбрали самый молодой вуз России местом своей работы.
Партнер спецпроекта — Университет «Сириус». Инновационный научно-технологический центр «Сириус» – это «город» внутри Сочи с собственными научно-технологическим университетом, инфраструктурой и с резидентами, «делающими» науку.
Первая статья нашего спецпроекта уже познакомила читателя с тем, как живет и работает самый молодой вуз России [1]. Настало время поглубже погрузиться в мир исследовательской работы, совсем недавно развернувшейся на берегу Черного моря.
В структуре Научно-технологического университета (НТУ) «Сириус» научное направление «Биотехнология» работает в рамках Центра трансляционной медицины. Под загадочным термином «трансляционная медицина» скрывается не что иное, как одно из самых перспективных направлений медицинской мысли современности. Под этой «трансляцией» понимается использование в клинической медицине широкого спектра данных, полученных в результате биомедицинских исследований. Появление такого тренда вполне укладывается в логику исторического развития науки о врачевании: медицина всегда была подобна пауку, собирающему в свое логово всё полезное и постепенно избавляющемуся от нерабочих вещей. Если в XIX веке медицинский паук «ловил» в свою паутину эффективные методы дезинфекции, то сейчас настала очередь генной инженерии и таргетной терапии [2], [3]. Ученые, вовлеченные в биотехнологические исследования «Сириуса», занимаются разработкой подходов к профилактике и преодолению резистентности бактерий к противомикробным препаратам, а также трудятся над созданием платформы для производства пептидных препаратов для терапии диабета и ожирения. Задачи невероятно актуальные: антибиотикорезистентность микроорганизмов в наши дни стала ключевой проблемой фармакотерапии инфекционных заболеваний, а диабет — давно полноправный член списка социально-значимых заболеваний в России. Над решением других актуальных медико-социальных проблем работают сотрудники другой исследовательской группы, также функционирующей на базе Центра трансляционной медицины. Сотрудники направления «Генная терапия» сосредоточились на создании технологии лечения тяжелых генетических заболеваний, а также на разработке рекомбинантных онколитических вирусов, способных в будущем заместить разрушительную для организма пациента химиотерапию и рискованное воздействие ионизирующих излучений.
Биотехнология: пептидная атака на диабет
В широком смысле первые пептидные препараты появились в арсенале врачей очень давно: в донаучный период развития медицины такие субстанции получали путем изготовления вытяжек из различных органов животных и растений. На наш просвещенный взгляд, подобные манипуляции выглядят жутко архаично и где-то даже мракобесно (про струю кабарги ни слова, господа!), но рациональное зерно в этом всё же было: сырье, используемое эскулапами прошлого, содержало в себе действующее вещество. Что тут и говорить, и по сей день благополучно живет и процветает фармакогнозия — одна из фундаментальных наук о лекарственном сырье животного и растительного происхождения. Однако совершенствование технологий позволяет ученым выбирать и иные пути изготовления белковых и пептидных лекарств. В нынешних реалиях получение средств, прицельно действующих на основную причину болезни, находится в ведении специалистов-биотехнологов — недаром таргетная терапия стала одной из ключевых концепций фармакологии [3].
Долгое время считалось, что пептидный пул клетки — это своеобразный биохимический мусор, который остается после разрушения функциональных белков. Однако современной науке известно, что они способны оказывать комплексное регуляторное воздействие на организм, участвуя в поддержании гомеостаза, отвечая за деление, дифференцировку и апоптоз клеток [4]. Их преимущество заключается в том, что короткие пептиды, в отличие от белков, невидоспецифичны и неиммуногенны, так как целиком и полностью представляют собой активную последовательность аминокислот, несущую информацию об определенном физиологическом эффекте. Следовательно, использование пептидных препаратов избавляет ученых от огромных проблем, связанных с иммунным ответом организма пациента на препарат.
Со школьной скамьи нам известно, что в состав белков входят 20 аминокислот, и на этом зачастую общий экскурс в мир протеинов для человека, не планирующего связать свой жизненный путь с биологией, заканчивается. Назревает вопрос: а заканчивается ли на этом мир аминокислот? Конечно же, нет. И, разумеется, «Биомолекула» уже о них писала [5]! Сейчас известно более 500 непротеиногенных аминокислот (НПА), содержащихся в клетках грибов, растений и бактерий. Эти соединения получили свое название из-за того, что они не принимают участие в биосинтезе белков, но зато гораздо более разнообразны по функционалу, чем их протеиногенные собратья. Обилие функций таких аминокислот натолкнуло ученых на мысль о том, что это многообразие можно превратить в важный козырь в терапии самых разных заболеваний. Вот только как их получить и как избавиться от потенциальных проблем (например, некоторые из них токсичны: гипоглицин и канаванин [6]).
Биотехнологи Университета «Сириус» обратили внимание на потенциал непротеиногенных аминокислот для создания лекарственных препаратов против таких опасных заболеваний, как ожирение и тесно связанный с ним диабет 2 типа (СД2). Вопрос стоит острее, чем это может показаться на первый взгляд: ожирением и диабетом действительно нельзя заразиться, но отчеты органов здравоохранения по всему миру заставляют врачей говорить о существовании настоящей «тихой эпидемии» по этим нозологиям. По данным европейского сегмента ВОЗ, избыточная масса в 80% случаев являются причиной СД2, а 90% больных сахарным диабетом страдают ожирением. В связи со значительным экономическим ущербом, высокими показателями заболеваемости, инвалидности и преждевременной смертности лиц трудоспособного возраста, в 2004 году сахарный диабет был включен в перечень социально значимых заболеваний и в России. Прогноз эпидемиологов неутешителен: построенная модель говорит о том, что уже к 2030 году треть россиян будет обременена избыточным жироотложением.
И здесь ученые «Сириуса» оказались на передовой российского терапевтического фронта, приступив к разработке препаратов-антагонистов глюкагоноподобного пептида-1 (ГПП-1). Этот гормон усиливает секрецию инсулина и ослабляет выработку глюкагона, что делает его одной из важнейших мишеней для подобных направлений фармакотерапии [7]. На российском рынке уже присутствует семаглутид, но медицина нуждается в иных, более современных и дешевых способах получения таких лекарственных препаратов. Ранее «Биомолекула» уже писала о проблеме рационального конструирования лекарств в статье и путях ее решения с помощью продуцирования активных субстанций живыми системами [8].
«Первые представители этого класса препаратов уже с прошлого года применяются для лечения ожирения в некоторых зарубежных странах [9]», — делится с «Биомолекулой» Роман Иванов, проректор по Научно-технологическому развитию Университета «Сириус», руководитель направления «Биотехнология» Научного центра трансляционной медицины Университета «Сириус». — «Где-то, как в Великобритании, пока только обсуждается проект клинических рекомендаций. Скоро на рынке появятся препараты второго поколения [10], а препараты третьего поколения [11] находятся на этапе доклинических исследований. Конечно, неизбежно, что в будущем препараты этого класса станут стандартом терапии СД 2 типа и ожирения и в России. Хотя будут ли зарубежные препараты регистрироваться в России в нынешних условиях — непонятно. Так что мы в данном случае пытаемся догнать зарубежных коллег и обеспечить возможность локального производства собственных инновационных препаратов этого класса».
Агонисты рецепторов глюкагоноподобного пептида-1 представляют собой класс сахароснижающих препаратов, разрабатываемых в течение последних 15 лет. При сахарном диабете 2 типа отмечается снижение «инкретинового эффекта» за счет недостаточности секреции ГПП-1 или ответа на него, что может быть компенсировано применением АР ГПП-1.
Инкретины — это гормоны желудочно-кишечного тракта, вырабатываемые в ответ на прием пищи и стимулирующие секрецию инсулина. В медицинской практике инкретиновый эффект рассматривается как отношение разницы выделения инсулина в ответ на пероральное и внутривенное поступление глюкозы к секреции инсулина в ответ на пероральную глюкозу.
Результаты исследований говорят о том, что пероральное введение глюкозы в большей мере стимулирует секрецию инсулина, чем внутривенное. Следовательно, на уровень глюкозы в крови влияют прежде всего вещества, секретирующиеся в желудочно-кишечном тракте. Препараты-антагонисты рецепторов также оказывают и другие эффекты, типичные для ГПП-1, которые включают глюкозозависимое снижение секреции глюкагона, задержку скорости опорожнения желудка, снижение потребления пищи, улучшение функции левого желудочка и снижение артериального давления [12].
Например, один из пептидных препаратов-антагонистов третьего поколения SAR441255 направлен на рецепторы сразу трех пептидов: уже известного нам ГПП-1 и глюкозозависимого инсулинотропного полипептида (ГИП), также участвующего в регуляции уровня инсулина. Помимо этого, этот пептид также способен оказывать антагонистический эффект на рецепторы глюкагона (рис. 1) [11].
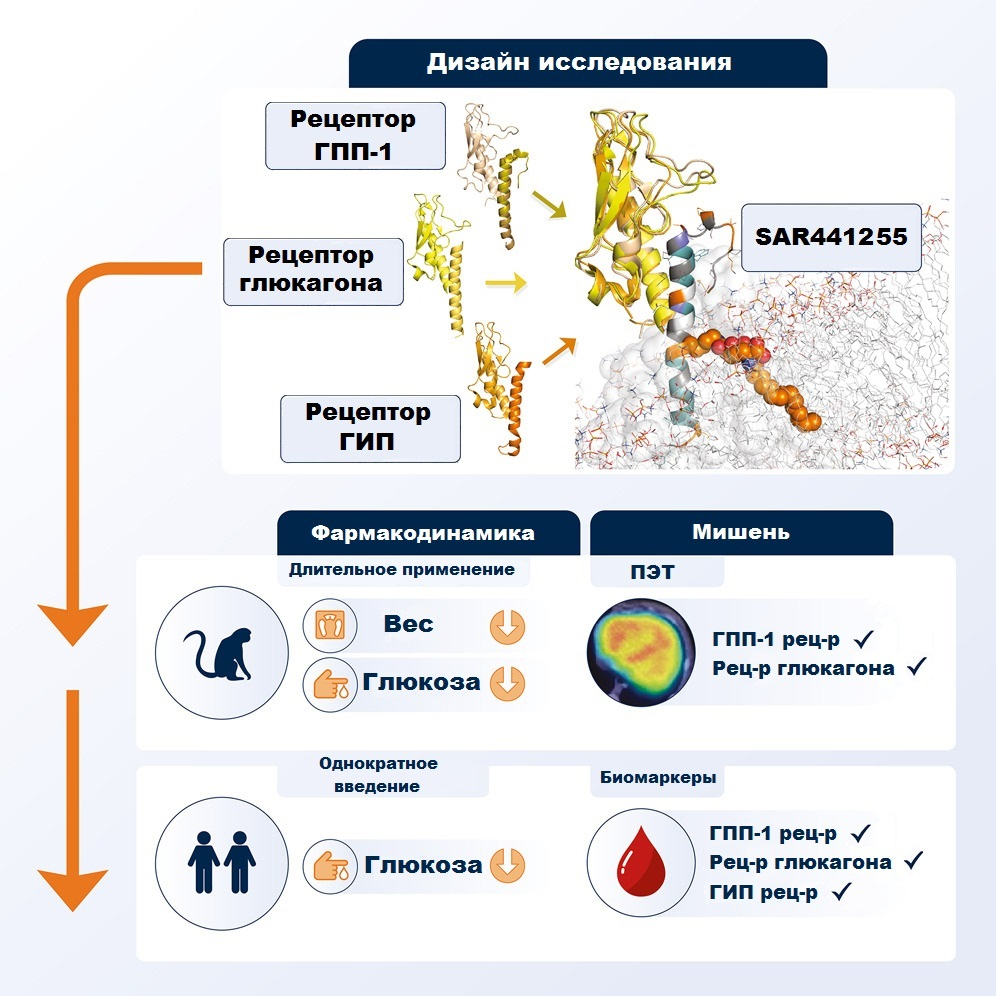
Рисунок 1. Дизайн исследования эффективности пептидного препарата SAR441255. Препарат-антагонист воздействует на рецепторы сразу трех соединений, ответственных за инкретиновый эффект: ГПП, ГИП и глюкагона. Длительные доклинические исследования на яванских макаках показали снижение массы тела и улучшение метаболических параметров у животных, страдающих ожирением и диабетом 2 типа. Работа на клеточной линии поджелудочной железы человека продемонстрировала высокую активность пептида и снижение уровня глюкозы. Данные позитронно-эмиссионной томографии (ПЭТ) свидетельствовали о специфичности пептида к рецепторам ГПП-1 и глюкагона. У здоровых особей SAR441255 улучшал гликемический контроль и влиял на биомаркеры активации рецепторов всех трех соединений.
рисунок адаптирован из [11]
Физиологические эффекты ГПП-1, связанные со снижением аппетита и стимуляцией быстрого выброса инсулина, делают его привлекательной мишенью для препаратов, борющихся с диабетом. Несмотря на относительно недавнюю разработку АР ГПП-1, международные руководства по терапии сахарного диабета признают преимущества этого класса препаратов и рекомендуют их в качестве варианта лечения пациентов с СД2. Вот только как его получить? Совсем недавно, в конце 2021 года, сотрудники направления «Биотехнология» Университета «Сириус» получили грант на создание такого препарата, способного стать флагманом подобной терапии в России. Ждем новостей, увенчается ли разработка успехом!
Основной камень преткновения при разработке таких препаратов заключается в том, что себестоимость традиционных методов синтеза активных пептидов с НПА значительно выше, чем у препаратов, получаемых с помощью биологических продуцентов. На данный момент отечественная фарминдустрия аналоги вышеназванных зарубежных препаратов не производит, и работа сотрудников направления «Биотехнология» станет первой в России попыткой в этом направлении. Ученые «Сириуса» собираются решить эту проблему, разработав универсальную платформу на основе клеток кишечной палочки Escherichia coli для быстрого и экономически эффективного получения НПА-содержащих белков и пептидов. Ученые видят своей целью создание стабильного генетически модифицированного штамма E. coli путем вставки в некодирующую область ДНК бактерии генов, кодирующих элементы ортогональной пары аминоацил-тРНК-синтетазы (aaRS) и тРНК. Здесь дело осложняется тем, что для создания ортогональной пары, способной специфически присоединять к распознающей один из стоп-кодонов тРНК определенную НПА и не взаимодействовать при этом ни с одной из 20 протеиногенных аминокислот, необходимо создать целую библиотеку мутантных клонов, кодирующих различные варианты синтетаз с измененным активным сайтом. Затем из этого набора мутантов необходимо отобрать одного-единственного, нужного ученым, и создать на его основе бактериальный штамм-продуцент (рис. 3) [13]. «Биомолекула» уже писала о том, как работают подобные технологии в персонифицированной медицине [14].
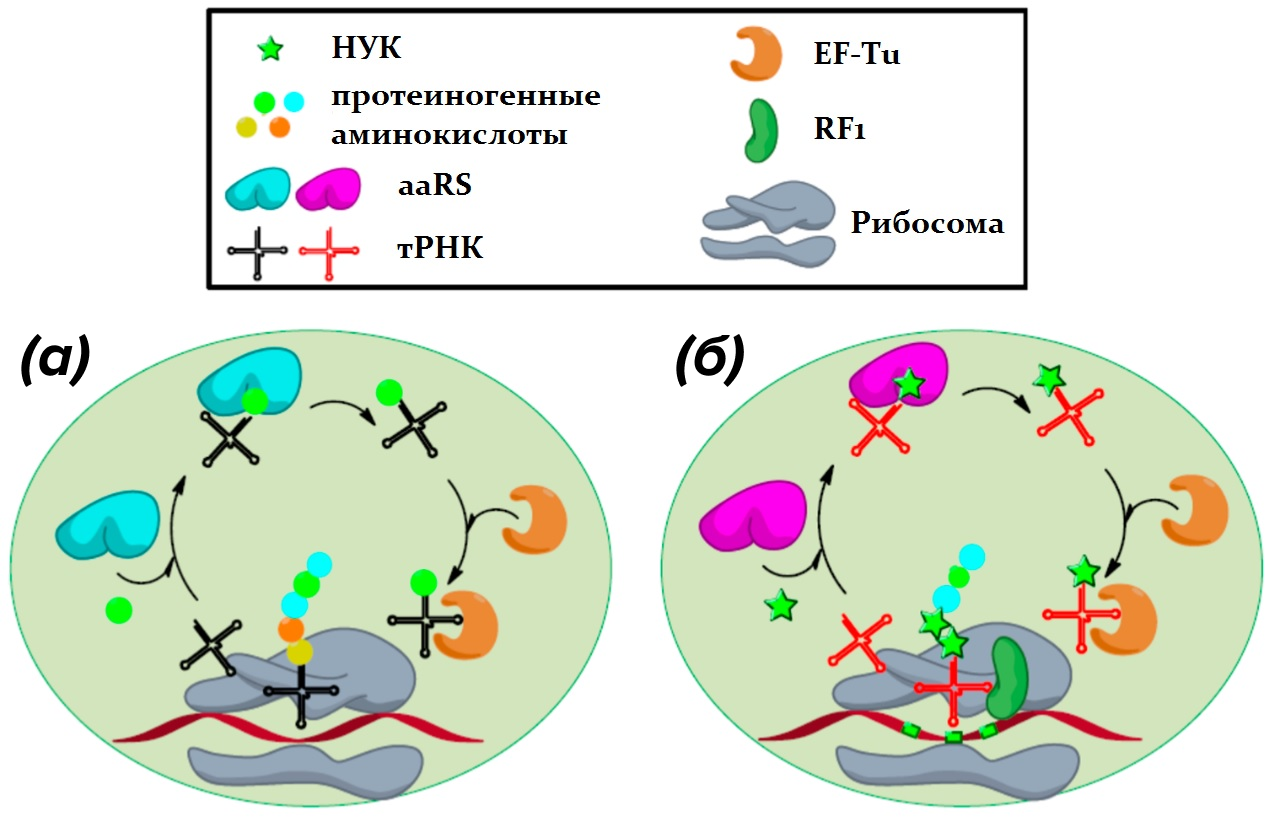
Рисунок 2. Схема получения расширенного генетического кода.
(а) — трансляция в клетке E. coli: эндогенные аминоацил-тРНК-синтетазы (aa-RS) (окрашены голубым) присоединяют аминокислотный остаток к молекуле тРНК (черный), а заряженная аминоацил-тРНК переносится с помощью фактора элонгации (EF-Tu) к рибосоме. Надлежащее взаимодействие кодонов мРНК и тРНК необходимо для высвобождения EF-Tu и образования пептидной связи. Стоп-кодоны, которые кодируют некоторые непротеиногенные аминокислоты, отмечены цветными кружками.
(б) — экспансия генетического кода: включение 1-нафталинуксусной кислоты (НУК) взамен стоп-кодона (желтый) обеспечивается за счет ортогональной ааРS (фиолетовый) и распознающей один из стоп-кодонов тРНК (красный).
рисунок адаптирован из [13]
Итак, идея получения улучшенной схемы создания библиотеки клонов и отбора штамма-продуцента для встраивания новых уникальных НПА сформулирована. Роман Иванов полагает, что технология биосинтеза пептидов с НПА может стать чрезвычайно востребованной как фармацевтическими компаниями — производителями дженериков, так и научными группами, ведущими разработку оригинальных лекарственных препаратов. Для воплощения этих смелых планов в жизнь ученые направления «Биотехнология» в конце 2021 года уже получили грантовую поддержку, и нам остается следить за новостями. В работе будут принимать участие магистранты и аспиранты Университета «Сириус», которым призван помочь в коммерциализации результатов своих исследований специально созданное подразделение — Центр интеллектуальной собственности и трансфера технологий.
Пробить оборону и…
В эпоху пандемии несложно позабыть о еще одной проблеме, связанной с инфекционными заболеваниями. То, что вирусные заболевания антибиотиками не лечатся, это ясно, но в реальности и от бактериальных болезней теперь не всегда можно с их помощью избавиться. Со времен переломных для истории медицины работ Александра Флеминга прошло почти целое столетие, и бактерии нашли оружие против природных антибиотиков. Например, даже такой простой и понятный нам микроорганизм, как золотистый стафилококк, поспособствовавший судьбоносному открытию британского микробиолога, сейчас способен доставить врачам массу неприятностей. Метициллин-резистентный штамм (MRSA) этой бактерии — одна из основных напастей, подстерегающих пациентов с ослабленным иммунитетом при госпитализации в лечебно-профилактические учреждения. Инфекция легко присоединяется к ослабленному операцией организму и дает невероятное количество осложнений [15].
Научно-технический прогресс заставляет людей всё больше применять антибиотики в совершенно разных сферах деятельности. Бесконтрольное использование этих препаратов в сельском хозяйстве способно резко увеличить циркуляцию генов устойчивости в мире микробов из-за горизонтального переноса генов у бактерий. Другой аспект этой проблемы — снижение интереса к разработке антибиотических препаратов со стороны фармацевтических компаний, который, впрочем, надзорные органы всячески стараются подстегнуть. Ведь действительно, кому захочется вкладывать значительные суммы в продукт, который через пару лет станет уже неактуальным. Однако объективная реальность жестока: согласно актуальным отчетам ВОЗ, инфекционные заболевания нижних дыхательных путей занимают устойчивое четвертое ранговое место в общей этиологической структуре смертности по всему миру.
Бороться с устойчивостью микроорганизмов можно по-разному. Например, воздействовать на клеточную стенку, защищающую бактерии от внешних факторов (этот эффект называется бактерицидным), или подавить синтез нуклеиновых кислот и тем самым не дать микробам размножаться (такой подход ученые называют бактериостатическим). «Биомолекула» уже посвятила данному фундаментальному медицинскому разделу целый цикл статей [16].
Ученые «Сириуса» прорабатывают несколько подходов к этому вопросу. Один из проектов Университета посвящен увеличению эффективности уже существующих антибиотиков путем разработки новых ингибиторов ферментов, продуцирующих сероводород. Основная сложность заключается в том, чтобы ингибиторы воздействовали именно на ферменты бактерий и не затрагивали аналогичные ферменты человека. Помимо этого, ингибиторы ферментов синтеза сероводорода способны побороть еще одну систему обороны бактерий — способность образовывать биопленки. В конгломератах бактерий существуют группы клеток, получившие название «персистеры», находящиеся в состоянии, при котором они невосприимчивы ко всем известным антибиотикам. Кроме того, компоненты внеклеточного матрикса биопленок служат одним из барьеров между клетками и внешней средой и участвуют в защите микробов от факторов иммунной системы, а также могут связывать поступающие молекулы антибиотиков [17].
В 2020 году группа отечественных авторов представила результаты детального исследования механизма действия ароматического поликетидного антибиотика тетраценомицина X (TcmX), способного перекрывать рибосомный туннель и подавлять трансляцию. Такие соединения представляют собой вторичные метаболиты, образующиеся в клетках бактерий, грибов, растений и даже некоторых животных. В процессе изучения этого вещества выяснилось, что некоторые бактерии все же обладают устойчивостью к нему ввиду отсутствия у них неканонической нуклеотидной пары U—U, с которой и происходит стэкинг-взаимодействие TcmX [18]. Эта проблема лишь подтолкнула исследователей к поиску других препаратов того же класса, обладающих бóльшим терапевтическим потенциалом, нежели тетраценомицин X.
Продолжилось изучение этого перспективного в борьбе с антибиотикорезистентностью класса макролидов уже в стенах Университета «Сириус», как мы уже упоминали в первой статье этого спецпроекта [1]. Ученым удалось выделить 6-гидрокситетраценомицин X (6-OH-TcmX), синтезированный путем тех же химических реакций, что и «обычный» TcmX. В природе 6-OH-TcmX продуцируется родом бактерий Amycolatopsis, производящим и другие известные науке антибиотики (например, ванкомицин и ристоцетин). Ранее тетраценомицины привлекали относительно мало внимания ученых по сравнению с другими более распространенными ароматическими поликетидами. Главная загадка антибиотиков с четырьмя ароматическими кольцами заключается в их способности проявлять совершенно разную биологическую активность, даже если они структурно похожи друг на друга. Например, антрациклины (яркий представитель — доксорубицин) и тетрациклины имеют значительное сходство, но совершенно разные мишени. Антрациклины являются противоопухолевыми антибиотиками, ингибирующими функцию топоизомеразы II, тогда как тетрациклины используются в качестве антибактериальных средств из-за их способности ингибировать синтез белка (рис. 4) [19].

Рисунок 3. Примеры ароматических поликетидов с четырьмя кольцами из нескольких структурных семейств.
(а) — тетрациклин, (б) — доксорубицин, (в) — тетраценомицины С и Х, (г) — 6-гидрокситетраценомицин X. Представленные на рисунке антибиотики структурно похожи друг на друга, все они имеют в основе 4 ароматических кольца. Однако замена радикалов приводит к достаточно сильным изменениям терапевтического эффекта тетрациклинов. Это дает ученым возможность для поиска новых действующих средств путем модификации уже имеющихся антибиотиков этой группы.
Оказалось, что, в отличие от TcmX, 6-OH-TcmX проявлял более низкую противомикробную и цитотоксическую активность, но ингибировал синтез белка in vitro наравне со своим «старшим братом». Обзор спектральных свойств тетраценомицинов показал значительные отличия как в УФ-поглощении, так и в спектрах флуоресценции TcmX и 6-OH-TcmX, что свидетельствует о значительном влиянии 6-гидроксилирования на хромофор тетраценомицина. Тем не менее, характерные спектральные свойства тетраценомицинов делают их подходящими кандидатами для разработки полусинтетических лекарств (например, для адресной доставки действующего вещества). Такие препараты могут использоваться одновременно как в качестве средства ранней диагностики, так и в виде терапевтического агента [19].
Однако биосинтетическое происхождение природных соединений типа 6-гидроксилированных тетраценов остается нерешенным для науки вопросом. На данный момент известно, что в случае 6-ОН-тетраценомицина С гидроксилирование было результатом комбинации генов биосинтеза тетраценомицина и урдамицина в одном штамме-продуценте. Потенциально различия в регуляции этих генов могут служить причиной низкого уровня выхода получаемого учеными гидроксилированного тетраценомицина [19]. Наука развивается непрерывно, и решение этого вопроса — обширное поле уже для новых амбициозных исследований!
Генная терапия: растворить опухоль!
Еще одно направление, функционирующее на базе Центра трансляционной медицины Университета «Сириус», — «Генная терапия» — ориентировано преимущественно на два типа проектов.
Первые связаны с разработкой онколитических вирусов для терапии злокачественных новообразований, вторые направлены на разработку продуктов для заместительной генной терапии генетических заболеваний. При поддержке фармацевтической компании BIOCAD «Биомолекула» уже публиковала немало статей, посвященных различным направлениям применения генных технологий в лечении самых разных заболеваний. Руководитель направления «Генная терапия» Александр Карабельский до назначения на должность руководителя одного из подразделений НТУ «Сириус» возглавлял департамент перспективных исследований в BIOCAD, связанных как раз с созданием платформ для генотерапевтических лекарств. Теперь он решил продолжить свою работу уже на базе первой в России федеральной территории.
Итак, почему же ученые «Сириуса» решили сосредоточиться именно на виротерапии злокачественных опухолей и борьбе с наследственными болезнями? Александр Карабельский отмечает, что в первую очередь выбор проектов обусловлен их высоким терапевтическим потенциалом и острой медицинской потребностью. В рамках работы над проектами сейчас в стенах «Сириуса» разрабатывают две технологические платформы: ведут разработку рекомбинантных онколитических вирусов, которые могут быть использованы в комбинации с антителами для лечения широкого спектра онкологических заболеваний, а также создание AAV-векторов (аденоассоциированных вирусных векторов) для доставки терапевтических генов в целевые ткани — в первую очередь для лечения заболеваний, связанных с мутациями в генах цикла фототрансдукции и приводящих к потере или нарушениям зрения (пигментный ретинит, амавроз Лебера, нейропатия Лебера и др.) (рис. 5) [20]. О российской пациентской организации, сотрудничающей с «Сириусом», можно прочесть в материале «Ленты.ру».

Рисунок 4. Диаграмма, отражающая группировку различных подходов среди 206 клинических испытаний онколитических вирусов в иммунотерапевтических целях. На лучах отмечена родовая принадлежность вирусов (внутренний круг), тип рака, варианты терапии (один вирусный агент, моно, или комбинированный подход, комбо; комбинированный агент, если применимо). Внешний сектор иллюстрирует препараты, допущенные к III фазе клинических испытаний.
Изображены различные подходы к лечению онкологических заболеваний: Chemo-химиотерапия, ATC — аутологичные опухолевые клетки, HNSCC — плоскоклеточный рак головы и шеи, NSCLC — немелкоклеточный рак легкого, SCC — плоскоклеточный рак, BCG — Bacillus Calmette-Guérin (БЦЖ), МСКТ — терапия мезенхимальными стволовыми клетками, GM-CSF — гранулоцитарно-макрофагальный колониестимулирующий фактор, IL-2 — интерлейкин-2, OV — онколитический вирус, HSV — вирус простого герпеса, MV — вирус кори, Rhabdo — рабдовирусы (VSV и Maraba ), NDV — вирус ньюкаслской болезни, другие — парвовирус и вирус долины Сенека.
Уникальность платформенных решений в том, что, меняя всего один компонент системы, исследователи могут получить уже совершенно новый препарат. «Если у нас уже есть технология получения какого-либо продукта и методология его усовершенствования, например, рациональным дизайном, — говорит Александр, — то мы можем значительно ускорить первые этапы конструирования нового лекарства. Когда появляется идея создания нового препарата с определенным функционалом, то нам остается лишь внести в эту систему некоторые модификации. Дальнейшим этапом в таких исследованиях будет скрининг, то есть отбор вариантов, обладающих необходимыми свойствами. Имея платформу, по сути уже пошаговую инструкцию, как получать нужный вам препарат, можно быстро создавать разные продукты, просто меняя отдельные компоненты исходного вектора. Например, можно создавать векторные системы на основе вирусов не только для доставки терапевтических генов, но и для изучения патогенеза заболеваний, клеточных взаимодействий, контроля экспрессии целевых генов, путем таргетной доставки оптогенетических модулей. Все это похоже на генетический конструктор» [21].
Талант и успех
Проекты направлений Научного центра трансляционной медицины многообразны и представляют интерес для тех, кто хочет понять, из чего состоит работа по созданию лекарственных препаратов и как для этого используются достижения молекулярной биологии и биоинформатики. Например, в качестве векторов в современной генной терапии ученые научились использовать даже смертоносные лентивирусы [22], а терапевтические моноклональные антитела наука уже взяла на вооружение для борьбы с широким спектром недугов: от болезни Альцгеймера до злокачественных опухолей.
Биотехнологические проекты направлены на создание конкретного продукта, путь к которому может быть непростым. В отличие от проектов фундаментальных исследований, меньшая часть экспериментов дает публикуемые результаты. Но и удовлетворение от достижения цели для тех, кто хочет видеть, как результаты их работы дают шанс на излечение людям с тяжелыми заболеваниями, мало с чем сравнимо. Директор Научного центра трансляционной медицины, проректор по научно-технологическому развитию и Университета «Сириус» Роман Иванов отмечает, что такие исследования учат проектному мышлению, ориентированности на результат. Они дают очень хорошие шансы на последующее трудоустройство в R&D подразделения ведущих фармацевтических компаний, отвечающих за создание, выведение на рынок продукта и управление его жизненным циклом.
Университет «Сириус» набирает кандидатов для поступления в вуз по программам магистратуры и аспирантуры через короткие интенсивы — образовательные программы для студентов других вузов, которые проводятся в «Сириусе» в течение всего года. Пройдя отбор и посетив такую программу, по словам Романа Иванова, студент не только получает возможность учиться у лучших и поработать над реальными практическими задачами от компаний-партнеров, но и может познакомиться с Университетом, его преподавателями, условиями жизни в «Сириусе».
Сегодня мы познакомились с работой ученых, вовлеченных в биотехнологические и генотерапевтические проекты научно-исследовательской работы Научно-технологического университета «Сириус». В третьей и финальной статье спецпроекта читателя ожидает рассказ о еще четырех направлениях: «Биоматериалы», «Нанобиомедицина», «Иммунология и биомедицина» и «Нейробиология». «Биомолекула» расскажет о том, как в стенах Университета разрабатывают технологии применения биоразлагаемых систем в медицинских целях, изучают нейробиологические причины патологий ЦНС, конструируют новые векторы для доставки нуклеиновых кислот в клетку, анализирую новые подходы к борьбе с SARS-CoV-2 и о многом другом.
Литература
- Как живет и работает самый молодой вуз России — Университет «Сириус»;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Таргетная терапия — прицельный удар по болезни;
- Неизвестные пептиды: «теневая» система биорегуляции;
- Неканонические аминокислоты. Биомолекулы, о которых не принято говорить;
- . (2019). OUP accepted manuscript. Nucleic Acids Research;
- Nina A. Petunina, Milena Е. Telnova. (2018). Diabetes and obesity. The role of agonists glucagon-like peptide-1 of in the treatment of type 2 diabetes. Diabetes mellitus. 21, 293-300;
- Три поколения лекарств;
- Domenica Rubino, Niclas Abrahamsson, Melanie Davies, Dan Hesse, Frank L. Greenway, et. al.. (2021). Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity. JAMA. 325, 1414;
- Clifford J Bailey. (2021). Tirzepatide: a new low for bodyweight and blood glucose. The Lancet Diabetes & Endocrinology. 9, 646-648;
- Martin Bossart, Michael Wagner, Ralf Elvert, Andreas Evers, Thomas Hübschle, et. al.. (2022). Effects on weight loss and glycemic control with SAR441255, a potent unimolecular peptide GLP-1/GIP/GCG receptor triagonist. Cell Metabolism. 34, 59-74.e10;
- Gagik R. Galstyan, Evgeniya A. Karataeva, Ekaterina A. Yudovich. (2017). Evolution of glucagon-like peptide-1 receptor agonists for the treatment of type 2 diabetes. Diabetes mellitus. 20, 286-298;
- Sviatlana Smolskaya, Yaroslav Andreev. (2019). Site-Specific Incorporation of Unnatural Amino Acids into Escherichia coli Recombinant Protein: Methodology Development and Recent Achievement. Biomolecules. 9, 255;
- Расширенный геном;
- G. Sganga, C. Tascini, E. Sozio, M. Carlini, P. Chirletti, et. al.. (2016). Focus on the prophylaxis, epidemiology and therapy of methicillin-resistant Staphylococcus aureus surgical site infections and a position paper on associated risk factors: the perspective of an Italian group of surgeons. World J Emerg Surg. 11;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Iris Keren, Devang Shah, Amy Spoering, Niilo Kaldalu, Kim Lewis. (2004). Specialized Persister Cells and the Mechanism of Multidrug Tolerance in Escherichia coli. J Bacteriol. 186, 8172-8180;
- В каждой бочке затычка: как тетраценомицин X затыкает бактериальные и эукариотические рибосомы;
- Vera A. Alferova, Tinashe P. Maviza, Mikhail V. Biryukov, Yuliya V. Zakalyukina, Dmitrii A. Lukianov, et. al.. (2022). Biological evaluation and spectral characterization of a novel tetracenomycin X congener. Biochimie. 192, 63-71;
- Alexander Malogolovkin, Nizami Gasanov, Alexander Egorov, Marianna Weener, Roman Ivanov, Alexander Karabelsky. (2021). Combinatorial Approaches for Cancer Treatment Using Oncolytic Viruses: Projecting the Perspectives through Clinical Trials Outcomes. Viruses. 13, 1271;
- Alexander Malogolovkin, Alexander D. Egorov, Alexander Karabelsky, Roman A. Ivanov, Vladislav V. Verkhusha. (2022). Optogenetic technologies in translational cancer research. Biotechnology Advances. 60, 108005;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo.







