
Расширенный геном
14 ноября 2015
Расширенный геном
- 2175
- 5
- 3
Возможное разнообразие белкового мира, где 20 — количество типов протеиногенных аминокислот, n — количество аминокислотных остатков и n → ∞.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: «Создана новая жизнь из пробирки» — такому заголовку уже явно не стать сенсацией в XXI веке; современные ученые успели развить такое громкое научное направление, как генная инженерия, в целую научно-философскую концепцию под названием синтетическая биология.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучший обзор» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
С синтетической биологией связаны основные надежды решения проблем биомедицины и персонифицированной медицины, методов лечения генетических заболеваний, а также разработка инновационных фармацевтических препаратов и даже создание новых материалов с заданными свойствами. Так, например, компания Bolt Threads развивает направление по созданию новых революционных материалов на основе паучьих нитей. Давно известно, что паутина лучше любого материала: она в несколько раз прочнее стали и кевлара, но в то же время это очень эластичный, гибкий и износостойкий материал. Усилиями научного коллектива компании Bolt Threads создан генетически модифицированный микроорганизм, который синтезирует уникальный белок со свойствами, близкими к свойствам паутины. Модифицируя этот белок, можно получать нити с разной эластичностью и прочностью — самый настоящий искусственный биополимер. Так что не за горами появление одежды тонкой, как шелк, и прочной, как бронежилет [1].
Еще один подход к получению новых материалов с помощью микроорганизмов «Биомолекула» уже описывала: «Археи “хамят” и помогают» [2]. — Ред.
Возвращение к истокам
Ядро концепции синтетической биологии составляет возможность использовать молекулы ДНК, а именно, составляющие ее элементы — нуклеотиды аденин, гуанин, цитозин и тимин — как строительные кирпичики для манипуляций по созданию абсолютно новых биологических конструкций, ранее не существовавших в природе [3]. Но, как оказалось, этих природных инструментов и механизмов ученым уже мало для работы, они спешат вслед за фантазиями футурологов об искусственной жизни и активно взялись за работу по расширению генетического кода — а там, глядишь, недалеко и до создания полностью синтетического кода с принципиально новым устройством. Ну а пока остановимся на тех разработках, что уже ведутся в этой области.
Вспоминая центральную догму молекулярной биологии, повторим, что реализация генетической информации, заложенной в молекуле ДНК, осуществляется через белковые молекулы, на язык которых она переводится посредством процессов репликации, транскрипции и трансляции. Даже при существующей организации живой материи, казалось бы, есть неограниченные возможности для осуществления самых буйных фантазий синтетических биологов. Смотрите сами: генетический код состоит из четырех основных нуклеотидов , затем информация перекодируется на язык РНК в процессе транскрипции, а далее кодонами (тройками рибонуклеотидов) переводится в аминокислотные последовательности — первичные полипептидные молекулы. Так как типов нуклеотидов четыре, то общее разнообразие кодонов будет 43 = 64, в них закодированы 20 протеиногенных (природных) аминокислот (АК) (не считая редкие АК: пирролизин, кодируемый генами некоторых метаногенных архей, и селеноцистеин, входящий в состав селенопротеинов и нескольких других белков). А это дает возможное разнообразие белковых молекул 20n (где n — число аминокислотных остатков), то есть бесчисленное множество вариантов [4]. Однако и этого ученым оказывается мало: им хочется узнать, как изменится функциональность белковых молекул, какие новые свойства могут приобрести белки, если в их состав включить искусственные, «неприродные», АК — те, что выходят за канонический ряд двадцатки и не синтезируются внутри живых организмов. И вот для осуществления таких амбициозных задач природой заложено не так уж много возможностей.
О необычных, но важных нуклеотидах — пятом и особенно шестом — рассказывает статья «Шестое ДНК-основание: от открытия до признания» [5]. — Ред.
Как известно, осуществление процесса трансляции в клетках обеспечивают рибосомы, узнающие трехбуквенные кодоны на матричной РНК (мРНК) и сопоставляющие с ними соответствующие антикодоны транспортных РНК (тРНК), несущих АК. Молекула тРНК присоединяет АК с помощью фермента аминоацил-тРНК-синтетазы. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью работы аминоацил-тРНК-синтетаз. Терминация синтеза белка осуществляется, когда в сайте узнавания рибосомы оказывается один из стоп-кодонов — UAG, UAA, UGA. У них, кстати, есть свои интересные названия: UAG — амбер, или янтарь (amber), UAA — охра (ochre), UGA — опал (opal). Им не соответствует ни одна из тРНК, и в действие вступают специфические белки-терминаторы RF1 или RF2, которые катализируют отсоединение полипептидной цепи от мРНК.
От природного к искусственному
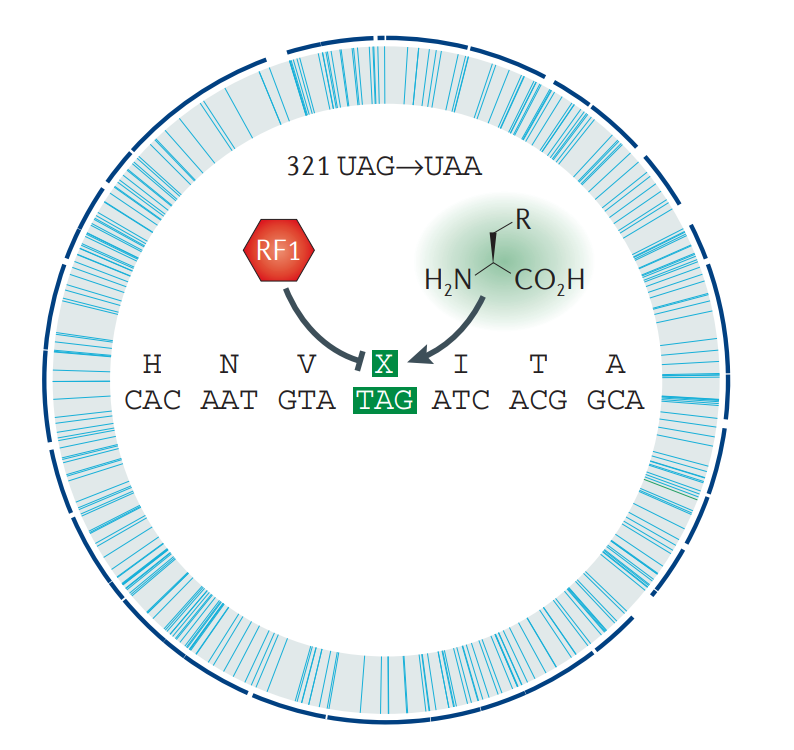
Рисунок 1. Схематичная карта отредактированного генома E. coli, в котором провели замену 321 амбер-кодона на охра-кодоны с элиминированием фактора терминации RF1.
Для того чтобы включить новую, искусственную АК в генетический код, требуются изменения отлаженной системы. Во-первых, для успешного ввода новой АК необходим «пустой» кодон, который будет кодировать эту АК. Но где его взять? Ведь все 64 кодона мРНК плотно задействованы в работе: 61 из них кодирует природные АК, а оставшиеся три — стоп-кодоны. Во-вторых, нужна новая ортогональная пара тРНК и аминоацил-тРНК-синтетазы (такая, которая клеткой не производится, «не вмешивается» в природные процессы биосинтеза белка, а предназначена лишь для работы с искусственными АК): новая молекула тРНК должна точно узнавать и присоединять искусственную АК, а новая аминоацил-тРНК-синтетаза — эффективно катализировать именно эту реакцию. Затем аминоацилированная тРНК должна точно доставлять АК к «пустому» кодону.
При исследовании штаммов Escherichia coli (E. coli) было обнаружено, что в их геномах не все стоп-кодоны используются с одинаковой частотой. Например, амбер-кодон UAG встречается реже остальных и составляет около 8% от общего числа стоп-кодонов. В рамках исследования его значимости для бактерии в 1990 году был получен первый жизнеспособный штамм E. coli, у которого был подавлен один амбер-кодон, то есть последовательность прочитывалась сквозь него [6]. В лаборатории П. Шульца (Peter G. Schultz) из Исследовательского института Скриппса смогли в E. coli вставить соответственно амбер-кодону обычную, протеиногенную, АК тирозин, а затем и некоторые искусственные АК [7]. Еще позже исследовательской группой профессора Джорджа Чёрча (George McDonald Church) из Гарварда была проведена масштабная работа по всеобъемлющему редактированию генома E. coli с целью замены всех амбер-кодонов на охра-кодоны: UAG → UAA. Это было сделано с помощью мощного современного метода мультиплексного геномного редактирования (MAGE), который позволяет проводить полномасштабные манипуляции с геномом при помощи синтетических одноцепочечных олигонуклеотидов (рис. 1) [8].
Такая модификация затронула 83 пептида бактерии, но новый генно-модифицированный штамм E. coli C321.ΔA получился не просто жизнеспособным, но и обладал повышенной устойчивостью к бактериофагу T7. Это означает, что у такого организма есть расширенные возможности относительно использования амбер-кодонов в новых целях. Так, например, одно из направлений работы — модификация этого штамма в синтетический ауксотроф — организм, зависимый от какого-нибудь органического соединения, в нашем случае — от искусственных АК. Зачем это нужно? В последнее время развиваются опасения, что генно-модифицированные организмы (ГМО), и в первую очередь микроорганизмы, могут распространиться за пределы исследовательских лабораторий и выйти из-под контроля ученых. Это можно предупредить приданием ГМО зависимости от искусственных АК, которые бы заменяли протеиногенные АК в жизненно важных для организма белках. Соответственно, такой штамм не смог бы развиваться на средах без источника аминокислоты, от которой зависим.
Для одновременного эффективного кодирования нескольких неприродных АК требуется больше «пустых» кодонов и ортогональных пар аминоацил-тРНК-синтетаз и тРНК, которые бы «признавали» неприродные АК и декодировали новые кодоны. Поэтому следующим логичным шагом стали попытки расширения триплетного генетического кода до квадруплетного [7]. Использование квадруплетного кода гипотетически увеличило бы количество кодонов до 256 (= 44) [4]. Но для распознавания таких кодонов нужна модификация всего трансляционного аппарата: изменение тРНК для расширения антикодоновой петли, новые аминоацил-тРНК-синтетазы, катализирующие присоединение неприродных АК к молекулам тРНК, новые рибосомы с расширенным сайтом узнавания, способным вмещать укрупненный комплекс аминоацил-тРНК-молекул [9]. Такая ортогональная квадруплетная рибосома была создана и работала в сочетании с особой мРНК [7], никак не влияя на «природный» биосинтез белка обычными клеточными рибосомами. А значит, не затрагивая нормальную внутриклеточную жизнь, можно создавать в клетке абсолютно новые трансляционные пути — синтезировать белковые молекулы, состоящие частично или даже полностью из неприродных АК, некие новые биополимеры. В общем, ученые показали, что отправной точкой таких исследований является эволюция рибосомы.
Немного информатики на закуску
К рассмотрению генетического кода можно применять теории и понятия из других научных областей. Так, например, приложение теории информации может помочь нам ответить на главный вопрос: действительно ли расширение генетического кода расширяет его информационную емкость? Иначе зачем проводить все эти масштабные исследования? Мерой количества информации служит степень разнообразия элементов системы или сведений о ней. А поскольку задачей расширения генетического кода как раз и является углубление и расширение информационной емкости генетического кода, то нужен расчет, который бы количественно отразил закодированную информацию. Таким расчетом может служить расчет показателя энтропии Шеннона (рис. 2) для первичной аминокислотной последовательности. Он может дать представление о том, сколько информации теоретически закодировано в ней.
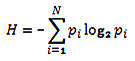
Рисунок 2. Общая формула для показателя энтропии Шеннона. i — буква алфавита, pi — частота встречаемости буквы алфавита в последовательности; количество информации измеряется в битах.
рисунок автора
Вообще говоря, понятие энтропии пришло из термодинамики открытых систем и определяется как мера неопределенности системы. А информация может рассматриваться как мера упорядоченности. Соответственно, процесс накопления информации — необходимое условие для снятия неопределенности. Энтропия Шеннона будет принимать высокие значения для последовательностей, содержащих максимальное число различных типов АК, в которых все типы АК распределены наиболее равномерно, — последовательностей с максимальным объемом информации. Это объясняется следующим примером: для очень однородной последовательности (например, полиаланиновой цепочки), зная положение конкретной АК в последовательности и зная, что каждая из них — это аланин, расчет энтропии Шеннона даст 0 бит информации (H = log21 = 0). Неопределенность в такой системе сведена к минимуму, так как мы знаем, что любая АК в цепочке — аланин. В то же время в таком сложном белке, как кальмодулин, в котором представлены 18 из 20 возможных типов АК, показатель Шеннона составит 3,9 бита от максимально возможных 4,3 бит (H = log220 ≈ 4,3), информационная нагрузка такой цепочки в разы возрастает (рис. 3).
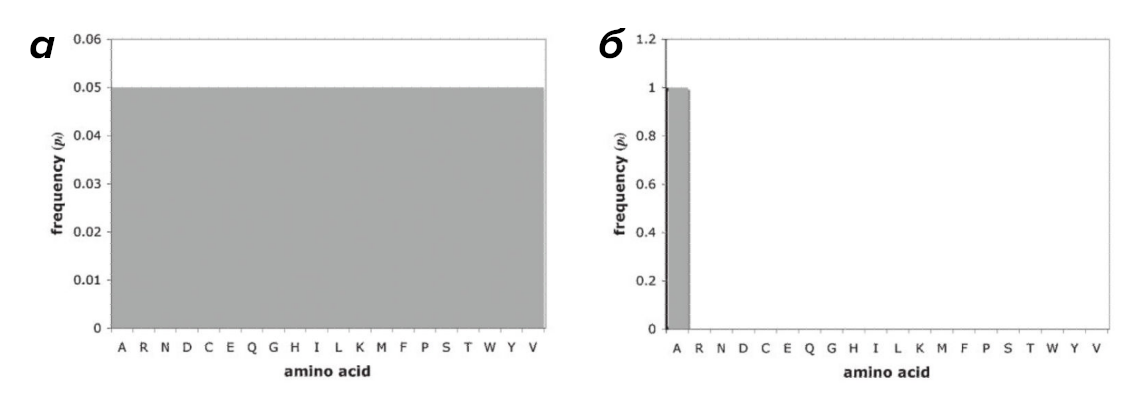
Рисунок 3. Примеры величины энтропии Шеннона для разных пептидов: а — максимальное значение энтропии Шеннона при однородном распределении АК в гипотетической полипептидной цепочке, б — минимальное значение — например, в полиаланиновой цепочке.
[4], рисунок адаптирован
То есть, если теоретически можно будет составлять белковые молекулы из 255 типов АК, то информационная емкость на один шаг должна увеличиться до 8 бит (H = log2255 ≈ 7,99) [4]. Математические расчеты — это, конечно, хорошо, но как представление о количестве теоретически закодированной информации соотнести с функциональностью молекул? Будет ли это отражаться на биологической активности молекул, составленных из белковых последовательностей с большей информационной емкостью? То есть возникает вопрос о корреляции энтропии Шеннона белковых последовательностей с их биологической функцией.
Частично ответ на этот вопрос пришел из исследований, посвященных изучению эволюции РНК-мира — того раннего этапа жизни, когда молекулы РНК служили хранилищами генетической информации и основой для построения каталитических молекул [10], [11]. Используя стандартный алфавит (аденин, гуанин, цитозин и урацил), in vitro получали высокоактивные рибозимы с константой скорости каталитической реакции kcat = 20 мин−1. Далее алфавит уменьшали, первым элиминируя цитозин, так как он наименее стабилен (наиболее подвержен разложению). Такое сокращение по-прежнему давало рибозимы, но уже с более низкой каталитической активностью: kcat = 0,01 мин−1. Сокращение алфавита до двух букв — это крайний из возможных вариантов, которым можно передавать информацию; в таком случае получались рибозимы с kcat = 0,001 мин−1. Однако и это значение все еще в 10000 раз превышало константу скорости некаталитической реакции. Примечательно, что этот рибозим состоял из урацила (U) и неприродного основания диаминопурина (D). Оказалось, что преимущество D-U-системы над А-U-системой состоит в том, что неприродная пара оснований формирует три, а не две, водородные связи во время гибридизации, тем самым стабилизируя вторичную структуру рибозима.
Хотя открытие рибозимов только с двумя или тремя видами оснований и само по себе довольно интересно, оно еще послужило подтверждением предположения, что уменьшение размера алфавита снижает активность биомолекул. А следовательно, теоретически заложенная информация соотносится с функциональной активностью, подтверждая интуитивное предположение: чем больше информации, тем лучше. Поэтому в ближайшие годы можно ожидать еще больше статей с сенсационными исследованиями на тему расширения генетического кода.
Пятое колесо в телеге
Еще одна исследовательская группа под руководством доктора Ф. Ромесберга (Floyd E. Romesberg) проделала поистине революционную работу: им удалось создать полусинтетический штамм E. coli с искусственной нуклеотидной парой, которая реплицировалась с высокой точностью, сохранялась и передавалась по наследству [12]. То есть эта нуклеотидная пара распознавалась ферментными структурами клетки как «своя» (не чужеродная) и не редактировалась системами репарации. Но обо всем по порядку.
Сначала синтетическими методами был получен ряд нуклеотидных аналогов и среди них выбрана потенциальная пара для включения в ДНК. Эти искусственные нуклеотиды получили кодовые названия d5SICS и dNaM; водородные связи в этой паре не образовывались, а комплементарность обеспечивалась гидрофобными взаимодействиями. Оказалось, что такая вставка не нарушает природную Уотсон-Криковскую структуру молекулы ДНК и не препятствует работе полимеразы (рис. 4). In vitro, то есть в пробирках, была проверена амплифицируемость ДНК-фрагментов, содержащих искусственную нуклеотидную пару, и наилучшие результаты показала Taq-полимераза. Ура! Часть работы была выполнена, настало время переходить к экспериментам in vivo — а это самое сложное.
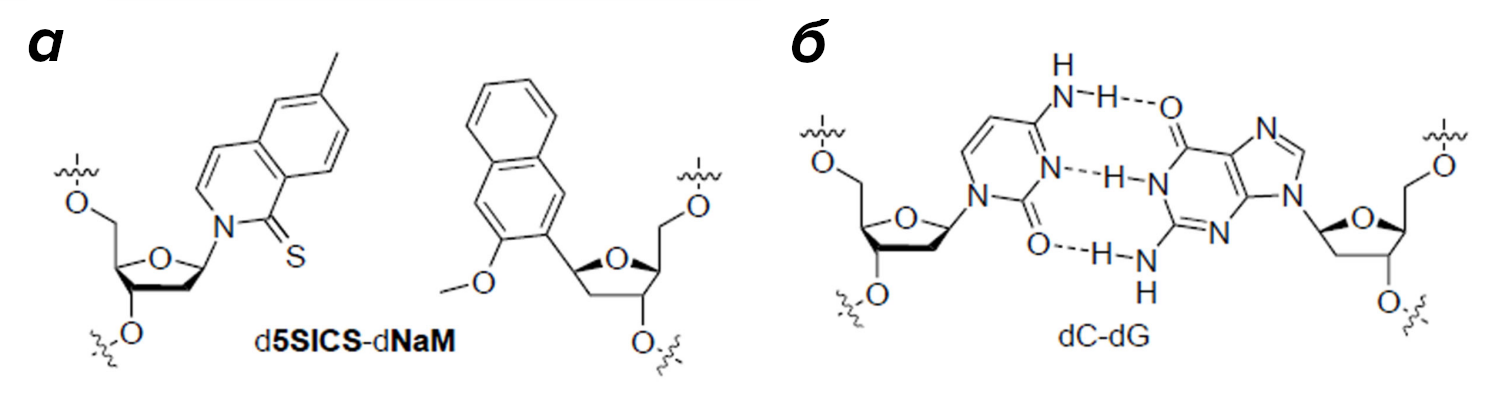
Рисунок 4. Искусственная нуклеотидная пара d5SICS-dNaM (а) в сравнении с естественной парой цитозина-гуанина (б).
[12], рисунок адаптирован
Для проверки гипотезы о возможной работе искусственной нуклеотидной пары в клетке (в E. coli) была сконструирована плазмида pINF (рис. 5) из стандартного лабораторного вектора pUC19: методом твердофазного синтеза был получен олигонуклеотид с искусственным основанием, затем с помощью кольцевой ПЦР с перекрывающимися концами (circular extension PCR overlap) искусственная пара была вставлена по 505 положению в вектор. Такое положение искусственных нуклеотидов в векторе было выбрано не случайно. Из внутренних полимеразных ферментов E. coli — а их у нее целых 5 — с наибольшей точностью для искусственных оснований работала ДНК-полимераза I. Но основную работу по репликации бактериального генома осуществляет ДНК-полимераза III, а ДНК-полимераза I выполняет лишь вспомогательную функцию по замене РНК-затравок и заполнению пропусков между фрагментами Оказаки на отстающей цепи («−» цепь ДНК). Поэтому положение искусственных оснований выбрали так, чтобы на «+» цепи ДНК они располагались сразу после сайта origin (места начала репликации), а на «−» цепи — в интервале между фрагментами Оказаки: для уверенности, что эти нуклеотиды попадут в «зону ответственности» ДНК-полимеразы I.
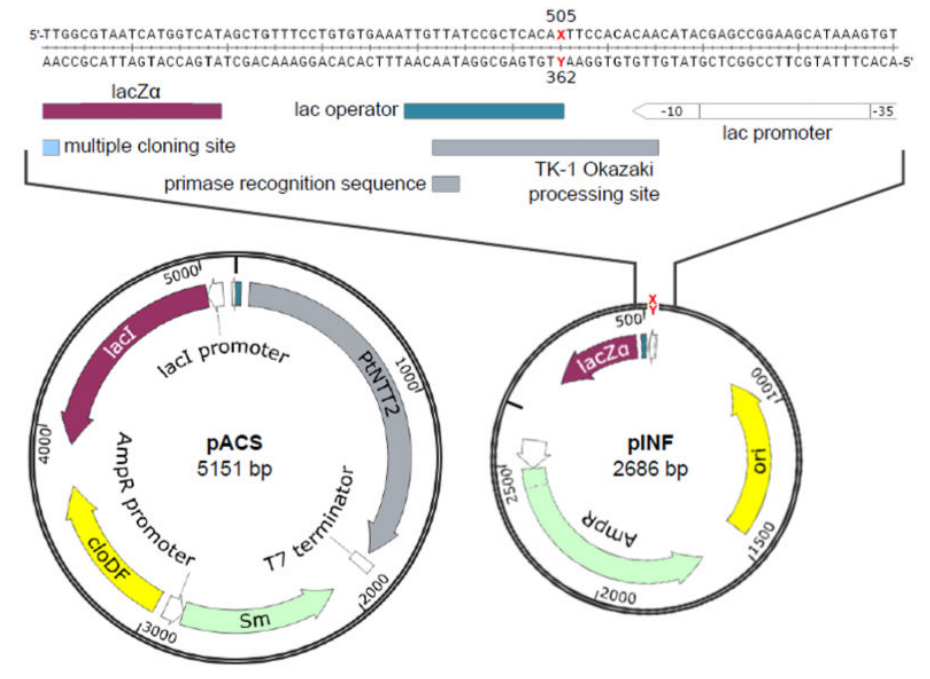
Рисунок 5. Карты плазмидных векторов pACS и pINF.
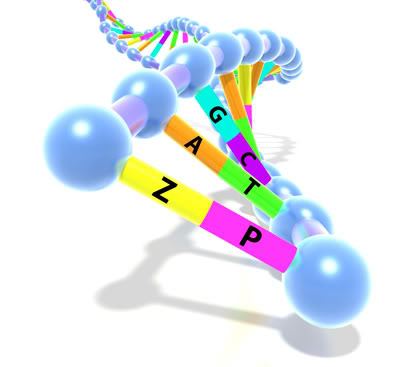
Рисунок 6. Третья пара нуклеотидов в генетическом коде.
Но для успешной высокоточной репликации искусственной нуклеотидной пары необходимо где-то добывать соответствующие искусственные дезоксирибонуклеозидтрифосфаты (дНТФ). Внутри клетки сами по себе они не синтезируются — на то они и искусственные, — поэтому остается добавлять их в среду, на которой будут расти колонии E. coli. А для этого у бактерии должен быть эффективный транспортер искусственных дНТФ внутрь клетки. Поэтому пришлось сконструировать еще одну плазмиду — pACS (рис. 5), содержащую заимствованный у диатомей Protochlamydia amoebophila ген, кодирующий дНТФ-транспортер. Предварительно, разумеется, ученые протестировали, эффективно ли этот транспортер доставлял нужные искусственные дНТФ.
После трансформации сконструированными плазмидами pINF и pACS клетки E. coli выращивали на среде с добавлением искусственных дНТФ. Анализ на «удерживание» искусственных нуклеотидов проводился после 15 часов роста бактерий, что соответствовало минимально 24 клеточным удвоениям. Для достоверного анализа выбрали сразу несколько параллельных методов: ВЭЖХ/МС-анализ (жидкостная хроматография с масс-детекцией), секвенирование по Сенгеру, ПЦР с биотинированными праймерами. С помощью этих методов выяснилось, что точность репликации составила 99,4% (выход искусственных нуклеотидов — 0,86). Такая точность — 1 ошибка на 1000 пар нуклеотидов — характерна для работы некоторых полимераз с полностью природными ДНК. К третьему дню роста бактериальной культуры удерживание искусственных нуклеотидов падало до 45%, а к шестому — до 15%. Но и это исследователи считают прекрасным результатом! Они предполагают, что это только первые шаги в направлении расширения генетического кода. Следующим этапом может стать разработка механизма транскрипции последовательности ДНК с искусственным нуклеотидом в РНК-последовательность. Это помогло бы расширить функциональные возможности разнообразных РНК-структур, например, РНК-переключателей (riboswitches) — активных участков молекул РНК, регулирующих работу генов [13] или рибозимов. Но, конечно, главная идея всей затеи состоит в создании новых триплетных кодонов, способных закодировать синтетические АК (рис. 6), но для этого потребуется и перестройка трансляционного аппарата организмов.
Таким образом, синтетическая биология обладает огромными возможностями в создании и исследовании совершенно «новой» основы жизни, с потенциально новыми свойствами, ранее не существовавшими в природе. Не исключено, что нам удастся дожить до времен, когда все будет ограничиваться лишь фантазией ученых.
Литература
- Technology. (2015). Bolt Threads;
- Археи «хамят» и помогают;
- Синтетическая жизнь;
- Chen I.A. and Schindlinger M. (2010). Quadruplet codons: one small step for a ribosome, one giant leap for proteins. Bioessays. 32, 650–654;
- Шестое ДНК-основание: от открытия до признания;
- Normanly J., Kleina L.G., Masson J.M., Abelson J., Miller J.H. (1990). Construction of Escherichia coli amber suppressor tRNA genes. III. Determination of tRNA specificity. J. Mol. Biol. 213, 719–726;
- Слово из четырёх букв;
- Haimovich A.D., Muir P., Isaacs F.J. (2015). Genomes by design. Nat. Rev. Genet. 16, 501–516;
- Wang L., Brock A., Herberich B., Schultz P.G. (2001). Expanding the genetic code of Escherichia coli. Science. 292, 498–500;
- Levy M. and Miller S.L. (1998). The stability of the RNA bases: implications for the origin of life. Proc. Natl. Acad. Sci. USA. 95, 7933–7938;
- Rogers J. and Joyce G.F. (1999). A ribozyme that lacks cytidine. Nature. 402, 323–325;
- Malyshev D., Dhami K., Lavergne T., Chen T., Dai N., Foster J.M., Corrêa I.R. Jr. et al. (2014). A semi-synthetic organism with an expanded genetic alphabet. Nature. 509, 385–388;
- РНК у истоков жизни?.







