Шестое ДНК-основание: от открытия до признания
25 августа 2015
Шестое ДНК-основание: от открытия до признания
- 3442
- 0
- 5
Изображение двойной спирали ДНК, где вспышками показаны метилированные основания.
Рисунок в полном размере.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: «Подстрели-ка ты, Иван-царевич, селезня! В селезне утка, в утке яйцо, в яйце иголка, а в иголке — жизнь и смерть Кощеева». Так гласит народная сказка. Однако в отношении живой клетки это не сказка, а быль: в организме содержатся клетки, в клетке ядро, в ядре хромосомы, а в хромосоме таится ДНК — хранительница генетического кода. В свою очередь в ее двойной спирали спарены четыре основания — цитозин и гуанин, аденин и тимин. Но испанские исследователи Х. Хейн и М. Эстеллер говорят нам, что не всё так просто и что помимо этих четырех «классических» оснований в живых организмах существуют их модификации.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшее новостное сообщение» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Пятое основание , метилцитозин, было обнаружено еще в 80-х годах прошлого века. С тех пор его находили в самых разных организмах — от прокариот до высших животных. В этом году к пятерке оснований прибавили еще одно, тоже модифицированное, — метиладенин [1]. Чаще всего метиладенин присутствует в геноме бактерий, но в незначительных количествах он содержится и в других организмах.
О том, как буквы складываются в слова (т.е. основания ДНК определяют первичную структуру белка), об истоках генетического кода и его характере — цифровом и аналоговом — читайте в статье «У истоков генетического кода: родственные души» [2]. А о том, как в высоких целях «апгрейда» белков преодолеть природную ограниченность кода (и даже его триплетность!), поколдовав над рибосомами и не только, — в работах «Слово из четырёх букв» [3], «Две рибосомные субъединицы объединили в функциональный гибрид» [4]. — Ред.
Возникает вопрос, зачем нужны метилированные основания? Или это просто цитозин и аденин с СН3-группой? Нет, конечно. Метилированные основания необходимы всем организмам, будь то прокариоты или эукариоты. В первом случае процесс метилирования некоторых сайтов (участков) защищает бактериальную ДНК от разрушения собственными расщепляющими ферментами — эндонуклеазами. Что же касается инородных молекул, которые подобному метилированию не подвергаются, то их ждет незавидная участь быть переваренными. Такая мудрая тактика распознавания «свой—чужой» называется системой рестрикции-модификации (рис. 1) [5].
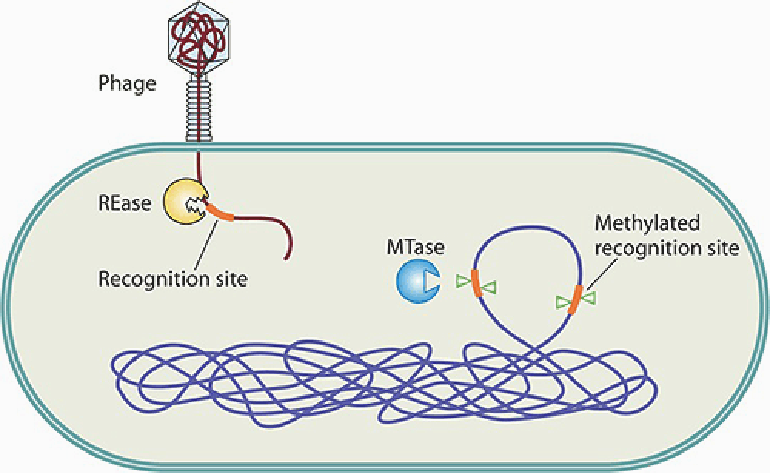
Рисунок 1. Система рестрикции-модификации (РМ) — древний механизм защиты, помогающий бактериям отличить свою ДНК от чужеродной — например, от фаговой — по паттерну метилирования. Модифицированное (метилированное) состояние определенных участков собственной ДНК поддерживает метилтрансфераза (MTase), защищая геном от разрушения. Проникающие в клетку неметилированные молекулы распознаются РМ-системой как чужеродные и разрезаются эндонуклеазами рестрикции (REase).
У эукариот метилирование ДНК приводит к стабильному подавлению экспрессии некоторых генов. Также оно отвечает за такие интересные явления, как инактивация одной Х-хромосомы у самок млекопитающих и импринтинг. В первом случае одна из двух половых хромосом самок теряет активность (неважно, отцовская или материнская) с той целью, чтобы самки не образовывали продуктов экспрессии генов больше, чем самцы. А в случае импринтинга аллели проявляются по-разному в зависимости от того, откуда они поступили: от мамы или от папы. Наглядным подтверждением этому служат различные болезни, которые наследуются только от родителя определенного пола, например, синдром Ангельмана (рис. 2).
Метилирование нуклеотидов ДНК — один из главных механизмов эпигенетических модификаций хроматина (наряду с химическим изменением гистонов: ацетилированием, метилированием, убиквитинированием и пр.). Эпигенетические метки, не меняя последовательность ДНК, определяют, как ее нужно читать — каким генам молчать, а каким — работать: «Развитие и эпигенетика, или история о минотавре» [6], «Катится, катится к ДНК гистон» [7]. Но мало знать, «как оно там устроено», важно применять знание в оценке состояния здоровья (особи и ее потомства) и лечении болезней: «Эпигенетические часы: сколько лет вашему метилому?» [8], «Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?» [9], «Пилюли для эпигенома» [10]. — Ред.

Рисунок 2. Синдром Ангельмана. Редкая генетическая аномалия, вызванная инактивацией генов материнской 15 хромосомы. Отцовские аллели при этом импринтированы (выключены), потому не могут компенсировать мутацию. Патологию также называют «синдромом счастливой марионетки». Для больных характерны судороги, задержка психического развития, частый смех, улыбки.
картина «Мальчик с рисунком (марионеткой)», Дж. Карото, Wikipedia
ДНК-метилирование в чём-то подобно мутации. Оно является стабильной и наследуемой модификацией. Но в отличие от мутаций, метилирование не изменяет генетический код, а регулирует экспрессию генов. Именно поэтому метилирование ДНК — эпигенетическое событие (меняется активность генов), а не генетическое.
Новые технологии и результаты

Рисунок 3. Ультравысокоэффективный жидкостный хроматограф UltiMate™ 3000 XRS (Thermo Scientific).
Теперь, разобравшись, насколько большую роль метилирование ДНК играет в живых клетках, мы можем перейти непосредственно к исследованию Хейна и Эстеллера [1], [11]. Они в своей работе определили содержание метиладенина в геноме зеленой водоросли Chlamidomonas reinhardtii, мухи Drosophila melanogaster и червя Caenorhabditis elegans и изучили его эпигенетическую функцию. По причине минимального содержания этого основания в клетках эукариот (в отличие от метилцитозина, который содержится в большем количестве) ученым пришлось использовать высокочувствительное оборудование для его обнаружения.
Им понадобился секвенатор нового поколения и аппаратура для ультравысокоэффективной жидкостной хроматографии (рис. 3), сочетающейся с масс-спектрометрией. С помощью хроматографии можно обнаружить модифицированные нуклеотиды, содержание которых в образце ДНК незначительно. Вот как это работает: ДНК разделяется с помощью жидкостной хроматографии на компоненты, различные по массе [12], которые затем анализируются масс-спектрометрами. Таким образом, разница между немодифицированной и модифицированной ДНК устанавливается на основе различия их молекулярных масс.
Хейн и Эстеллер применили инновационный метод определения нуклеотидной последовательности в реальном времени — одномолекулярное секвенирование ДНК (рис. 4) [13]. Он дает возможность исследователям наблюдать за работой единичной молекулы ДНК-полимеразы в реальном времени, пока она достраивает вторую цепь ДНК. Нуклеотиды, которыми оперирует ДНК-полимераза, предварительно помечены флуоресцентными красителями. Метки испускают свет, который регистрируется прибором. Этот метод позволяет расшифровывать очень длинные последовательности ДНК .
Другие прогрессивные методы секвенирования генома и оценки его экспрессии — на уровне отдельных клеток — обсуждаются в статьях «Секвенирование единичных клеток (версия — Metazoa)» [14] и «Разработан метод анализа экспрессии генов на уровне индивидуальных клеток» [15]. — Ред.
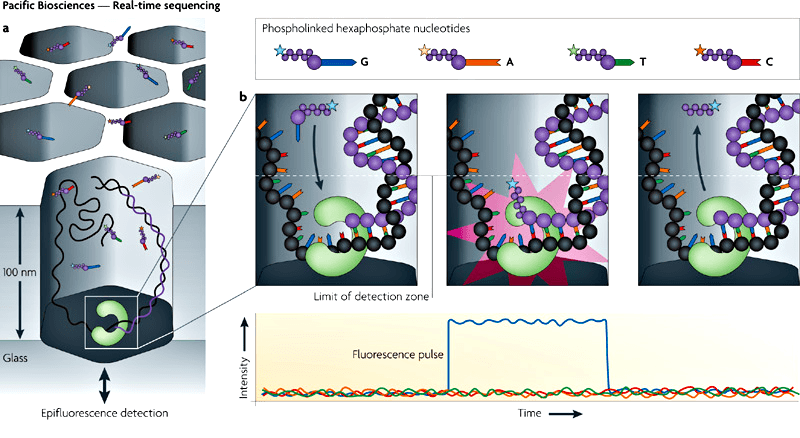
Рисунок 4. Одномолекулярное секвенирование в реальном времени — технология нового поколения. Чтобы увидеть, в каком порядке ДНК-полимераза достраивает вторую цепь ДНК, достаточно просто пометить нуклеотиды флуоресцентными красителями с различными спектрами.
Итак, с помощью всех этих стратегий исследователи проанализировали содержание метиладенина у трех различных организмов. И у зеленой водоросли, и у мухи, и у червя метиладенина оказалось мало. Настолько мало, что приходилось проводить некоторые эксперименты повторно, чтобы его обнаружить. Но низкий процент содержания — не синоним бесполезности. Хейн и Эстеллер считают, что метиладенин является эпигенетической меткой, регулирующей экспрессию определенных генов. Также их удивил тот факт, что у эмбрионов мух уровень метиладенина выше, чем у взрослых насекомых. «Это может означать, что метиладенин играет особую роль на ранних стадиях развития», — говорят исследователи.
Процент метилированных оснований в ДНК контролируется с помощью специального фермента — деметилазы. Этот фермент преобразует метилированные основания в обычные, не нарушая целостности генома. Важность этого процесса доказывает тот факт, что при изменении активности деметилазы возрастает смертность эмбрионов.
А есть ли метиладенин у человека?
Оставив в стороне мух и червей, зададим прямой вопрос: есть ли метилированный аденин у человека? Ответ неоднозначен: если и есть, то в очень малых количествах. Косвенные свидетельства говорят в пользу наличия метиладенина — например, особый деметилирующий фермент присутствует у высших эукариот. Мы знаем, что он деметилирует исключительно метиладенин, а значит, скорее всего, шестое основание обнаружат и у нас с вами. Для подтверждения наличия метиладенина у человека предстоит провести опыты, используя технологии нового поколения.
В заключение
Метиладенин — так называемый шестой нуклеотид, обнаруженный у бактерий, водорослей, животных. «Мы до сих пор недооценивали роль модифицированных оснований в жизни организмов, но теперь ясно, что они несут в себе неизвестные прежде функции», — вот главная мысль исследователей Х. Хейна и М. Эстеллера. Мы знаем, что метиладенин необходим для защиты генома бактерий, и предполагаем, что он регулирует экспрессию генов у эукариот. Совершенствуя технологии секвенирования и хроматографии, мы сможем обнаружить метиладенин в различных биологических объектах и предсказать его новые функции.
Литература
- Holger Heyn, Manel Esteller. (2015). An Adenine Code for DNA: A Second Life for N6-Methyladenine. Cell. 161, 710-713;
- У истоков генетического кода: родственные души;
- Слово из четырёх букв;
- Две рибосомные субъединицы объединили в функциональный гибрид;
- «Мятный холодок»: почему ментол создаёт ощущение прохлады во рту;
- Развитие и эпигенетика, или История о Минотавре;
- Катится, катится к ДНК гистон;
- Эпигенетические часы: сколько лет вашему метилому?;
- Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?;
- Пилюли для эпигенома;
- Sixth DNA base discovered? ScienceDaily (4 May 2015);
- Википедия: «Высокоэффективная жидкостная хроматография»;
- Википедия: «Одномолекулярное секвенирование в реальном времени»;
- Секвенирование единичных клеток (версия — Metazoa);
- Разработан метод анализа экспрессии генов на уровне индивидуальных клеток.