Две рибосомные субъединицы объединили в функциональный гибрид
18 августа 2015
Две рибосомные субъединицы объединили в функциональный гибрид
- 3255
- 0
- 2
-
Автор
-
Редактор
Темы
Биоинженеры разработали гибридные рибосомы, в состав которых вместо двух длинных цепочек рРНК входит единая молекула, обеспечивающая «неделимость» органеллы. Такие рибосомы могут поддерживать синтез всех необходимых для бактериальной клетки белков, хотя инициация трансляции у них происходит намного медленнее, чем у обычных рибосом.
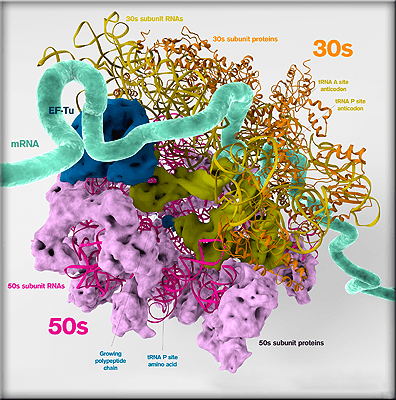
Рибосомы — молекулярные машины для синтеза белка — у всех известных организмов устроены похоже. У рибосомы всегда есть малая субъединица, которая связывается с молекулой матричной РНК (мРНК), а также большая субъединица, которая присоединяется к ним позже. Функции субъединиц отличаются: задача малой — опознать подходящую РНК и место на ней, с которого нужно начать синтез белка, а большая субъединица, содержащая каталитический центр, присоединяется ко всей конструкции, когда всё уже готово — завершая создание рабочей рибосомы. Преждевременное соединение половин рибосомы настолько нежелательно, что в клетке даже есть специальные белковые факторы, которые этому препятствуют.
То, что рибосома состоит из двух отдельных половин, важно и для продолжения синтеза полипептида. Повороты субъединиц друг относительно друга протаскивают мРНК сквозь активный центр, так что все ее участки, которые должны быть прочитаны, своевременно в него попадают*. Наконец, разъединение субъединиц, считавших всю кодирующую часть цепочки РНК, знаменует окончание синтеза белковой молекулы.
* — Узнать, как работает рибосома и как работают ученые, чтобы узнать, как работает рибосома, можно здесь: «Рибосома за работой» [1]. — Ред.
И всё же биоинженерам очень хотелось получить рибосомы, в которых субъединицы были бы объединены в одну молекулу и, несмотря на это, могли проводить все стадии трансляции. Субъединицы таких «машин» не смешивались бы с пулом обычных рибосом клетки, поэтому на них можно было бы экспериментировать, не влияя на обычные процессы синтеза клеточных белков. Такой отдельный набор рибосом можно было бы подстраивать под наработку необычных пептидов: например, перестраивать выходной туннель рибосомы, чтобы его могли покидать крупные молекулы, или модифицировать ее активный центр под специфические реакции.
Молекулы РНК служат каркасами рибосомных субъединиц. Поэтому скрепить субъединицы между собой можно, получив единую протяженную молекулу рибосомной РНК (рРНК), включающую в себя каркасы для обеих субъединиц. При этом новая РНК должна как можно меньше отличаться от суммы исходных, чтобы клеточные системы контроля ошибок не распознали новую молекулу как ошибочно синтезированную или чужеродную*. Проще всего было бы соединить концы рибосомных РНК цепочками нуклеотидов. Но концы рРНК большой и малой субъединиц природных рибосом располагаются далеко друг от друга. Зато два конца РНК большой субъединицы сближены. Поэтому их можно сшить, а новые концы сделать в другом месте. Получившиеся варианты называются циркулярными пермутантами РНК большой субъединицы.
* — В ходе эволюции клетки отобрали строжайших контролеров качества РНК, особенно матричной. Разные системы контроля распознают разные дефекты РНК, изощренно утилизируя и бракованные, и избыточные, и чужие молекулы: «Как избавиться от РНК за несколько минут» [2]. — Ред.
Ученым пришлось получить большую коллекцию таких мутантов, потому что не было известно, в каком месте рРНК лучше делать новые концы [3, 4]. По случайности один из невредных разрывов в РНК большой субъединицы 70S рибосомы располагался там, где большая субъединица контактирует с частью малой, которая, по данным прошлых исследований, к модификациям относится спокойно. Поэтому ученые решили соединить РНК в этом месте. Им пришлось еще и подбирать правильную длину рибонуклеиновых связок: они должны были быть не слишком короткими, чтобы связанные половины рибосомы могли двигаться друг относительно друга, но и не слишком длинными, чтобы к малой субъединице на старте синтеза белка не могла пристроиться одна из свободных клеточных больших субъединиц. Опыт показал, что подходящая длина линкеров — восемь и девять нуклеотидов.
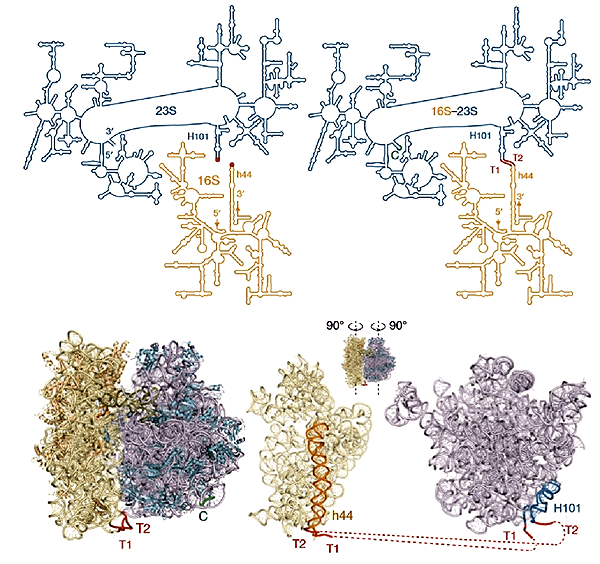
Рисунок 1. Соединение двух рРНК для получения единой и неделимой рибосомы Ribo-T. Вверху — Вторичная структура нативных рРНК (слева) и их гибрида. Природные концы 16S и 23S рРНК располагаются в субъединицах рибосомы таким образом, что сшивать их не удобно (концы РНК отмечены как 3’ и 5’). Поэтому ученым пришлось соединить концы РНК большой субъединицы (справа вверху место сшивки (С) 23S рРНК отмечено зеленым) и сделать новые концы там, где их будет удобно подсоединить к 16S рРНК. Для сшивки использовали короткие цепочки РНК — линкеры Т1 и Т2 (отмечены красным). Внизу — Модели обычной бактериальной рибосомы (слева) и синтетической Ribo-T. Рисунок из [3].
Получившимися гибридными рибосомами Ribo-T (от англ. tethered — связанный) (рис. 1) ученые снабдили штаммы бактерий, не нарабатывающие обычных рибосом. Оказалось, что гибриды вполне способны поддерживать жизнь бактерий и синтезировать все необходимые для них белки. Правда, скорость роста бактерий, несущих лишь гибридные рибосомы, была в два раза меньше, чем у бактерий с обычными рибосомами. И даже такой скорости удалось добиться только клеткам с мутацией в гене одного из рибосомных белков и нарушенным синтезом предполагаемого транспортера ионов магния и кобальта. Как и скорость роста, скорость синтеза белков у бактерий, несущих гибридные рибосомы, оказалась в два раза меньше нормальной.
Ученые решили выяснить, почему гибридные рибосомы медленнее синтезируют белок. Оказалось, что рибосомы со скрепленными субъединицами тормозят сразу после распознавания стартового кодона. То есть основная проблема для них — правильная инициация трансляции. Ученые выяснили, что эта проблема не связана с худшим взаимодействием гибридных рибосом с факторами инициации, так как их добавление не компенсировало стартовое торможение. Так что новый вариант рибосом еще предстоит подробнее исследовать и усовершенствовать.
Гибридные рибосомы хоть и не очень быстро, но делали свое дело, так что ученые решили испытать их пригодность к работе в качестве независимой популяции рибосом. Во-первых, рибосомы отдельной популяции можно задействовать для чтения мРНК с необычными стартовыми сигналами. Для этого получили гибридные рибосомы с модифицированным участком, узнающим последовательность Шайна-Дальгарно — стартовую точку посадки бактериальных рибосом на РНК. РНК с измененной последовательностью Шайна-Дальгарно обычные клеточные рибосомы не распознавали, однако ее продукт обнаруживался в цитоплазме клеток, несущих особым образом модифицированные гибридные рибосомы. Значит, синтезом белка на такой матрице занимались только гибридные рибосомы, и трансляцию РНК со специфическими сигналами можно будет исследовать, не влияя на трансляцию остальных мРНК клетки.
Еще ученые получили модификацию гибридных рибосом, зависимую от антибиотика. Такие рибосомы будут работать, если добавить в среду антибиотик, блокирующий обычные рибосомы клетки. Антибиотик в такой системе служит переключателем, определяющим, какой набор рибосом будет активным. Так что клетки можно будет поддерживать либо в природном режиме жизни, либо в условиях, когда всю наработку белка берут на себя синтетические рибосомы. Манипулируя свойствами отдельной популяции рибосом, можно будет узнать о процессе синтеза белка гораздо больше.
Литература
- Рибосома за работой;
- Как избавиться от РНК за несколько минут;
- Orelle C., Carlson E.D., Szal T., Florin T., Jewett M.C., Mankin A.S. (2015). Protein synthesis by ribosomes with tethered subunits. Nature. 524, 119–124;
- Io S.B. and Gy L.O. (2015). Synthetic biology: Ribosomal ties that bind. Nature. 524, 45–46..