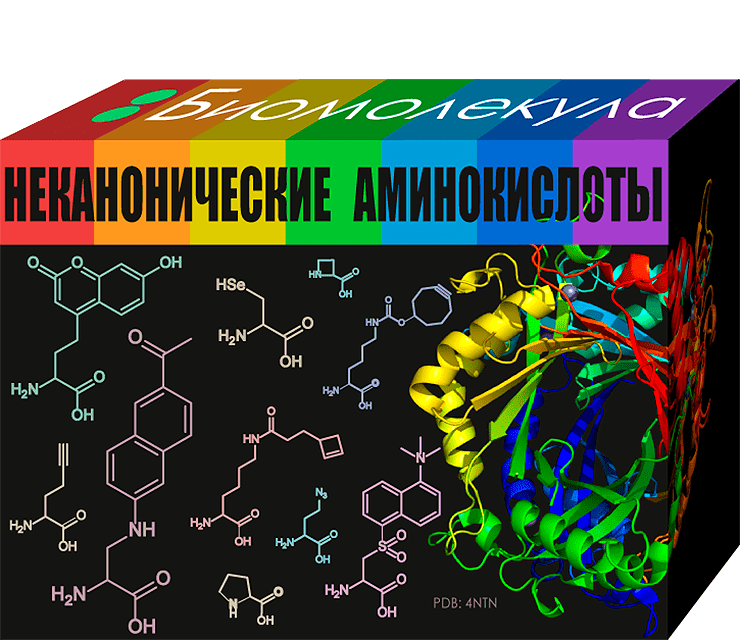
Неканонические аминокислоты. Биомолекулы, о которых не принято говорить
29 октября 2019
Неканонические аминокислоты. Биомолекулы, о которых не принято говорить
- 3356
- 1
- 6
-
Авторы
-
Редакторы
Статья на конкурс «био/мол/текст»: Запомните, дети: белки состоят из 20 аминокислот! Этот факт нам постоянно твердят учебники по молекулярной биологии. Но всё не так просто. Их правда 20 (а бывает и 21 или 22), но кого волнует, что там в скобках: если это в скобках, значит — можно не учить? Благодаря такой навязчивости и постоянному упоминанию 20 штук и правда может показаться, что в конструкторе под названием «живой организм» имеется лишь 20 различных кубиков для построения белков. Это, конечно, немало. Но ведь сколько бы конструкторов не было куплено и сколько бы построек из них не было собрано, всё равно на прилавках привлекают взор новые наборы с эксклюзивными детальками! Предлагаю ознакомиться с ассортиментом.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Инструкция
Понимаю, что большинство читает инструкции, только когда что-то сломалось. Тем не менее собрать белок намного сложнее, чем шкаф из «Икеи», да и последствия неправильной сборки весомее. Поэтому рекомендую ознакомиться с кратким экскурсом в процесс синтеза белка в статье «Рибосома за работой» [1] или в любом учебнике по биохимии, например «Наглядной биохимии» Кольмана и Рёма.
Наборы «Юный натуралист»
Знаменитые 20 аминокислот называют каноническими: из этих деталей состоит практически любой белок. Они встраиваются в цепь согласно установленному плану по синтезу белка, который записан в генетическом коде. Несмотря на то, что число возможных комбинаций аминокислот и так невообразимо велико, природа ими не ограничивается. Среди природных аминокислот эксклюзивными детальками являются селеноцистеин и пирролизин, загадочные №21 и №22. Стоит отметить, что хотя включение данных аминокислот в белок заранее планируется клеткой, их всё равно относят к неканоническим.
Селеноцистеин (или проще — Sec) похож на одну из 20 канонических аминокислот — цистеин. Как можно было догадаться по его названию, Sec содержит селен вместо серы. Sec встречается у разных организмов: от бактерий до человека, и в некоторых из них он используется как строительный блок для селенопротеинов. Обычно Sec находится в активном центре белка, а добавляется — в самом конце его синтеза. Для этого действия клетке надо добыть особое оборудование со специфическими ферментами и РНК, а потом потратить много сил на его установку. Чего ради? Основная функция таких белков — переработка селена на благо организму [2]. Этот элемент поступает в нас с морепродуктами, мясом, крупами, и постоянное поддержание его уровня в организме необходимо для нормальной жизнедеятельности [3]. Так, селенопротеины участвуют в восстановлении смертельно опасной для жизни клетки перекиси. И всё благодаря щедрому селену, который охотно отдает свои электроны на это дело. Еще селенопротеины регулируют активность гормонов щитовидной железы, нехватка которых приводит к кретинизму [4].

Рисунок 1. На коробке изображен белок GPX4, в котором один из остатков цистеина замещен на селеноцистеин. Gpx4 катализирует восстановление перекиси и участвует в защите клеток от окислительного стресса.
Фундаментальные вопросы по поводу функций селенопротеинов еще остаются открытыми: почему некоторые организмы страдают от их нехватки [5], а другие — нет? Ранее считалось, что у всех грибов функция Sec была утеряна в процессе эволюции. Однако в 2019 году ученым всё же удалось обнаружить селенопротеины у нескольких из них. Благодаря этой находке в скором времени удастся выяснить, почему одни грибы спокойно живут без Sec, а другие его сохранили [6].
Более необычной деталью, демонстрирующей многообразие природных белков, является селенометионин (SeMet). По аналогии с селеноцистеином, SeMet — это метионин, где сера замещена на селен. Это первая аминокислота, которую удалось искусственно вставить в белок. В отличие от селенопротеинов, SeMet-содержащие белки образуются случайным включением SeMet вместо Met. А вообще, для роста клеток она необязательна и, скорее всего, нужна для утилизации селена [7].
Пирролизин (Pyl) — это еще одна аминокислота, о которой редко вспоминают. Скорее всего, потому что Pyl не синтезируется в клетках человека. Однако она может условно там присутствовать! Как так? Всё просто — эта аминокислота есть у кишечных бактерий Bilophila wadsworthia, представляющих собой первого известного человеческого симбионта, имеющего Pyl [8]. Но не стоит пытаться повышать свое аминокислотное разнообразие: это патогенные бактерии, ведущие к нарушению обмена веществ и последующему ожирению [9]. Естественное место нахождения Pyl — бактерии и археи-метаногены (образующие метан), где она получается из двух молекул канонической аминокислоты лизина (см. на упаковке). Особенности строения пирролизина как раз и используются данными организмами в процессе синтеза метана [10].
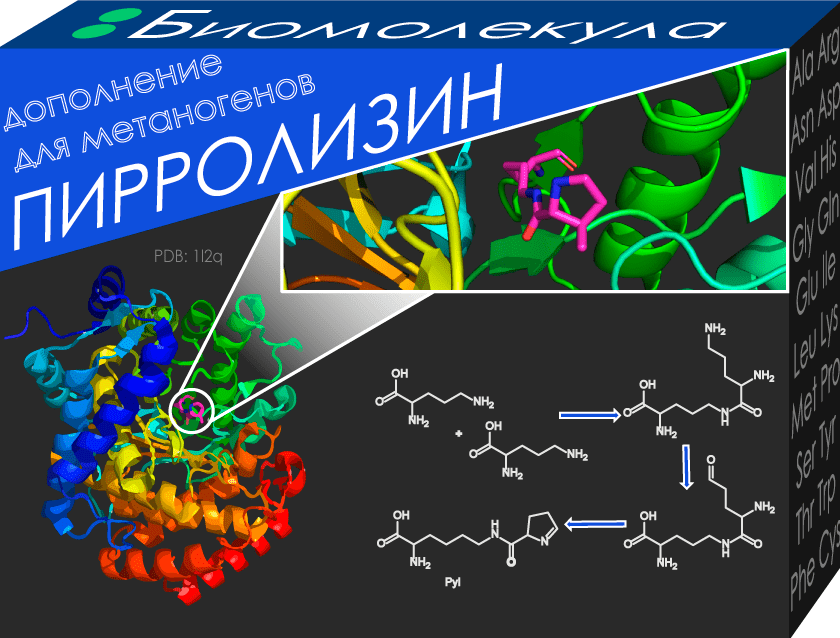
Рисунок 2. Здесь представлен MtmB, участвующий в метаногенезе за счет пирролизина
Наборы «Токсины»
В природе существуют сотни непротеиногенных (не образующих белки) аминокислот, которые могут проникнуть в организм, имитировать родные аминокислоты и бесцеремонно встроиться в белок. Некоторые растения используют этот метод для защиты от хищников и угнетения конкурентов. Например, аминокислота канаванин (Can), встречающаяся у некоторых бобовых, заменяет аргинин в белках личинок хищников, позарившихся на горох [11]. А мета-тирозин в овсяной траве препятствует развитию корней у конкурирующих растений, замещая фенилаланин в их белках [12]. Обман удается за счет структурного сходства непротеиногенных аминокислот с белковыми.
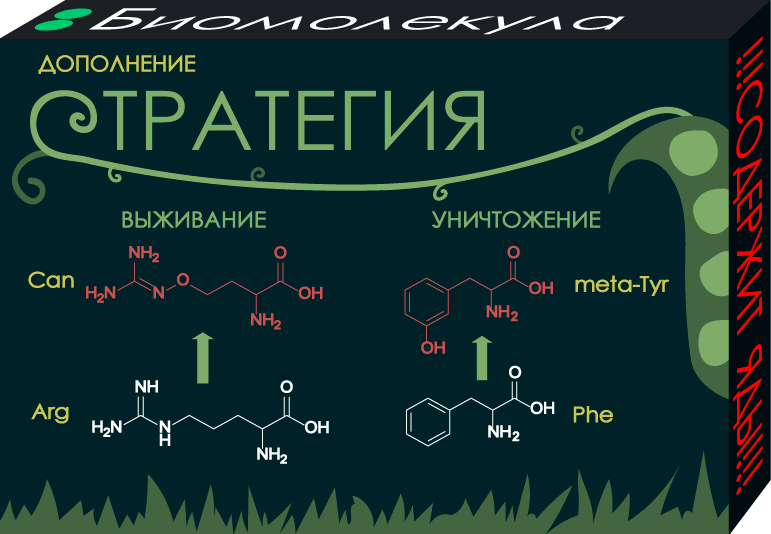
Рисунок 3. Канаванин и мета-тирозин как стратегические ресурсы растений
Аминокислота азетидин-2-карбоновая кислота (Aze) содержится в сахарной свекле (Beta vulgaris), ландышах (Convallaria majalis) и является структурным аналогом кодируемой белком аминокислоты пролина (Pro). Было обнаружено, что если в клетках человека есть Aze, то примерно 13,8% Pro замещается на нее [13]. Сахарная свекла редко употребляется в количествах, которые могут вызывать опасения по поводу воздействия Aze. Тем не менее ежегодно во всем мире выращивается более 250 миллионов тонн этого корнеплода в год. Из свеклы получают сахар, а побочные продукты используются в качестве корма для скота. Это значит, что люди потенциально могут подвергаться воздействию Aze в результате ее накопления в молочных и мясных продуктах [14].
Aze включается в богатый пролином основной миелиновый белок, окружающий отростки нервных клеток. Данный процесс может вызвать нейродегенеративные расстройства: разрушение миелинового слоя снижает скорость передачи нервных импульсов и разные органы перестают получать сигналы из головного мозга. Актуальность проблемы подчеркивает тот факт, что распространение рассеянного склероза коррелирует с регионами переработки сахарной свеклы [14].

Рисунок 4. Именно на мальтозосвязывающем белке (MBP) доказали, что Aze встраивается вместо Pro
Aze — не единственная аминокислота, внедрение которой в белки потенциально приводит к неврологическим заболеваниям.
Аминокислота β-метиламин-аланин (BMAA) вовлечена в сложное неврологическое расстройство, впервые обнаруженное на острове Гуам в южной части Тихого океана. У жителей острова массово развивались признаки бокового амиотрофического склероза, болезни Паркинсона и деменции в совокупности. При этом люди из соседнего племени на острове Сайпан не знали горя. Оказалось, что эпидемия связана с употреблением муки из семян саговника (пальма такая), содержащей BMAA. Одним из механизмов поражения людей этой аминокислотой является замена в белках серина и аланина, приводящая к их неправильному сворачиванию [15]. Однако ставится под сомнение, что именно неправильное включение BMAA происходит всегда и является причиной развития заболевания [16]. Так что, возможно, это Ктулху.
Наборы «Неестественные аминокислоты»
Подсмотрев за природой, человеку захотелось самостоятельно встраивать аминокислоты в белки для различных целей, в первую очередь, для научной. Знание того, где находится белок и для чего он нужен, необходимо не только для удовлетворения интереса, но и для разработки лекарств. Обо всем по порядку.
Первый вопрос — как можно с помощью встраивания неестественной аминокислоты в белок узнать его местонахождение?
Идея проста: нужно вставить в белок аминокислоту-маячок, который потом можно отследить с помощью детектора и сказать, где находится интересующий белок. Вначале в качестве таких маячков пытались вводить аминокислоты с флуоресцентными метками. Этот подход оказался малоэффективным из-за необычно громоздких флуоресцентных молекул, которые встраивались очень неохотно и светились слабовато. Альтернативой методу послужило введение аминокислоты, которая реагировала с меченым веществом уже после синтеза белка. Несмотря на то, что технология еще сыровата из-за не всегда безопасных для организма условий проведения реакции, она имеет потенциальное клиническое применение. Уже были сделаны попытки введения в организм мыши антител с радиоактивно мечеными аминокислотами для того, чтобы обнаружить позитронно-эмиссионной томографией опухоли со специфическими белками [17].
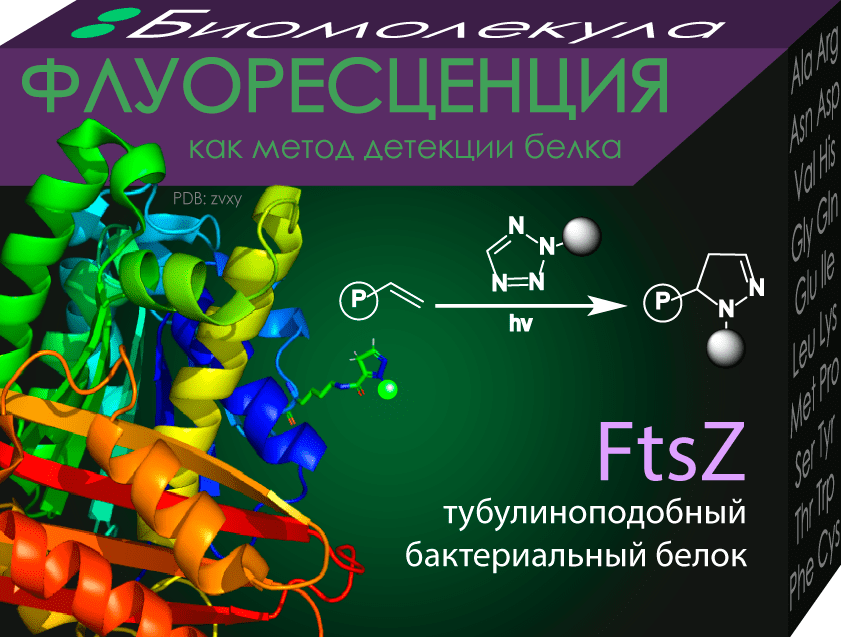
Рисунок 5. Отслеживание белка FtsZ в бактериях с использованием фотоклик-реакции («фото» значит, что она активируется ультрафиолетом, а «клик» — что проходит быстро, с высоким выходом и в физиологических условиях). FtsZ необходим бактериям для деления, его ингибиторы являются перспективными антибиотиками [18].
Как понять, зачем конкретный белок нужен в клетке?
У каждого белка есть часть, отвечающее за его рабочий день — активный центр. Если сделать так, чтобы в активный центр при синтезе белка попала аминокислота, умеющая регулировать его «сон» или «бодрствование», можно было бы посмотреть на его вклад в общее дело клетки. Химикам удалось разработать аминокислоты, которые могут активировать или подавлять белок при обычном облучении.
Активирующая белок аминокислота имеет объемную фотолабильную группу. Фотолабильная она потому, что при действии света разрывается на части с образованием привычной для белка природной аминокислоты. Белку уже ничего не мешает, и он выходит на работу [19].
Подавляющая активность белка аминокислота называется фотосшивающей. Она маленькая и не особо мешает работе белка, но при облучении реагирует с соседней природной аминокислотой, меняя конформацию активного центра. Это приводит к отключению белка [19].
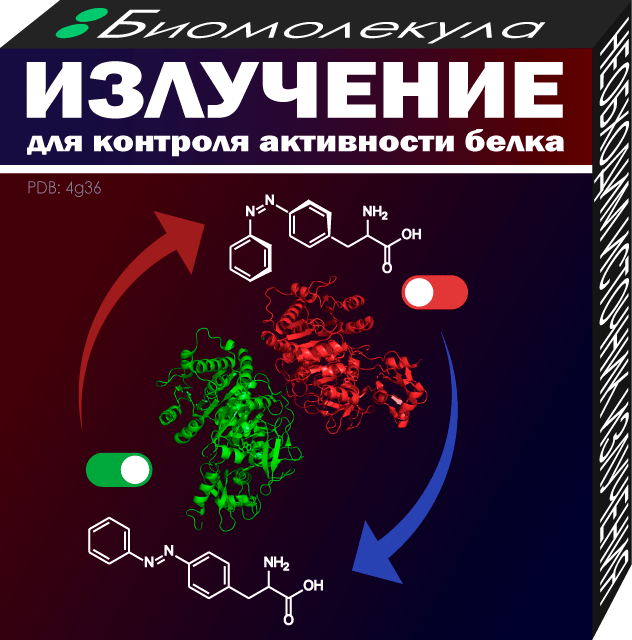
Рисунок 6. Кроме фотолабильных и фотосшивающих аминокислот существуют фотопереключаемые, геометрия которых зависит от длины волны света и влияет на активность белка [20]
Где это применяется?
Все обсуждаемые ранее манипуляции с белками происходили исключительно в клетках. Ученые, которым уж очень не терпелось самим поиграть в конструктор, разработали систему бесклеточной сборки белков. Подход оказался более гибким: больше не нужно было заморачиваться по поводу токсичности используемых реагентов, а значит, можно вставлять какие угодно аминокислоты. Эта технология сейчас используется для синтеза неестественных белков, привлекающих внимание в области биомедицины. Например, комплекс «антитело — лекарственное средство», сконструированный с помощью системы бесклеточной сборки белков, оказался эффективным против нескольких видов рака [21]. Также имеются случаи включения неестественных аминокислот для повышения чувствительности белка к молекулам, отключающим его функции, что весьма привлекательно для области разработки лекарств [22].
В качестве вывода
20 канонических аминокислот сами по себе уже не могут удовлетворить растущие потребности фундаментальной и прикладной наук. Сегодня в литературе встречается около 800 природных и несколько тысяч синтетических аминокислот, количество которых стремительно растет [23]. Поэтому не нужно ограничивать себя представленными выше наборами, ведь на складе знаний припасено еще много интересного!
Литература
- Рибосома за работой;
- Rachel L. Schmidt, Miljan Simonović. (2012). Synthesis and decoding of selenocysteine and human health. Croat Med J. 53, 535-550;
- Selenium. (2019). National Institutes of Health;
- Vyacheslav M. Labunskyy, Dolph L. Hatfield, Vadim N. Gladyshev. (2014). Selenoproteins: Molecular Pathways and Physiological Roles. Physiological Reviews. 94, 739-777;
- Ulrich Schweizer, Noelia Fradejas-Villar. (2016). Why 21? The significance of selenoproteins for human health revealed by inborn errors of metabolism. The FASEB Journal. 30, 3669-3681;
- Marco Mariotti, Gustavo Salinas, Toni Gabaldón, Vadim N. Gladyshev. (2019). Utilization of selenocysteine in early-branching fungal phyla. Nat Microbiol. 4, 759-765;
- Toshihiko Kitajima, Yasunori Chiba. (2013). Selenomethionine metabolism and its toxicity in yeast. BioMolecular Concepts. 4;
- Marsha A Gaston, Ruisheng Jiang, Joseph A Krzycki. (2011). Functional context, biosynthesis, and genetic encoding of pyrrolysine. Current Opinion in Microbiology. 14, 342-349;
- Jane M. Natividad, Bruno Lamas, Hang Phuong Pham, Marie-Laure Michel, Dominique Rainteau, et. al.. (2018). Bilophila wadsworthia aggravates high fat diet induced metabolic dysfunctions in mice. Nat Commun. 9;
- Michael Rother, Joseph A. Krzycki. (2010). Selenocysteine, Pyrrolysine, and the Unique Energy Metabolism of Methanogenic Archaea. Archaea. 2010, 1-14;
- Emanuel G. Worst, Matthias P. Exner, Alessandro De Simone, Marc Schenkelberger, Vincent Noireaux, et. al.. (2015). Cell-free expression with the toxic amino acid canavanine. Bioorganic & Medicinal Chemistry Letters. 25, 3658-3660;
- C. Bertin, L. A. Weston, T. Huang, G. Jander, T. Owens, et. al.. (2007). Grass roots chemistry: meta-Tyrosine, an herbicidal nonprotein amino acid. Proceedings of the National Academy of Sciences. 104, 16964-16969;
- Youngzee Song, Huihao Zhou, My-Nuong Vo, Yi Shi, Mir Hussain Nawaz, et. al.. (2017). Double mimicry evades tRNA synthetase editing by toxic vegetable-sourced non-proteinogenic amino acid. Nat Commun. 8;
- Kate Samardzic, Kenneth J. Rodgers. (2019). Cell death and mitochondrial dysfunction induced by the dietary non-proteinogenic amino acid l-azetidine-2-carboxylic acid (Aze). Amino Acids. 51, 1221-1232;
- A. A. Popova, O. A. Koksharova. (2016). Neurotoxic non-proteinogenic amino acid β-N-methylamino-L-alanine and its role in biological systems. Biochemistry Moscow. 81, 794-805;
- R. van Onselen, L. Venables, M. van de Venter, T. G. Downing. (2018). β-N-Methylamino-L-Alanine Toxicity in PC12: Excitotoxicity vs. Misincorporation. Neurotox Res. 33, 15-23;
- Lee K.J., Kang D., Park H.S. (2019). Site-specific labeling of proteins using unnatural amino acids. Mol. Cells. 42, 386–396;
- Fahui Li, Hua Zhang, Yun Sun, Yanchao Pan, Juanzuo Zhou, Jiangyun Wang. (2013). Expanding the Genetic Code for Photoclick Chemistry inE. coli, Mammalian Cells, andA. thaliana. Angew. Chem. Int. Ed.. 52, 9700-9704;
- Alexander R. Nödling, Luke A. Spear, Thomas L. Williams, Louis Y.P. Luk, Yu-Hsuan Tsai. (2019). Using genetically incorporated unnatural amino acids to control protein functions in mammalian cells. Essays Biochem.. 63, 237-266;
- Ji Luo, Subhas Samanta, Marino Convertino, Nikolay V. Dokholyan, Alexander Deiters. (2018). Reversible and Tunable Photoswitching of Protein Function through Genetic Encoding of Azobenzene Amino Acids in Mammalian Cells. ChemBioChem. 19, 2178-2185;
- Nicolas V. Currier, Shelley E. Ackerman, James R. Kintzing, Rishard Chen, Maria Filsinger Interrante, et. al.. (2016). Targeted Drug Delivery with an Integrin-Binding Knottin–Fc–MMAF Conjugate Produced by Cell-Free Protein Synthesis. Mol Cancer Ther. 15, 1291-1300;
- Wei Gao, Eunhee Cho, Yingying Liu, Yuan Lu. (2019). Advances and Challenges in Cell-Free Incorporation of Unnatural Amino Acids Into Proteins. Front. Pharmacol.. 10;
- Tanja Narancic, Sarah A. Almahboub, Kevin E. O’Connor. (2019). Unnatural amino acids: production and biotechnological potential. World J Microbiol Biotechnol. 35.