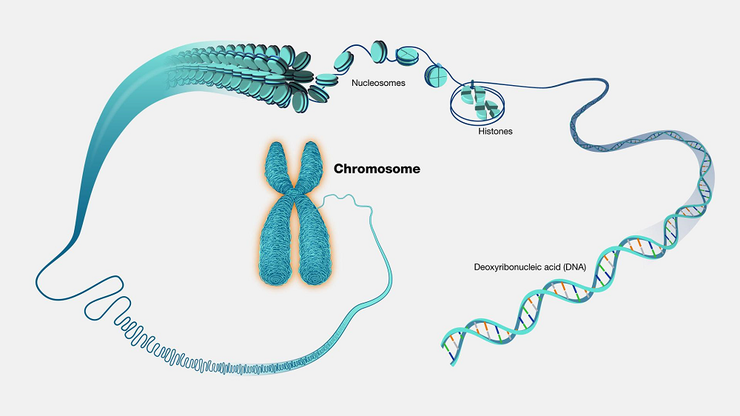
От хромосом к молекулам: молекулярная цитогенетика
17 марта 2023
От хромосом к молекулам: молекулярная цитогенетика
- 2590
- 0
- 6
Как известно, клетки человека имеют ядро, а в нем находятся хромосомы — сложные молекулярные комплексы из ДНК и белков. При этом ДНК, выделенную из клеток, часто тестируют в научных и диагностических целях, что сегодня мало кого удивляет. Гены входят в состав «главной молекулы жизни», а значит, изучая ее, мы можем многое узнать о наследственности как в норме, так и за ее пределами. Но не все задумываются, что и исследования целых хромосом могут дать немало — это до сих пор надежный инструмент обнаружения некоторых отклонений.
Рисунок в полном размере.
-
Автор
-
Редакторы
Бурное развитие генетики и молекулярной биологии в XX веке заложило основы изучения генов на уровне молекул, что сегодня зачастую важнее клеточных исследований, особенно когда речь идет о клинической диагностике, ─ ведь многие молекулярно-генетические методы имеют завидную прогностическую силу. Например, полногеномное секвенирование дает наибольшую информацию при изучении генов и постепенно становится своего рода «мейнстримом», о чем неоднократно уже упоминалось на «Биомолекуле». В то же время, изучающая изменения генома на микрохромосомном уровне цитогенетика (а ей уж более полувека) ─ также по-прежнему актуальна, и на то есть веские причины. Обсудим их в статье, а заодно разберем, какую роль классическая и молекулярная цитогенетика играют в современных клиниках.
Как все начиналось?
История классической цитологии (исследований клетки) восходит к 17–18 векам, когда активное развитие оптики позволило наблюдать в микроскоп крошечные биологические частицы разного типа, в том числе клетки млекопитающих и человека. Позднее привлекли внимание хромосомы (рис. 1) — в 19 веке; а еще позже, в веке 20-м, — их уже рассматривали в качестве носителей наследственности.

Рисунок 1. Хромосомы — сложные молекулярные комплексы ядра клетки, состоящие из ДНК и белков. В 1960 году на Международной научной конференции в американском городе Денвер они были распределены по группам на основе морфологии. Слева — женский кариотип (полный набор хромосом), справа — мужской. Группы парных аутосом (неполовых хромосом) обозначены порядковыми номерами от 1 до 22, половым хромосомам присвоены обозначения X и Y.
«Познайка»
Немалая заслуга всех этих открытий принадлежит труду конкретных ученых: микроскопия развилась во многом благодаря Роберту Гуку и Антонию Ван Левенгуку (см. «12 методов в картинках: микроскопия» [1]), а идея генетической роли хромосом была сформулирована немецким биологом Теодором Бовери (см. «100 лет хромосомной теории наследственности (1915–2015)» [2]).
Цитогенетика: как изучают хромосомы сегодня?
Хромосомы можно увидеть в самый обычный световой микроскоп на определенных фазах клеточного цикла (таких как метафаза ), а также наблюдать в них изменения, вызванные мутациями (хромосомные мутации еще известны как «аберрации»).
В метафазе митотического деления хромосомы имеют четкую структуру «как из учебника»: они похожи на «крестики» с перетяжками по центру (рис. 1), и потому отклонения в них легче идентифицировать.
Классическая клиническая цитогенетика как раз изучает взаимосвязь хромосомных аберраций с заболеваниями человека, а молекулярная цитогенетика для тех же целей применяет не только рутинные цитогенетические техники, но и некоторые подходы молекулярной биологии (зачастую сочетая их между собой).
Например, препараты хромосом можно приготовить, окрасить, затем рассмотреть их под световым микроскопом для поиска хромосомных аберраций, связанных с патологиями, — это классическая цитогенетика и есть. Но можно сделать немного по-другому: на тех же препаратах соединить участок хромосомы с зондом — с особой однонитевой ДНК, имеющей флуоресцентную метку. В этом случае видеть отклонение (или его отсутствие) поможет контрастно светящийся сигнал (рис. 2, рис. 6, рис. 7), и здесь уже мы говорим о применении цитогенетики молекулярной (все подробности ниже).
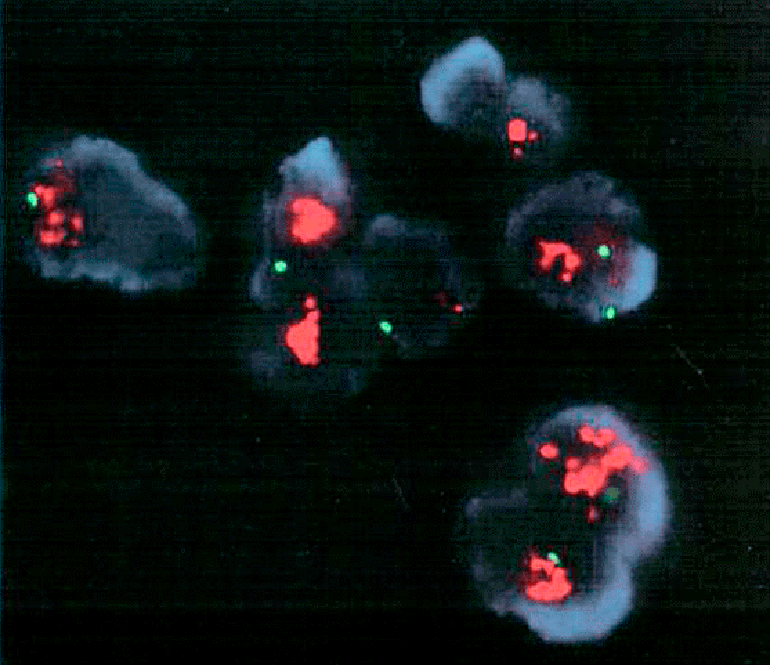
Рисунок 2. Методами молекулярной цитогенетики можно выявить изменения, связанные с раком. На фото хромосомы в интерфазе без ярко выраженной компактной формы (в отличие от метафазы), представляя деконденсированный (т.е. разрыхленный) хроматин. Здесь же her2 (увеличенное число этого гена — показатель агрессивной формы рака молочной железы) соединен с ДНК-зондом оранжевого сигнала флуоресценции, а центромера хромосомы 17 ─ с зондом зеленого сигнала (это стандарт для сравнения). Если оранжевый сигнал более чем вдвое превышает зеленый (как здесь), — можно говорить о повышенном количестве копий her2.
Методология, или как все это в цитогенетике работает?
Выделенные из организма клетки подготавливают для получения препаратов фиксированных хромосом, а для этого в качестве источника подходят клетки периферической крови, буккальный соскоб (мазок клеток эпителия внутренней стороны щеки), ворсинки хориона (в т.ч. ворсинчатой части плаценты), амниотическая жидкость и пр. [3].
Обычно после отбора клетки размножают в питательной среде, стимулирующей деление (например, можно добавить фитогеммаглютинин), но застопоривающей его в метафазе митоза (а для этого добавляют клеточный яд колхицин, разрушающий митотическое веретено деления) [4]. После окончания культивирования клетки с питательной средой обрабатывают гипотоническим раствором, разобщающим (т.е. отделяющим друг от друга) хромосомы. Далее препарат фиксируют и раскапывают на предметные стекла таким образом, чтобы все хромосомы метафазной пластинки лежали раздельно. Последний этап — окрашивание, и тут есть свои особенности в зависимости от исследовательских целей [5].
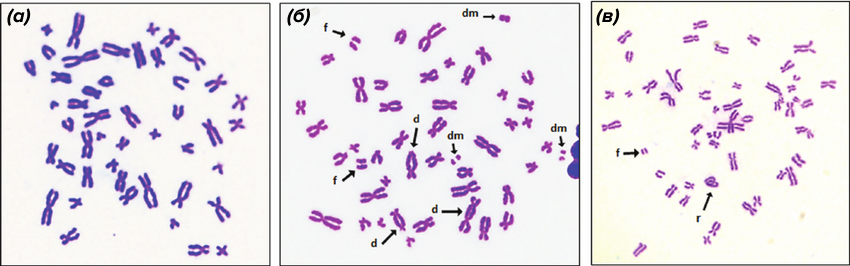
Рисунок 3. Метафазные пластинки, полученные из культуры клеток крови человека, визуализированные с помощью рутинного окрашивания. (а) — контроль — нормальный хромосомный набор без изменений. (б) и (в) — метафазные пластинки, полученные из цельной крови после облучения гамма-лучами в дозе 4 Гр. Видны специфичные для воздействия радиации маркеры: d = дицентрики; f = ацентрические фрагменты; dm = двойные минуты (парные фрагменты); r = центромерное кольцо (кольцевая хромосома).
Зачастую хромосомы сплошняком прокрашивают по всей длине красителем Романовского—Гимзы (известным также как азур-эозин) — это «рутинное» окрашивание (рис. 3) [6]. После этого все хромосомы окрашены одинаково, из-за чего сходные по размеру и морфологии «экземпляры» трудно отличить, а значит, и идентифицировать. Поэтому такой способ обычно используют для исследований, не требующих изучения всех хромосом набора — например, при выявлении хромосомных перестроек, ассоциированных с мутагенным облучением (см. врезку).
В цитогенетике хромосомы также делают видимыми в световой микроскоп дифференциальным окрашиванием, методики которого различны (Q-, G-, C-бендинг, и др.), но суть сводится к визуализации в них определенных паттернов. Например, при G-бендинге (рис. 5) перед окраской азур-эозином препараты в течение 5–10 минут обрабатывают трипсином, в результате чего после окрашивания на них проявляется специфичный для каждой рисунок поперечной исчерченности («полосатости»).
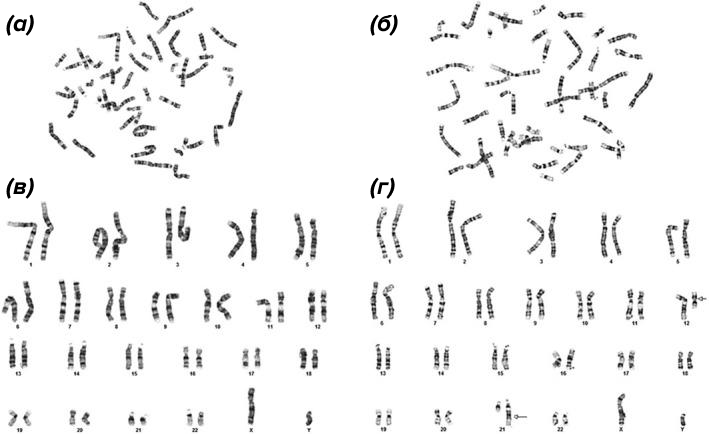
Рисунок 5. G-бэндинг — одна из методик дифференциального окрашивания. Поскольку паттерны полос каждой отдельной хромосомы хорошо известны, они здесь служат «инструментом измерения» для сравнения и сличения, выявления дополнительных или отсутствующих фрагментов.
Так как расположение светлых и темных полос для каждой хромосомы строго индивидуально, G-бэндинг позволяет идентифицировать их все, а значит, проводить анализ всего хромосомного набора клетки (т.е. осуществлять кариотипирование). Это находит применение в онкогематологии (выявлении маркеров хронического лимфолейкоза), в диагностике причин наследственной хромосомной патологии, для определения причин потери беременности (в том числе, связанной с пороками развития или гибелью плода) и в меньшей степени — при оценке воздействия мутагенных факторов (см. врезку выше).
Молекулярная цитогенетика: уже ближе к ДНК
Основным преимуществом кариотипирования является возможность оценить численные изменения хромосом и структурные аномалии генома (хромосомные перестройки) в одном тесте. Минус в том, что оно может пропустить тонкие хромосомные аномалии, размеры которых меньше предела разрешения светового микроскопа.
Из-за таких ограничений цитогенетический анализ подходит не для всех случаев. Преодолеть некоторые его недостатки может молекулярная цитогенетика.
Диагностика на уровне молекул: в чем плюсы?
Молекулярная цитогенетика, включая современные технологии молекулярной биологии, зачастую позволяет обнаруживать изменения в геноме с большей чувствительностью. Это означает, что можно выявить субмикроскопические хромосомные аномалии, которые с помощью стандартного цитогенетического анализа не диагностируются.
К молекулярной цитогенетике относят:
- Метод флуоресцентной in situ-гибридизации (FISH-метод).
- Хромосомный микроматричный анализ (ХМА).
FISH — это не только лишь рыба!
Методологически подавляющее большинство методов молекулярной цитогенетики (FISH и ХМА — не исключение) основано на гибридизации — это специфическое связывание генетических последовательностей исследуемого материала с комплементарными пробами (или зондами) — специальным образом сконструированными однонитевыми ДНК.
Для этого материал с исследуемой ДНК сначала обрабатывают специальными реагентами, чтобы облегчить доступ к молекуле нуклеиновой кислоты. Затем добавляют пробу (зонд) и нагревают до 70–80 oC для расплавления ДНК (ее денатурации — разрыва водородных связей между двумя комплементарными цепочками, благодаря чему они расплетаются).
Затем препарат выдерживают несколько часов при определенной температуре (обычно 37 oC), чтобы исследуемый участок генома накрепко связался с комплементарным ему флуоресцентным ДНК-зондом (это и есть гибридизация). После этого проводят ряд отмывок, наносят контрастный краситель, и вуаля!
То, что получилось, готово к наблюдению во флуоресцентный микроскоп (рис. 6), где сквозь специальные фильтры можно увидеть цветное свечение меченых хромосом (или их участков), по которому судят о наличии или отсутствии хромосомных изменений.

Рисунок 6. Методом FISH можно обнаруживать транслокации (переносы участков с одной хромосомы на другую). Некоторые такие изменения в геноме ассоциированы с гемобластозами (онкологическими заболеваниями крови), и их выявление помогает в диагностике таких болезней. К примеру, на этом рисунке филадельфийская хромосома — симметричная (сбалансированная) транслокация, ассоциированная с хроническим миелоидным лейкозом (ХМЛ). Эта хромосома образуется за счет переноса участка хромосомы 9 с геном abl на хромосому 22 с геном bcr. Слияние этих участков и их генов приводит к филадельфийской хромосоме с мутантным онкогеном bcr-abl (слитый сигнал в центре рисунка под белой стрелочкой), вызывающим ХМЛ.
Для чего все это нужно?
Одно из основных преимуществ FISH-исследований, в сравнении с цитогенетическим анализом, заключается в том, что их можно проводить на неделящихся (интерфазных) клетках (рис. 2). При этом можно использовать не только свежеприготовленные препараты, но и уже готовые, имеющиеся в лаборатории (тканевые, клеточные или те же препараты фиксированных хромосом). Это зачастую упрощает и ускоряет анализ (ведь несколько суток на культивирование есть не всегда, в то время как подготовленные образцы зачастую уже в наличии ).
Да и приготовить препараты, для которых культивирование без надобности (например, гистологические срезы), тоже иногда можно быстрее.
Что касается возможностей FISH, то он может, например, выявить делеции (утрата сегмента хромосомы), транслокации (перемещение участка хромосомы с одной на другую), инверсии (поворот сегмента хромосомы на 180o), дупликации (удвоение сегмента хромосомы) и некоторые другие геномные аномалии [3].
Все это находит применение в разных клинических случаях — для выявления гемобластозов (рис. 6); для определения амплифицированных онкогенов, вызывающих злокачественные сóлидные опухоли (см. рис. 2); как метод диагностики наследственных хромосомных аномалий (рис. 7); и при некоторых других показаниях [4].
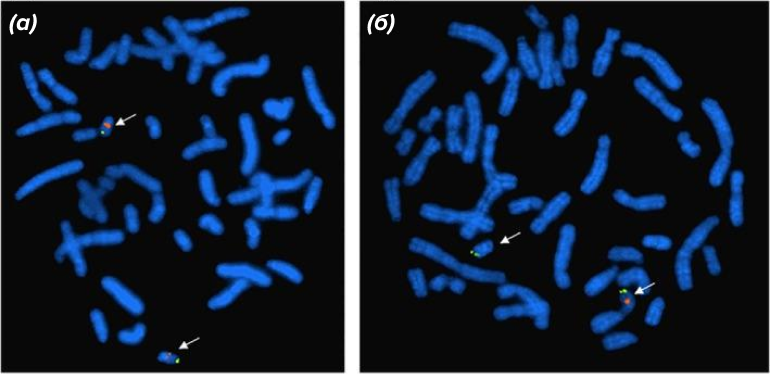
Рисунок 7. Методом FISH можно идентифицировать хромосомное нарушение, приводящее к синдрому Ди Джорджи. Это заболевание вызвано микроделецией на длинном плече хромосомы 22. На этом рисунке каждая из пары таких гомологичных хромосом гибридизована с двумя зондами: на центромере и на локусе длинного плеча. Слева — норма: все четыре сигнала флуоресценции (по два на каждую хромосому) на месте. Справа наблюдается один оранжевый и два зеленых сигнала, что говорит об отсутствии (делеции) у одной из этих хромосом длинного плеча — это и указывает на синдром Ди Джорджи.
Одно из важных применений — ретроспективная биодозиметрия: по возникающим при радиационном воздействии транслокациям можно оценивать повреждения организма даже спустя годы после облучения, так как такие хромосомные обмены стабильны (FISH дает возможность их идентификации в лимфоцитах, подсчета и реконструкции поглощенной дозы на основе их количества [18], см. врезку выше).
Несмотря на относительную широту возможностей и показаний, недостаток FISH-метода — точечность и специфичность, ведь «добываемая» им информация ограничена участком, с которым реагирует (гибридизируется) соответствующий зонд. Поэтому иногда перед его использованием полезно определить наличие отклонения в определенной области генома другим методом (например, тем же ХМА), а затем уже применить FISH для уточнения структуры изучаемой сложной хромосомной перестройки [3].
Хромосомный микроматричный анализ (ХМА)
В то время как другие цитогенетические методы обнаруживают лишь серьезные изменения числа или структуры хромосом, ХМА опускается на уровень ДНК, позволяя видеть в ней субмикроскопические изменения. Этот мощный диагностический инструмент использует амплификацию всего генома; обильно полученные фрагменты затем гибридизируют с метками или зондами , закрепленными на твердой матрице из кремния или стекла (собственно микрочипе). Такое специфическое связывание позволяет визуализировать множество функционально значимых участков генома и выявлять до нескольких сотен затрагивающих их изменений (рис. 8), — так что этот метод имеет более высокое разрешение, в сравнении с обычной цитогенетикой и FISH-методом.
Закрепляемые на чипе последовательности ДНК недлинные и соответствуют известным локациям на каждой из 46 хромосом набора. Это дает возможность обнаруживать хромосомные изменения и позволяет отнести данный метод к цитогенетическим.

Рисунок 8. Схематическое изображение этапов ХМА.
Этапы ХМА:
- пробоподготовка образцов анализируемой и референсной (эталонной) ДНК;
- амплификация ДНК в подготовленных образцах;
- мечение амплифицированных образцов специфичными зондами с флуоресценцией;
- гибридизация ДНК полученных проб с комплементарными последовательностями, нанесенными на микрочип;
- детекция и анализ данных с чипа на соответствующем оборудовании и программном обеспечении.
Диагностику на базе ХМА рекомендуют при подозрениях на:
- задержку развития;
- умственную отсталость;
- расстройства аутистического спектра;
- множественные врожденные пороки развития.
Диагностические возможности
ХМА позволяет выявить почти любые численные и структурные несбалансированные изменения хромосом в рамках его разрешающей способности:
- Анеуплоидии [19] — изменения числа одной или нескольких хромосом по сравнению с нормой.
- Полиплоидии — кратное увеличение количества всех хромосом.
- Делеции и дупликации.
- Несбалансированные транслокации — потеря фрагментов одной хромосомы или увеличение участка другой .
- Однородительские дисомии — когда человек получает по две копии какой-либо хромосомы (или ее части) от одного родителя (а не от двух), а также участки потери гетерозиготности .
- Мозаицизм [20], [21] — присутствие в одном организме клеток с разным набором хромосом (на уровне более 25%).
В отличие от сбалансированных (симметричных, реципрокных) транслокаций, которые может выявить FISH (рис. 6), при несбалансированных транслокациях обмен хромосомным материалом неравный, что приводит к дополнительным или отсутствующим генам.
Это когда теряется одна копия всего гена и окружающего его хромосомного региона. Так как диплоидные клетки имеют по две копии генов (по одной от каждого родителя), другая копия утерянного гена остается.
Так что же для диагностики лучше?
Выбор методов диагностики пока что зависит от конкретного случая и очень индивидуален. На пятки описанным в статье клиническим методикам вовсю наступают еще и методики генетики молекулярной, зачастую имеющие более высокое разрешение (например, полногеномное секвенирование) и уже используемые в некоторых исследовательских центрах. Однозначно, их применение будет расширяться, но вот вытеснят ли они полностью более рутинные (хорошо зарекомендовавшие себя) методы ─ вопрос пока еще дискуссионный. Дело в том, что исследовать весь геном нужно далеко не всегда, а значит, повышение «диагностического потенциала» хоть и является хорошей «заявкой на победу», ─ но это еще далеко не все.
Некоторые цитогенетические методики сумели зарекомендовать себя как «золотой стандарт» для отдельных показаний вовсе не из-за того, что умеют «видеть больше», а просто потому что видят именно то, что нужно, и не требуют особых условий. Они несложны в исполнении (не требуют высококвалифицированного персонала), быстрые, дешевые и высокоспецифичные (надежно обнаруживают именно то, что исследуется, и ничего лишнего). Кроме того, постоянное улучшение этих «зрелых» технологий еще и постепенно выводит их на новый уровень.
Например, автоматизация анализа цитогенетических препаратов значительно улучшила эффективность работы многих лабораторий, а технология ХМА ─ объединяя тысячи нуклеотидов на одном чипе и используя компьютерную обработку для их «обратной сборки в хромосомы», ─ фактически стирает грань между молекулярной генетикой и цитогенетикой. Также на подходе приложения, способные обойти и ограничение дифракционного предела [22], что поможет расширить применение клинически значимых методов флуоресцентной микроскопии (опять же, подняв их возможности до уровня анализа изменений в отдельных молекулах).
Так или иначе — наука не стоит на месте, и ландшафт используемых диагностических методик будет меняться к лучшему.
Первоначальная версия этой статьи опубликована на сайте компании Genetiko.
Литература
- 12 методов в картинках: микроскопия;
- 100 лет хромосомной теории наследственности (1915–2015);
- Genetiko: Цитогенетика и молекулярная цитогенетика;
- Stela Z. Berisha, Shashi Shetty, Thomas W. Prior, Anna L. Mitchell. (2020). Cytogenetic and molecular diagnostic testing associated with prenatal and postnatal birth defects. Birth Defects Research. 112, 293-306;
- S. Dutta, M. L. Gupta. (2014). Alleviation of radiation-induced genomic damage in human peripheral blood lymphocytes by active principles of Podophyllum hexandrum: an in vitro study using chromosomal and CBMN assay. Mutagenesis. 29, 139-147;
- Соколова Т.А., Котловский Ю.В., Дубынина Е.В., Ивановская О. В., Веселова В.К., Кузнецова Е.Ю. Окрашивание хромосом / в: «Цитогенетическая диагностика при онкогематологических заболеваниях». М.: «Академия Естествознания», 2012;
- Ademir Amaral. (2005). Physical and biological dosimetry for risk perception in radioprotection. Braz. arch. biol. technol.. 48, 229-234;
- Wanwisa Sudprasert, Oleg V Belyakov, Satoshi Tashiro. (2022). Biological and internal dosimetry for radiation medicine: current status and future perspectives. Journal of Radiation Research. 63, 247-254;
- NK Chaudhury, PabanK Agrawala, JS Adhikari. (2010). Lymphocyte chromosomal aberration assay in radiation biodosimetry. J Pharm Bioall Sci. 2, 197;
- Harold M. Swartz, Benjamin B. Williams, Ann Barry Flood. (2014). Overview of the principles and practice of biodosimetry. Radiat Environ Biophys. 53, 221-232;
- C.M.A. Lima, A.R. Lima, Ä.L. Degenhardt, N.J. Valverde, F.C.A. Da Silva. (2015). Reconstructive dosimetry for cutaneous radiation syndrome. Braz J Med Biol Res. 48, 895-901;
- Moore D., Tucker J., Jones I., Langlois R., Pleshanov P., Vorobtsova I., Jensen J. (1997). A study of the effects of exposure on cleanup workers at the Chernobyl nuclear reactor accident using multiple end points. Radiat Res. 148, 463–475;
- Воробцова И.Е., Семенов А.В. (2006). Комплексная цитогенетическая характеристика лиц, пострадавших в результате аварии на Чернобыльской АЭС. Радиационная биология. Радиоэкология. 46, 140–151;
- Romm H., Oestreicher U., Kulka U. (2009). Cytogenetic damage analysed by the dicentric assay. Ann Ist Super Sanità. 45, 251–259;
- G. M. Ludovici, M. G. Cascone, T. Huber, A. Chierici, P. Gaudio, et. al.. (2021). Cytogenetic bio-dosimetry techniques in the detection of dicentric chromosomes induced by ionizing radiation: A review. Eur. Phys. J. Plus. 136;
- Снигирева Г.П. Биологическая дозиметрия на основе цитогенетического анализа. Вестник РНЦРР МЗ РФ. 11, 1-22;
- Воробцова И.Е. Любимова Н.Е., Перова А.А., Семенов А.В. (2004). Исследование стабильных хромосомных аберраций, выявляемых FISH-методом, у ветеранов подразделения особого риска. Экологическая генетика человека. 11, 35-40;
- Нугис В.Ю. (2016). FISH-метод: способ цитогенетической ретроспективной оценки дозы. Medical Radiology. 12, 671–678;
- Неинвазивная диагностика анеуплоидий у плода: от идеи к продукту;
- Геномная головоломка: открой в себе мозаика;
- Сотни мутаций в мозге, «гены аутизма» и ранняя диагностика болезней: ученые поделились новыми данными;
- STORM над PALMами: как современная микроскопия высокого разрешения позволила посмотреть на одиночные молекулы.