STORM над PALMами: как современная микроскопия высокого разрешения позволила посмотреть на одиночные молекулы
08 февраля 2023
STORM над PALMами: как современная микроскопия высокого разрешения позволила посмотреть на одиночные молекулы
- 1153
- 0
- 3
История о том, как сочетание методов химии и оптики позволило создать новые подходы в микроскопии.
Рисунок в полном размере.
иллюстрация авторов статьи
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Световая микроскопия давно стала незаменимым методом исследования биологических структур. После открытия и широкого распространения флуоресцентных красителей биологи научились визуализировать множество клеточных компонентов — от клеток целиком до отдельных белковых комплексов; однако разрешающая способность здесь фундаментально ограничена дифракционным пределом. Долгое время преодолеть его могла лишь электронная микроскопия, не использующая источников света. Однако в последнее время развитие физики, химии и компьютерной обработки данных вывело на это поле нового игрока — микроскопию сверхвысокого разрешения. В этой статье мы рассмотрим, как соединяются оптика, фотофизика и фотохимия, биомедицина, а также компьютерная обработка полученных результатов для двух методов микроскопии локализации одиночных молекул (SMLM) — PALM и STORM.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Грани жизни» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — Сколтех: университет, который основан в 2011 году командой российских и зарубежных ученых с мировым именем.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Откуда берется флуоресценция?
Явление флуоресценции возникает, когда определенные молекулы излучают свет при поглощении фотонов от «возбуждающего» источника света. При этом электронам сообщается дополнительная энергия, что возбуждает их и переводит на более высокий энергетический уровень. После этого электрон «падает» на прежнее «место», что, при определенных условиях, сопровождается излучением света (рис. 1). При этом возбуждение в излучающее состояние может произойти только тогда, когда длина волны падающего фотона соответствует разности энергий между основным и возбужденным состоянием молекулы и при условии, что этот электронный переход разрешен законами квантовой механики. Для органических флуорофоров в конденсированной фазе возбужденные молекулы возвращаются в свое основное энергетическое состояние в течение наносекунд после возбуждения. Испускаемые фотоны имеют меньшую энергию (и большую длину волны) по сравнению с соответствующими фотонами возбуждения. Этот эффект носит название красного сдвига или сдвига Стокса, и вызывается тем, что некоторая часть энергии возбуждения диссипирует в виде тепла или тратится на переходы между колебательными подуровнями.

Рисунок 1. Физические основы флуоресценции и диаграмма Яблонского. При попадании фотона на атом происходит ионизация, а на освободившееся место падает электрон и испускает фотон меньшей энергии (слева). В центре: диаграмма Яблонского, показывающая энергетические переходы при флуоресценции. При возбуждении молекула переходит в колебательное состояние с более высокой энергией. Перед испусканием молекула релаксирует нерадиационно, после чего может произойти испускание (справа).
иллюстрация авторов статьи
При этом каждая молекула флуорофора может участвовать и в других физико-химических процессах, часть из которых может приводить к обесцвечиванию флуоресценции.
Про применение классической флуоресцентной микроскопии в биологических исследованиях «Биомолекула» уже писала: «Флуоресцентные репортеры и их молекулярные репортажи» [1]. Однако классическая флуоресцентная микроскопия имеет фундаментальную проблему дифракционного предела. Дело в том, что точечный источник света, будучи сфокусированным с помощью линз, формирует не точку, а пятно [2]. С помощью различных техник фокусировки размер такого кругляшка можно свести до минимума (тогда он будет называться диском Эйре), но, тем не менее, «разделить» множество пятен, находящихся на расстоянии менее половины длины волны освещения в рамках классической флуоресцентной микроскопии невозможно.
Обзор методов микроскопии сверхразрешения
Вклад микроскопии сверхразрешения в науку был признан Нобелевской премией по химии в 2014 году, присужденной трем ученым — Эрику Бейтцигу, Уильяму Мёрнеру и Стефану Хеллу [3]. Бейтциг и Мёрнер разработали принципы микроскопии локализации одиночных молекул (SMLM), а Хелл работал над микроскопией на основе подавления спонтанного испускания (STED). В последнее время набирает популярность также и микроскопия со структурированным разрешением (SIM), разработанная Матсом Густафссоном. Общий обзор с сопоставлением методов микроскопии сверхвысокого разрешения вы можете почитать в статье «Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения» [4]. Методы SMLM, на которых мы сфокусируемся в этой статье, включают фотоактивируемую локализационную микроскопию (PALM), микроскопию стохастической оптической реконструкции (STORM), накопление точек на основе ДНК для визуализации топографии в наномасштабе (DNA-PAINT), а также MINFLUX (рис. 2). SMLM имеет наибольшее разрешение среди остальных методов: 10–30 нм, однако требует самых сложных алгоритмов анализа данных [5], [6].

Рисунок 2. Классификация методов наноскопии сверхразрешения.
иллюстрация авторов статьи
Принцип методов локализационной микроскопии STORM (Stochastic Optical Reconstruction Microscopy — стохастическая оптическая реконструкция) и PALM (PhotoActivation Localization Microscopy — фотоаквационная локализационная микроскопия) заключается в получении разреженной картины случайно распределенных отдельно флуоресцирующих молекул. Пятно, получаемое от точечного источника света (отдельной флуоресцирующей молекулы), имеет функцию распределения интенсивности. Если не брать в расчет диски Эйре малой интенсивности, распределение описывается распределением Гаусса с довольно малой ошибкой. Основываясь на таком анализе, можно получить уточненное положение центра пятна и, соответственно, расположение отдельных молекул. Путем проведения последовательной активации и дезактивации флуорофоров в случайных положениях и суммирования уточненных координат получается целое изображение с высоким пространственным разрешением [5].

Рисунок 3. Наложение функций Эйри определяет разрешение. Рэлей рассчитал, что человеческий глаз может разрешить ±20% уменьшения интенсивности. Это соответствует перекрытию диска Эйри одной функции Эйри с первым минимумом второй функции Эйри. Слева показаны две разрешенные функции Эйри, а справа — две неразрешенные. В центре изображены две функции Эйри, разделенные пределом Рэлея.
иллюстрация авторов статьи
Маркировка мишеней: белки-светяшки и вырвиглаз-краски
Так же, как и в обычной флуоресцентной микроскопии, первый шаг для микроскопии сверхвысокого разрешения — флуоресцентное мечение молекулы-мишени. В STORM, как правило, используются антитела, коньюгированные с органическими флуорофорами (например, Alexa-647). В PALM для мечения цели используются флуоресцентные белки (например, всеми любимый GFP [7]).
Однако все флуорофоры, использующиеся для микроскопии сверхвысокого разрешения, обладают очень важным свойством — они имеют режим «фотопереключения», то есть могут управляемо переходить из светящегося состояния в несветящееся, и пока одна часть молекул одного и того же флуорофора в клетке светится, другая «ждет своего часа» в темноте. Такое разделение свечения молекул во времени и позволяет заглянуть за пределы дифракции. При этом низкомолекулярные флуорофоры, использующиеся для STORM, как правило, имеют более высокую эффективность флуоресценции (то есть выпускают больше фотонов в ответ на одинаковое возбуждение), нежели флуоресцентные белки, чем позволяют сократить время детекции сигнала [6].
Существует несколько «режимов переключения», по которым и классифицируют флуорофоры (рис. 3). Первый — фотоактивируемые, необратимо переходящие под воздействием возбуждающего лазера из состояния Off (обесцвеченного) в состояние On (светящееся). Для их применения в методах микроскопии сверхвысокого разрешения необходимо сначала активировать все флуорофоры с помощью УФ-лазера, а затем поэтапно фиксировать их обесцвечивание — либо спонтанное, либо происходящее при помощи второго, более длинноволнового, лазера.
Второй класс флуорофоров — фотопереключаемые, имеющие обратимый переход между светящимся и несветящимся состояниями. Обычно в начале эксперимента все флуорофоры находятся в состоянии On, а затем с помощью лазера и благодаря особо приготовленным буферным растворам (содержащим тиольные восстановители, такие как бета-меркаптоэтанол) переходят в состояние Off. Затем часть молекул снова возбуждается и переходит в светящееся состояние — и изображение фиксируется. Среди таких флуорофоров — белок Dronpa и многие родаминовые красители из семейства Alexa Flour (например, А647).
Третий класс флуорофоров — фотоконвертируемые. Фотоконверсия представляет собой необратимый фотохимический переход флуорофора — как правило, из зеленой формы в красную. Представители этого класса флуорофоров — флуоресцентные белки (например, Kaede), имеющие в составе хромофора консервативную триаду аминокислотных остатков HYG. При воздействии возбуждающего света определенной длины на такой хромофор его структура претерпевает изменения, система π-электронного сопряжения меняется, и происходит сдвиг эмиссии в красную область.

Рисунок 4. Три типа флуоресцентных белков. PAFP — photoactivatable fluorescent proteins, PCFP — photoconvertible fluorescent proteins, PSFP — photoswitchable fluorescent proteins.
иллюстрация авторов статьи
Наконец, последний тип флуорофоров, который используется в микроскопии сверхвысокого разрешения — спонтанно обесцвечивающиеся. Для флуоресцентных белков такое явление не характерно, но некоторые силикон-родаминовые красители способны обратимо переключаться между включенным и выключенным состоянием исключительно в зависимости от рН буфера.
Реализация PALM и STORM
SMLM требует только широкопольного микроскопа, оснащенного непрерывными лазерами для возбуждения и активации, и камеры, способной обнаруживать отдельные молекулы. Таким образом, флуоресцентные метки, прикрепленные к интересующим структурам, будут видны как яркие точечные излучатели на огромном темном фоне — как звезды на ночном небе, что значительно улучшает контраст. Большинство микроскопов для SMLM включают автоматические системы удержания образца в фокусе. Для многоцветной микроскопии несколько лазерных линий могут быть объединены и выровнены с помощью дихроичных зеркал. Флуоресцентное излучение образца попадает через объектив на детектор, размер пикселя которого должен быть приблизительно равен стандартному отклонению функции рассеяния точки (PSF). В дополнение к локализации фотонных событий возбужденных флуорофоров в плоскости (т.е. в координатах x и y), введение цилиндрической линзы в световой тракт системы формирования изображения деформирует PSF в соответствии с глубиной (т.е. координатой z) молекулы в образце. Получение значения глубины для одной молекулы включает в себя подгонку многомерной гауссовой PSF к деформированной форме PSF [8]. В статье «Биомолекулы» «12 методов в картинках: Микроскопия» наглядно продемонстрированы принципы работы микроскопии сверхразрешения [9].
В начале эксперимента все флуоресцирующие молекулы находятся в ярком состоянии — это помогает визуализировать клетки и поместить их в фокус микроскопа. Затем большинство флуорофоров при помощи второго, обесцвечивающего лазера выключают в темное состояние. Отдельные флуоресцентные белки с помощью активирующего лазера включаются для получения изображения и затем выключаются. Затем процесс повторяется до тех пор, пока все молекулы в образце не будут отображены. В случае флуоресцентных белков используется как переход между темной и флуоресцирующей формой белка (фотопереключение), так и необратимая фотоконверсия из зеленой в красную форму. Все эти процессы контролируются облучением света определенной длины волны. В случае фотоконверсии наблюдают за красной формой флуоресцентного белка, а для перехода между циклами используют необратимую фотодеструкцию красной формы.
Процесс визуализации повторяется тысячи раз с использованием гауссовой PSF для определения локализации отдельных молекул с высоким разрешением. Каждое местоположение молекулы может иметь другую информацию, такую как неопределенность локализации (ошибка подгонки гауссовой PSF), номер кадра и количество фотонов. Окончательное сверхразрешенное изображение формируется путем перекомбинации всех локализаций из всех полученных кадров. Как показано на рисунке 4, локализация молекул получается из каждого кадра изображения по отдельности, что позволяет пользователю отображать локализации в двумерном (2D) или трехмерном координатном пространстве.
Анализ данных
Набор молекулярных локализаций и связанные с ними метаданные известны как облака точек, список событий, поинт-лист и так далее. В обычной микроскопии для представления данных используется сетка интенсивности, оцениваемая по пикселям или вокселям, так что нетривиальная репрезентация данных для SMLM предполагает особые методы анализа [10].
В результате белок-белковых взаимодействий образуются комплексы. Несколько однородных комплексов молекул образуют кластеры, изучение структуры и организации которых необходимо для определения их свойств в клетке. Элементы кластера, грубо говоря, находятся ближе друг к другу, чем к другим комплексам молекул, которые были детектированы.
Не все кластеры в данных SMLM связаны с биологическими структурами. Некоторые являются артефактами изображения (т.е. это, по сути, псевдокластеры), вызванными неопределенностью фотофизических свойств флуоресцентных репортеров, а также маркировкой молекулы-мишени более чем одним зондом антитела. Псевдокластеры могут исказить количественную оценку и интерпретацию обнаруженных молекулярных кластеров. Устранить эти артефакты может предварительный анализ. Мы же остановимся на методах постпроцессинга.
Классические подходы к изучению данных, полученных методами сверхразрешения, лежат в области молекулярного кластерного анализа, включающего математические операции для нахождения отношений, паттернов, кривых по всему набору данных для обнаружения подмножеств молекулярных комплексов. Данный подход включает статистические, байесовские, основанные на плотности, мозаиках Вороного и графовые методы [5].
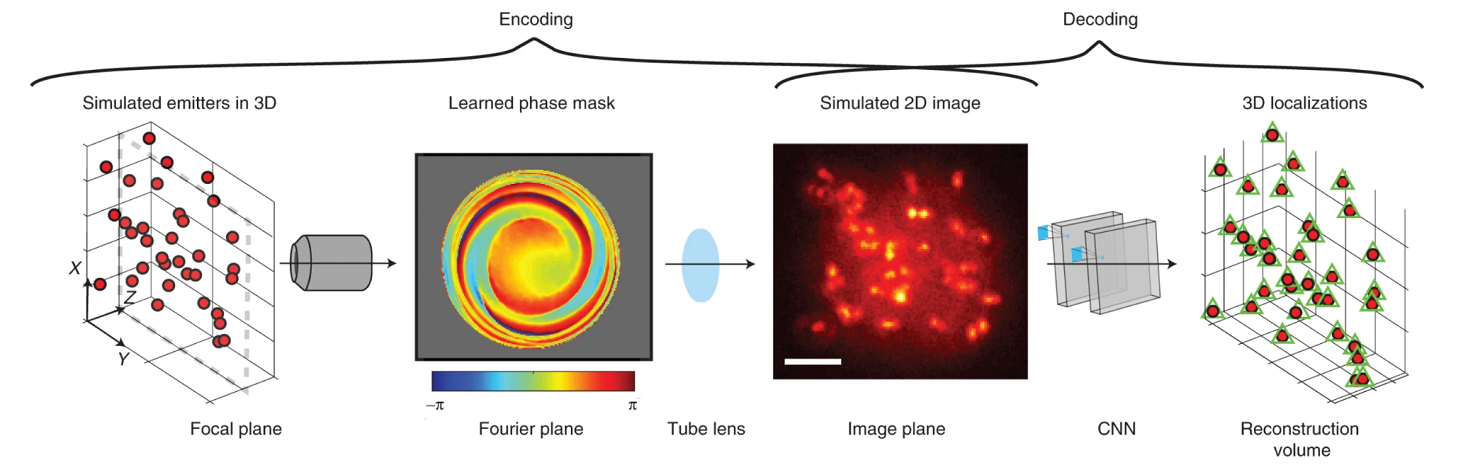
Рисунок 5. Принцип получения изображений с помощью SMLM. Фиолетовый круг — исследуемая структура с диаметром меньше дифракционного предела, помечен флуоресцентным красителем. Обычный широкопольный микроскоп с дифракционными ограничениями дает размытое изображение. SMLM-визуализация производится из набора изображений, где на каждом временном кадре детектируются разреженные в пространстве возбужденные меченые белки. Каждый из белков может быть локализован по функции PSF для формирования окончательного точечного сверхразрешенного изображения структуры.
иллюстрация авторов статьи
Однако некоторые методы могут использовать изображения для получения информации напрямую, без интерпретации списка событий в текстовом формате. Для этого из картинки извлекаются статистические показатели с помощью компьютерного зрения на основе глубокого обучения.
Применение глубокого обучения для анализа изображений SMLM
Машинное обучение — это применение искусственного интеллекта, которое позволяет системам обучаться и совершенствоваться на основе прошлого опыта без явного программирования. Этот подход сосредоточен на разработке алгоритма, который может получить доступ к данным и использовать их для обучения. Алгоритм может быть определен на основе входных данных, выходных данных и модели. В машинном обучении оптимизируется соответствующая функция для предсказания желаемого результата по заданным входным данным [11]. Эта функция определяется ее формой и коэффициентами, называемыми архитектурой модели и весовыми параметрами, соответственно.
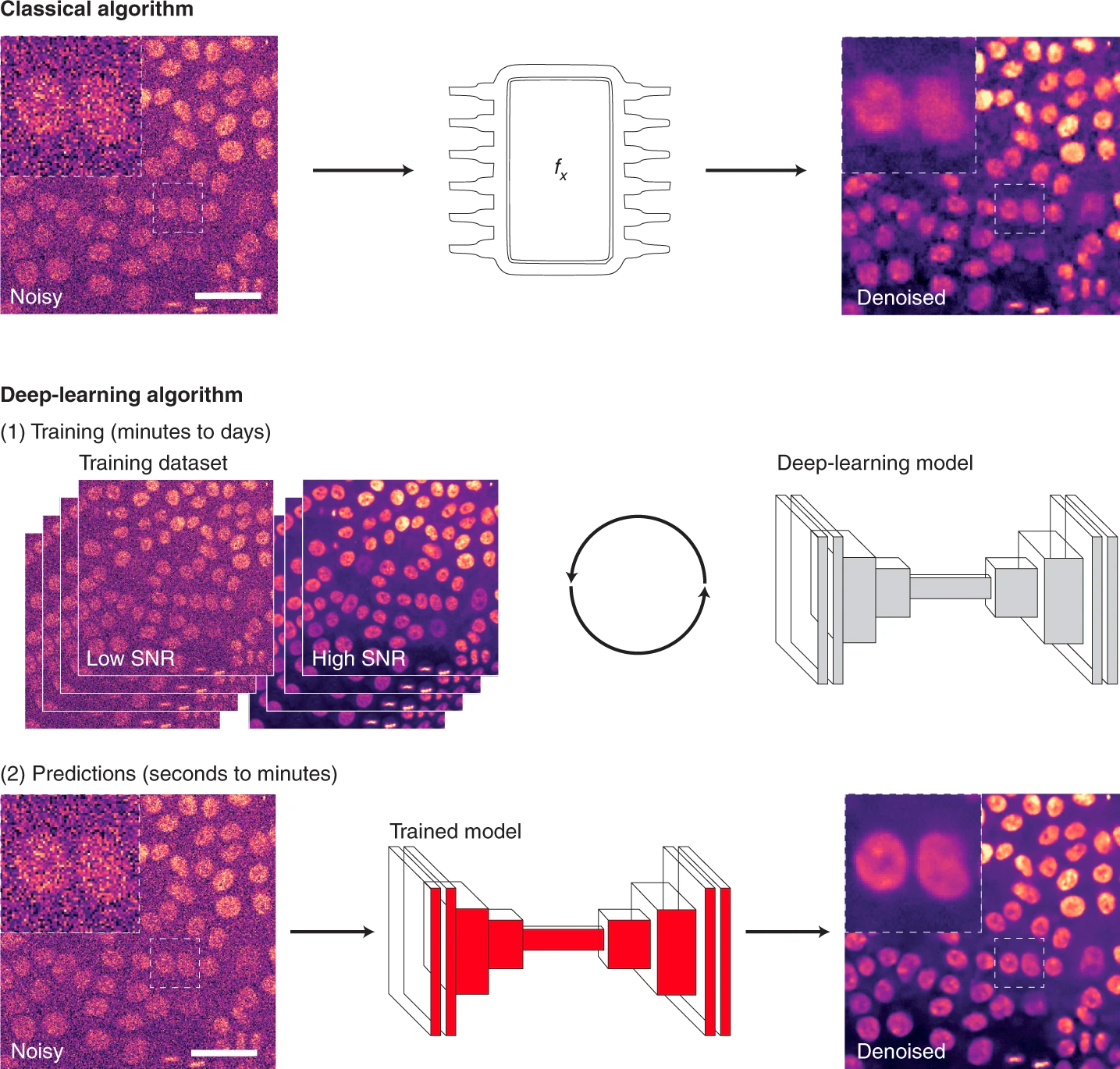
Рисунок 6. Шаги, необходимые при использовании классических или DL-алгоритмов для анализа микроскопических изображений на примере удаления шума (denoising). При использовании классического алгоритма усилия исследователей направлены на разработку математических формул (fx), которые затем могут быть непосредственно применены к изображениям. При использовании DL-алгоритма сначала необходимо обучить модель, используя набор обучающих данных. Затем модель можно непосредственно применять к другим изображениям и генерировать прогнозы. Представленные изображения — клетки рака молочной железы, помеченные кремний-родамин (SiR)-ДНК для визуализации ядер и полученные с помощью конфокального микроскопа с вращающимся диском. Обесцвечивание в примере классического алгоритма было выполнено с помощью PureDenoise. Обесцвечивание в примере алгоритма DL было выполнено с использованием CSBDeep content-aware restoration (CARE).
Масштабные линейки — 50 мкм.
В нейронных сетях архитектура построена на так называемых нейронах, которые самостоятельно выполняют различные операции в одно действие, а затем передают результат другим нейронам, чтобы они выполнили уже свое действие, и так далее по слоям. Операции в каждом слое могут быть разными, и каждый слой обычно содержит весовые параметры, необходимые для вычисления его выхода. Для обработки изображений и видео используется операция свертки, в которой каждый элемент картинки при передаче через нейроны упрощается, сохраняя только главную информацию, которая определяется самой сетью с помощью весовых коэффициентов. Для «расшифровки» используют операцию обратной свертки.
Фундаментально нейросети выполняют линейные операции и матричное преобразование, что не дает решать сложные задачи, такие как распознавание образов. Для того, чтобы позволить нейронным сетям обучаться более мощным операциям, вычисления сопровождают функции активации — функции, которые выдают небольшое значение при малых входных данных и большее значение, если входные данные превышают порог. Если входные данные достаточно велики, функция активации «срабатывает», в противном случае она ничего не делает. Другими словами, функция активации похожа на ворота, которые проверяют, что входящее значение больше критического числа. Известные функции активации включают функцию выпрямленной линейной единицы (ReLU) и семейство сигмоидных функций.
Для обучения многослойных нейросетей часто используют алгоритм обратного распространения ошибки, который при предъявлении примеров входных и выходных данных получает ошибку предсказания и использует ее для коррекции весов нейронов в скрытых (не входном и не выходном) слоях нейросети. Алгоритм использует «пошаговый» принцип обучения, и с каждой следующей итерацией минимизирует ошибку.
SMLM может использовать преимущества компьютерного зрения на основе глубокого обучения именно из-за сложного анализа данных. Большой плюс также состоит в том, что под разные задачи анализа изображений SMLM можно использовать множество разных архитектур машинного обучения.
Быстрая локализация отдельных молекул с помощью глубокого обучения решает проблему затратности вычислений при подгонке PSF для каждого флуорофора. Первым таким подходом был Deep-STORM, который использует сверточную нейронную сеть, которой на вход подаются «сырые» изображения. Для обучения данных, пары дифракционно-ограниченного изображения и соответствующего сверхразрешенного изображения сначала генерируются с помощью PSF-моделирования, а затем тестируются как с моделируемыми данными, так и экспериментальными изображениями относительно простых структур, например, микротрубочек. Для примера на видео 1 постпроцессинг занял всего 1 час 15 минут. Если использовать ThunderSTORM (один из классических подходов, не включающий машинное обучение), то примерно такое же изображение мы увидим через 4 дня [12].
Видео 1. Пример данных, которые могут быть получены с помощью Deep-STORM. Один кадр необработанного набора данных BIN10, маркировка фаллоидином глиальной клетки и широкопольное изображение.
Создание высокоплотного изображения сверхразрешения из низкоплотного позволяет делать кадры с меньшими промежутками для получения качественных изображений. Популярный метод для уменьшения временного разрешения SMLM — ANNA-PALM [13] с использованием нейронной сети типа pix2pix, входные и выходные данные которой представляют собой изображения [2]. Для генератора в этом подходе используется сверточная нейросеть U-net, которая была создана для сегментации биомедицинских изображений.
Улучшение точности локализации одной молекулы происходит обычно алгоритмами подгонки, так что этот этап может быть качественно улучшен с помощью глубокого обучения. Например, недавно разработанная глубокая нейронная сеть BGnet уменьшает шум PSF-изображения [14].
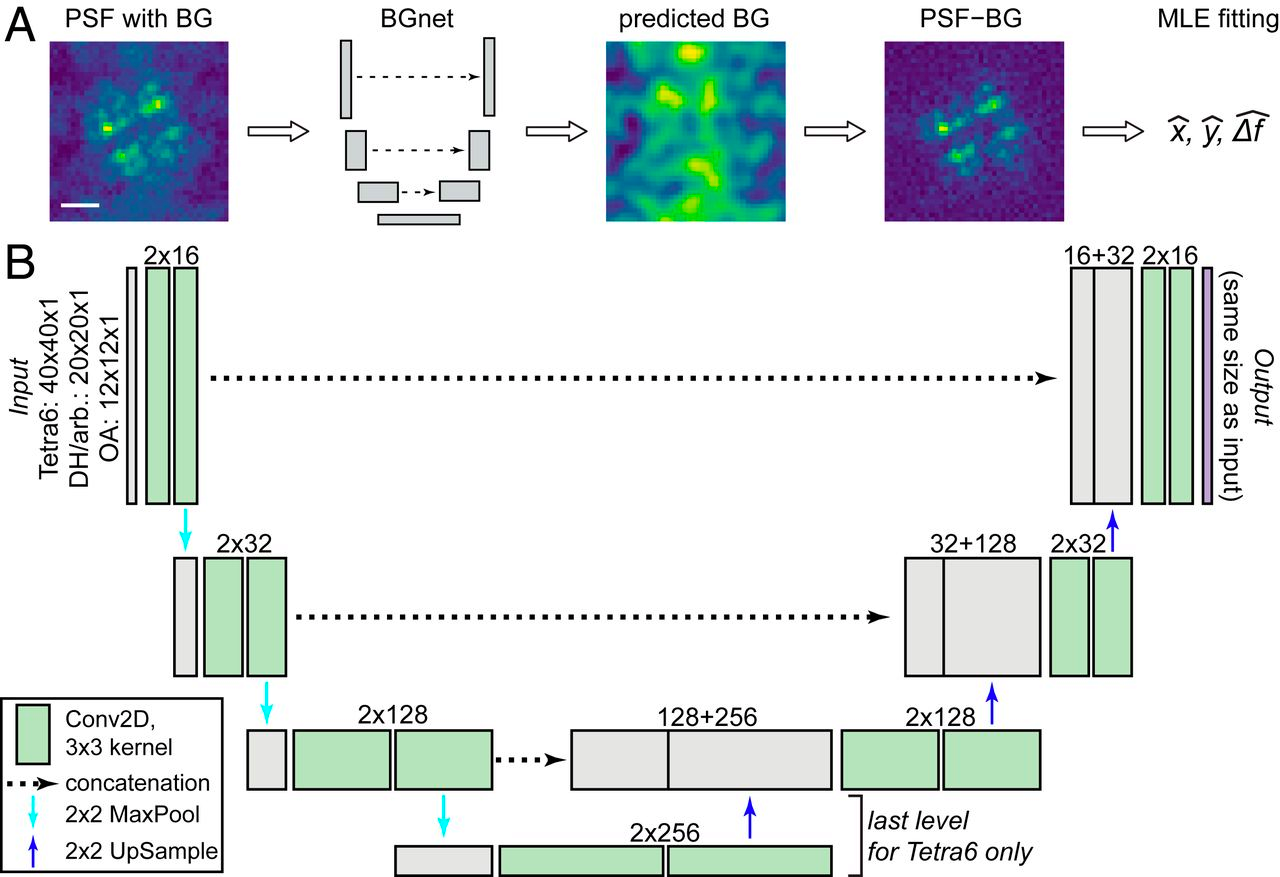
Рисунок 7. Общий подход и архитектура BGnet. BGnet получает изображение PSF (здесь — Tetra6 PSF) с BG. Его выходным сигналом является предсказанный вклад BG (background — фон) в каждом пикселе. Таким образом, предсказанный BG может быть легко вычтен из входного изображения PSF. PSF с коррекцией BG может быть впоследствии проанализировано, например, с помощью подгонки MLE для оценки положения в x и y с дефокусом Δf.
Локализация перекрывающихся PSF, которые с некоторой вероятностью получаются из-за случайности переключения флуорофоров, в методах кластерного анализа предполагает множество итераций. Метод DECODE одновременно выполняет обнаружение и локализацию излучателей. Архитектура сети состоит из двух сложенных U-сетей. Первый этап вычисляет представление признаков одного кадра, а второй использует интегрированные представления признаков последовательных кадров для получения окончательных прогнозов. Прогноз DECODE включает информацию о вероятности нахождения излучателя в конкретном месте, яркости, интенсивности фона каждого пикселя [15].
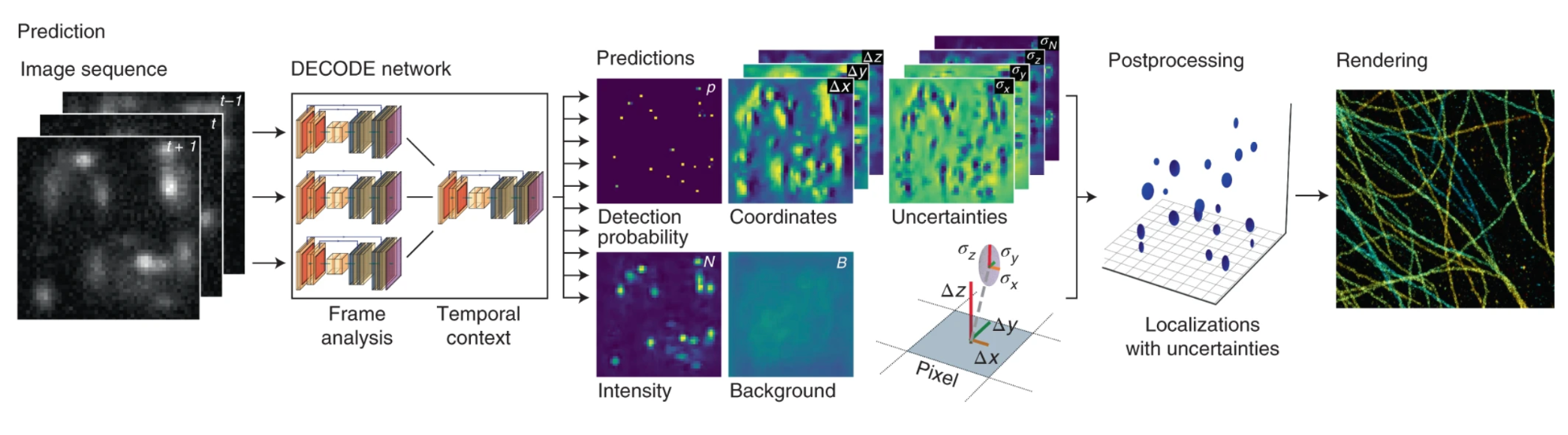
Рисунок 8. Архитектура DECODE. Сеть DECODE использует информацию из нескольких кадров для прогнозирования выходных карт, представляющих для каждого пикселя вероятность обнаружения излучателя и его субпиксельные пространственные координаты (Δx, Δy, Δz), яркость (N), неопределенность, связанную с этими прогнозами (σx, σy, σz), и необязательную карту фона (B).
Кроме уточнения информации изображений, с помощью сверточных нейронных сетей можно получать дополнительную спектральную информацию из PSF — например, длины волны излучения и ориентации меченного белка (smNet, DeepSTORM3D). Конечно, эта информация может быть восстановлена и методологически — с помощью спектрально разрешенного SMLM (SR-SMLM). В SR-SMLM спектры одиночных молекул могут быть получены с помощью локализации путем вставки призмы или пропускающей решетки. Хотя этот новый метод спектроскопии одиночных молекул предоставляет многомерную и функциональную информацию об отдельных молекулах, которая обычно спрятана в усредненных значениях обычных объемных спектроскопических измерений, спектральное разрешение ограничено количеством обнаруженных фотонов, как и пространственное разрешение. На момент написания статьи методы машинного обучения вдвое лучше справляются с задачей получения спектров излучателей и в 10 раз реже ошибаются с классификацией — по сравнению с ранее используемым методом преобразования спектрального среднего значения из пикселя в длину волны [16], [17].
Возможности и применение PALM и STORM
Микроскопия сверхвысокого разрешения позволила заглянуть туда, докуда не дотягивались классические методы. Здесь мы приведем лишь несколько самых ярких примеров применения PALM и STORM для исследования биологических процессов.
Траектории движения одиночных молекул в клетке
Обычная флуоресцентная микроскопия позволяет ученым отслеживать флуоресцентно меченые молекулы лишь в «неподвижном» состоянии. Некоторые методы микроскопии со сверхвысоким разрешением позволяют решить эту проблему. В рамках одного метода PALM существует возможность отслеживания траектории движения единичных белков по клетке — от вирусных частиц до отдельных элементов цитоскелета. Такой подход получил название single-particle-tracking PALM (sptPALM). Для этого положение единичной флуоресцирующей метки отслеживается во времени в течение нескольких миллисекунд, которые проходят от фотоактивации до фотообесцвечивания метки. За это время метка успевает изменить свои координаты в клетке — и это изменение положения и составляет трек индивидуальной молекулы. Разумеется, при наблюдении лишь одной флуоресцентной метки невозможно отличить стохастическое движение молекулы от ее систематического поведения в клетке — поэтому положение отслеживается для нескольких фотоактивируемых меток. Главное ограничение этого метода, как часто бывает в биологии, — аппаратное. Частота съемки изображений ограничена возможностями оптических систем микроскопа, и, хотя в современных приборах мы можем получать по изображению в 10 миллисекунд, иногда этого бывает недостаточно для отслеживания сверхточных треков молекул.
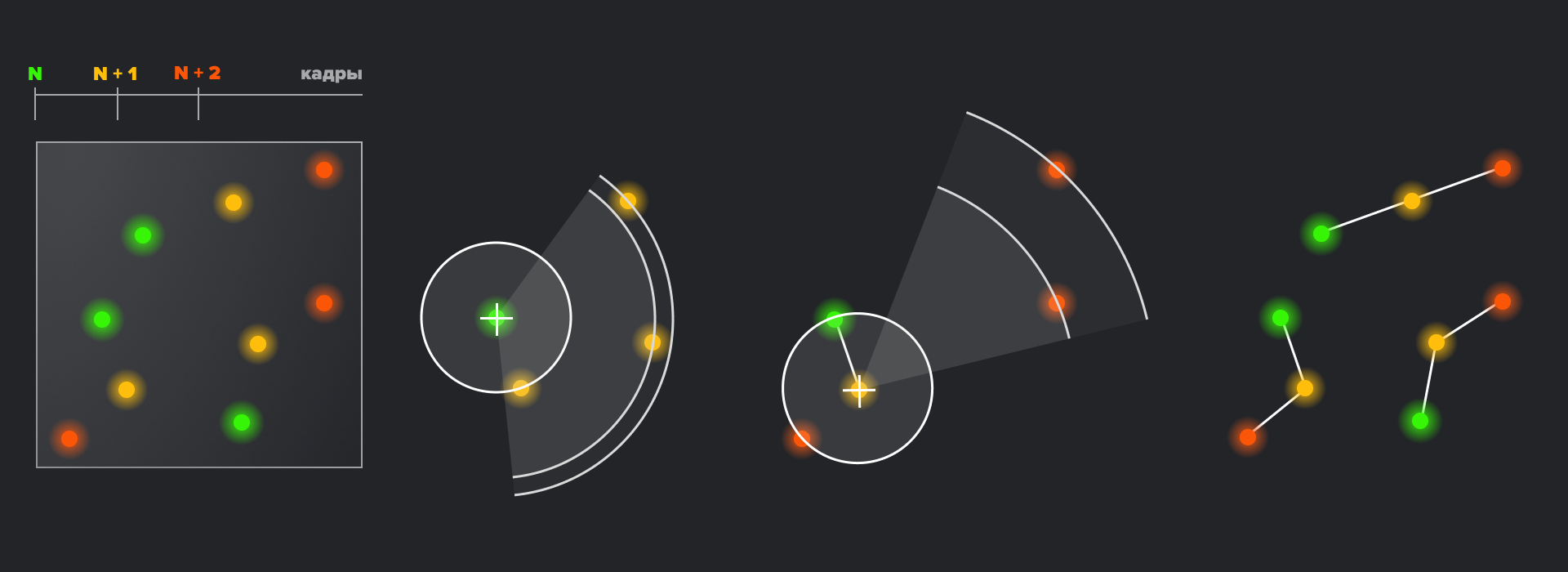
Рисунок 10. Реализация метода трекинга одиночных молекул в клетке. Слева совмещенные изображения, полученные за три кадра. Путем нахождения ближайшего соседа, полученного в следующем кадре, для каждой молекулы предыдущей временной точки, получают наиболее вероятную траекторию (справа).
иллюстрация авторов статьи
In vivo мечение белков интереса для PALM
Громкий бум генетической инженерии отразился и на методах микроскопии сверхвысокого разрешения. Благодаря системе CRISPR/Cas [18] и другим способам направленного внесения разрывов в ДНК биологи получают возможность модифицировать гены, кодирующие белок интереса, делая в них вставку, кодирующую PAFP (фотоактивируемый флуоресцентный белок). Для этого в клетки, содержащие необходимую мишень, доставляют плазмиду, кодирующую гидовую РНК, комплементарную участку целевого белка; ген, кодирующий белок Cas, и донорскую ДНК, в которой закодирована уже знакомая нам флуоресцентная метка. Cas производит разрыв в определенной точке гена, кодирующего белок интереса, и донорская ДНК при помощи систем репарации встраивается в образовавшийся разрыв. В результате прямо в геноме клетки появляется химерный ген, кодирующий белок с PAFP-меткой. Такой подход позволил исследовать белки с труднодоступной локализацией внутри клеток — например, белки мембран.
Диагностика патологий
Для точной диагностики различных патологий при работе с биологическим материалом (например, биопсиями) широко применяются методы иммунофлуоресцентного мечения [19] (иммуноцитохимическое и иммуногистохимическое окрашивание), позволяющие с высокой точностью охарактеризовать исследуемый образец по наличию в нем специфичных маркеров заболевания. Обычно для таких проб не требуется заглядывать за дифракционный предел, но оказалось, что SMLM может открыть новые горизонты и в этой области. К примеру, была показана возможность применения STORM при исследовании биологических образцов больных различными аутоиммунными заболеванием почек (мембранозным гломерулонефритом и волчаночным нефритом), патогенез которых связан с поликлональными аутореактивными IgG [20]. Для этого поликлональные антитела метились диагностическими антителами, несущими флуоресцентные метки. Таким же образом метился ламинин, входящий в состав базальных мембран. С помощью STORM по уровню детекции сигнала от ламинина удалось оценить толщину гломерулярной базальной мембраны (признак, свидетельствующий о тяжести заболевания), а также положение скоплений молекул IgG относительно этой самой мембраны.
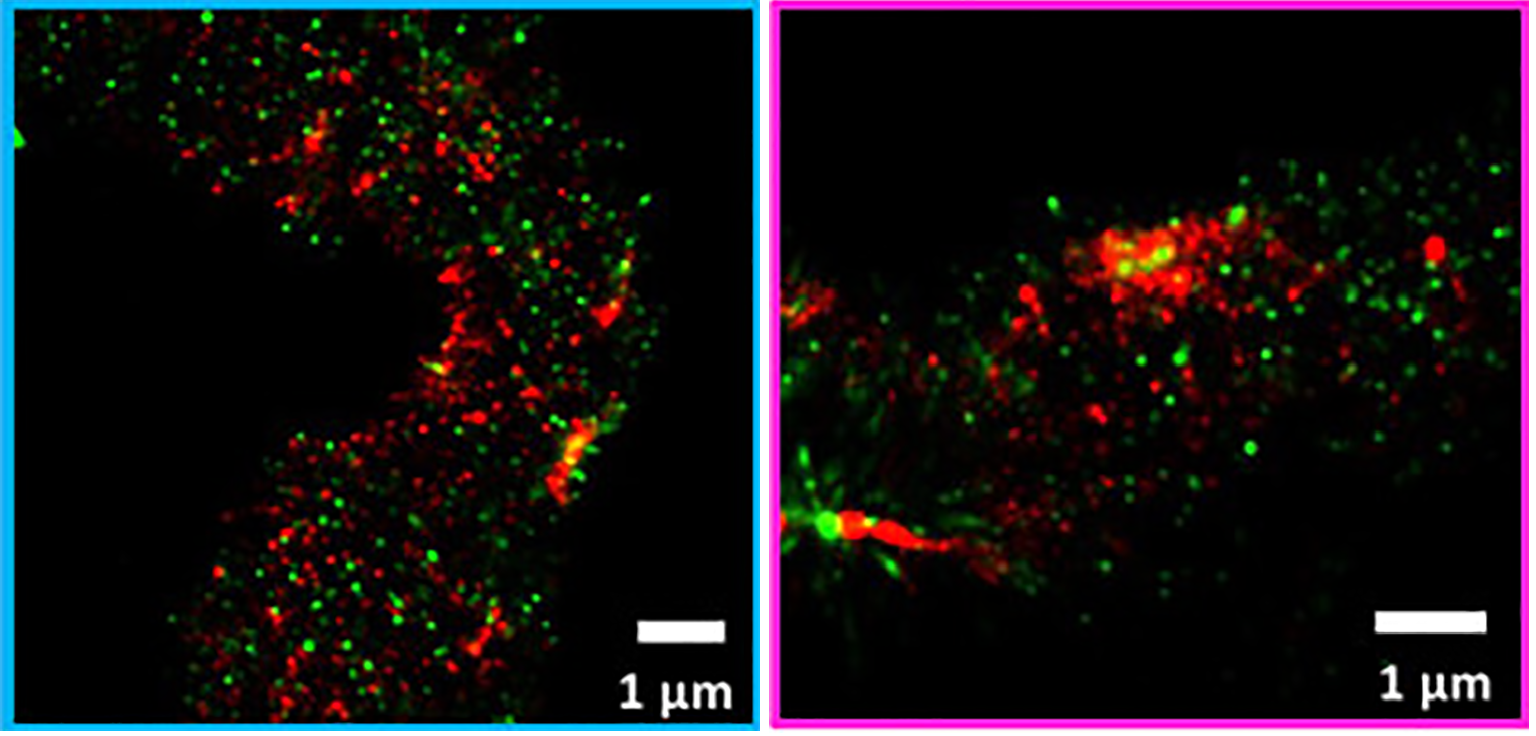
Рисунок 11. Изображения, полученные с помощью STORM. Кластеры иммуноглобулина помечены красителем iFluor 647 (красный), ламинины базальной мембраны — красителем Alexa Fluor 555 (зеленый).
Тут стоит отметить, что для исследования толщины гломерулярной базальной мембраны применить классические методы флуоресцентной микроскопии не получается, и обычно эти исследования проводятся с использованием электронной микроскопии. Использование STORM в подобных патологических исследованиях могло бы дать патологам опцию «два в одном» — на одном образце и оценить толщину мембраны, и провести иммуногистохимическое окрашивание.
3D-геномика
Не обошла микроскопия сверхвысокого разрешения и исследования генома. Об исследованиях пространственной структуры наследственного материала был опубликован обзор: «Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра» [21]. Всем хорошо известен метод флуоресцентной гибридизации in situ (FISH), позволяющий с помощью флуоресцентно меченого ДНК-зонда определить положение определенного участка на хромосоме, исследовать уровень экспрессии тех или иных генов и многое другое. Но что, если применить к этой пробе принципы микроскопии сверхвысокого разрешения? Первый получившийся таким образом метод был назван DNA-PAINT (Point Accumulation for Imaging in Nanoscale Topography). Небольшой ДНК-зонд метится специфичным флуорофором, который флуоресцирует только в том случае, когда зонд связан со своей мишенью. Такой зонд связывается с целевой последовательностью обратимо, и, отрываясь от нее, переключается в темную фазу. В отличие от классического STORM, разрыва дуплекса достаточно для обесцвечивания флуорофора, и никакой дополнительный гаситель флуоресценции не требуется.
Другой подход к получению изображений ДНК сверхвысокого разрешения использует классический STORM, а также технологию ДНК-зондов, называющуюся Oligo-Paint. В ней последовательность зонда, комплементарная целевому участку ДНК, фланкируется с двух сторон некомплементарными последовательностями, которые называются Mainstreet и Blackstreet. А если пометить одну из этих последовательностей фотопереключающимся флуорофором? Получится STORM-зонд! При этом выбор флуорофоров для STORM шире, чем для PAINT, и, таким образом, становится доступным использование множества зондов в одной пробе для визуализации пространственного расположения разных участков ДНК. Такой подход получил название OligoSTORM [22].
Наконец, использование Oligo-Paint-нуклеотидов можно совместить и с методом DNA-PAINT. Для этого DNA-PAINT-зонд должен быть комплементарен не целевой последовательности в геноме, а фланкирующей последовательности Oligo-Paint-зонда (рис. 12) [22].
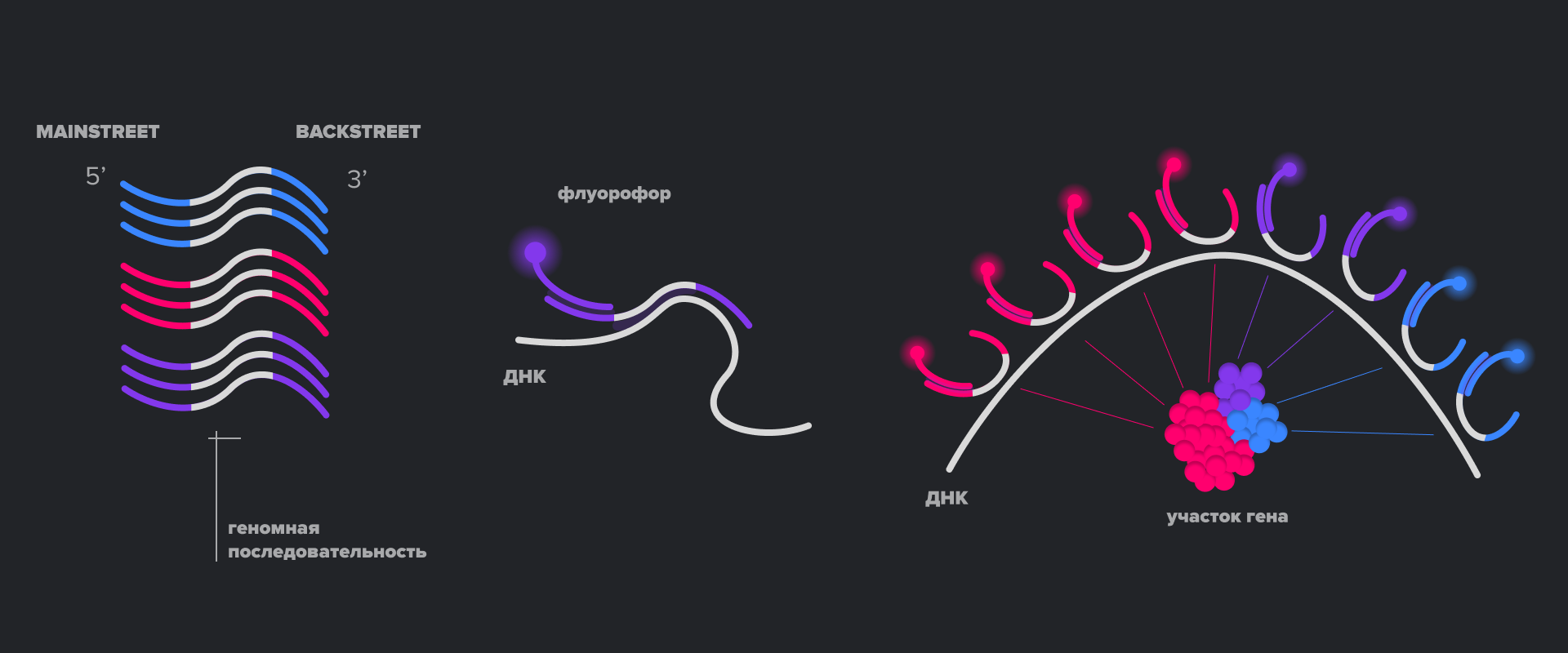
Рисунок 12. Методы микроскопии сверхвысокого разрешения для визуализации ДНК. Реализация метода DNA-PAINT (слева), Oligo-STORM (по центру) и Oligo-DNA-PAINT (справа).
иллюстрация авторов статьи
Использование всех этих подходов микроскопии сверхвысокого разрешения позволило, например, визуализировать участки геномной ДНК размером около 3 тысяч п.н., и даже установить их статус метилирования. Кроме того, использование Oligo-STORM вместе с известным методом Hi-C позволило с очень высокой точностью устанавливать статус компактизации хроматина на участках генома размером всего несколько тысяч пар нуклеотидов, что довольно сложно достижимо для Hi-C «в одиночку».
Заключение
Итак, методы микроскопии локализации одиночных молекул открыли перед исследователями новые возможности визуализации клеточных структур. Это стало возможным благодаря сложению достижений из самых разных научных областей — от получения множества флуоресцентных белков и низкомолекулярных красок до машинного обучения в обработке результатов. Вместе с тем, из-за относительной дороговизны и трудоемкости, эти методы пока уступают в применяемости более классическим вариантам микроскопии. Но кто знает — возможно, в недалеком будущем PALM и STORM будут доступны каждому микроскописту?
Литература
- Флуоресцентные репортеры и их молекулярные репортажи;
- Chinmay Belthangady, Loic A. Royer. (2019). Applications, promises, and pitfalls of deep learning for fluorescence image reconstruction. Nat Methods. 16, 1215-1225;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Steffen J. Sahl, Stefan W. Hell, Stefan Jakobs. (2017). Fluorescence nanoscopy in cell biology. Nat Rev Mol Cell Biol. 18, 685-701;
- Mickaël Lelek, Melina T. Gyparaki, Gerti Beliu, Florian Schueder, Juliette Griffié, et. al.. (2021). Single-molecule localization microscopy. Nat Rev Methods Primers. 1;
- Флуоресцирующая Нобелевская премия по химии;
- Jessica Valli, Adrian Garcia-Burgos, Liam M. Rooney, Beatriz Vale de Melo e Oliveira, Rory R. Duncan, Colin Rickman. (2021). Seeing beyond the limit: A guide to choosing the right super-resolution microscopy technique. Journal of Biological Chemistry. 297, 100791;
- 12 методов в картинках: микроскопия;
- Ismail M. Khater, Ivan Robert Nabi, Ghassan Hamarneh. (2020). A Review of Super-Resolution Single-Molecule Localization Microscopy Cluster Analysis and Quantification Methods. Patterns. 1, 100038;
- Romain F. Laine, Ignacio Arganda-Carreras, Ricardo Henriques, Guillaume Jacquemet. (2021). Avoiding a replication crisis in deep-learning-based bioimage analysis. Nat Methods. 18, 1136-1144;
- Lucas von Chamier, Romain F. Laine, Johanna Jukkala, Christoph Spahn, Daniel Krentzel, et. al.. (2021). Democratising deep learning for microscopy with ZeroCostDL4Mic. Nat Commun. 12;
- Wei Ouyang, Andrey Aristov, Mickaël Lelek, Xian Hao, Christophe Zimmer. (2018). Deep learning massively accelerates super-resolution localization microscopy. Nat Biotechnol. 36, 460-468;
- Leonhard Möckl, Anish R. Roy, Petar N. Petrov, W. E. Moerner. (2020). Accurate and rapid background estimation in single-molecule localization microscopy using the deep neural network BGnet. Proc. Natl. Acad. Sci. U.S.A.. 117, 60-67;
- Artur Speiser, Lucas-Raphael Müller, Philipp Hoess, Ulf Matti, Christopher J. Obara, et. al.. (2021). Deep learning enables fast and dense single-molecule localization with high accuracy. Nat Methods. 18, 1082-1090;
- Zheyuan Zhang, Yang Zhang, Leslie Ying, Cheng Sun, Hao F. Zhang. (2019). Machine-learning based spectral classification for spectroscopic single-molecule localization microscopy. Opt. Lett.. 44, 5864;
- Elias Nehme, Daniel Freedman, Racheli Gordon, Boris Ferdman, Lucien E. Weiss, et. al.. (2020). DeepSTORM3D: dense 3D localization microscopy and PSF design by deep learning. Nat Methods. 17, 734-740;
- Просто о сложном: CRISPR/Cas;
- Жизнь и судьба: визуализируем клеточный состав ткани;
- Edwin Garcia, Jonathan Lightley, Sunil Kumar, Ranjan Kalita, Frederik Gőrlitz, et. al.. (2021). Application of direct stochastic optical reconstruction microscopy (
dSTORM ) to the histological analysis of human glomerular disease. J Pathol Clin Res. 7, 438-445; - Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра;
- Brian J. Beliveau, Alistair N. Boettiger, Guy Nir, Bogdan Bintu, Peng Yin, et. al.. (2017). In Situ Super-Resolution Imaging of Genomic DNA with OligoSTORM and OligoDNA-PAINT. Methods in Molecular Biology. 231-252.