
Жизнь без сахара — не сахар: третий алфавит в молекулярной биологии
07 июня 2020
Жизнь без сахара — не сахар: третий алфавит в молекулярной биологии
- 4342
- 0
- 15
Если одежка — углеводная, то по ней и встречают, и провожают, и вообще все свои взаимодействия осуществляют
иллюстрация автора статьи
-
Автор
-
Редактор
-
Иллюстратор
Темы
Как говорил Шекспир, вся наша жизнь игра, а люди в ней актеры. Удивительно, но эту аналогию можно применить и к живым организмам в целом. Тогда ДНК окажется сценарием, РНК будет интерпретацией этого сценария конкретным лицедеем (клеткой), белок — самой его игрой на сцене, действием. Но как же костюмный образ, сценическая импровизация, взаимодействия актеров, создающие всю магию спектакля? Верьте или нет, но этим занимаются посттрансляционные модификаторы, и, в частности, гликаны, что по сути своей являются сахарами. Представляем вам первую статью из цикла, посвященного гликобиологии.
Гликобиология
Сахар — это не только компонент кофе и булочек, топливо для мозга и вечно гонимый диетологами компонент рациона. Углеводы — одни из важнейших биоинформационных макромолекул, наравне с нуклеиновыми кислотами и белками. Именно этим удивительным веществам посвящен наш спецпроект.
Спонсор спецпроекта — «БиоХимМак» — поставщик научного и медицинского оборудования в лаборатории России и стран СНГ.
Мы все привыкли к клишированной фразе: «Сахар — это топливо для мозга». В ассоциативном ряду мы воспринимаем сахар как источник энергии, как безусловный компонент чаепития, как вечно гонимый диетологами компонент рациона. Это, безусловно, верно, ведь углеводы — сахара, клетчатка и крахмал — действительно являются главными источниками метаболической энергии для растений и животных. Помимо этого, прозорливые вспомнят структурную и запасающую роли углеводов (целлюлоза и крахмал растений).
Но мало кто припомнит, что бóльшая часть белков, ответственных за появление многоклеточной жизни, посттрансляционно (то есть по завершении синтеза белка) модифицируется сахарами. И мало кто сходу ответит, что углеводы — одни из важнейших биоинформационных макромолекул, стоящие наравне с нуклеиновыми кислотами и белками [1]. Но как так, спросите вы, это же просто сахар?
Ответы — ниже, в нашей первой статье спецпроекта о гликобиологии, организованного при поддержке компании «БиоХимМак».
Гликаны — что это за сахар, и почему его не насыпать в чай?
Развитие и функционирование организма — это невероятно сложные задачи. Количество и разнообразие биохимических процессов в клетке поистине огромно, и каждый биохимический процесс требует (как минимум) определенной структуры и функций участвующих в нем молекулярных компонентов. Вспоминая, что количество генов у обычной бактерии всего лишь в десять раз меньше, чем у высших эукариот, сложно представить, что только разнообразие белковых структур обусловило такое впечатляющее различие в сложности их организации. Огромный вклад в разнообразие функциональных возможностей белков внесли модификации, что происходят уже после их синтеза по шаблону, закодированному в геноме. И декорирование белков сахарными полимерами — гликозилирование — является не только самой распространенной посттрансляционной модификацией (около 50% всех белков нашего организма гликозилировано!), но и, пожалуй, обладает необходимым разнообразием и изменчивостью для не закодированной напрямую в геноме функциональной пластичности. Ведь гликаны синтезируются не по шаблону ДНК, а через многоступенчатую ферментативную систему, на которую влияют сотни генетических и внешних средовых факторов. Таким образом, в отличие от многих других посттрансляционных модификаций (например, фосфорилирования, сульфирования — да и вообще сейчас науке известно более 250 модификаций! [2]), работающих в большинстве своем как выключатель для белковой функции, гликозилирование вносит масштабнейший вклад в структуру и функцию белков. Важность этой модификации косвенно подчеркивается и тем, что почти все белки, появившиеся вместе с многоклеточностью, гликозилированы.
В первом приближении гликаны можно представить как одежду для белков — куда сподручнее копать огород в комбинезоне, нежели в бальном платье, хотя в нем и не заявишься на светский прием. Но чтобы точнее увидеть, как всё это устроено, необходимо понять, как и чем обусловливается многогранность и разнообразие сахарного декора.
Структурно гликаны представляют собой относительно небольшие полимеры из моносахаридов — самых простых форм сахара и базовых строительных блоков для углеводов. Эти блоки иногда именуют «третьим алфавитом» молекулярной биологии (тогда как первые два — нуклеотиды и аминокислоты). Из пары таких кирпичиков можно составить дисахариды (например, сахарозу или мальтозу), а из большего количества — олиго- или полисахариды. В последние две группы и попадают гликаны, собранные из трех и больше моносахаридов.
Стоит отметить, что «подслащиваться» (то есть модифицироваться гликанами) могут не только белки, но и липиды. Однако в этой статье мы коснемся лишь белкового гликозилирования.
Как и где появляются сахарные модификации?
Гликаны сперва синтезируются в виде предшественника на мембранах эндоплазматического ретикулума и там же ковалентно прикрепляются к строго определенной аминокислотной последовательности уже синтезированного белка. После этого начальный гликоконъюгат переносится в аппарат Гольджи, где гликан может остаться как есть либо претерпеть тримминг — стрижку ненужных сахаридов — с последующей достройкой до новой сахарной структуры. Этим занимается огромное количество ферментов гликозилтрансфераз, которые строго специфичны к тому, какой моносахарид, куда и каким образом они присоединяют [13].
Как именно клетка решает, что за гликан будет построен для конкретного белка, — этого ученые пока не знают наверняка. Но уже известно, что гликаны важны для правильного фолдинга (пространственного сворачивания) белка, а значит, сама зарождающаяся трехмерная структура может диктовать максимально стабилизирующую ее молекулу полисахарида [14]. Помимо этого, на возможность постройки гликана будет влиять доступность исполнителей (ферментов) и материала (набора моносахаридов). Одни лишь эти факторы — достаточно непредсказуемы и зависят от генетического статуса клетки (генотипа и мутаций экспрессии генов), от уровня экспрессии генов и от клеточного гомеостаза в данный момент времени. Всё это взаимосвязано и может регулироваться как внутренними стимулами клетки, так и факторами среды. Такая беспрецедентная пластичность — настоящее испытание для системных биологов и синтетической биологии в целом. Сейчас даже нет исчерпывающих данных обо всех условиях, обеспечивающих появление того или иного гликана, не говоря уже о предсказании и нацеленном синтезе желаемых структур.
Получившиеся гликоконъюгаты либо секретируются наружу, либо остаются связанными с клеточной мембраной и становятся компонентом гликокаликса, формируя структурно-функциональный рельеф клетки (рис. 1). Таким образом, что бы ни приблизилось к клетке, будь то белок, другая клетка или микроорганизм, в первую очередь оно соприкоснется с клеточной «сахарной шубой» [15]. Интересно заметить, что этот рельеф напрямую не закодирован в геноме, однако наследуется дочерними клетками после деления и чрезвычайно важен для правильного их функционирования [7]. Секретируемые же гликоконъюгаты формируют межклеточный матрикс, появление которого считается одним из важных эволюционных шагов к формированию многоклеточности [16]. Матрикс необходим для координированной работы клеток: дифференциации, пространственной локализации, межклеточной коммуникации, передвижения и транспорта. Таким образом, вероятнее всего, гликаны были на передовой эволюции многоклеточности и дальнейшего усложнения организмов, обусловливая необходимую коммуникацию между клетками единого организма.
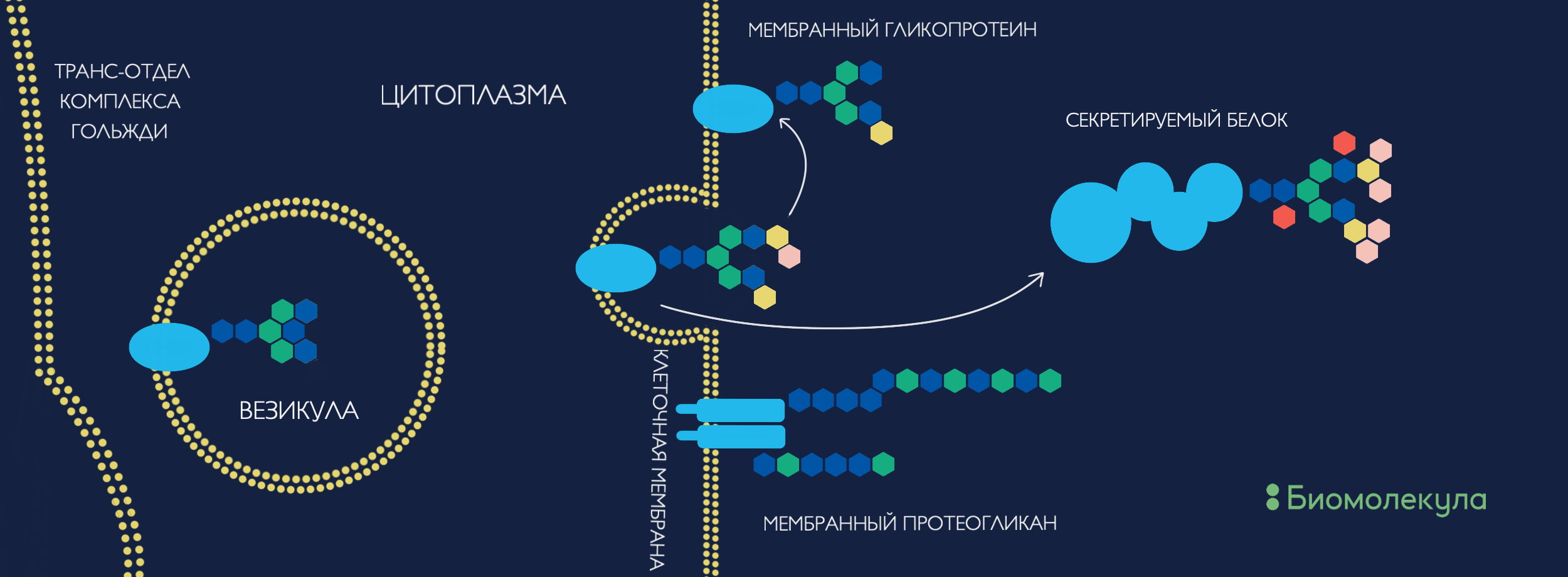
Рисунок 1. Так гликаны попадают на поверхность клетки и создают ее структурно-функциональный рельеф. В эндоплазматическом ретикулуме происходит синтез предшественника с восемью маннозами, который цепляется к определенной последовательности аминокислот на белке-мишени. Уже вместе они путешествуют через отделы комплекса Гольджи, где гликан может структурно изменяться и редактироваться до финальной формы. Если гликопротеин останется связанным с мембраной, то поучаствует в формировании ландшафта клеточной поверхности. Незаякоренные гликопротеины могут секретироваться в межклеточное пространство, аналогично немодифицированным белкам. Такие ребята в основном займутся постройкой и регуляцией функционирования межклеточного матрикса и клеточных взаимоотношений.
иллюстрация автора статьи
Какими бывают гликаны?
Если гликаны составляют до 90–95% от общей массы белка, они могут быть весьма однообразны — состоять из довольно длинных цепочек чередующихся дисахаридных звеньев, прикрепленных к разным частям белка. Тогда такой гликоконъюгат (белок + полисахарид) будет называться протеогликаном. Большая масса протеогликанов секретируется клетками, составляет межклеточный матрикс и выполняет структурную функцию, например, в составе костей или роговице глаза. Углеводная часть превосходно связывает воду, обеспечивая большую массу и упругость соединительной ткани, и в протеогликанах является основным структурным и функциональным компонентом. Но не стоит забывать, что существенная часть гликокаликса состоит из протеогликанов, выполняющих в основном механическую защитную функцию.
Намного интереснее ситуация, когда гликаны являются меньшей частью гликоконъюгата. Такой вариант молекул называют гликопротеинами. Чаще всего в этом случае мы имеем дело с N- или O-гликозилированием (по обозначению атома присоединения гликанов на белке — азота или кислорода).
Помимо большего набора сахарных «кирпичиков» для постройки, по сравнению с протеогликанами, эти типы гликозилирования еще и характеризуются куда более вариативной системой ветвления и межмоносахаридных связей, а значит, и невероятно бóльшим разнообразием структур (нагляднее — смотрите на рисунке 2).
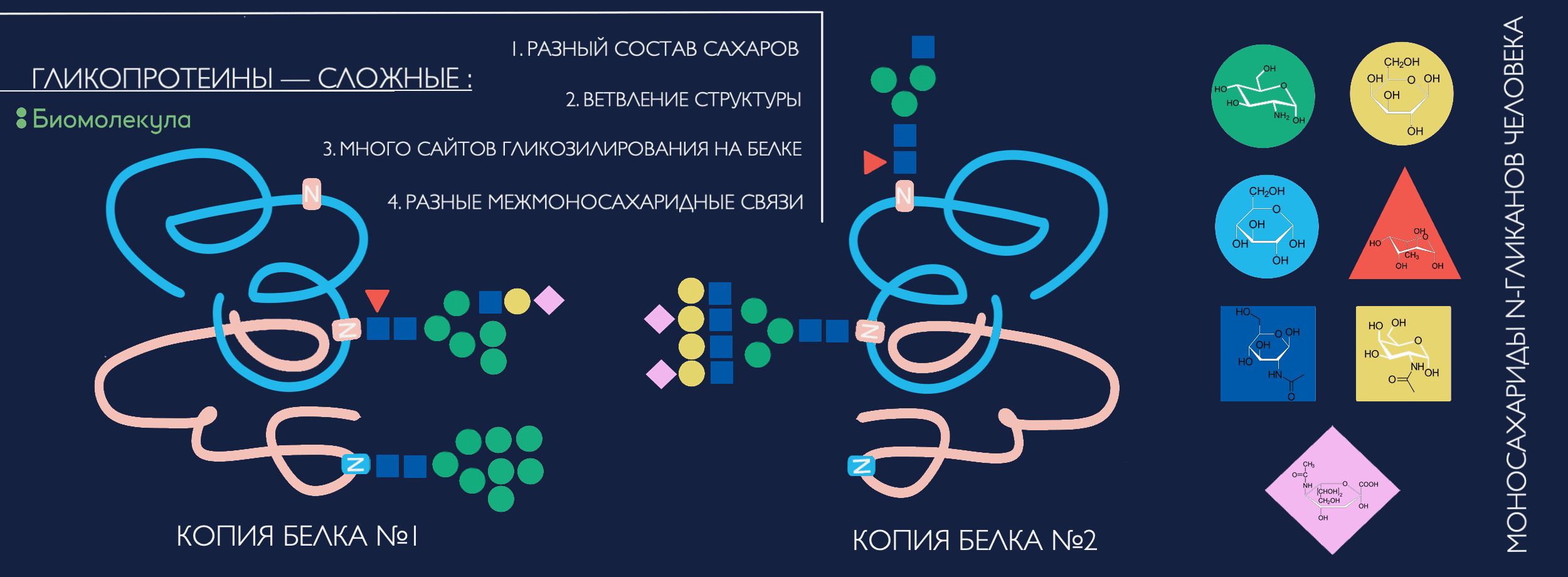
Рисунок 2. Откуда появляется многообразие гликопротеинов? Разные наборы кирпичиков-сахаридов (чаще более 10 штук) могут быть по-разному собраны в целостные структуры. Варьировать может ветвление антенн гликана, позиция отдельных моносахаридов (особенно фукозы) и тип химической связи между моносахаридами, что обусловливает создание функционально важных изомеров. И не стоит забывать, что на каждой отдельной молекуле белка может быть несколько сайтов гликозилирования (вплоть до сотни и даже больше) с разными гликанами, а разные молекулы того же белка могут нести отличающийся набор гликанов или не быть модифицированы вовсе... Ух! И всё это может меняться со временем под влиянием внешних и внутренних факторов.
иллюстрация автора статьи
Сейчас предполагается, что в человеческом организме существует до 10 000 разных гликанов, что вполне возможно хотя бы с точки зрения комбинаторики и учитывая известные пути биосинтеза гликанов. Принимая во внимание, что на одном белке может быть более сотни сайтов гликозилирования, количество их возможных комбинаций лишь на одной копии одного белка поражает воображение. А также сильно сбавляет энтузиазм ученых-аналитиков, обескураживая сложностью анализа, — пожалуй, это одна из главных причин долгого избегания гликобиологии и ее относительной молодости. Однако скачкообразное развитие методов и приборов для гликоанализа повлекло за собой огромный массив новых исследований — через сахарную призму даже давно изученные функции белков и целых организмов стали выглядеть совсем иначе.
Что гликаны могут делать?
Вы можете спросить: «Неужели структура каждого из них настолько важна для функционирования белка и неужели она так сильно его меняет?» Наиболее правильным ответом будет: «Пока мы еще не знаем». Но далеко не исключено, что так и есть. Примером этому может служить важный для зачатия и вынашивания ребенка белок гликоделин, аминокислотная последовательность которого одинакова и у женщин, и у мужчин, зато разительно различается гликозилирование. У женщин бóльшая часть его гликоформ работает как контрацептив (мешает проникновению сператозоидов в яйцеклетку), тогда как мужской вариант, напротив, стимулирует контакт сперматозоида с яйцеклеткой [17].
Раз уж речь зашла об оплодотворении, нельзя не отметить, насколько ключевым фактором является гликозилирование и в этом процессе [18]. Как таковой, сперматозоид чужероден для женского организма и должен бы запустить иммунную реакцию. Однако он (как и некоторые вирусы!) несет на клеточной мембране белки, модифицированные гликанами с сиаловыми кислотами в составе, что позволяет адаптироваться во враждебной среде. Для сближения с яйцеклеткой эти сахара должны быть убраны — иначе не произойдет оплодотворение. В свою очередь, в защитную оболочку ооцита человека (zona pellucida) встроено четыре гликопротеина. Гликаны на них являются лигандами для рецепторов сперматозоида, инициирующих акросомную реакцию (высвобождение растворяющих эту защитную оболочку ферментов из головки сперматозоида) и, как следствие, проникновение сперматозоида внутрь. В процессе проникновения сперматозоида в яйцеклетке запускается цепочка биохимических процессов, приводящих к отщеплению сахаров от гликопротеинов оболочки яйцеклетки и так называемому «блоку полиспермии» — недопущению проникновения более одного сперматозоида в ооцит. Таким образом, даже самое начало нашей жизни никак не обходится без сахаров.
Совсем недавно на «Биомолекуле» появился постер о тонкостях процесса оплодотворения: «Через тернии к звездам» [19]. А о zona pellucida есть отдельная заметка: «Рецептор для сперматозоида» [20].
В целом, биологические функции гликанов очень сложно классифицировать и обобщить, так как почти вся поверхность любой клетки покрыта разнообразными гликоконъюгатами. А это значит, что любое действие, в котором участвуют эти молекулы, — от оплодотворения до клеточной смерти — будет зависеть от корректного гликозилирования.
Суммируя грубо, гликаны выполняют структурную и запасающую функции (например, гликоген в мышцах и печени и ламинин — важнейший для эмбрионального развития и структуры тканей гликопротеин), функцию молекулярной мимикрии (важную для патогенных и симбиотических организмов, и для ситуации, описанной чуть выше), а также функцию специфических рецепторов для других молекул (чаще всего гликансвязывающих белков, иначе называемых лектинами). Последнее обеспечивает едва ли не все процессы межклеточной коммуникации (а на этом основаны едва ли не все известные биологические функции клеток), их миграцию и взаимодействие в пределах клеточных формаций. Разнообразие уже изученных лектинов довольно велико, и информация о них продолжает пополняться, обогащая наши знания о системной биологии белок-углеводного взаимодействия.
Приведем еще пару примеров поворотной роли гликанов в функционировании белков.
Самым известным (и в то же время — самым неожиданным) будет AB0-система определения группы крови. По системе АВ0 группы крови делятся на А, В, АВ и 0 (нулевую). Вероятнее всего, вы знаете, почему не все эти группы крови совместимы между собой . Однако именно характерная олигосахаридная группа в составе белковых или липидных антигенов на поверхности эритроцитов (рис. 3) обусловливает эту разницу и, соответственно, кросс-реакцию собственных агглютининов на перелитую чужеродную кровь. Интересно заметить, что гликаны скорее запускают специфические реакции врожденного иммунитета, тогда как на белки реагирует специфический приобретенный иммунитет.
Про агглютинины и наследование групп крови можно прочитать в статье «“Кровавая” работа врачей, ученых и природы» [21].
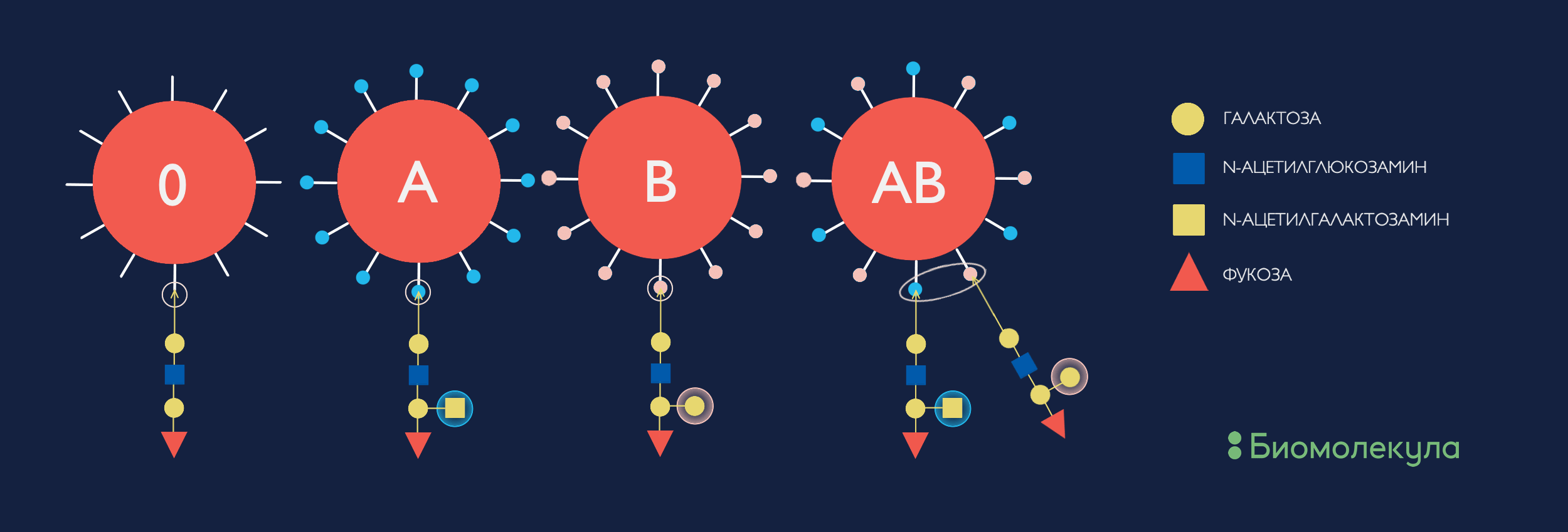
Рисунок 3. Углеводные детерминанты системы групп крови AB0. Как мы видим, отличия в O-гликанах совсем небольшие, но какой эффект!
иллюстрация автора статьи по Glycans and cells
И, пожалуй, в 2020 году никакая статья не может считаться полной без упоминания коронавируса . Как мы уже говорили выше, патогенные организмы неплохо защищаются от запуска приобретенного иммунного ответа, прикрывая белковые эпитопы менее иммуногенными сахарами. В то время как наш организм научился распознавать бактериальные липополисахариды (и генерировать штормовой врожденный иммунный ответ, о котором можно почитать в [22]), вирусные частицы обладают врожденным преимуществом. Так как синтез новых вирионов проходит внутри клетки хозяина, вирусные белки посттрансляционно модифицируются (читайте — маскируются) гликанами, похожими на хозяйские [23]. В зависимости от строения капсида вирионы могут иметь разную плотность «сахарного щита», что определит степень уязвимости вириона для приобретенных специфических иммунных реакций организма, то есть эффективно работающих антител. Хорошие новости в том, что плотность углеводной оболочки коронавирусов оказывается не такой уж высокой по сравнению с другими «знаменитыми» вирусами [23]. А значит, в теории, можно ожидать довольно хороший гуморальный ответ на SARS-CoV-2.
Если вас интересуют последние новости о пандемии нового коронавируса (не обманывайте, это всех сейчас интересует) — добро пожаловать в регулярно пополняемую рубрику SARS-CoV-2.
Однако стоит упомянуть и о чуть менее радостных новостях — о составе углеводной оболочки нового коронавируса. Чаще всего вирусы выставляют на поверхность гликаны олигоманнозного или высокоманнозного типа, так как эти гликаны появляются первыми в процессе биосинтеза гликанов и их проще наставить по принципу «тяп-ляп» [24], [25]. Наша иммунная система давно научилась быстро реагировать на большие количества манноз на поверхности белков — это зачастую является сигналом чужеродных инфекционных агентов (например бактерий) или патологических процессов внутри клеток (рака, вирусных инфекций). Сайт-специфический анализ гликанов SARS-CoV-2 показал, что этот вирус более предусмотрителен: на поверхности его капсида очень много гликанов так называемого complex type (сложных олигосахаридов) [25], [26]. А это, увы, может означать, что этот коронавирус лучше прячется от нашего иммунного ответа.
Со стороны нашей иммунной системы сахарные модификации тоже играют не последнюю роль. Fc-фрагмент молекул иммуноглобулина G в норме гликозилирован, и эта модификация напрямую влияет на правильность трехмерной структуры и даже на протекание иммунного ответа. Например, наличие или отсутствие всего лишь одного моносахарида (фукозы) в составе углевода на специфичном к патогену иммуноглобулине G может привести либо к запуску цитотоксического Т-клеточного иммунного ответа, либо к активации каскада комплемента и сборке комплекса белков, повреждающего мембрану клетки-мишени (рис. 4) [27]. Обе функции важны для нейтрализации патогена, но в зависимости от протекания иммунного ответа один или другой может быть более предпочтителен.

Рисунок 4. Как себя поведет связанный с антигеном IgG, зависит всего лишь от «маленького красного треугольника» фукозы. Если гликан тяжелой цепи иммуноглобулина G не фукозилирован, то комплекс антиген—антитело провзаимодействует с Fcγ-рецептором на поверхности иммунных клеток и запустит цитотоксический иммунный ответ. Если же гликан фукозилирован, то несколько комплексов антиген—антитело одновременно свяжутся с гексамером из копий белка C1q (субъединиц белка комплемента С1) и запустят классический путь каскада комплемента и образование мембраноатакующего комплекса.
иллюстрация автора статьи по [27]
В последние годы всё быстрее развивается терапевтическое применение биотехнологически синтезированных антител в медицине, особенно широкими шагами идет иммунотерапия онкологических заболеваний. Более подробно про технологию и ее применение можно прочитать в статье «Биотехнология антител» [28]. Раз такое небольшое изменение в углеводной части антитела может привести к весьма драматическим функциональным последствиям, тщательный контроль качества и постоянный мониторинг профиля гликозилирования обязателен для любого биотех-производства. Помимо того, гликозилирование иммуноглобулина G напрямую влияет на период полувыведения из организма и общую стабильность антитела, а значит, общую эффективность и безопасность продукта. Вдобавок, как и любой лекарственный препарат, моноклональные антитела имеют срок действия патента, после истечения которого возможно производство дженериков. В контексте биотех-фармакологии такие препараты чаще называются биосимилярами: в отличие от малых химических молекул их сложно сделать абсолютно идентичными оригиналу по структуре. Но их можно сделать очень сильно похожими на оригинал и подтвердить, что эффективность аналогична. И как вы, наверное, уже догадались, и здесь повторение паттерна гликозилирования важно для получения биомолекулы со сходными с патентом свойствами.
Комбинаторное разнообразие, привнесенное гликанами в структуру строго закодированного в геноме белка, обусловливает важное свойство организма — эпигенетическую адаптируемость, дополнительный уровень усложнения внутренней саморегуляции и взаимодействия с внешней средой. Вдобавок, этот пул новых, постоянно адаптирующихся молекул не привносит изменений в геном, что не только обеспечивает необходимую пластичность организма на «эпипротеомном» уровне, но и более эволюционно полезно, так как не рискует уже упорядоченными в геноме базовыми важнейшими функциями.
Методы изучения гликопротеома
Толщину этой новой главы биологической науки еще сложно достоверно оценить, ведь гликобиология — весьма молодая дисциплина. Интерес к биохимии и метаболизму углеводов возник в первой четверти ХХ века, однако тогда их воспринимали лишь как источник энергии или структурный материал для организма, и не ожидали от них никаких других биологических активностей. Даже в 1970-х — годах взрывного интереса к молекулярной биологии — исследования углеводов катастрофически игнорировались и не поспевали за изучением триады ДНК—РНК—белок. Годами «белковые» и «углеводные» научные сообщества оперировали едва ли не независимо, создавая отдельные архивы гликанов и белков. Мы уже знаем, что углеводные модификации белков могут быть поистине огромными и часто превышать массу самого белкового остова.
Это заставляет задуматься, почему же гликобиология является такой молодой наукой, и как же, добросовестно изучая структуры и функции белков, ученые умудрялись игнорировать гликаны столь долго. По большей части это объясняется структурной сложностью гликомодификаций, которая не вытекает из последовательности геномной ДНК. При имеющихся тогда методах молекулярной биологии расшифровка последовательности углеводных структур была невероятна сложна. Не следует забывать, что на одной клетке могут быть десятки тысяч молекул гликопротеинов, на каждой из них — десятки разных гликанов.
Однако с развитием технологического оснащения (и особенно — методов масс-спектрометрии) гликобиология привлекает всё больший интерес и приобретает всё большее признание.
Так что же за методы используются для изучения гликопротеома?
По аналогии с антителами — рабочими лошадками для избирательной детекции макромолекул в образцах, — мы можем определять углеводы с помощью лектинов — белков, специфически распознающих углеводы или их определенные фрагменты. Лектины и их избирательность во взаимодействии с углеводами являются основой огромного числа молекулярных процессов, протекающих в организме. Однако, если в теории мы можем «натравить» иммунную систему на любой антиген (в том числе и углеводный остаток) и получить специфическое антитело, с лектинами такого не получится: их избирательность уже определена закодированной в геноме структурой. Но ввиду огромного разнообразия лектинов в клетках растений и животных мы почти всегда можем подобрать подходящую для углеводной мишени ловушку. Лектины куда проще и дешевле синтезировать или выделять в больших масштабах.
На рисунке 5 показаны популярные методы, использующие лектины в качестве детектора или наживки [29]. Основой их всех являются принципы сродства двух биологических молекул, благодаря которому мы можем охарактеризовать углеводные структуры в образце, подтвердить наличие нужной углеводной детерминанты или же отфильтровать молекулы с интересующими углеводами в составе для последующего анализа. Последний подход часто используется в подготовке проб для повышения чувствительности и селективности метода.
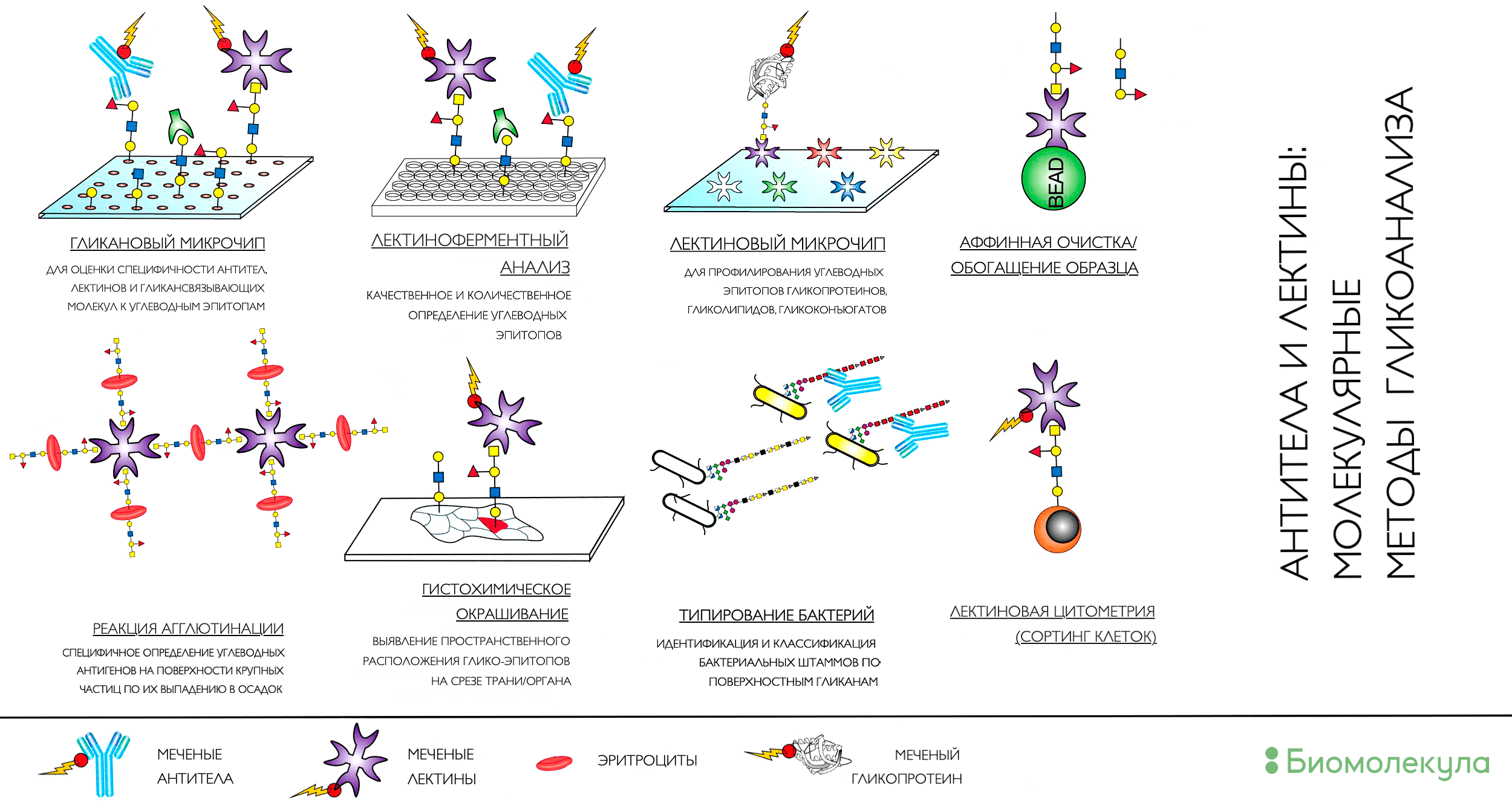
Рисунок 5. Лектины (гликансвязывающие белки) в молекулярной биологии могут быть как инструментом, так и целью эксперимента. Понимание работы лектинов очень важно для функциональной гликобиологии, стремящейся расшифровать устройство «сахарного кода» на поверхности клеток. Но они же являются очень специфичным инструментом для детекции и обогащения молекул с определенными гликомодификаторами.
[29], рисунок адаптирован
Как пример рассмотрим подход к поиску новых онкологических биомаркеров в сыворотке крови. Подавляющее большинство известных сегодня циркулирующих онкомаркеров (например, раковый эмбриональный антиген (РЭА) или альфа-фетопротеин (АФП)) попадают в кровь после секреции раковыми или окружающими их клетками и по структуре являются гликопротеинами, и ученым было бы интересно обогатить именно эту фракцию [30]. Для этих целей можно использовать препаративную афинную хроматографию, где панель иммобилизованных лектинов будет улавливать все гликопротеины в составе образца.
Давайте представим себе, что мы хотим проанализировать отдельно взятый образец гликопротеина с несколькими сайтами N-гликозилирования. Мы помним, что из-за нешаблонной сборки, на отдельно взятой молекуле этого белка могут быть несколько разные гликаны на каждом единичном сайте. А также мы помним, что сама структура каждого гликана может быть очень важна. Какие методы могут охарактеризовать каждый аспект этой проблемы (рис. 6)?

Рисунок 6. Три уровня анализа гликопротеинов: анализируем глубже, точнее и шире
иллюстрация автора статьи
Для начала мы можем оценить, какие гликаны вообще присутствуют в этом образце белка. Для этого мы отсоединим все углеводные модификации от белкового скелета. Это можно сделать с помощью бактериального фермента N-гликозидазы F либо в результате химических реакций, разрушающих белковый остов, но оставляющих сахара нетронутыми. Первый метод используется для получения N-связанных гликанов, второй — чаще для О-гликанов.
После очистки и концентрирования полученных сахаров, нам нужно понять, как установить их состав и структуру.
Стоит отметить, что вероятность наличия в полученном образце более чем одного гликана стремится к единице. Даже если наш белок содержит лишь один сайт гликозилирования, каждая копия этого белка может нести несколько иной вариант гликомодификации. Такой феномен называется микрогетерогенностью гликозилирования и является прямым следствием не шаблонной, но ферментативной сборки углеводного полимера. А раз в нашем образце находится не одна молекула, а несколько, необходимо их как-то разделить и уже затем по очереди отправлять в анализатор или детектор.
Для большинства задач биоаналитической химии, требующих высокой производительности, высокоэффективная жидкостная хроматография (ВЭЖХ) [31] остается самым популярным методом разделения сложных образцов, и гликаны не оказались исключением. ВЭЖХ не только позволяет существенно сократить время одного разделения (вплоть до 5–10 минут!), но и обеспечивает высокую воспроизводимость и повторяемость результатов. Последнее очень важно в том случае, если идентификация гликанов происходит путем сравнения скорости их схода с колонки с набором стандартов. Тогда детекторы — UV-детектор или флуоресцентный — входят в состав системы разделения и регистрируют сигнал схода с колонки. Так как гликаны сами по себе не поглощают ультрафиолет и не флуоресцируют, перед хроматографией необходимо модифицировать стандарты и экспериментальные образцы подходящей меткой.
Другой вариант детекции — это масс-спектрометр [32]. Он зачастую не требует химической модификации образцов и по сути своей функционирует как очень точные молекулярные весы, способные определить массу и состав молекулы. Вдобавок к этому, тандемная масс-спектрометрия может позволить узнать структуру исследуемого гликана. В этом подходе мы сперва определяем молекулярную массу целой молекулы, затем дробим ее на части и (в тандеме с первым измерением) узнаём массу осколков. После чего с помощью компьютерных программ (а иногда даже вручную) собираем полученный паззл и определяем пространственную структуру углеводного полимера. До повсеместного распространения масс-спектрометров и точных аналитических стандартов сахаров эта же задача установления первичной структуры решалась биохимическими методами. Экзогликозидазы — ферменты, специфически отщепляющие определенные моносахариды с конца гликана, — последовательно добавляли к одному и тому же образцу смеси гликанов. Дальше хроматографический анализ проводили после каждой реакции, оценивали изменения во времени миграции и интенсивности сигнала. Идеология такого подхода очень напоминает метод белкового секвенирования по Эдману [32].
Однако не только ВЭЖХ может использоваться как метод разделения. Очень популярным и эффективным методом для анализа гликанов оказался капиллярный электрофорез (КЭ). Изначально метод завоевал популярность среди исследователей ДНК и РНК, и лишь потом ученые осознали, что им можно делить что угодно, практически любые молекулы. В системе КЭ соединения мигрируют в зависимости от их электрофоретической мобильности, которая зависит от размера и заряда молекулы. КЭ — очень простая система, по сути своей — очень тонкая трубка с буфером, к концам которой прикладывается электрический потенциал (рис. 8). Детекция после разделения в системе КЭ может осуществляться теми же методами, что и в ВЭЖХ: UV- и флуоресцентным детекторами и (тандемной) масс-спектрометрией [31].
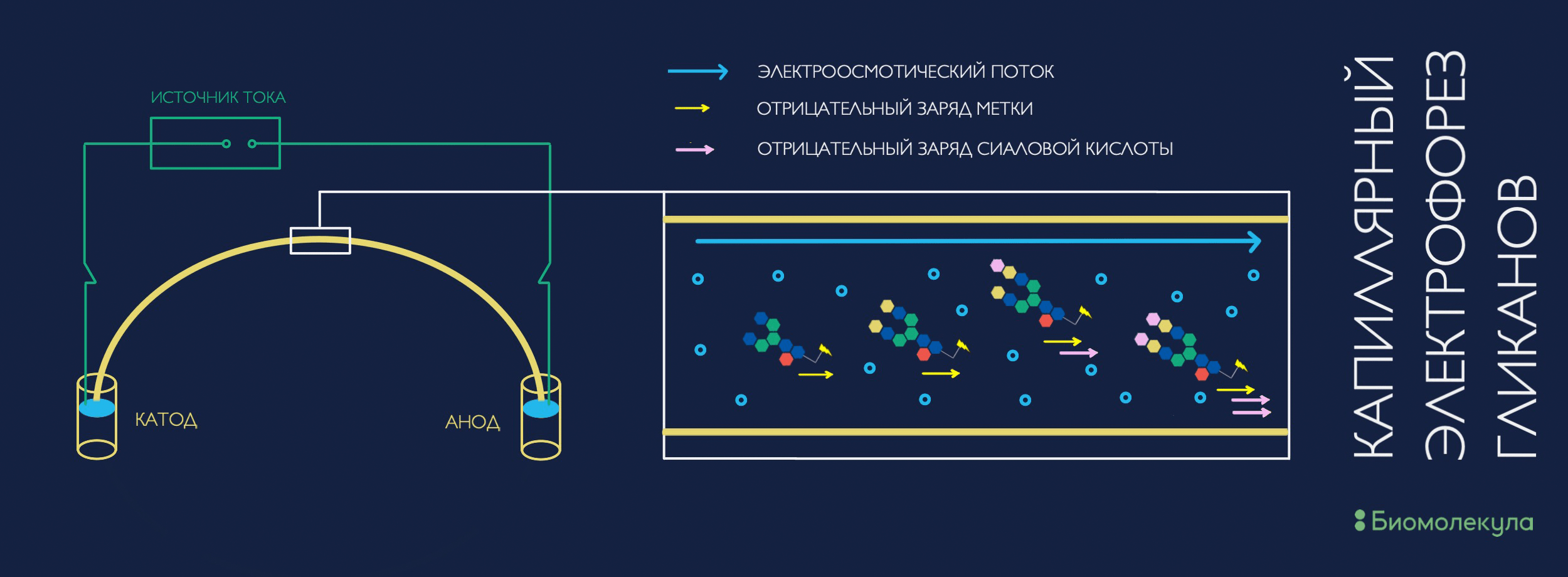
Рисунок 8. Схема устройства системы капиллярного электрофореза и процесса разделения в ней гликанов. Скорость миграции зависит от их заряда и размера (электрофоретической подвижности), а также от скорости движения окружающего их буферного раствора (электроосмотического потока).
иллюстрация автора статьи по [31]
Оба предыдущих варианта анализа подходят и для следующего уровня разбора нашего гипотетического гликопротеина — сайт-специфического картирования гликанов. В этом варианте мы оставляем гликаны прикрепленными к пептидному остову, но обрабатываем белок специфической протеазой, например, трипсином. В результате применения этого стандартного для протеомики [32] метода получится смесь пептидов и гликопептидов, которую мы можем анализировать тем же способом, что и свободные гликаны: разделением и детекцией. Однако в этом случае оптимальным детектором все же станет масс-спектрометр. Во-первых, гликопептидных стандартов для расчета времени миграции обычно не производят. Во-вторых, тандемная масс-спектрометрия может одномоментно понять структурный состав гликана и последовательность несущего его пептида.
Такой подход имеет несколько преимуществ перед простой оценкой набора углеводных модификаций. Во-первых, если белок имеет больше одного предполагаемого сайта гликозилирования, мы можем узнать, какие именно гликаны находятся в той или иной части молекулы. Во-вторых, если в образце больше одного гликопротеина или мы не уверены в качестве очистки препарата, это сразу станет очевидно по пептидному остову.
Третий уровень анализа — самый крупный, простой и в то же время безумный. А что если мы просто возьмем наш гликопротеин, ничего с ним делать не будем и сразу отправим в хроматограф? При достаточной мощности разделения и очень высоком разрешении масс-спектрометра такой подход может сработать и показать сразу всё множество гликоформ нашего гликопротеина. Попытки так называемого анализа интактного (полноразмерного) белка начали всё чаще встречаться в публикациях, шагая рука об руку с инструментальным и вычислительным прогрессом. Однако до сих пор самыми успешными выходят лишь попытки проанализировать сравнительно небольшие белки с одним, максимум двумя сайтами гликозилирования.
Также важным аспектом в анализе гликозилирования становится внедрение высокопроизводительных методов анализа. Гликомика — широкомасштабное изучение всех гликанов в биологической системе или целом организме — ввиду ее сложности по праву является такой же «-омикой», как и геномика, метаболомика и протеомика [33]. Аналогично белковому фингерпринту, биологическая система может иметь и углеводный отпечаток. Этот тип данных активно используется для понимания системных биологических процессов и для поиска биомаркеров различных состояний организма (в том числе и патологических). Получение такого фингерпринта возможно как с помощью высокоавтоматизированных версий уже описанных вариантов анализа свободных гликанов всей системы (отдельной единичной клетки, ткани, плазмы крови), так и с использованием MALDI масс-спектрометрии. В этом случае после отщепления углеводов их отправляют в масс-спектрометр без предварительного разделения, таким образом получая не точный профиль, но относительно густонаселенный отпечаток масс содержащихся в образце гликанов. По их точной массе можно предположить их моносахаридный состав, но главное, как и в случае протеомики, их можно легко и быстро сравнить между собой.
Все методы, упомянутые выше, относятся к структурному анализу гликанов и гликопротеинов, скорее служащим для охвата разнообразия и накопления данных о составе гликомодификаций белков различных организмов. Однако для построения сколь-либо однозначных заключений об организации, механизмах и ролях компонентов системы гликозилирования необходимы классические функциональные гликомные и гликобиологические исследования — об информации, зашифрованной в гликоме организма, и о том, как и при каких условиях ее считывают и расшифровывают гликансвязывающие белки — лектины, — передавая сигнал дальше. Пока гликопротеомика становится на ноги, наращивая технологические мощности, функциональной гликомике предстоит еще подрасти и перевернуть системную биологию и наше понимание функционирования клеток.
Заключение
Подводя итоги, хотелось бы вернуться в самое начало статьи и поставить на нем акцент. Пускай гликобиология молодая, сложная и часто незаслуженно игнорируемая генетиками и другими учеными наука, не стоит повторять ошибку исследователей ХХ века и воспринимать углеводы лишь как энергоемкий компонент еды. Потенциал гликобиологии и гликомики в объяснении работы иммунитета, взаимодействия с ним патогенов, клеточного сигналинга и коммуникации, эмбрионального развития и онтогенеза, в синтетической биологии и исследованиях биомаркеров настолько огромен и далек, что пока сложно оценить его реальные масштабы, но не замечать уже невозможно. Поэтому в следующей статье цикла мы поговорим про гликобиологию, всё выше поднимающую голову в аспекте медицины. Почему именно углеводы могут сказать новое слово в биотехе и здоровье организма? Почему белок не может прийти в организм голым, и почему нам не хватает белков, РНК и малых молекул? Об этом — в следующий раз.
Литература
- Jun Hirabayashi. (2004). On the Origin of Glycome and Saccharide Recognition. Trends in Glycoscience and Glycotechnology. 16, 63-85;
- Drazen Petrov, Christian Margreitter, Melanie Grandits, Chris Oostenbrink, Bojan Zagrovic. (2013). A Systematic Framework for Molecular Dynamics Simulations of Protein Post-Translational Modifications. PLoS Comput Biol. 9, e1003154;
- E.M.Martin Del Valle. (2004). Cyclodextrins and their uses: a review. Process Biochemistry. 39, 1033-1046;
- Sampada Chitale, Joshua S. Derasp, Bashir Hussain, Kashif Tanveer, André M. Beauchemin. (2016). Carbohydrates as efficient catalysts for the hydration of α-amino nitriles. Chem. Commun.. 52, 13147-13150;
- Monireh Dashty. (2013). A quick look at biochemistry: Carbohydrate metabolism. Clinical Biochemistry. 46, 1339-1352;
- Hirt R.P.and Horner D.S. Organelles, genomes and eukaryote phylogeny: an evolutionary synthesis in the age of genomics. CRC Press, 2004;
- Cavalier-Smith T. The membranome and membrane heredity in development and evolution. In: Hirt R.P.and Horner D.S. Organelles, genomes and eukaryote phylogeny: an evolutionary synthesis in the age of genomics. CRC Press, 2004. P. 335–351;
- Andrea Du Toit. (2013). Ciliary membrane inheritance directs ciliogenesis. Nat Rev Mol Cell Biol. 14, 750-751;
- Andrei L. Lomize, Mikhail A. Lomize, Shean R. Krolicki, Irina D. Pogozheva. (2017). Membranome: a database for proteome-wide analysis of single-pass membrane proteins. Nucleic Acids Res. 45, D250-D255;
- Robert Stern, Mark J. Jedrzejas. (2008). Carbohydrate Polymers at the Center of Life’s Origins: The Importance of Molecular Processivity. Chem. Rev.. 108, 5061-5085;
- Laurence Burroughs, Paul A. Clarke, Henrietta Forintos, James A. R. Gilks, Christopher J. Hayes, et. al.. (2012). Asymmetric organocatalytic formation of protected and unprotected tetroses under potentially prebiotic conditions. Org. Biomol. Chem.. 10, 1565;
- Andrew M. Steer, Nicolas Bia, David K. Smith, Paul A. Clarke. (2017). Prebiotic synthesis of 2-deoxy-d-ribose from interstellar building blocks promoted by amino esters or amino nitriles. Chem. Commun.. 53, 10362-10365;
- Rini J.M. and Esko J.D. Glycosyltransferases and glycan-processing enzymes. In: Essentials of glycobiology (3rd Edition) / ed. by Varki A., Cummings R.D., Esko J.D. et al. NY: Cold Spring Harbor Laboratory Press, 2017;
- Проблема фолдинга белка;
- P. Gagneux, A. Varki. (1999). Evolutionary considerations in relating oligosaccharide diversity to biological function. Glycobiology. 9, 747-755;
- Richard O. Hynes. (2009). The Extracellular Matrix: Not Just Pretty Fibrils. Science. 326, 1216-1219;
- M. Seppälä, H. Koistinen, R. Koistinen, P.C.N. Chiu, W.S.B. Yeung. (2007). Glycosylation related actions of glycodelin: gamete, cumulus cell, immune cell and clinical associations. Human Reproduction Update. 13, 275-287;
- Philip C.N. Chiu, Ben S.T. Wong, Man-Kin Chung, Kevin K.W. Lam, Ronald T.K. Pang, et. al.. (2008). Effects of Native Human Zona Pellucida Glycoproteins 3 and 4 on Acrosome Reaction and Zona Pellucida Binding of Human Spermatozoa. Biology of Reproduction. 79, 869-877;
- Через тернии к звездам;
- Рецептор для сперматозоида;
- «Кровавая» работа врачей, ученых и природы;
- Иммунологическая Нобелевская премия (2011);
- Ieva Bagdonaite, Hans H Wandall. (2018). Global aspects of viral glycosylation. Glycobiology. 28, 443-467;
- Ian A. York, James Stevens, Irina V. Alymova. (2019). Influenza virus N-linked glycosylation and innate immunity. Bioscience Reports. 39;
- Stanley P., Schachter H., Taniguchi N. N-Glycans. In: Essentials of glycobiology (2nd Edition) / ed. by Varki A., Cummings R.D., Esko J.D. et al. NY: Cold Spring Harbor Laboratory Press, 2009;
- Yasunori Watanabe, Joel D. Allen, Daniel Wrapp, Jason S. McLellan, Max Crispin. (2020). Site-specific glycan analysis of the SARS-CoV-2 spike. Science. eabb9983;
- Gillian Dekkers, Louise Treffers, Rosina Plomp, Arthur E. H. Bentlage, Marcella de Boer, et. al.. (2017). Decoding the Human Immunoglobulin G-Glycan Repertoire Reveals a Spectrum of Fc-Receptor- and Complement-Mediated-Effector Activities. Front. Immunol.. 8;
- Биотехнология антител;
- Cummings R.D., Darvill A.G., Etzler M.E., Hahn M.G. Glycan-recognizing probes as tools. In: Essentials of glycobiology (3rd Edition) / ed. by Varki A., Cummings R.D., Esko J.D. et al. NY: Cold Spring Harbor Laboratory Press, 2017;
- Shuwei Li, Stefani N. Thomas, Shuang Yang. (2017). Glycoprotein Biomarkers. Targeted Biomarker Quantitation by LC-MS. 245-272;
- 12 методов в картинках: очистка молекул и разделение смесей;
- 12 методов в картинках: протеомика;
- «Омики» — эпоха большой биологии.








