Через тернии к звездам
20 ноября 2019
Через тернии к звездам
- 2092
- 0
- 4
-
Автор
-
Редакторы
Постер на конкурс «био/мол/текст»: Увлекательное путешествие сперматозоида из влагалища к яйцеклетке. Миллионы, огромное количество сперматозоидов, сравнимое с населением, например, Польши, попадает во влагалище в составе эякулята. Однако до яйцеклетки — конечного пункта назначения, добираются лишь сотни, чтобы единственный̆ счастливчик оплодотворил ее. Какой̆ квест проходят мужские половые клетки в половых путях женщины, лишаясь своих собратьев? Давайте разберемся, пройдя увлекательную игру по пути сперматозоида!
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
1. Ready—Set—Go!
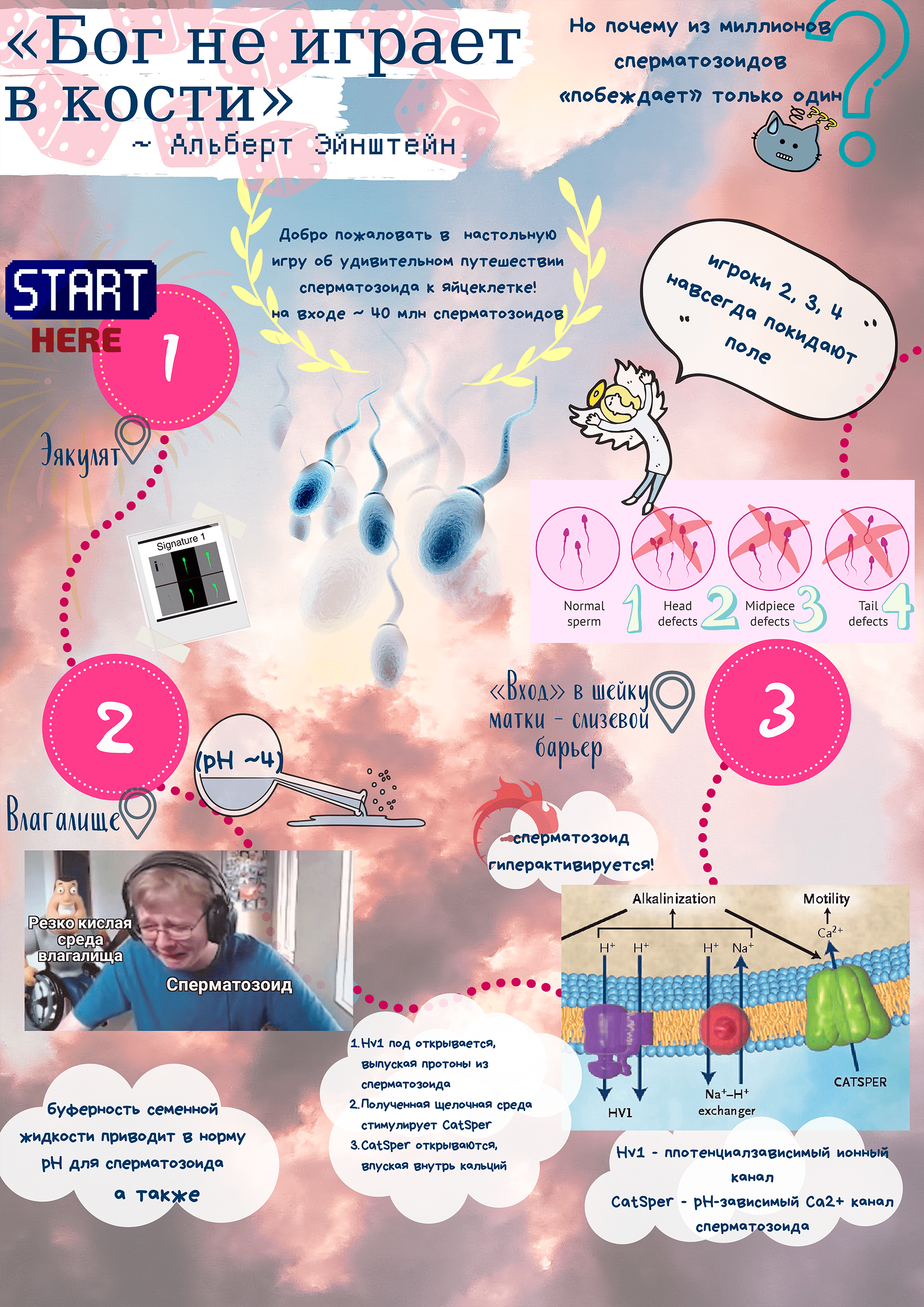
2. Уже первая станция — влагалище, оказывает далеко не радушный прием гостям. Резко кислая среда (pH ~4), необходимая для предотвращения инфекций, несовместима с нормальными условиями для сперматозоида — он вязнет и обездвиживается. Чтобы повысить щелочность внутри себя, сперматозоид запускает специальные ионные каналы — белковые агрегаты на мембране, регулирующие передвижение веществ и ток ионов сквозь клетку. Основной ионный канал сперматозоида Hv1 открывается, выпуская протоны из сперматозоида, — таким образом внутренняя среда защелачивается. Защелачивание вызывает открытие pH-зависимого Ca2+ канала CatSper — он, в свою очередь, «впускает внутрь» ионы кальция. Внутриклеточный кальций гиперактивирует сперматозоид, обеспечивает ему те самые хлесткие и резкие движения, что помогает справиться со следующей задачей — пройти сквозь слизь шейки матки и попасть внутрь.
3. В слизи шейки матки застревают сперматозоиды неправильного строения — двухголовые, двухвостовые или с другими дефектами. Они неспособны пробиться сквозь этот слизевой барьер! Получается такой естественный отбор прямо на месте.

4. Святая святых — матка — встречает наших пилигримов... вооруженными силами: армией нейтрофилов и макрофагов — иммунных клеток женщины! Вообще-то их функция — стоять на страже здоровья и предотвращать инфекции в матке, но так уж получилось, что они нападают на сперматозоидов, «обстреливая» их активными формами кислорода (reactive oxygen species, ROS). Может показаться, что матка — действительно какая-то камера пыток, чистилище сперматозоидов. Однако свободные радикалы воздействуют на сперматозоиды, запуская биохимический цикл, приводящий к структурным изменениям в их мембранах. Эти изменения приводят к увеличению оплодотворяющей способности: за счет большей ионной проницаемости, повышения текучести мембран и активации белков, которые потом будут участвовать в связывании сперматозоида и яйцеклетки. В частности, ROS вызывают запуск важнейшего вторичного посредника — циклического аденозиомономосфата (цАМФ). Он ингибирует тирозинфосфатазу, что позволяет фосфорилировать остатки тирозина в важных для оплодотворения белках. Весь этот процесс — капацитация — биохимическая перестройка сперматозоидов под влиянием микросреды в матке, в результате которой они обретают оплодотворяющую способность. К слову, работа Hv1 и CatSper — тоже стадии капацитации.
5. А сколько по времени может занимать все путешествие? Несмотря на гиперактивацию, капацитацию и то, что сперматозоиды — такие молодцы, передвигаются они с весьма низкой скоростью — несколько десятков микрометров в секунду. Самостоятельное путешествие заняло бы несколько часов! Тут уж матка решила помочь беднягам и ускорить их: в нашей игре это сектор «Приз» на барабане! При оргазме стенки матки сокращаются, способствуя продвижению сперматозоидов дальше. Такое путешествие займет примерно полчаса.
6. Капацитировавшие сперматозоиды на предпоследнем этапе своей жизни делятся на два потока, ведущих к двум фаллопиевым трубам. Это очень важный «выбор» в жизни хвостатого, ибо лишь в одной из них можно встретить яйцеклетку. Причем возможно, что сперматозоид действительно осознанно подходит к делу — показано, например, что активность CatSper зависит не только от pH внутри сперматозоида, но и от концентрации гормона прогестерона, который как нельзя кстати выделяется оболочками яйцеклетки. Внимательный читатель поймет, что прогестерон, таким образом, является еще одним фактором капацитации, — это показано на сперматозоидах макак резусов. Но очень хочется назвать эту прогестерон-сперматозоидную связь... хемотаксисом в сперматозоидах. Задумайтесь: клетки оболочки как бы протягивают прогестероновую руку плывущему на веслах любви сперматозоиду! Пока что авторы статей лишь скромно выдвигают гипотезы, признаваясь, что необходимы дальнейшие исследования механизмов этих процессов. А я оставляю слово «выбор» в кавычках.

7. На судьбоносное рандеву яйцеклетка приходит в многослойной шубе, то есть в оболочках:
- Zona pellucida (надмембранный гликопротеиновый слой).
- Corona radiata (слой фолликулярных клеток, сформированный еще в яичнике).
А теперь... экшн!!
Сотни или около того оставшихся сперматозоидов подплывают к яйцеклетке, каждый пытается пробраться сквозь клетки corona radiata и открыть заветную дверь — оплодотворить яйцеклетку. Биохимически это подразумевает еще несколько действий:
- Связывание белков мембраны сперматозоида с рецепторами ZP3 на поверхности Zona pellucida. Эта реакция провоцирует выброс ферментов из специализированного органоида сперматозоида – акросомы; а ферменты растворяют оболочки яйцеклетки в месте контакта половых клеток.
- Последующие изменения в концентрации ионов кальция контролируют выстрел так называемых кортикальных гранул. Это органоиды яйцеклетки, модифицирующие ее оболочки после оплодотворения. Например, они содержат протеазы, растворяющие ZP3 и другие рецепторы, предотвращая связывание с другими сперматозоидами.
- Так яйцеклетка защищается от полиспермии — оплодотворения бóльшим, чем один, числом сперматозоидов, поскольку такие эмбрионы нежизнеспособны.
В яйцеклетку из сперматозоида заходит только ядро и молекулы РНК. Но и дальше не все так просто — яйцеклетка (ооцит I порядка) завершает мейоз, ядра сливаются, а сперматозоидная РНК тоже способна влиять на фенотип эмбриона за счет эпигенетических перестроек... впрочем, это уже совсем другая история, хотя не менее интересная и обсуждаемая в науке!
Удивительно то, что красной линией сквозь все эти процессы идет концентрация цинка. Давно известно, что цинк является элементом мужского плодородия и накапливается в семенниках, где в составе металлопротеинов выполняет такие важнейшие для развития сперматозоидов функции, как стабилизация сперматозоидного хроматина, подавление транскрипции в сперматозоидах, убиквитинирование белков и т. д.
Для капацитации, наоборот, необходимо отсутствие цинка как, например, ингибитора CatSper, а также акрозина и MMP2 — белков акросомной мембраны, важных для проникновения сперматозоида сквозь ZP (Zona pellucida). Так что поддержание высокой концентрации цинка до попадания в женские половые органы обязательно — чтобы сперматозоид не капацитировал до поры до времени, ибо pre-capacitated spermatozoa — тоже патология.
Наша недремлющая яйцеклетка тем временем использует эту «фичу» цинка в своих, антиполиспермических целях. Сразу же после оплодотворения она устраивает толпящимся вокруг нее остаточным сперматозоидам цинковую баньку — масштабный выброс цинка в ZP, чтобы уж точно больше никому не достаться.
Итого: в течение жизни, а главное — пути сперматозоида к яйцеклетке, — концентрация цинка в нем меняется. Исследователи придумали этому явлению название Zinc Signature — цинковая подпись, — причем разная в зависимости от стадии капацитации и, косвенно, положения в женских половых органах. Хотя исследования цинковой подписи пока что проводили только in vitro (интересно, а как бы это организовать in vivo? :) ), на карте игры цинковая подпись перенесена картинками со сперматозоидами, покрашенными флуоресцентным зеленым красителем. Где есть цинк и чем его больше, там зеленое свечение насыщеннее.
А знаете, в чем еще большая красота? В том, что таким образом измерение концентрации цинка может помочь диагностировать низкокачественные сперматозоиды и отбирать сперматозоиды для искусственного оплодотворения. И так ведь очень часто происходит в науке: сначала какое-то проявление природы интригует страстного исследователя, а потом оказывается, что его открытия спасают жизни. Или на них летят ракеты в космос. Да просто люди становятся счастливее!
Удивительное дело: с одной стороны, все этапы на пути сперматозоида — действительно какая-то игра на выживание: и кислотность влагалища, и мукополисахариды шейки матки, и атака нейтрофилов. А с другой, что нас не убивает — делает сильнее, так и биохимические испытания в женских половых путях как бы готовят сперматозоид к самому важному событию в его жизни.
Литература
- WHO laboratory manual for the examination and processing of human semen (5th Edition). WHO, 2010. — 287 p.;
- Anatomy and physiology. OpenStax CNX, 2013;
- Horacio B Croxatto. (2002). Physiology of gamete and embryo transport through the Fallopian tube. Reproductive BioMedicine Online. 4, 160-169;
- Polina V. Lishko, Inna L. Botchkina, Andriy Fedorenko, Yuriy Kirichok. (2010). Acid Extrusion from Human Spermatozoa Is Mediated by Flagellar Voltage-Gated Proton Channel. Cell. 140, 327-337;
- C. L.R. Barratt, R. J. Aitken, L. Bjorndahl, D. T. Carrell, P. de Boer, et. al.. (2010). Sperm DNA: organization, protection and vulnerability: from basic science to clinical applications--a position report. Human Reproduction. 25, 824-838;
- Thomas E. DeCoursey. (2018). Voltage and pH sensing by the voltage-gated proton channel, H V 1. J. R. Soc. Interface. 15, 20180108;
- S.S. Suarez, A. A. Pacey. (2006). Sperm transport in the female reproductive tract. Human Reproduction Update. 12, 23-37;
- Polina V. Lishko, Yuriy Kirichok. (2010). The role of Hv1 and CatSper channels in sperm activation. The Journal of Physiology. 588, 4667-4672;
- Shi-Kai Jin, Wan-Xi Yang. (2017). Factors and pathways involved in capacitation: how are they regulated?. Oncotarget. 8;
- Katerina Georgadaki, Nikolas Khoury, Demetrios A. Spandidos, Vasilis Zoumpourlis. (2016). The molecular basis of fertilization (Review). International Journal of Molecular Medicine. 38, 979-986;
- Hillary Wagner, Julie W. Cheng, Edmund Y. Ko. (2018). Role of reactive oxygen species in male infertility: An updated review of literature. Arab Journal of Urology. 16, 35-43;
- Shiho Sumigama, Steven Mansell, Melissa Miller, Polina V. Lishko, Gary N. Cherr, et. al.. (2015). Progesterone Accelerates the Completion of Sperm Capacitation and Activates CatSper Channel in Spermatozoa from the Rhesus Macaque1. Biology of Reproduction. 93;
- Maria E. Teves, Hector A. Guidobaldi, Diego R. Uñates, Raul Sanchez, Werner Miska, et. al.. (2009). Molecular Mechanism for Human Sperm Chemotaxis Mediated by Progesterone. PLoS ONE. 4, e8211;
- Meritxell Jodar, Sellappan Selvaraju, Edward Sendler, Michael P. Diamond, Stephen A. Krawetz, for the Reproductive Medicine Network. (2013). The presence, role and clinical use of spermatozoal RNAs. Human Reproduction Update. 19, 604-624;
- Karl Kerns, Michal Zigo, Erma Z. Drobnis, Miriam Sutovsky, Peter Sutovsky. (2018). Zinc ion flux during mammalian sperm capacitation. Nat Commun. 9.