Цинковые пальцы смерти
30 января 2017
Цинковые пальцы смерти
- 4900
- 0
- 9
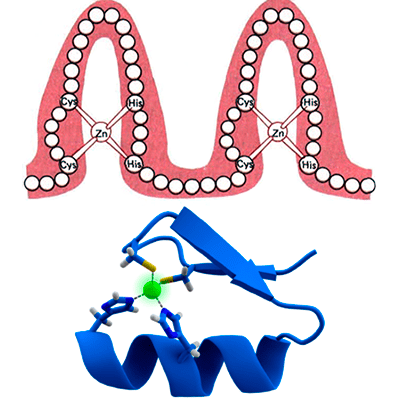
Схема строения типичных белковых мотивов «цинковые пальцы». Чаще всего цинковый палец состоит из 20 аминокислот. Ион цинка связан с двумя гистидинами и двумя цистеинами.
сайт studopedia.su и «Википедия»
-
Автор
-
Редакторы
Белковый комплекс под названием шелтерин связывается с теломерными повторами и защищает их от деградации. Однако недавно обнаружили, что у него есть конкурент с менее мягким характером: белок TZAP с одиннадцатью цинковыми пальцами способен специфически связываться с теломерами хромосом, но не оберегать, а обрезать их. В нормальных условиях он клетке помогает, но если дать волю его пальцам, TZAP основательно «пощиплет» теломеры, а это может довести клетку до самоубийства.
Для нормального функционирования клеток эукариот очень важна длина теломер — концевых участков хромосом. Теломеры состоят из коротких повторов ДНК (TTAGGG) и почти 200 белков, выполняющих множество важных функций — от синтеза ДНК до защиты теломеры [1].
До января 2017 года был известен лишь один белковый комплекс, специфически взаимодействующий с ДНК-повторами теломеры, — шелтерин. Но теперь ученые обнаружили еще один белок, обладающий сродством к участкам TTAGGG. Благодаря особым ДНК-связывающим мотивам (см. заглавную картинку) этот белок в зависимости от условий может убить клетку, а может и спасти [1].
Новый белок, открытый Эросом Лаццерини Денчи и Джулией Су Джоу Ли (рис. 5) — учеными из Исследовательского института Скриппс в США, — наряду с шелтерином играет важную роль в гомеостазе хромосомных теломер. Ученые назвали его теломерным белком с цинковыми пальцами (TZAP, telomeric zinc-finger associated protein).

Рисунок 5. Профессор Денчи и студентка Ли.
сайт scripps.edu
Отличительная черта TZAP — 11 цинковых пальцев, которыми он «хватается» за TTAGGG-повторы теломер. При этом оказалось, что для эффективного взаимодействия с ДНК белку необходимы только три последних пальца, Znf9–11 (рис. 6). Связываясь с ДНК, TZAP инициирует «стрижку» теломер: из них вырезаются шестинуклеотидные повторы [1].
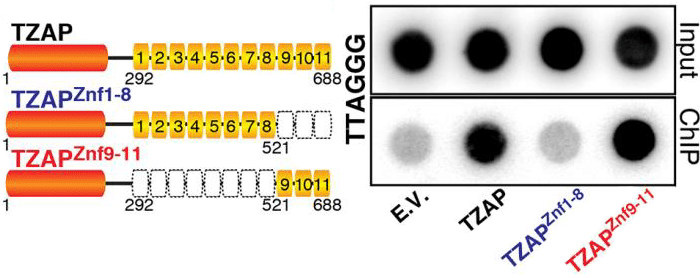
Рисунок 6. Три последних пальца требуются TZAP для присоединения к теломерной ДНК. Слева — Варианты белка TZAP: целый, с восемью первыми пальцами (Znf1–8) и с тремя последними (Znf9–11). Справа — Эксперимент по взаимодействию трех вариантов TZAP с теломерой. С ДНК связывается лишь целый белок и белок с тремя последними пальцами.
TZAP присоединяется к теломерам как в клетках с работающей теломеразой, так и в клетках без нее. При этом белок не нуждается во взаимодействии с компонентами шелтерина [1].
TZAP предпочитает присоединяться к длинным теломерам. Это показали в эксперименте с клетками HeLa: одна их линия содержала теломеры длиной 5 т.п.н., вторая — 20 т.п.н. TZAP соединялся с теломерами второй линии и совсем не проявлял интереса к теломерам из первой. Оказалось, что количество шелтерина (в том числе и его субъединицы TRF2) в клетке постоянно и не зависит от длины теломер. Поэтому на длинных теломерах могут «обнажаться» повторы TTAGGG, свободные от TRF2. К ним-то и тянется своими пальцами TZAP. Причем конкурирует за субстрат он именно с TRF2, а не с TRF1. При повышенной экспрессии гена TRF2 количество присоединенного к ДНК TZAP сокращается [1].
В то же время в клетках с повышенной экспрессией гена TZAP, лишенных теломеразы (как в обычных соматических клетках), хромосомы быстро теряли теломеры (рис. 7). В итоге появлялись клетки с хромосомами вообще без теломер. Видимо, при высокой концентрации TZAP теснит в конкурентной борьбе TRF2, получая возможность ухватиться пальцами за повторы и «подстричь» теломеру «под ноль». А это приводит к печальным последствиям: хромосомным аберрациям, сенесценции клеток и апоптозу [1].
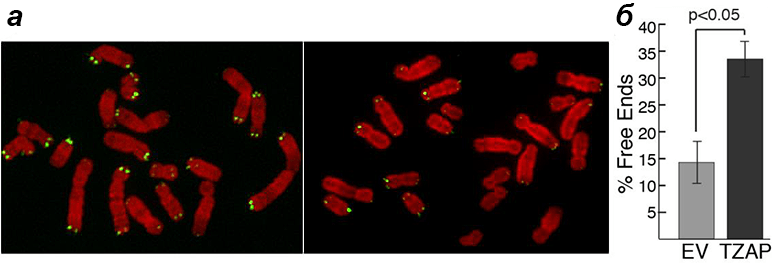
Рисунок 7. Эксперимент с гиперэкспрессией TZAP в клетках без теломеразы. а — Хромосомы в обычной клетке (слева) и в клетке с повышенной экспрессией TZAP (справа). Зелеными точками помечены теломеры. б — Процентное соотношение количества хромосом с лишенными теломер концами в обоих вариантах.
В клетках с нормальным балансом TRF2/TZAP последнему позволено лишь следить за тем, чтобы теломера не стала слишком длинной. Эту функцию TZAP выполняет и в эмбриональных стволовых клетках: при экспериментальной делеции генов TZAP теломеры в стволовых клетках существенно удлинялись, а после введения экзогенного TZAP возвращались к норме [1].
Известно, что слишком длинные теломеры могут способствовать трансформации клетки в раковую, разрешая ей бóльшее количество делений, чем положено. Получается, что TZAP, регулируя максимальную длину теломер, участвует в защите организма от возникновения опухолей [1]. Но если синтез TRF2 вдруг нарушится, крючковатые пальцы TZAP тут же потянутся к теломерам, чтобы резать, резать и резать... До самой клеточной смерти.
Эти клеточные часы должны быть очень точно настроены, чтобы позволять клеткам делиться достаточное количество раз, развивая дифференцированные ткани организма и поддерживая возобновляемые, и в то же самое время препятствовать появлению злокачественных клеток.
Литература
- Li J.S., Miralles Fuste J., Simavorian T., Bartocci C., Tsai J., Karlseder J., Lazzerini Denchi E. (2017). TZAP: a telomere-associated protein involved in telomere length control. Science. 355, 638–641;
- Википедия: «Теломеры»;
- Зверева М.Э., Щербакова Д.М., Донцова О.А. (2010). Теломераза: структура, функции и пути регуляции активности. Успехи биологической химии. 50, 155–202;
- Capper R., Britt-Compton B., Tankimanova M., Rowson J., Letsolo B., Man S. et al. (2007). The nature of telomere fusion and a definition of the critical telomere length in human cells. Genes Dev. 21, 2495–2508;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Старение — плата за подавление раковых опухолей?;
- Теломеры и новые мишени протоонкогенной терапии;
- Длина теломер и времена года;
- Википедия: «Теломераза»;
- Рубцова М.П., Василькова Д.П., Малявко А.Н., Нарайкина Ю.В., Зверева М.Э., Донцова О.А. (2012). Функции теломеразы: удлинение теломер и не только. Acta Naturae. 4, 44–61;
- Janknecht R. (2004). On the road to immortality: hTERT upregulation in cancer cells. FEBS Lett. 564, 9–13;
- Bollmann F.M. (2007). Targeting ALT: the role of alternative lengthening of telomeres in pathogenesis and prevention of cancer. Cancer Treat. Rev. 33, 704–709;
- Википедия: «Шелтерин»;
- Panero J., Santos P.D., Slavutsky I. (2017). Telomere protein complexes and their role in lymphoid malignancies. Front. Biosci. (Schol. Ed.). 9, 17–30;
- de Lange T. (2005). Shelterin: the protein complex that shapes and safeguards human telomeres. Genes Dev. 19, 2100–2110;
- TSRI scientists discover master regulator of cellular aging. (2017). The Scripps Research Institute.