
Теломеры и новые мишени протоонкогенной терапии
09 февраля 2015
Теломеры и новые мишени протоонкогенной терапии
- 2217
- 0
- 2
ALT (alternative lengthening of telomeres) — один из механизмов удлинения концов ДНК, который используется раковыми клетками.
Рисунок в полном размере.
-
Автор
-
Редактор
Теломеры — это не просто концы молекулы ДНК, а важный регуляторный элемент. Механизмы их удлинения представляют большой интерес для науки и медицины. Данная статья посвящена открытию новых деталей регуляции длины теломер в раковых клетках, а также потенциальному терапевтическому агенту против остеосаркомы и глиобластомы.
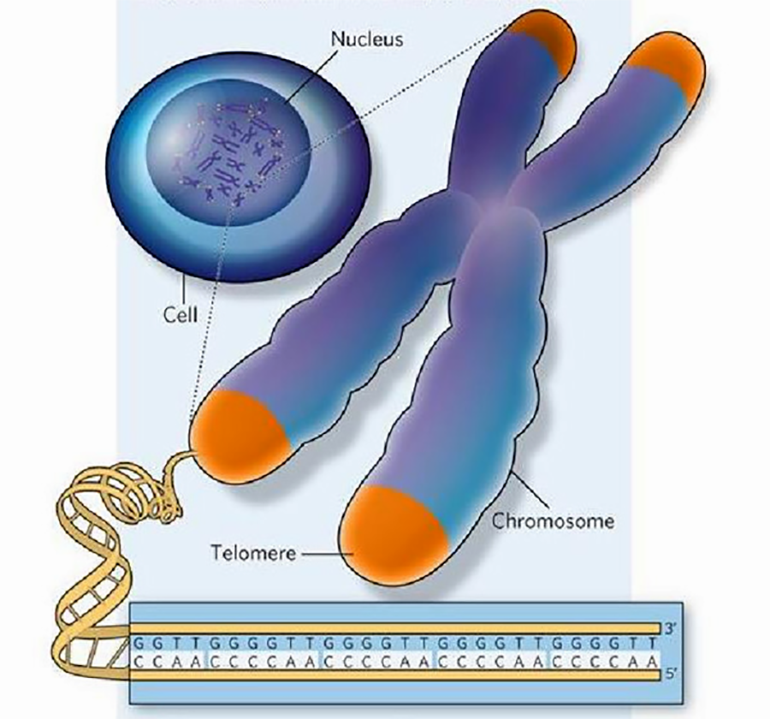
Рисунок 1. Локализация и нуклеотидная последовательность теломер. Концевые фрагменты хромосом содержат длинные нуклеотидные повторы (приведенная последовательность характерна для Tetrahymena). Эти зоны называются теломерами (показаны оранжевым) и играют важную регуляторную роль в жизни клетки.
Генетический материал эукариот представлен молекулами ДНК, которые уложены определенным образом, взаимодействуя с белками и образуя хромосомы. Особенно плотно ДНК упакована во время деления клетки. В хромосомах можно выделить определенные структуры, в частности, на их концах имеются теломеры, состоящие из тандемных нуклеотидных повторов (рис. 1). У человека последовательность 5’—TTAGGG—3’ повторяется
Механизм удвоения генетического материала устроен так, что теломерные повторы не могут воспроизводиться полностью. Поэтому после каждого деления клетки концы хромосом укорачиваются. Когда они становятся слишком маленькими, то появляется угроза повреждения экспрессируемых участков генома: «обглоданные», уже не защищенные шелтерином, концы хромосом активируют репарацию ДНК, что приводит к различным мутациям вплоть до хромосомных аберраций. Во избежание таких нарушений «постаревшая» клетка перестает делиться. Получается, репликативное старение просто необходимо, ведь слишком большое число делений порождает множество мутаций и ведет к онкогенезу [2].
Однако описанный алгоритм в природе не универсален: длина теломерной ДНК у разных организмов (а иногда и у одного и того же) может со временем как уменьшаться, так и расти [3]. Например, раковые клетки способны делиться бесконечно. В них работают специальные механизмы для восстановления концов хромосом. Удлиняться теломеры могут двумя способами. Во-первых, с помощью специального фермента — теломеразы, который достраивает концевые повторы ДНК [4]. В нормальных клетках взрослого организма этот фермент не работает, но при патологии может активироваться. Во-вторых, существует путь удлинения концов хромосом с помощью гомологичной рекомбинации [5–7]. Его также называют альтернативным путем удлинения теломер — ALT (alternative lengthening of telomeres). Интересно, что такой механизм является основным в ряде опухолей, например, в остеосаркоме и глиобластоме [8]. Получается, что такие опухоли попадают в зависимость от рекомбинации, а это уже можно использовать в терапевтических целях.
Почему гомологичная рекомбинация концов ДНК становится возможной?
Молекула ДНК представляет собой двойную спираль. Когда создается копия генома для дальнейшего деления клетки, то двойная спираль частично расплетается и появляются участки одноцепочечной ДНК. Такие участки покрываются специальным белком — репликационным белком А [9], за счет чего приобретают способность к гомологичной рекомбинации. Обычно этот белок связан с теломерами временно [10], [11]. А именно — в момент синтеза дочерней цепи ДНК. Однако при патологии репликационный белок А не уходит с теломерных участков, способствуя развитию «назапланированных» рекомбинационных событий [12].
Роль некодирующей РНК в удлинении теломер
Известно, что при реализации генетической информации с ДНК считывается РНК, а с РНК — белок. Но так происходит не всегда. Наравне с молекулами РНК, кодирующими белок, синтезируются некодирующие РНК, которые выполняют разнообразные важные функции в клетке. Вот и в гомологичной рекомбинации концов хромосом без них не обошлось. Оказалось, что репликационный белок А поддерживает особая некодирующая РНК (TERRA — telomere repeat-containing RNA) [10–15]. Именно ее регуляция и нарушается в раковых клетках. Обнаружили, что эту некодирующую РНК должен убирать с теломер белок ATRX — АТФ-зависимая хеликаза, ремоделирующая хроматин. Выстроилась такая последовательность событий: когда ATRX перестает правильно работать, некодирующая РНК продолжает удерживать репликационный белок А на ДНК дольше, чем необходимо, и концы ДНК становятся готовыми к удлинению [12].
Важно заметить, что просто описанной подготовки теломер недостаточно для их удлинения путем гомологичной рекомбинации. Видимо, это только один из ключевых моментов.
Прикладное значение
Изучать механизмы восстановления теломер интересно не только с точки зрения фундаментальной науки. Ученые разрабатывают подходы к применению таких знаний в терапии злокачественных опухолей. Проверка предположения, что ингибирование ключевых белков, ответственных за рекомбинацию, может специфично убивать раковые клетки, дала положительный результат (рис. 2).
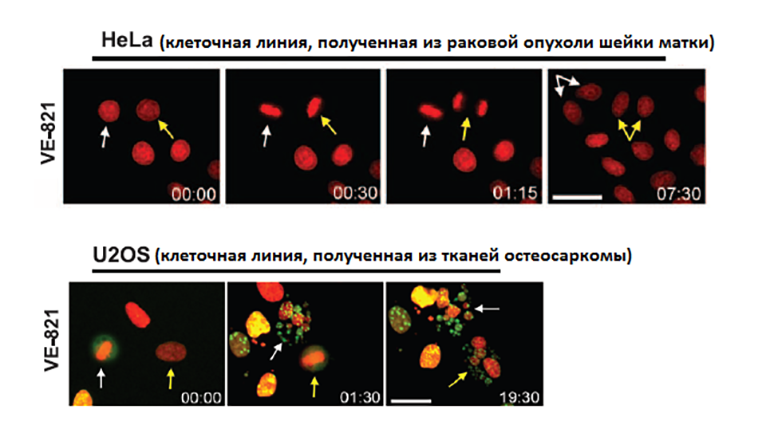
Рисунок 2. Действие ингибитора VE-821 на клеточные линии HeLa и U2OS. Изменения фиксировались через определенные промежутки времени. Желтые и белые стрелки указывают на клетки, которые переходят в следующую фазу клеточного цикла и начинают делиться. Клетки HeLa (верхняя панель) не чувствительны к действию ингибитора, т.к. для удлинения теломер используют теломеразу, а не гомологичную рекомбинацию. Клетки остеосаркомы под действием ингибитора перестают делиться и разрушаются.
адаптировано из [12]
Было выявлено разрушительное действие на клетки опухолей ингибитора протеинкиназы ATR, которую репликационный белок А привлекает для осуществления рекомбинации. Ингибитор VE-821 избирательно воздействовал на клетки, способные удлинять теломеры с помощью гомологичной рекомбинации. Он вызывал фрагментацию их хромосом и способствовал клеточной гибели. Интересно, что ингибитор считают безопасным для нормальных тканей. Проверка воздействия VE-821 на клетки эпителия выявила лишь замедление их деления, но не гибель. Ингибитор оказался бесполезным для предотвращения роста опухолей, в которых концы ДНК удлиняются с помощью теломеразы. Однако VE-821 эффективно блокирует деление клеток, полученных из остеосаркомы и детской глиобластомы, что авторы исследования [12] и предлагают использовать в терапевтических целях.
Литература
- Старение — плата за подавление раковых опухолей?;
- Вероятность возникновения рака зависит от количества делений стволовых клеток;
- Хромосомные концы не перестают удивлять;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Jerry W. Shay, Woodring E. Wright. (2011). Role of telomeres and telomerase in cancer. Seminars in Cancer Biology. 21, 349-353;
- S. E. Artandi, R. A. DePinho. (2010). Telomeres and telomerase in cancer. Carcinogenesis. 31, 9-18;
- Anthony J. Cesare, Roger R. Reddel. (2010). Alternative lengthening of telomeres: models, mechanisms and implications. Nat Rev Genet. 11, 319-330;
- Christopher M. Heaphy, Andrea P. Subhawong, Seung-Mo Hong, Michael G. Goggins, Elizabeth A. Montgomery, et. al.. (2011). Prevalence of the Alternative Lengthening of Telomeres Telomere Maintenance Mechanism in Human Cancer Subtypes. The American Journal of Pathology. 179, 1608-1615;
- Marc S. Wold. (1997). REPLICATION PROTEIN A: A Heterotrimeric, Single-Stranded DNA-Binding Protein Required for Eukaryotic DNA Metabolism. Annu. Rev. Biochem.. 66, 61-92;
- Rachel Litman Flynn, Richard C. Centore, Roderick J. O’Sullivan, Rekha Rai, Alice Tse, et. al.. (2011). TERRA and hnRNPA1 orchestrate an RPA-to-POT1 switch on telomeric single-stranded DNA. Nature. 471, 532-536;
- Vera Schramke, Pierre Luciano, Vanessa Brevet, Sylvine Guillot, Yves Corda, et. al.. (2004). RPA regulates telomerase action by providing Est1p access to chromosome ends. Nat Genet. 36, 46-54;
- Rachel Litman Flynn, Kelli E. Cox, Maya Jeitany, Hiroaki Wakimoto, Alysia R. Bryll, et. al.. (2015). Alternative lengthening of telomeres renders cancer cells hypersensitive to ATR inhibitors. Science. 347, 273-277;
- Claus M. Azzalin, Patrick Reichenbach, Lela Khoriauli, Elena Giulotto, Joachim Lingner. (2007). Telomeric Repeat–Containing RNA and RNA Surveillance Factors at Mammalian Chromosome Ends. Science. 318, 798-801;
- Antonio Porro, Sascha Feuerhahn, Patrick Reichenbach, Joachim Lingner. (2010). Molecular Dissection of Telomeric Repeat-Containing RNA Biogenesis Unveils the Presence of Distinct and Multiple Regulatory Pathways. Molecular and Cellular Biology. 30, 4808-4817;
- Stefan Schoeftner, Maria A. Blasco. (2008). Developmentally regulated transcription of mammalian telomeres by DNA-dependent RNA polymerase II. Nat Cell Biol. 10, 228-236.






