«Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе
05 октября 2009
«Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе
- 13738
- 9
- 10
В отличие от бактерий, имеющих кольцевую хромосому, хромосомы эукариот устроены линейно, и концы ДНК «подрезаются» при каждом делении. Чтобы избежать порчи важных генов, окончания каждой хромосомы защищены теломерами.
-
Автор
-
Редакторы
В 2009 году Нобелевская премия по физиологии и медицине вручена трём американским учёным, разрешившим важную биологическую проблему: как хромосомы при делении клетки копируются полностью, без того, чтобы ДНК на их кончиках укорачивалась? В результате их исследований стало известно, что «защитным колпачком» для хромосом служат особым образом устроенные окончания ДНК — теломеры, достройкой которых занимается специальный фермент — теломераза.
Длинная нитеобразная молекула ДНК — главный компонент хромосом, несущий генетическую информацию, — с обоих концов закрыта своего рода «заглушками» — теломерами. Теломеры представляют собой участки ДНК с уникальной последовательностью и защищают хромосомы от деградации. Это открытие принадлежит двум лауреатам Нобелевской премии по физиологии и медицине за 2009 г. — Элизабет Блэкберн (Elizabeth Blackburn), уроженке США и в настоящее время сотруднице Университета Калифорнии (Сан-Франциско, США), и Джеку Шостаку (Jack Szostak), профессору Института Ховарда Хьюза. Элизабет Блэкберн в сотрудничестве с третьим лауреатом премии этого года — Кэрол Грейдер (Carol Greider), сотрудницей Университета Джона Хопкинса, — открыла в 1984 году фермент теломеразу, синтезирующий ДНК теломер (и тем самым достраивая их после неизбежного при каждом копировании хромосомы укорачивания). Таким образом, исследования, отмеченные премией в этом году (около 975 тысяч евро, поделенные поровну между лауреатами), объясняют, как теломеры защищают кончики хромосом, и как теломераза синтезирует теломеры.
Давно отмечено, что старение клетки сопровождается укорачиванием теломер. И, наоборот, в клетках с высокой активностью теломеразы, достраивающей теломеры, длина последних остается неизменной, и старение не наступает. Это, кстати, относится и к «вечно молодым» раковым клеткам, в которых механизм естественного ограничения роста не действует. (А для некоторых наследственных заболеваний характерна дефектная теломераза, что приводит к преждевременному клеточному старению.) Присуждение за работы в этой области Нобелевской премии является признанием фундаментального значения этих механизмов в живой клетке и огромного прикладного потенциала, заложенного в отмеченных работах.
Таинственная теломера
В хромосомах содержится наш геном, а «физическим» носителем генетической информации являются молекулы ДНК. Ещё в 1930 году Герман Мёллер (лауреат Нобелевской премии по физиологии и медицине 1946 года «за открытие появления мутаций под влиянием рентгеновского облучения») и Барбара Мак-Клинток (лауреат Нобелевской премии в той же категории 1983 года «за открытие транспозирующих генетических систем») обнаружили, что структуры на концах хромосом — так называемые теломеры — предотвращали слипание хромосом между собой. Было высказано предположение, что теломеры выполняют защитную функцию, но механизм этого явления оставался совершенно неизвестным.
Позже, в 1950-х, когда уже было в общих чертах понятно, как копируются гены, возникла другая проблема. При делении клетки основание за основанием дублируется и вся клеточная ДНК, — при помощи ферментов ДНК-полимераз. Однако для одной из комплементарных цепей возникает проблема: самый конец молекулы не может быть скопирован (дело тут в «посадочном» сайте ДНК-полимеразы). Вследствие этого, хромосома должна укорачиваться при каждом делении клетки, — хотя на самом деле этого не происходит (на рисунке: 1).
И та, и другая проблема были со временем решены, за что в этом году и вручают премию.
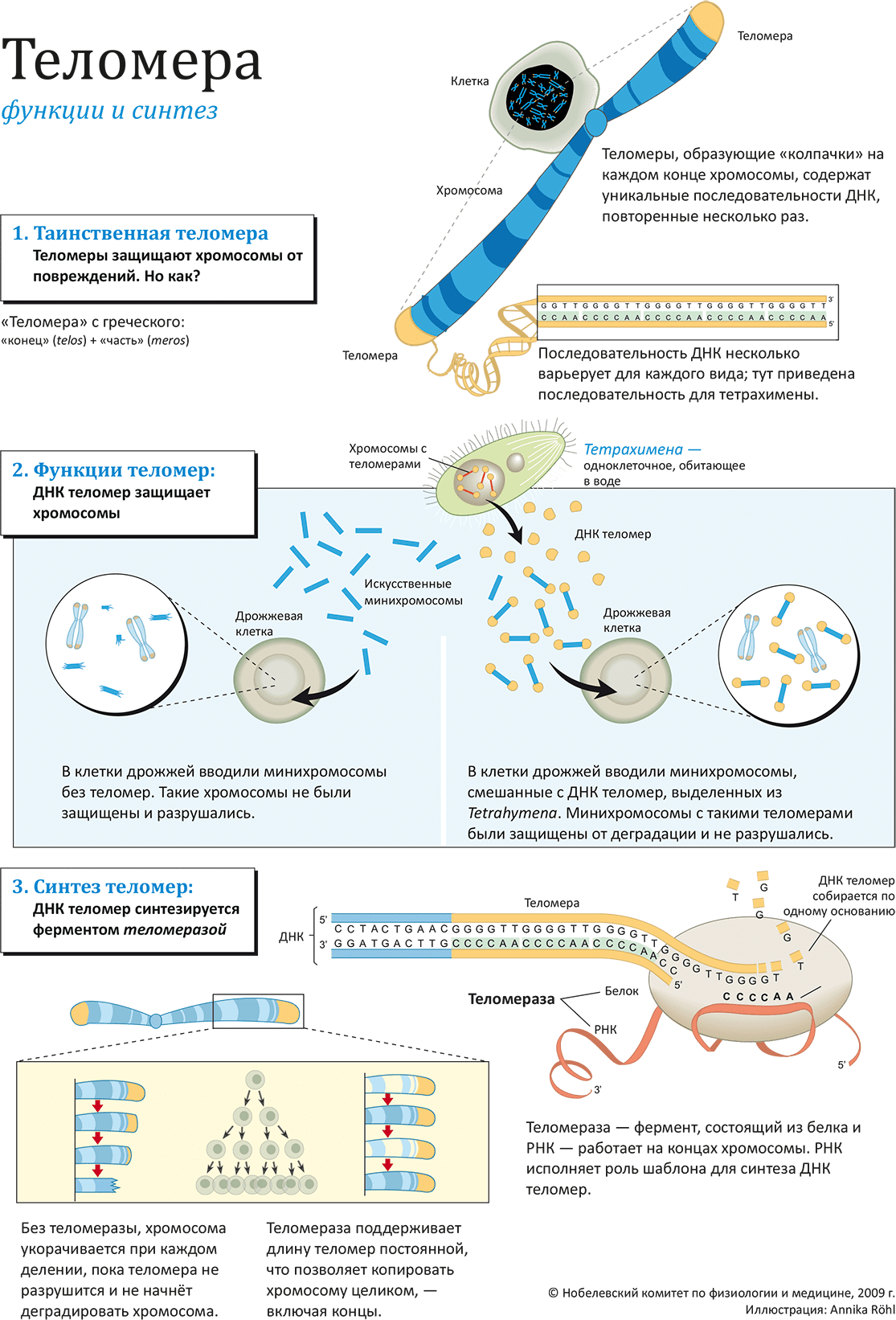
ДНК теломер защищает хромосомы
Ещё в начале своей научной карьеры Элизабет Блэкберн занималась картированием последовательностей ДНК на примере одноклеточного жгутикового организма тетрахимены (Tetrahymena). На концах хромосомы она обнаружила повторяющиеся последовательности ДНК вида CCCCAA, функция которых была на тот момент совершенно неизвестна. В то же время Джек Шостак обнаружил, что линейные молекулы ДНК (что-то вроде минихромосомы), введённые в клетку дрожжей, очень быстро деградируют.
Исследователи встретились на конференции в 1980 г., где Блэкберн докладывала свои результаты, заинтересовавшие Шостака. Они решили провести совместный эксперимент, в основе которого было «растворение барьеров» между двумя эволюционно весьма далёкими видами (на рисунке: 2). Блэкберн выделила из ДНК тетрахимены последовательности CCCCAA, а Шостак присоединил их к минихромосомам, помещённым затем в клетки дрожжей. Результат, опубликованный в 1982 году, превзошёл ожидания: теломерные последовательности действительно защищали ДНК от деградации! Это явление наглядно продемонстрировало существование неизвестного ранее клеточного механизма, регулирующего процессы старения в живой клетке. Позже подтвердилось наличие теломер в подавляющем большинстве растений и животных — от амёбы до человека.
Фермент, синтезирующий теломеры
В 1980-х аспирантка Кэрол Грейдер работала под началом Элизабет Блэкберн; они начали изучение синтеза теломер, за который должен был отвечать неизвестный на ту пору фермент. В канун рождества 1984 года Грейдер зарегистрировала искомую активность в клеточном экстракте. Грейдер и Блэкберн выделили и очистили фермент, получивший название теломераза, и показали, что в его состав входит не только белок, но и РНК (на рисунке: 3). Молекула РНК содержит «ту самую» последовательность CCCCAA, используемую в качестве «шаблона» для достройки теломер, в то время как ферментативная активность (типа обратной транскриптазы) принадлежит белковой части фермента. Теломераза «наращивает» ДНК теломеры, обеспечивая «посадочное место» для ДНК-полимеразы, достаточное для копирования хромосомы без «краевых эффектов» (то есть, без потерь генетической информации).
Теломераза отсрочивает старение клетки
Учёные начали активно заниматься исследованием роли теломер в клетке. Лаборатория Шостака установила, что дрожжевая культура с мутацией, приводящей к постепенному укорачиванию теломер, развивается очень медленно и, в конце концов, вообще прекращает рост. Сотрудники Блэкберн показали, что в тетрахимене с мутацией в РНК теломеразы наблюдается в точности такой же эффект, который можно охарактеризовать фразой «преждевременное старение». (По сравнению с этими примерами, «нормальная» теломераза предотвращает укорачивание теломер и задерживает наступление старости.) Позже в группе Грейдер открыли, что те же механизмы работают и в клетках человека. Многочисленные работы в этой области помогли установить, что теломера координирует вокруг своей ДНК белковые частицы, образующие защитный «колпачок» для кончиков молекулы ДНК.
Части головоломки: старение, рак и стволовые клетки
Описанные открытия имели самый сильный резонанс в научном сообществе. Многие учёные заявляли, что укорачивание теломер является универсальным механизмом не только клеточного старения, но и старости всего организма в целом. Однако со временем стало понятно, что теломерная теория не является пресловутым «молодильным яблоком», поскольку процесс старения на самом деле чрезвычайно сложен и многосторонен, и не сводится исключительно к «подрезанию» теломер. Интенсивные исследования в этой области продолжаются и сегодня.
Большинство клеток делится не так уж часто, так что их хромосомы не находятся в зоне риска чрезмерного укорачивания и, в общем-то, не требуют высокой теломеразной активности. Другое дело — раковые клетки: они обладают способностью делиться бесконтрольно и бесконечно, как бы не зная о бедах с укорачиванием теломер. Оказалось, что в опухолевых клетках очень высокая активность теломеразы, что и защищает их от подобного укорачивания и придаёт потенциал к неограниченному делению и росту. В настоящее время существует подход к лечению рака, использующий концепцию подавления теломеразной активности в раковых клетках, что привело бы к естественному исчезновению точек бесконтрольного деления. Некоторые средства с антителомеразным действием уже проходят клинические испытания.
Ряд наследственных заболеваний характеризуется сниженной теломеразной активностью, — например, апластическая анемия, при которой из-за низкого темпа деления стволовых клеток в костном мозге развивается анемия. К этой же группе относится ряд заболеваний кожи и лёгких.
Открытия, сделанные Блэкберн, Грейдер и Шостаком, открыли новое измерение в понимании клеточных механизмов, и, несомненно, имеют огромное практическое применение — хотя бы в лечении перечисленных заболеваний, а может быть (когда-нибудь) — и в обретении если не вечной, то хотя бы более длительной жизни.
По материалам пресс-релиза Нобелевского комитета.