Протеомный детектив, или В чем виновен альфа-амилоид?
19 апреля 2019
Протеомный детектив, или В чем виновен альфа-амилоид?
- 1321
- 0
- 8
(Ис)следователь(ница) со сворой трансгенных мышей преследует преступную биомолекулу. Рисунок в полном размере можно посмотреть здесь.
иллюстрация Лидии Лекс
-
Автор
-
Редакторы
Это очень личная история. Я расскажу о том, как пятнадцать лет назад мы с коллегами обнаружили подозреваемого (белок альфа-амилоид) в преступлении (соучастии в патогенезе рака). После нескольких лет работы с ним мы решили, что это просто свидетель (участник воспалительного каскада, не связанного с развитием рака) и отпустили его (прекратили проект). Я же никогда не верил в его невиновность. Маленькие зацепки у меня были, но... Только недавно с помощью отрядов спецназа, вездеходов, вертолетов и приборов ночного видения (статья в Nature, больше десятка линий трансгенных мышей, опухолевые трансплантаты и клинические образцы) другие следователи доказали вину подозреваемого в одном эпизоде преступления (метастазировании рака поджелудочной железы в печень).
В самом начале века молодым «постдоком» я оказался в первой в стране лаборатории протеомики . Мне поручили работать на своеобразном приборе: масс-спектрометре SELDI (surface-enhanced laser desorption/ionisation — усиленная поверхностью лазерная десорбция-ионизация). По сути, это был небольшой времяпролетный детектор, очень примитивный по нынешним временам. Лазерную ионизацию содержимого образца проводили на особых чипах, которые, помимо своих обычных свойств, содержали ковалентно привязанный хроматографический носитель. Разными способами образец можно было очищать и фракционировать на чипе, после чего те вещества, что на нем остались, анализировали в масс-спектрометре. Создатели прибора SELDI рекламировали его как будущее устройство для клиники. И действительно, он был очень простым в обращении и хорошо подходил для получения масс-спектров сложных биологических образцов — например, плазмы крови и других жидкостей человеческого организма.
Постдок — во многих странах это исследователь, который получил краткосрочный (1–3 года) контракт в лаборатории вскоре после защиты кандидатской (за рубежом — докторской, PhD). Конечно, в России постдоков до сих пор не существует, но этот термин хорошо описывает мое тогдашнее состояние.
Подробнее о протеомике и масс-спектрометрии в биологии я уже писал в статье «12 методов в картинках: протеомика» [1], с которой и рекомендую ознакомиться, чтобы лучше понимать рассказанное далее.
После того, как я немного освоил прибор, было решено сравнить с его помощью несколько образцов плазмы крови от пациенток с раком яичника с образцами от здоровых женщин. Профили оказались очень похожими, ведь прибор регистрировал в масс-спектре всего несколько десятков пиков. Но в некоторых спектрах крови больных в области молекулярных масс 11–12 кДа прямо-таки торчали два внушительных пика (рис. 1).
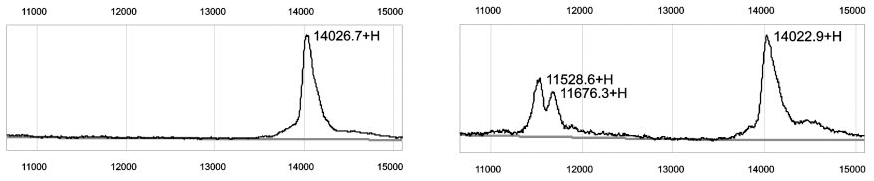
Рисунок 1. Пики сывороточного амилоида А на масс-спектре SELDI-TOF плазмы крови пациентки с раком яичника (справа) и их отсутствие у здоровой женщины (слева). По вертикальной оси — интенсивность сигнала; по горизонтальной — отношение молекулярной массы к заряду (m/z), Да.
Нам с коллегами не без труда удалось установить природу этих пиков, для чего потребовалось применить несколько косвенных методов. Пики были образованы разными изоформами белка сывороточного амилоида А (SAA) . Протеомное исследование SAA при раке яичника захватило меня на несколько последующих лет, в результате чего было опубликовано несколько статей [2], [3]. Амилоид А — хорошо известный белок острой фазы , и повышение его уровня при разных опухолях было известно давно, еще до развития протеомики (см. врезку). Это значительно остудило наш энтузиазм в плане его клинического значения. Тем более что для скрининга он бы вряд ли пригодился в связи с тем, что проявлялся далеко не у всех пациенток . Звучали мнения, что мы в очередной раз при помощи дорогой техники изобрели велосипед. Рак, мол, это совершенно отдельный процесс, просто он сопровождается воспалением, а в ответ выбрасываются белки острой фазы, о чем знали с середины двадцатого века. Дескать, с выбросом амилоида А в кровь при раке не связано никакой гипотезы, что за невежество!
Амилоид А, или альфа-амилоид, не имеет ничего общего с бета-амилоидом, патологические отложения которого в головном мозге — основной компонент развития болезни Альцгеймера. Последний кодируется другим геном, не родственным по последовательности гену альфа-амилоида, а накопление этих двух видов амилоида идет по разным механизмам.
Острая (наиболее интенсивная) фаза воспаления в организме сопровождается повышением концентрации в крови нескольких биомолекул. Самая известная из них — C-реактивный белок, признанный биомаркер острой фазы.
О том, какими характеристиками должны обладать биомаркеры заболеваний, чтобы использоваться для скрининга (диспансеризации), читайте в нашем материале «Омикс-биомаркеры и ранняя диагностика: когда счастье возможно» [4].
В медицинском плане об амилоиде А нам думать расхотелось. Прямое профилирование плазмы крови на времяпролетных масс-спектрометрах с лазерной ионизацией было заброшено. Морально устаревший прибор SELDI я чуть позже передал на Физтех, где он был разобран до винтиков местными суровыми обитателями. Но все же меня не покидало состояние какой-то незавершенности. Ведь в глубине души я полагал, что амилоид А может участвовать в патогенезе рака. Тем более, функция этого белка, открытого много лет назад, была, по сути, неизвестной. А если мы не знаем, что белок делает в норме, как мы можем утверждать, что он не участвует в развитии патологии?
Накапливались разрозненные сведения о том, что белки SAA активно синтезируются не только клетками печени, но и опухолевыми клетками. Это заставило нас внимательно отнестись к связи амилоида А с механизмами развития рака. В 2006 году мы даже написали на эту тему обзор литературы [10], но, честно говоря, ясного понимания того, как он может помогать болезни прогрессировать, достичь не смогли из-за недостатка сведений. Ситуация изменилась спустя несколько лет, когда в литературе появились данные о том, что амилоид А способен связываться с рецептором FPR2 на поверхности нейтрофилов, заставляя их проявлять иммуносупрессорные свойства [11]. Вообще идея того, что нейтрофилы способны к иммуносупрессии, появилась в иммунологии сравнительно недавно. Все медики и биологи помнят, что нейтрофилы позиционируются в учебниках как непримиримые борцы с бактериальными клетками. Однако постепенно стало выясняться, что почти все типы клеток миелоидного ряда содержат субпопуляции, способные оказывать иммуносупрессорное действие, в том числе на Т-клеточный иммунитет. В частности, таким свойством обладают и зрелые нейтрофилы [12].
Миелоидные клетки — это гранулоциты (нейтрофилы, эозинофилы и базофилы), а также моноциты и их потомки.
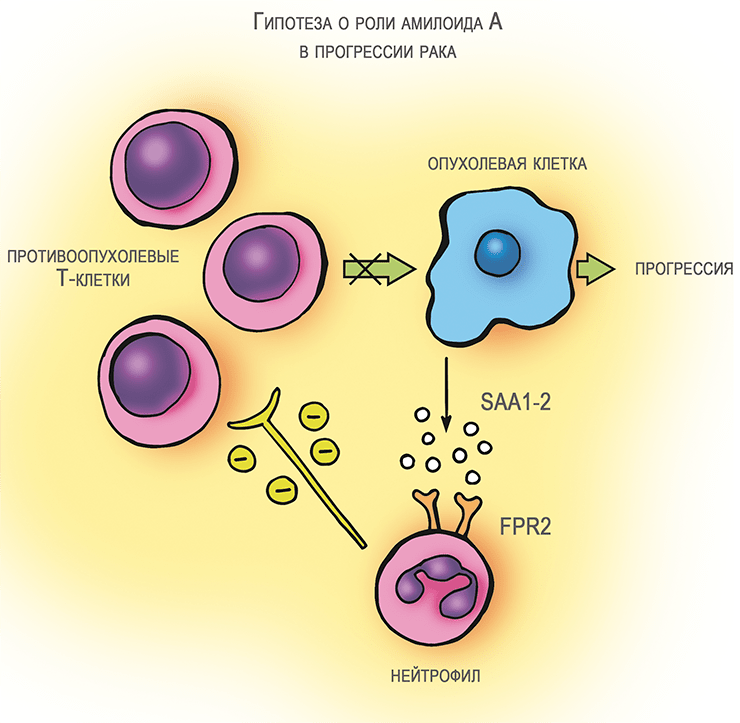
Уже бросив к тому времени заниматься амилоидом А, я, тем не менее, суммировал собственные знания о его роли при раке и последние на тот момент литературные данные о его взаимодействии с иммунными клетками в небольшом обзоре [5]. Гипотеза, сформулированная к тому времени, заключалась в следующем (рис. 3а). Клетки опухолей выделяют SAA острой фазы, который воздействует на находящиеся в составе опухоли нейтрофилы. Они под воздействием амилоида А проявляют иммуносупрессорные свойства и подавляют Т-клеточный ответ на опухоль. Последняя получает от выброса SAA существенные преимущества. Это мнение, сформированное в общем виде, в последующие годы не нашло убедительного подтверждения. При этом управление Т-клеточным иммунитетом, которое осуществляют клетки сóлидных (плотных, или твердых) опухолей, оказалось в центре внимания. В итоге, были разработаны хорошо известные сейчас противораковые лекарства — ингибиторы иммунного «контрольно-пропускного пункта» .
Подробнее о принципах работы этих препаратов можно узнать из материалов на нашем сайте: «Кишечная микрофлора: третий нелишний в иммунотерапии рака» [13], «Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018)» [14] и «Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль» [15]. — Ред.
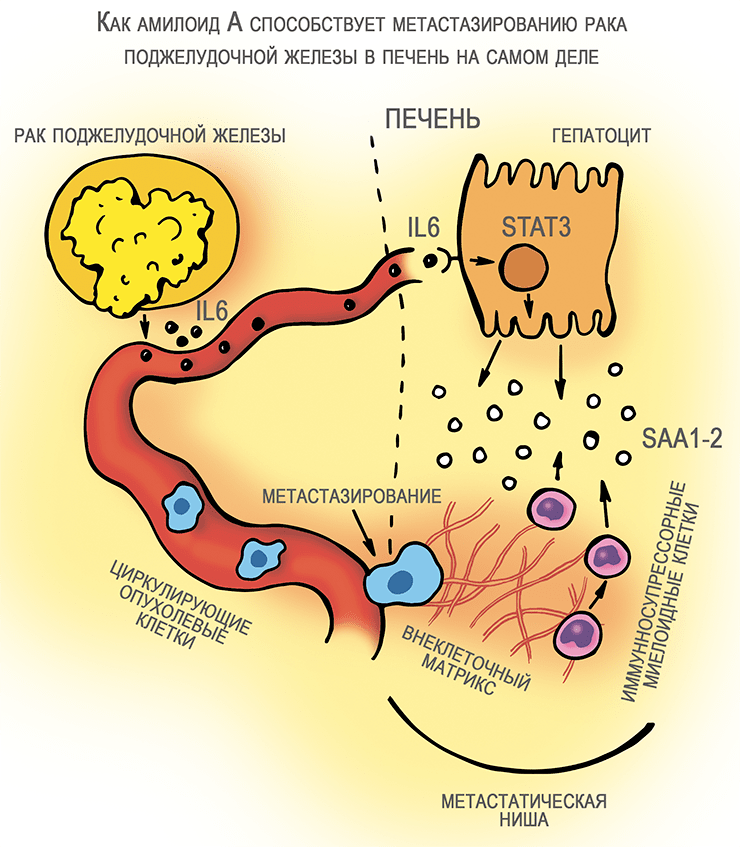
Прочно забыв о теме амилоида А, некоторое время назад я пролистывал хрустящие электронные страницы журнала Nature и вдруг наткнулся на материал Ли и соавторов, непосредственно связанный с участием этого белка в прогрессии рака [16]. С использованием нескольких линий трансгенных мышей с опухолями поджелудочной железы и клинического материала от пациентов был убедительно доказан механизм участия амилоидов А острой фазы в метастазировании рака этого типа в печень. Как выяснилось, клетки рака поджелудочной железы выделяют в кровоток интерлейкин-6 (IL6), известный индуктор острой фазы воспаления. Интерлейкин воздействует на гепатоциты, в которых путем фосфорилирования вызывает активацию транскрипционного фактора STAT3. Последний стимулирует усиленную экспрессию амилоида А — двух сходных продуктов генов SAA1 и SAA2. А они, как уже было известно до того, привлекают в ткань печени путем хемотаксиса иммуносупрессорные миелоидные клетки, характеризующиеся поверхностным маркером Ly6G [17]. Кроме того, SAA обеспечивают синтез и отложение в ткани печени белков внеклеточного матрикса (например, фибронектина).
Известно, что сóлидные злокачественные опухоли выделяют в кровоток много циркулирующих раковых клеток. Однако совсем немногие из них образуют отдаленные метастазы в других органах, причем печень — одно из основных направлений метастазирования. Для того чтобы циркулирующие клетки прижились, в ткани должны создаваться так называемые «метастатические ниши» [18]. В статье Ли и соавторов [16] проиллюстрировано, что метастатическая ниша в печени как раз образована привлечением иммуносупрессорных клеток одновременно с избыточным синтезом внеклеточного матрикса. Именно эти два события опосредуются сигнальной осью IL6—STAT3—SAA (рис. 3б), причем блокирование любого из ее компонентов путем генного нокаута почти сводило на нет метастазирование в печень в моделях аденокарциномы протоков поджелудочной железы. Сывороточный амилоид А, таким образом, первый раз был признан виновным в прогрессии злокачественной опухоли на доказательной основе. Теперь, по предположению авторов статьи, лекарственное вмешательство в работу «оси зла» IL6—STAT3—SAA способно отменять метастазирование в печень при тех злокачественных опухолях, для которых характерно это явление.
Но для чего же нужен самому организму амилоид А, который при воспалении выделяется печенью системно и в больших количествах? Не для того же, чтобы в случае чего обеспечивать метастазирование рака? Об этом в статье Ли ничего не сказано. Тем не менее можно предполагать, что SAA способен ингибировать иммунные реакции в областях воспаления по принципу отрицательной обратной связи. Хорошо известно, что после того, как инфекция побеждена, избыточные иммунные реакции могут нанести вред организму. Видимо, не случайно амилоидоз А в связи с избытком SAA в крови происходит при системных воспалительных заболеваниях (например, при псориазе), когда иммуносупрессия не справляется с наносимым аутоиммунными реакциями повреждением.
Вот так почти за пятнадцать лет знания об амилоиде А от описательных стали доказательными. Увидеть логическое завершение большой серии работ, особенно, когда ты сам внес свой небольшой вклад в эту область знания, всегда приятно. А меня эта история еще и заставила с грустью вспомнить славные времена, когда мы с коллегами только начинали работать в протеомике.
Литература
- 12 методов в картинках: протеомика;
- Sergei A. Moshkovskii, Marina V. Serebryakova, Konstantin B. Kuteykin-Teplyakov, Olga V. Tikhonova, Eugene I. Goufman, et. al.. (2005). Ovarian cancer marker of 11.7 kDa detected by proteomics is a serum amyloid A1. Proteomics. 5, 3790-3797;
- Sergei A. Moshkovskii, Maria A. Vlasova, Mikhail A. Pyatnitskiy, Olga V. Tikhonova, Metanat R. Safarova, et. al.. (2007). Acute phase serum amyloid A in ovarian cancer as an important component of proteome diagnostic profiling. Prot. Clin. Appl.. 1, 107-117;
- Омикс-биомаркеры и ранняя диагностика: когда счастье возможно;
- S. A. Moshkovskii. (2012). Why do cancer cells produce serum amyloid a acute-phase protein?. Biochemistry Moscow. 77, 339-341;
- Болезнь Альцгеймера: ген, от которого я без ума;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?;
- M. A. Vlasova, S. A. Moshkovskii. (2006). Molecular interactions of acute phase serum amyloid A: Possible involvement in carcinogenesis. Biochemistry (Moscow). 71, 1051-1059;
- Carmela De Santo, Ramon Arscott, Sarah Booth, Ioannis Karydis, Margaret Jones, et. al.. (2010). Invariant NKT cells modulate the suppressive activity of IL-10-secreting neutrophils differentiated with serum amyloid A. Nat Immunol. 11, 1039-1046;
- Janesh Pillay, Tamar Tak, Vera M. Kamp, Leo Koenderman. (2013). Immune suppression by neutrophils and granulocytic myeloid-derived suppressor cells: similarities and differences. Cell. Mol. Life Sci.. 70, 3813-3827;
- Кишечная микрофлора: третий нелишний в иммунотерапии рака;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Jae W. Lee, Meredith L. Stone, Paige M. Porrett, Stacy K. Thomas, Chad A. Komar, et. al.. (2019). Hepatocytes direct the formation of a pro-metastatic niche in the liver. Nature. 567, 249-252;
- M. Kowanetz, X. Wu, J. Lee, M. Tan, T. Hagenbeek, et. al.. (2010). Granulocyte-colony stimulating factor promotes lung metastasis through mobilization of Ly6G+Ly6C+ granulocytes. Proceedings of the National Academy of Sciences. 107, 21248-21255;
- Опухолевые разговоры, или Роль микроокружения в развитии рака.