
Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018)
01 октября 2018
Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018)
- 8197
- 0
- 11
Нобелевские лауреаты 2018 года Джеймс Эллисон и Тасуку Хондзё
-
Автор
-
Редакторы
Темы
Нобелевскую премию 2018 года вручили за открытия, позволившие разработать принципиально новый подход в иммунотерапии рака, совершивший прорыв в лечении некоторых ранее смертельных опухолей. Сегодня «Биомолекула» снова расскажет об антителах-ингибиторах иммунологических чекпоинтов и о работах лауреатов этого года — Джеймса П. Эллисона и Тасуку Хондзё.
Повстанцы внутри организма
Рак — это большая группа заболеваний, объединенных общей чертой: все они начинаются с одной клетки, мутации в которой позволяют ей неограниченно делиться и формировать огромные сложно организованные скопления клеток — опухоли. Ежегодно рак убивает миллионы людей, занимая почетное второе место среди причин смерти, сразу после сердечно-сосудистых заболеваний.
С точки зрения медицины, раковые опухоли представляют собой таких же паразитов, как болезнетворные бактерии или глисты. С тем лишь отличием, что раковые клетки намного более похожи на здоровые, нежели бактерии или вирусы, да и располагаться могут в любой части тела. Но задача и там и там одна — полностью избавить организм от причины заболевания, уничтожить ее. До недавнего времени врачи располагали лишь тремя инструментами для борьбы с раком — операция, облучение ионизирующей радиацией и химиотерапия (специальные яды, бьющие по быстро делящимся клеткам). Нобелевская премия этого года дана за важнейшие шаги в разработке четвертого способа борьбы — уничтожения опухолей с помощью иммунных клеток самого пациента.
Иммунный надзор
Идею, что иммунитет и рак могут быть как-то связаны, высказал еще отец-основатель иммунологии и Нобелевский лауреат 1908 года Пауль Эрлих. Этот исследователь предположил, что опухолевые клетки могут возникать в организме постоянно, но иммунитет блокирует их развитие [1], [2]. Его идеи отчасти подтвердились в 1950-х годах, когда оказалось, что переливание крови от пациентов, у которых меланома (рак кожи) ранее спонтанно исчезла, может спровоцировать такую же регрессию у пациента, получившего кровь. Исследователи пошли дальше и попробовали пересадить меланому между двумя пациентами, чем добились регрессии опухолей у обоих. Со временем идеи Эрлиха легли в основу целой теории иммунного надзора над опухолью.
Эти данные позволили разработать первую иммунотерапию рака. Подкожное введение бациллы Кальметта—Герена, сильного неспецифического иммуностимулятора, приводило к регрессии опухоли [3]. Введением пациентам вакцин на основе стрептококка и занимался «отец иммунотерапии рака» Уильям Коли. Его результаты подтвердили предположение Эрлиха о важной роли иммунитета в подавлении развития опухолей. Однако до поры это не вылилось в серьезные медицинские прорывы.
Чтобы совершить качественный рывок в лечении рака, исследователям пришлось потратить еще несколько десятилетий на раскрытие природы иммунной защиты от опухолей. В настоящий момент эта тема изучена очень хорошо. Взаимодействие опухоли и иммунной системы устроено очень сложно. Все клетки нашего организма подвергаются постоянному иммунному надзору. Эта слежка позволяет на ранних этапах опознать раковые опухоли и задушить их в зародыше.
Для того чтобы стать раковой, клетке необходимо накопить некоторое количество мутаций в своих генах. Одни гены должны активироваться и начать стимулировать деление (их еще называют онкогенами), другие, подавляющие деление клетки (гены-супрессоры), — выключиться. При этом внутри клетки появляются измененные этими и последующими мутациями белки — неоантигены. Этот термин пришел к нам из иммунологии, где антигеном называют мишень иммунных клеток.
Дело в том, что практически все клетки нашего тела в обязательном порядке сообщают иммунитету обо всех белках, которые они содержат. Этот «иммунологический паспорт» расположен на поверхности клеток и состоит из белков главного комплекса гистосовместимости (MHC), в которых как в тисках зажаты небольшие аминокислотные цепочки — пептиды. Эти фрагменты вырезаются из всех белков, присутствующих внутри данной клетки. Специальные клетки — Т-киллеры, постоянно «ощупывают» эти белковые комплексы и когда клетка начинает производить что-то странное, убивают ее. Поэтому практически все опухоли так или иначе умеют контролировать иммунный ответ и избегать его (рис. 1).
Рисунок 1. Схематическое изображение взаимодействия опухолевых клеток и иммунитета. Искаженный «иммунологический паспорт», состоящий из комплексов MHC и пептидов привлекает Т-киллеры, а его отсутствие — NK-клетки.
«Фейсбук»
Иммунологические тормоза
При той всеобъемлющей защите, которую обеспечивает нам иммунитет, кажется невероятным, что какие-то опухоли все-таки могут развиваться в организме. Особенно подобные меланоме (рис. 2), которая выделяется среди опухолей наиболее сильным искажением «иммунологического паспорта». Многие опухоли просто «набиты» иммунными клетками (рис. 3), которые почему-то их не атакуют. Должны существовать механизмы, позволяющие таким новообразованиям избегать иммунного надзора.
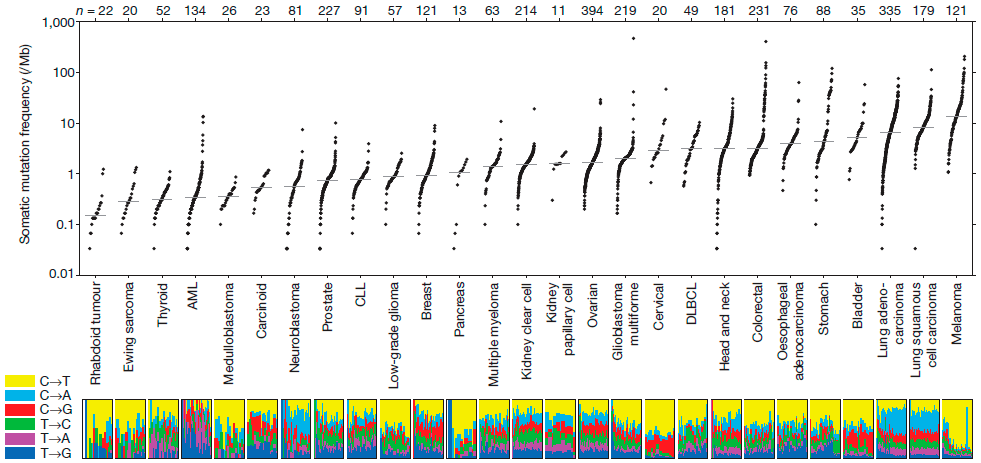
Рисунок 2. Количество мутаций в различных типах опухолей на миллион оснований ДНК. Косвенно может указывать на иммуногенность опухоли.
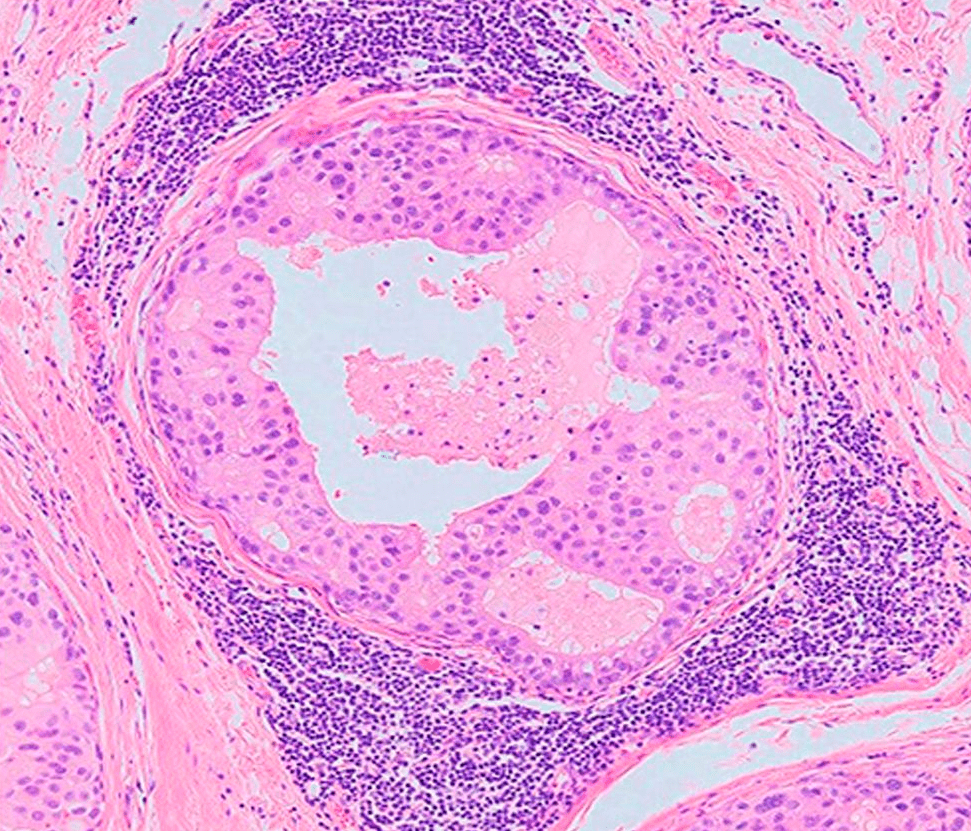
Рисунок 3. Лимфоциты (темно-фиолетовые), окружающие опухоль (в центре). Гистологический срез опухоли молочной железы.
Именно их изучением занимались лауреаты Нобелевской премии по физиологии и медицине 2018 года (рис. 4) [4]. В 1990-х годах первый из двух лауреатов, Джеймс Эллисон, занимался изучением белка CTLA-4, который располагается на поверхности различных групп Т-лимфоцитов. Он и его коллеги заметили, что этот белок способен подавлять иммунную реакцию [5]. Основными носителями этого белка в организме являются регуляторные Т-клетки, которые с его помощью предотвращают активацию других лимфоцитов, блокируя работу антигенпрезентирующих клеток в лимфоузлах и тканях [6]. Эта блокировка действует как тормоз для иммунной реакции и является важной защитой от аутоиммунных заболеваний. Если же заблокировать CTLA-4, Т-лимфоциты начинают работать намного активнее.
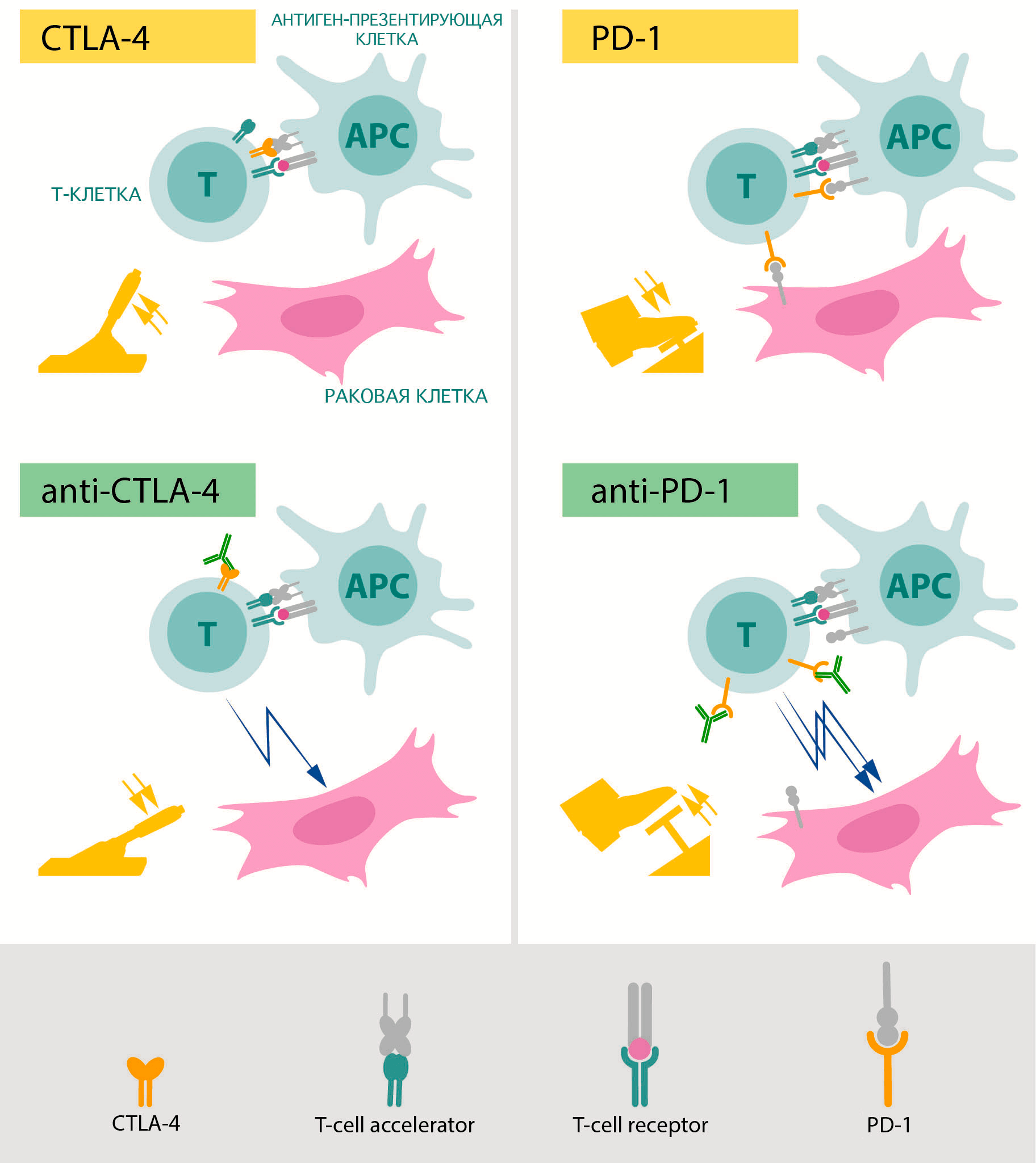
Рисунок 4. Схематическое изображение механизмов работы препаратов, разработанных на основе открытий Эллисона (слева) и Хондзё (справа). Зеленым показаны блокирующие антитела, «снимающие тормоза» с противоракового иммунитета.
Пока коллеги Эллисона изучали возможности применения знаний о CTLA-4 в терапии аллергий, ему пришло в голову, что гиперактивация этого белка может быть частью защиты опухолей от иммунитета. Его группа попробовала ввести блокирующие функцию CTLA-4 антитела мышам с развитыми формами рака и увидела серьезное снижение активности опухолевых клеток и уменьшение объема опухолевой ткани [7]. Поначалу фармакологические компании не заинтересовались этим открытием, однако впоследствии настойчивость Эллисона, продолжившего исследования на людях, принесла свои плоды. В настоящий момент терапия антителами против CTLA-4 [8] с использованием открытого Эллисоном механизма зарегистрирована по всему миру, в том числе и в России. Международное непатентованное название препарата — ипилимумаб [9]. Применяют его сейчас для лечения меланомы в последней стадии, которая ранее была смертным приговором. Этот препарат также тестируется и против других форм рака.
В то время, когда группа Эллисона работала над CTLA-4 в США, в Киото исследователи под руководством профессора Тасуку Хондзё изучали другой механизм подавления иммунного ответа [10]. Они обнаружили белок под названием PD-1, который появляется на активированных Т-киллерах [11]. В норме этот белок позволяет регуляторным Т-клеткам подавлять те Т-киллеры, которые активировались на «неправильный» антиген. Дело в том, что активация этого белка на лимфоцитах (с помощью лиганда PD-1 — PD-L1) отправляет их в апоптоз. Именно благодаря этому он и получил свое название: PD расшифровывается как programmed death, «программируемая смерть».
В исследованиях на мышах группа Хондзё показала эффективность блокировки нового белка в борьбе с различными опухолями [12]. Эти данные были использованы для разработки нового препарата под названием ниволумаб, который также зарегистрирован по всему миру и используется для лечения многих опухолей, в том числе и меланомы [13].
Так, более 100 лет спустя после первого, пророческого заявления Пауля Эрлиха, иммунитет наконец-то стал надежным союзником человека в борьбе с онкологическими заболеваниями.
Литература
- Christine V Ichim. (2005). . J Transl Med. 3, 8;
- Ehrlich P. (1909). Ueber den jetzigen stand der Karzinomforschung. Ned. Tijdschr. Geneeskd. 5, 273–290;
- Morton D.L., Eilber F.R., Joseph W.L., Wood W.C., Trahan E., Ketcham AS. (1970). Immunological factors in human sarcomas and melanomas: a rational basis for immunotherapy. Ann. Surg. 172, 740–749;
- Пресс-релиз на сайте Нобелевского комитета;
- D. R. Leach, M. F. Krummel, J. P. Allison. (1996). Enhancement of Antitumor Immunity by CTLA-4 Blockade. Science. 271, 1734-1736;
- Дендритные клетки: профессиональные разведчики в «Опухолевой войне»;
- E. D. Kwon, A. A. Hurwitz, B. A. Foster, C. Madias, A. L. Feldhaus, et. al.. (1997). Manipulation of T cell costimulatory and inhibitory signals for immunotherapy of prostate cancer. Proceedings of the National Academy of Sciences. 94, 8099-8103;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Лечение Джимми Картера;
- Hiroyuki Nishimura, Masato Nose, Hiroshi Hiai, Nagahiro Minato, Tasuku Honjo. (1999). Development of Lupus-like Autoimmune Diseases by Disruption of the PD-1 Gene Encoding an ITIM Motif-Carrying Immunoreceptor. Immunity. 11, 141-151;
- Y. Ishida, Y. Agata, K. Shibahara, T. Honjo. (1992). Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death.. The EMBO Journal. 11, 3887-3895;
- Y. Iwai. (2004). PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells. International Immunology. 17, 133-144;
- Рак почки: чтобы вылечить, надо восстановить естественный иммунитет!;
- Marie Colombe Agahozo, Dora Hammerl, Reno Debets, Marleen Kok, Carolien H M van Deurzen. (2018). Tumor-infiltrating lymphocytes and ductal carcinoma in situ of the breast: friends or foes?. Mod Pathol. 31, 1012-1025.






