Нейродегенерации, или Массовые вымирания нейронов
24 мая 2024
Нейродегенерации, или Массовые вымирания нейронов
- 4190
- 0
- 15
Нейродегенерации сопровождаются массовой гибелью нейронов, что приводит к ускоренной потере когнитивных и моторных функций.
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
В мире, где люди в среднем живут всё дольше и население быстро стареет, растет и бремя ассоциированных с возрастом («старческих») болезней. Тот, кто раньше умер бы от инфекции, травмы или заболевания сердца в молодом возрасте, сейчас имеет растущий шанс вместо этого попасть в пугающие «объятия» болезни Альцгеймера, Паркинсона или других нейродегенераций. Проблема становится всё злободневней, усилия ученых по поиску лекарств не прекращаются, но и не приносят успеха. Как и прежде, нейродегенеративные болезни неизлечимы и, по сути, такой диагноз подобен приговору. В этом тексте мы разбираемся, как устроен запутанный клубок патогенеза таких заболеваний и как нам наконец его распутать и решить проблему нейродегенерации.
Нейрофармакология

Заболевания нервной системы — одна из самых сложных и важных областей медицины. Их фармацевтическое лечение очень осложняется наличием гематоэнцефалического барьера, который не пропускает в мозг некоторые вещества. Необходимость обойти этот барьер, а также сложности при подборе мишеней и особенно трудности в понимании патогенеза большинства болезней — вот проблемы, которые приходится преодолевать при разработке новых лекарств от заболеваний нервной системы. Этот спецпроект расскажет о трудностях в лечении «нервных болезней», о тех победах, которые уже находятся у нас на счету, а также о перспективах развития этой области фармакологии.
Партнер спецпроекта — биотехнологическая компания LEENERS. Современные исследовательские лаборатории LEENERS — это место, где совершаются научные открытия и рождаются лекарственные препараты нового поколения.
Нездоровое старение
Старая как мир загадка спрашивает: кто сначала ходит на четырех, затем на двух, и наконец на трех ногах (подразумевая маленького ребенка, взрослого и пожилого человека в качестве отгадки). Мы теряем в пожилом возрасте то, что приобрели в молодости: силу, выносливость, нервные клетки, память и когнитивные возможности. Это и есть старение — сложный и разнообразный процесс, в котором сочетаются генетические, физиологические, психологические, экологические, социальные и другие факторы [1].
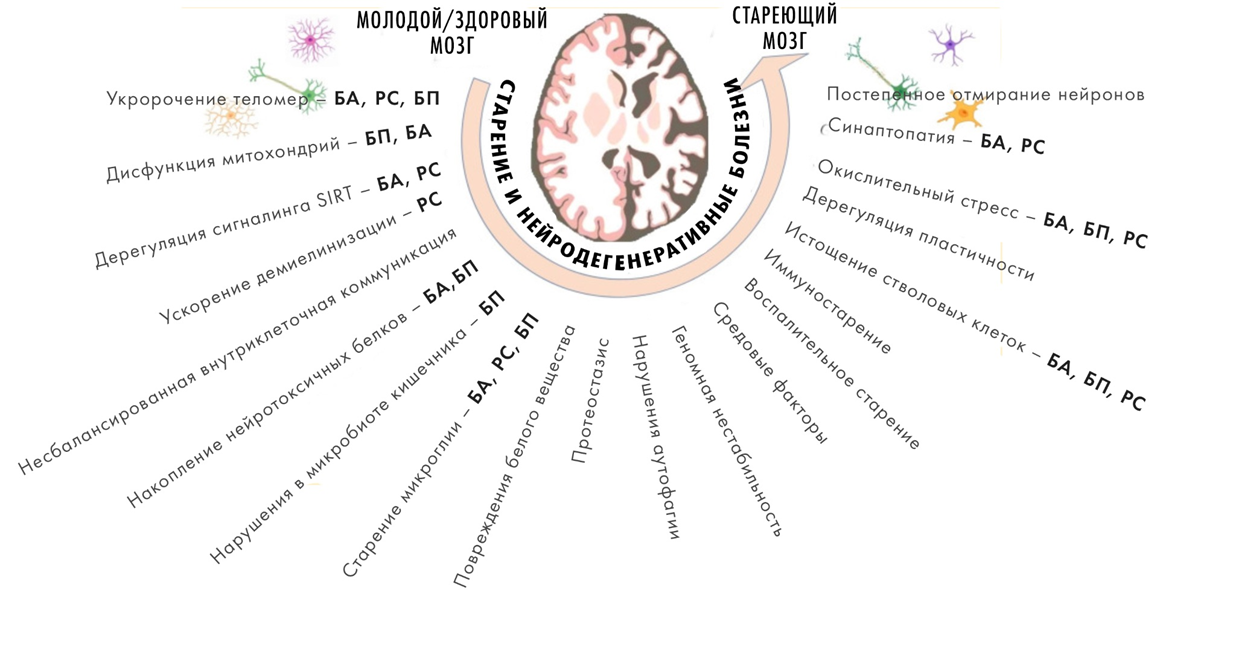
Рисунок 1. Причины старения мозга и общие механизмы старения и нейродегенераций. БА — болезнь Альцгеймера, БП — болезнь Паркинсона, РС — рассеянный склероз.
От старения страдают самые разные органы и ткани, но, пожалуй, самая важная его жертва — это человеческий мозг и в целом нервная система [2]. С возрастом ухудшаются когнитивные возможности и двигательная активность [3], и постепенно нарастает некоторая атрофия мозга, т.е. сокращение его объема, которое в норме составляет 0,44% за год. Такими темпами достичь порогового значения, соответствующего нейродегенерации, можно лишь к возрасту примерно 120 лет — однако при патологии это процесс многократно ускоряется и концентрируется в определенных частях мозга. При этом нейродегенерации почему-то все чаще затрагивают молодых [4].
За внешними проявлениями старения стоят потеря нейронов, клеток глии и синаптических контактов, а также рост числа сенесцентных клеток [5] в мозге, хроническое воспаление, нарушение функций митохондрий и в целом метаболизма. В упадок приходят системы, нужные для гомеостаза белков — аутофагии и протеасом. В результате в клетке скапливаются «сломанные» белки, их агрегаты и, например, «пигмент старения» — липофусцин. Происходит накопление мутаций, а защищающие ДНК механизмы справляются с ее повреждениями все хуже. Весь этот «букет патологий» способен усиливать сам себя, тогда как стареющий мозг теряет способность ему сопротивляться [1].
Эти процессы объединяют и условное «здоровое старение», и катастрофические по масштабу нейродегенерации. Разница скорее количественная и состоит в явном превалировании разрушительных тенденций над компенсаторными в случае нейродегенераций, а также в наличии ведущего патологического фактора, разрушающего мозг.
Нейродегенерации занимают важное место в ряду возраст-ассоциированных болезней вроде атеросклероза, рака и диабета. Важное отличие в том, что нейродегенеративные заболевания мы по-прежнему не умеем толком лечить (за одним важным исключением — рассеянным склерозом) — мы поговорим об этом подробнее позже.
Нейродегенеративные болезни — это не только личная трагедия и беда в семье, но и огромное бремя для общества, связанное прежде всего с необходимостью ухода за пациентами. Затраты на этот уход в глобальном масштабе в 2015 году составили около 818 миллиардов долларов. Согласно прогнозу [6], к 2030 году цифра увеличится до 2 триллионов долларов. И это — лишь часть общей картины быстрого роста распространенности неврологических патологий, которые стали одной из ведущих причин заболеваемости и смертности в мире. Сейчас от них страдает 15% жителей Земли.
Поэтому и ученые, и общество в целом очень мотивированы на поиск лекарств, способных повлиять на ход нейродегенеративных расстройств, — отсюда огромные усилия и затраты на них. Вот только похвастаться успехом — ни в понимании механизмов развития нейродегенерации, ни тем более в борьбе с этим самым развитием, — мы по сей день не можем. В чем же причины таких трудностей?
Единство в различиях
Среди довольно крупного «семейства» нейродегенеративных болезней чаще всего упоминают болезнь Альцгеймера [7], болезнь Паркинсона, деменцию с тельцами Леви (первые три места по распространенности), рассеянный склероз (РС), боковой амиотрофический склероз (БАС), лобно-височную деменцию (ранее болезнь Пика), хроническую травматическую энцефалопатию, болезнь (хорею) Хантингтона (Гентингтона), затем спинальную мышечную атрофию (СМА [8]), множество спиноцеребеллярных атаксий и другие полиглутаминовые болезни, гиперпролактинемию, нейрональные цероидные липофусцинозы, нейродегенерации с накоплением железа в мозге (ННЖМ), прионные заболевания, а иногда и другие недуги.
Это довольно пестрая команда из болезней, которые отличаются не только своими жуткими именами, но и той областью мозга (почти всегда головного), где происходит массовая гибель нейронов. Какие-то нейродегенерации (например, болезнь Альцгеймера) сильнее затрагивают когнитивную сферу, другие — двигательные функции (болезнь Паркинсона). Одни определяются хорошо изученными генами и конкретными мутациями в них (скажем, ННЖМ), другие ассоциированы со множеством генов и сильно зависят от среды и образа жизни (та же болезнь Альцгеймера). Более того, нейродегенерации не обязательно поражают только пожилых или даже людей зрелого возраста — так, нейрональные липофусцинозы (включая болезнь Баттена) чаще всего диагностируют у детей.
Смерть отдельных нервных клеток — не единственный и не первый процесс в основе нейродегенерации. Важны также потеря контактов между ними (синапсов) и разобщение целых нейронных сетей, в норме работающих сообща. При этом нейродегенеративный процесс обычно «мигрирует» или «растекается» по мозгу: начинаясь исходно в одном месте, он постепенно распространяется и затрагивает всё новые области мозга. Для нейродегенеративных болезней также характерен переход с центральной нервной системы (ЦНС) на периферическую [4].
Нейродегенерации по большей части — это полигенные болезни, в отличие от моногенных с одним конкретным геном-виновником. Впрочем, есть и исключения вроде болезни Хантингтона, при которых наличие конкретной мутации обязательно означает определенное нейродегенеративное расстройство, и наоборот, без мутации заболеть невозможно. Также и СМА почти всегда вызвана мутациями в генах SMN1 и SMN2.
Обычно при развитии полигенной болезни важны такие факторы [9], как образ жизни: физическая и умственная активность, социальная жизнь, диета, перенесенные инфекции, место жительства, экологическая обстановка и т. д. Отсюда следуют и некоторые перспективы профилактики. Далее, нейродегенерации роднит длительное и постепенное развитие. На первых порах, при доклинической стадии, они могут никак не проявляться или вызывать слабые и неспецифичные симптомы, плохо отличимые от депрессии и утомления. Такая «молчащая» фаза может длиться годами и целыми десятилетиями — до 30 лет! Когда же симптоматика проявляется и становится очевидной, что-то сделать с ее причинами уже невозможно. К этому времени от пострадавшей популяции нейронов обычно выживает лишь половина, а то и 20%. Врачу остается только поставить диагноз (который порой становится точным только после вскрытия) и констатировать неизлечимое прогрессирующее расстройство.
В чем причина такой коварной «подкрадывающейся» динамики нейродегенераций? Дело в том, что поначалу с гибелью нейронов и потерей их функций неплохо справляются компенсаторные механизмы мозга — его «запас прочности». Скажем, при болезни Паркинсона, даже когда многие дофаминергические (то есть синтезирующие дофамин) нейроны уже погибли, «работающие» на этом нейромедиаторе нервные клетки продолжают функционировать за счет усиления выработки дофамина в уцелевших клетках, подавления экспрессии мембранного переносчика дофамина, позднее — повышения чувствительности нейронов к низкой концентрации нейромедиатора и т. д. Кроме того, вопреки старой пословице, нервные клетки вполне могут восстанавливаться — за счет нейрогенеза, однако этот процесс и сам страдает при нейродегенерации, в том числе из-за истощения пула стволовых клеток и проблем с их дифференцировкой.
Однако компенсаторные механизмы, латающие разрушающийся мозг, имеют ограниченные возможности и в определенный момент кончаются. Человек узнает об этом из-за пугающей манифестации болезни и ее быстрого прогрессирования. Адаптация становится невозможной, и мозг оказывается на гибельной траектории — остановить или развернуть его современная медицина пока не в состоянии [4].
Порочный круг нейродегенерации
Что вызывает такие драматические последствия в мозге, и в конечном счете — его неминуемую гибель? За нейродегенерацией стоит целый ряд, а лучше сказать — спектр молекулярных патологических процессов. Обычно они встречаются не по отдельности, а «ходят вместе под руку» и усиливают разрушительный эффект друг друга, будучи связанными по принципу порочного круга (положительными обратными связями). Среди таких факторов стоит выделить (рис. 2):
- накопление патологических агрегатов белков,
- нарушенный протеостаз,
- изменения цитоскелета,
- патологию энергетического метаболизма,
- повреждения ДНК и РНК,
- нейровоспаление,
и, как следствие
- патологию синапсов,
- разобщение нейронных сетей,
и, last but not least (англ. последнее по порядку, но не по значению),
- гибель нейронов.
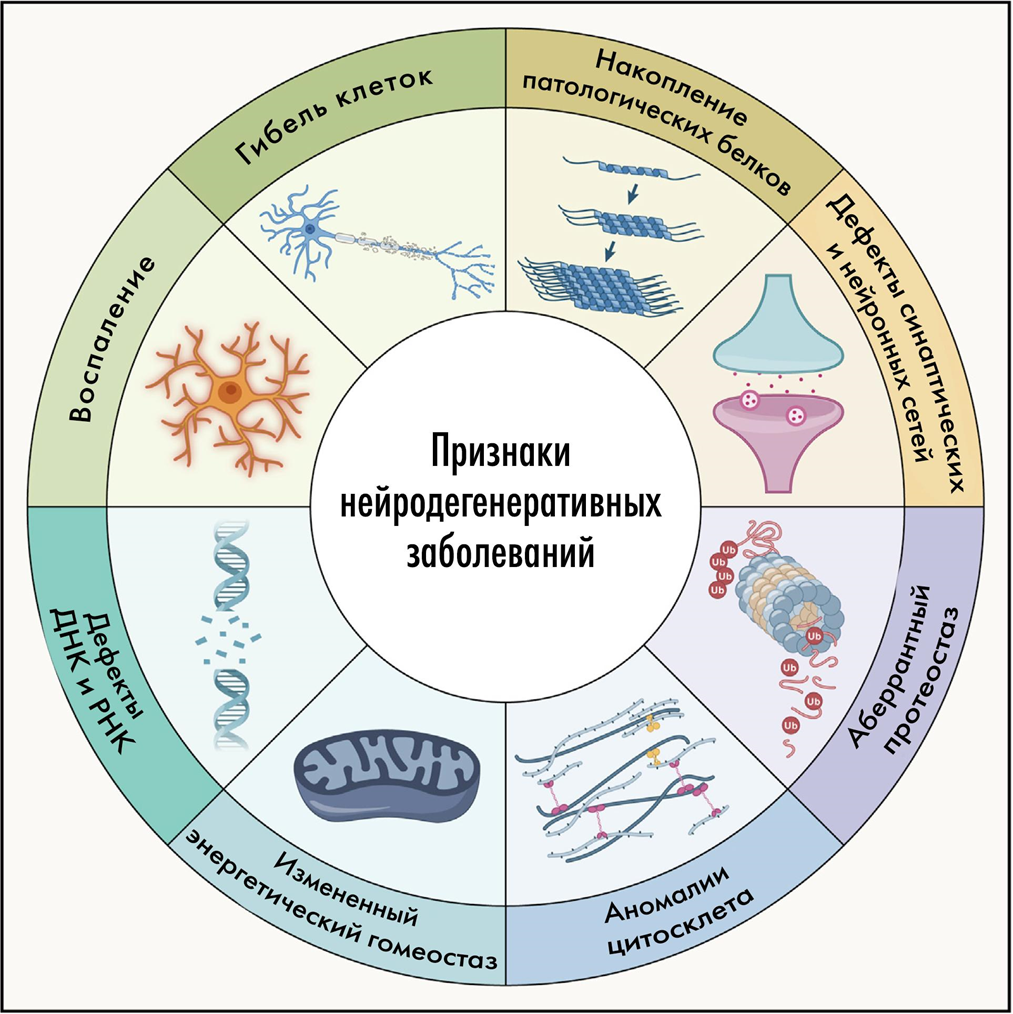
Рисунок 2. Общие механизмы нейродегенераций и их признаки.
Давайте теперь пройдемся по «порочному кругу» и кратко опишем его основные компоненты (рис. 3).
Накопление патологических агрегатов белков
Пожалуй, самый важный и универсальный патогенетический механизм нейродегенерации — проблемы с белками. Неправильно свернутые белки могут вызывать различные заболевания и передавать это свойство соседним молекулам [7].
Болезни, которые вызваны таким распространением патологической конформации белка, называют конформационными, или протеинопатиями. К ним относятся многие нейродегенерации.
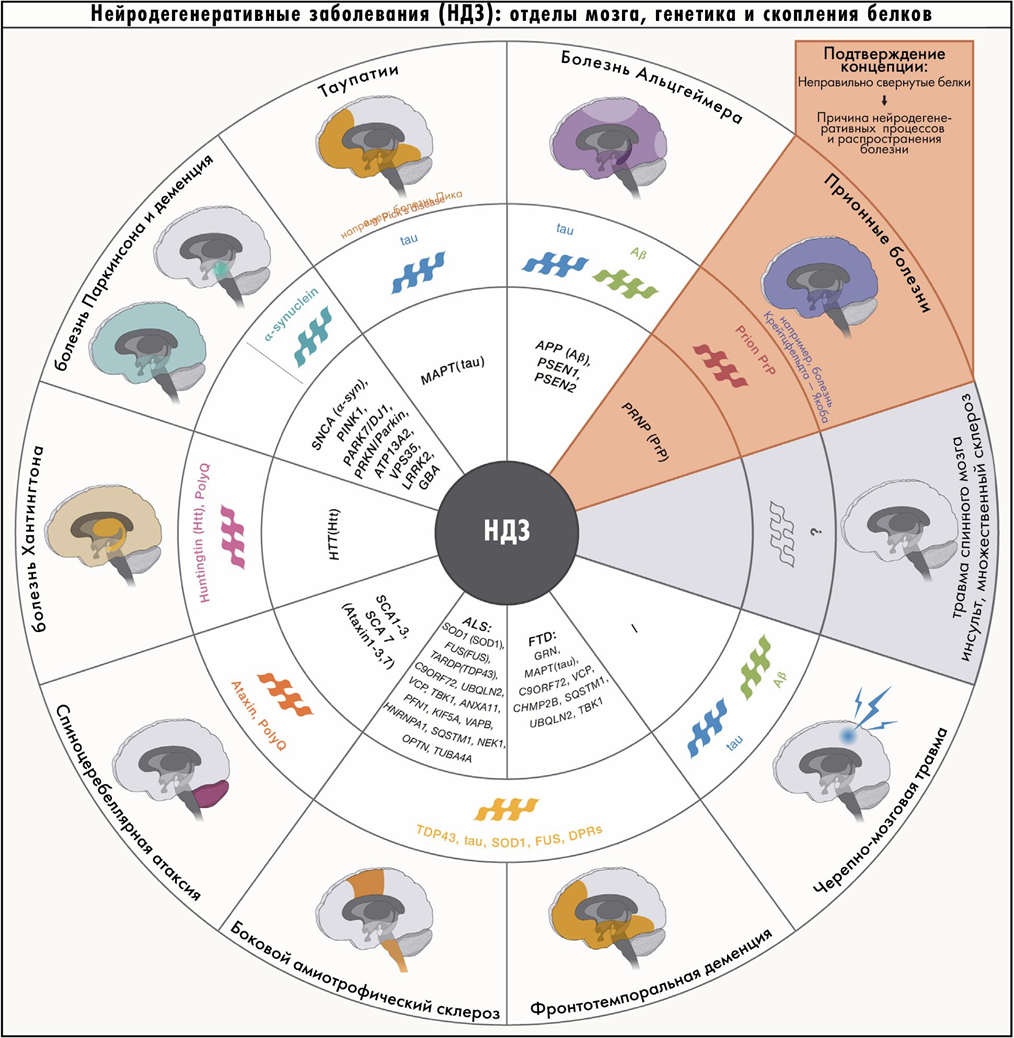
Рисунок 3. Основные причины развития нейродегенеративных болезней: связь патологических форм белка и поврежденных структур мозга.
Таупатии связаны с ассоциированным с микротрубочками белком тау [10] (ген MAPT, microtubule-associated protein tau), который собирает и стабилизирует цитоскелет нейронов. Белок имеет ряд изоформ, среди которых важнее всего две, отличающиеся числом тандемных повторов. Им соответствуют 3R-таупатии (лобно-височная деменция, в патогенезе участвует только 3R-форма), 4R-таупатии (прогрессирующий супрануклеарный паралич, кортикобазальная дегенерация и др. — только 4R-форма) и смешанные таупатии (болезнь Альцгеймера, при которой важны обе изоформы).
Вторая группа — синуклеинопатии — связаны с патологическими изменениями белков синуклеинов в мозге, главным образом альфа-синуклеина. Белок задействован в направленном транспорте веществ в везикулах и выделении нейромедиаторов в синапс. Сюда относятся болезнь Паркинсона, мультисистемная атрофия и деменция с тельцами Леви [1], [4].
Нарушенный протеостаз
Различные сломанные, неправильно свернутые и не до конца синтезированные белки для клетки — дело житейское. Конечно, если их не слишком много. Такой мусор есть кому убирать — им заняты две главные системы так называемого протеостаза, то есть поддержания протеома в должном состоянии. Первая — система убиквитинилирования протеасом [11], которая присоединяет к «неправильным» белковым молекулам остатки молекулы-метки (убиквитина) и транспортирует к особым белковым комплексам (протеасомам), где они деградируют. Вторая — система аутофагии и лизосом, — специализируется на «переваривании» в мембранных органеллах более крупных агрегатов белков и целых органелл (например, митохондрий). Она работает в том числе в синапсах и аксонах нейронов. Обычно обе системы-«уборщики» активируются в ответ на стресс в условиях голодания, а их поломка чревата запуском механизмов клеточной гибели (рис. 4).
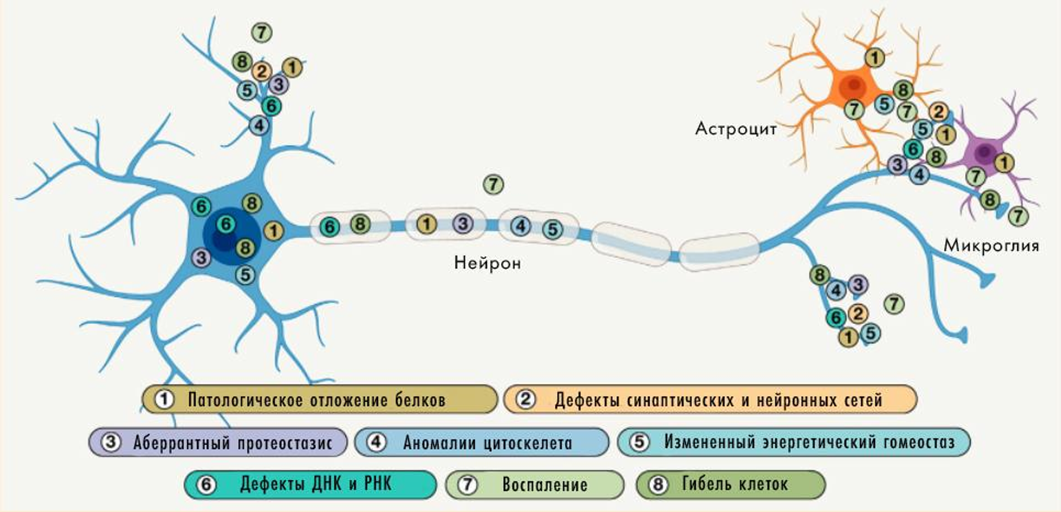
Рисунок 4. Локализация патологических изменений при нейродегенерации внутри клеток.
Изменения цитоскелета
Нейроны имеют сложную ультраструктуру, которую обеспечивает развитый и динамичный цитоскелет [12]. Он образован структурами трех типов: микротрубочками, промежуточными филаментами и микрофиламентами из актина (рис. 5) [13]. Благодаря им нейрон имеет сложную форму, перестраивает ее в синаптической части клетки и для внутриклеточного транспорта, в том числе вдоль своей «главной магистрали» — аксона. Нейродегенерации часто сопровождаются образованием агрегатов именно из белков-компонентов клеточного скелета, а нарушение аксонального транспорта — их важная примета. Для ряда болезней характерно разрушение аксонов как таковых или сбои в их работе. Причины не вполне ясны — но ясна роль гиперфосфорилирования промежуточных филаментов в нейронах (нейрофиламентов). Та же модификация стабилизирующего микротрубочки нейронов тау-белка имеет важное значение при болезни Альцгеймера [7].
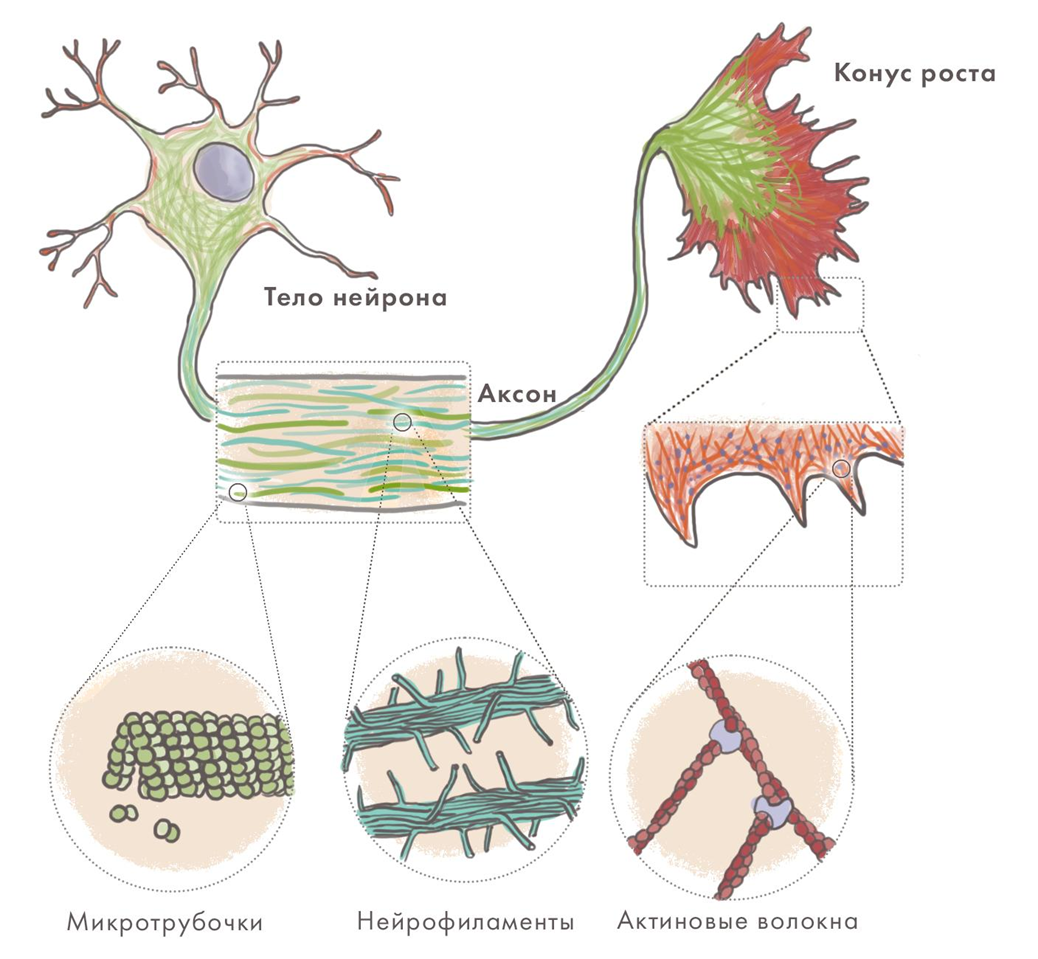
Рисунок 5. Цитоскелет нейрона.
иллюстрация Елены Беловой, адаптировано из [13]
Изменения в цитоскелете нейронов нарушают работу синапса (имеющего сложную структуру), энергетический метаболизм и транспорт РНК, а также подстегивают агрегацию белков и гибель нервных клеток [1].
Патология энергетического метаболизма
Мозг — чрезвычайно «прожорливый» орган в том смысле, что он потребляет очень много энергии. То же можно сказать о нейронах: по уровню потребления АТФ они превосходят другие клетки. Поэтому неудивительно, что нарушения энергетического метаболизма играют важную роль в развитии многих нейродегенеративных заболеваний. Для снабжения нейронов АТФ необходимы молекулы-субстраты — глюкоза или лактат, которые попадают в нервные клетки напрямую из кровотока или транзитом через астроциты.
Сбои в работе митохондрий связаны с недостатком АТФ и нарушением энергозатратных процессов в синапсах и в нейронах в целом. В результате страдают регуляция ионного баланса за счет активного мембранного транспорта, кальциевый гомеостаз, состояние цитоскелета и протеома. Более того, нарушение работы митохондрий чревато окислительным стрессом: дисбалансом между антиоксидантными системами (АОС) и активными формами кислорода (АФК). Те повреждают компоненты клетки: белки, липиды и нуклеиновые кислоты, тем самым запуская нарушения работы нейронов и клеточную смерть (рис. 6) [14].
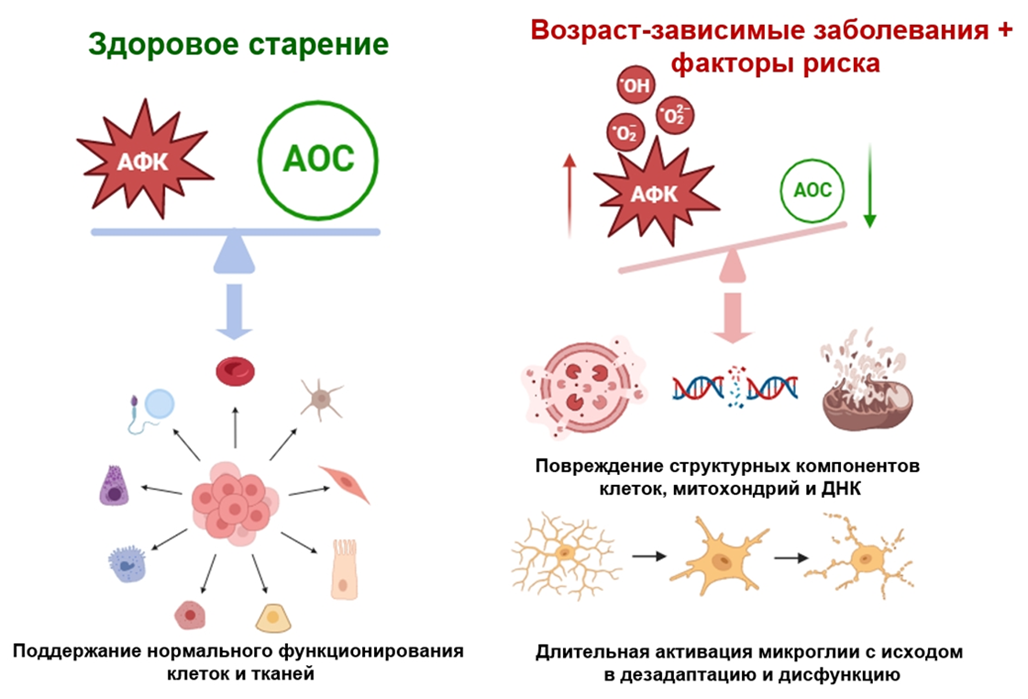
Рисунок 6. Окислительный стресс и его последствия.
С другой стороны, при повреждении митохондрии — важного депо ионов кальция, — нарушается кальциевый гомеостаз и опосредованная кальцием клеточная сигнализация. Концентрация кальция в клетке растет, что нарушает работу многих ферментов, приводит к высвобождению содержимого лизосом и повреждению белков, ДНК и цитоскелета. Из-за снижения синтеза АТФ становится меньше глутатиона — важного антиоксиданта — и усугубляется окислительный стресс. И вновь мы видим, как многие патологические факторы нейродегенерации связаны и действуют сообща [1].
Повреждения ДНК и РНК
В ЦНС генотоксичность вызвана прежде всего АФК, которые образуются в митохондриях из-за окислительного фосфорилирования. Кроме того, мутации в генах системы репарации двунитевых разрывов ДНК или системы защиты от репликативного стресса (при атаксии-телеангиэктазии) приводят к атрофии мозговой ткани. Это согласуется с тем, что накопление эндогенных повреждений в ДНК усиливает гибель нервных клеток.
Нарушения метаболизма РНК также участвуют в патогенезе ряда нейродегенераций за счет изменения физиологических процессов, прямой токсичности молекул РНК или стресс-гранул — сгустков из РНК и белка в цитоплазме, — и их участия в агрегации белка [1].
Отдельный важный механизм, связанный с изменениями ДНК, — это экспансия коротких нуклеотидных повторов [15] (рис. 7) [16], то есть их быстрое разрастание. При этом область повтора не обязательно транслируется с образованием патологического по структуре белка (содержащего полиглутаминовую вставку при одноименных заболеваниях) — их эффект может возникнуть и при попадании в некодирующую или регуляторную область ДНК [17].
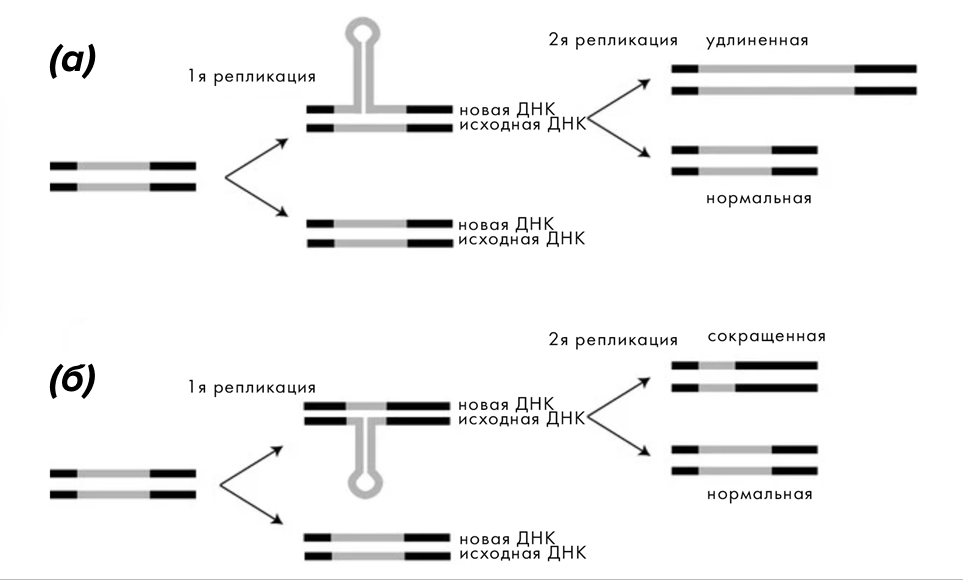
Рисунок 7. Шпилечный механизм экспансии и схлопывания нуклеотидных повторов.
Нейровоспаление
Не застрахован мозг и от воспалительных процессов, которые в этом случае носят специфическое название «нейровоспаление». Оно происходит при участии микроглии и астроцитов (рис. 8) [19], [20]. Нейровоспаление очень характерно для нейродегенераций, и его признаки легко различить в мозге при вскрытии умерших пациентов.
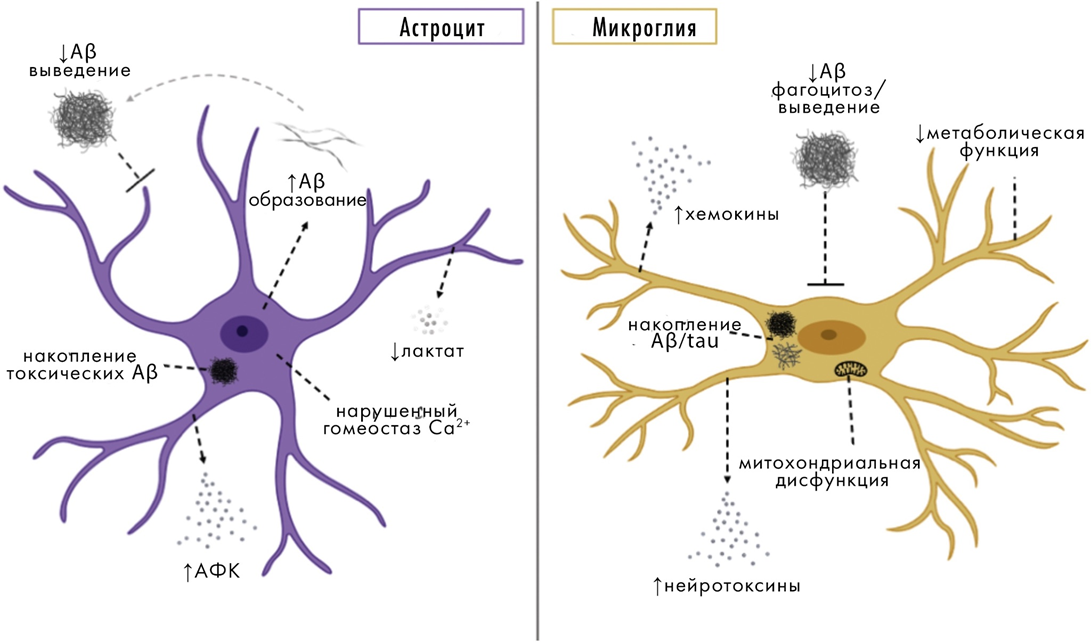
Рисунок 8. Роль астроцитов и микроглии в патогенезе болезни Альцгеймера.
Заболеваниям ЦНС, связанным с воспалением, посвящена отдельная статья этого спецпроекта.
Гибель нейронов
Кульминацией совместной разрушительной работы описанных процессов следом за разрушением синапсов и отдельных частей нейронов становится гибель нервных клеток и, как следствие, быстрая атрофия тканей мозга. Перечислим причины, по которым нейроны страдают особенно сильно.
- Нейроны — долгоживущие постмитотические клетки, которые потеряли способность делиться. Их замена возможна только за счет пула стволовых клеток. Как итог, нейроны со временем накапливают повреждения в ДНК, липидах, белках и целых органеллах.
- Повышенная потребность в энергии делает нейроны чувствительными к голоданию — главным образом из-за необходимости поддерживать работу синапсов. Она же означает ускоренную генерацию АФК за счет окислительного фосфорилирования в митохондриях.
- Наличие уязвимых выростов — аксона и дендритов, — для содержания которых необходим клеточный транспорт на значительные расстояния.
- Зависимость от обслуживающих клеток глии, обеспечивающих энергию и защиту.
Такая чувствительность нейронов особенно заметна, когда компенсаторные и защитные механизмы отдельных нейронов и мозга (о которых мы говорили в начале текста) истощаются, и клеткам ничего не остается, кроме как умереть. Сама клеточная гибель может происходить по разным сценариям: лучше прочих описаны механизмы эндогенного и экзогенного апоптоза [21], а также некроза, хотя клетки могут умирать и за счет других механизмов [1].
Нерадужный спектр нейродегенераций
Мы обсудили, почему происходят нейродегенерации — каковы общие механизмы их патогенеза. Теперь нужно обсудить, как происходят нейродегенерации — в чем различия между ними, каковы их основные симптомы и кто страдает от них чаще. При этом не будем забывать, что даже те нейродегенеративные болезни, которые, казалось бы, невозможно перепутать, в действительности основаны на общих процессах и имеют много общего — настолько много, что уверенно различить их порой может только патологоанатом. Таким образом, нам предстоит описывать скорее не дискретный набор нозологических единиц, а нерадостный спектр болезней, отдельные цвета и оттенки в котором могут плавно переходить друг в друга (рис. 9).
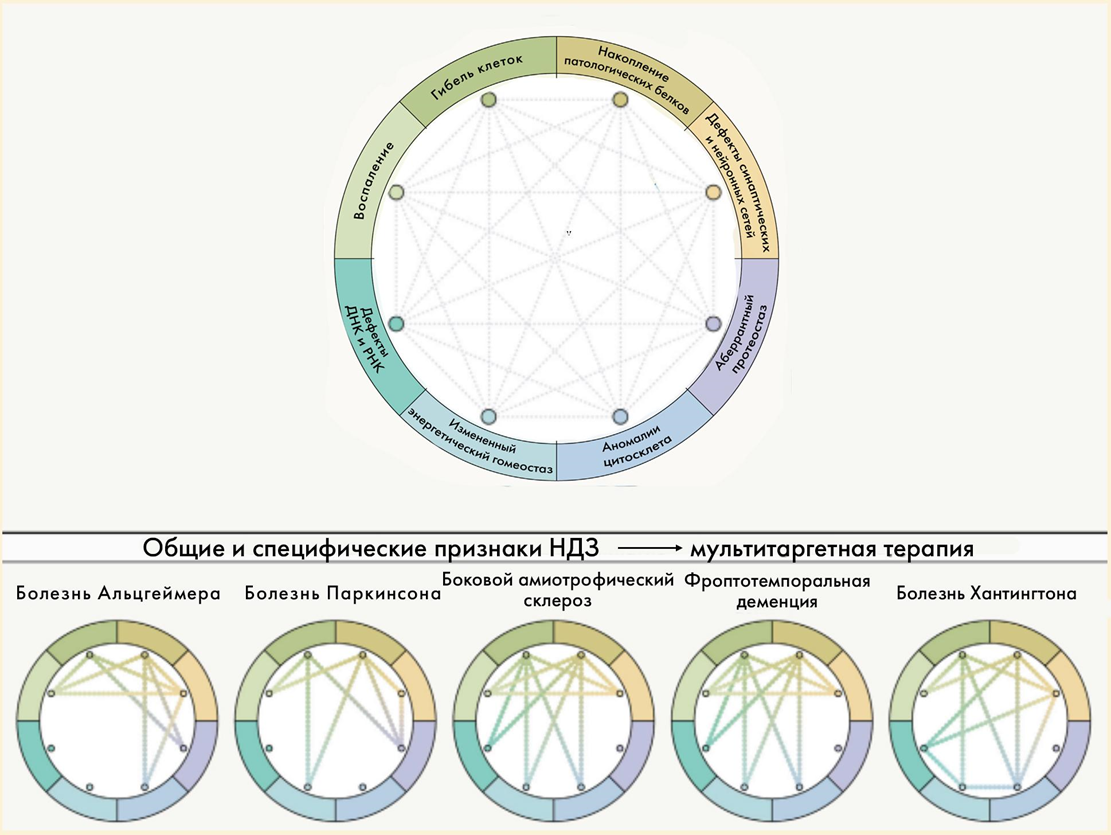
Рисунок 9. «Порочные круги» для отдельных нейродегенераций: показаны взаимосвязи отдельных патогенетических процессов и их значимость для конкретных болезней.
Нейродегенерация №1 — болезнь Альцгеймера
Разумеется, начать стоит именно с болезни Альцгеймера. Это острая социальная проблема, а кроме того — не поддающаяся решению (несмотря на огромные усилия и финансовые вливания) задача биомедицины. Самое распространенное нейродегенеративное заболевание, причина около 65 % всех деменций [14], тема тысяч статей и объект бесчисленных исследований и научных скандалов — всё это болезнь Альцгеймера [22].
В мозге умерших пациентов обнаруживают внеклеточные амилоидные бляшки, которые образованы бета-амилоидом (amyloid beta, Aβ), и внутриклеточные нейрофибриллярные клубки (скручивания), состоящие из агрегатов тау-белка. Такие белковые агрегаты токсичны, генерируют АФК и имеют прионоподобные свойства (рис. 10) [23].
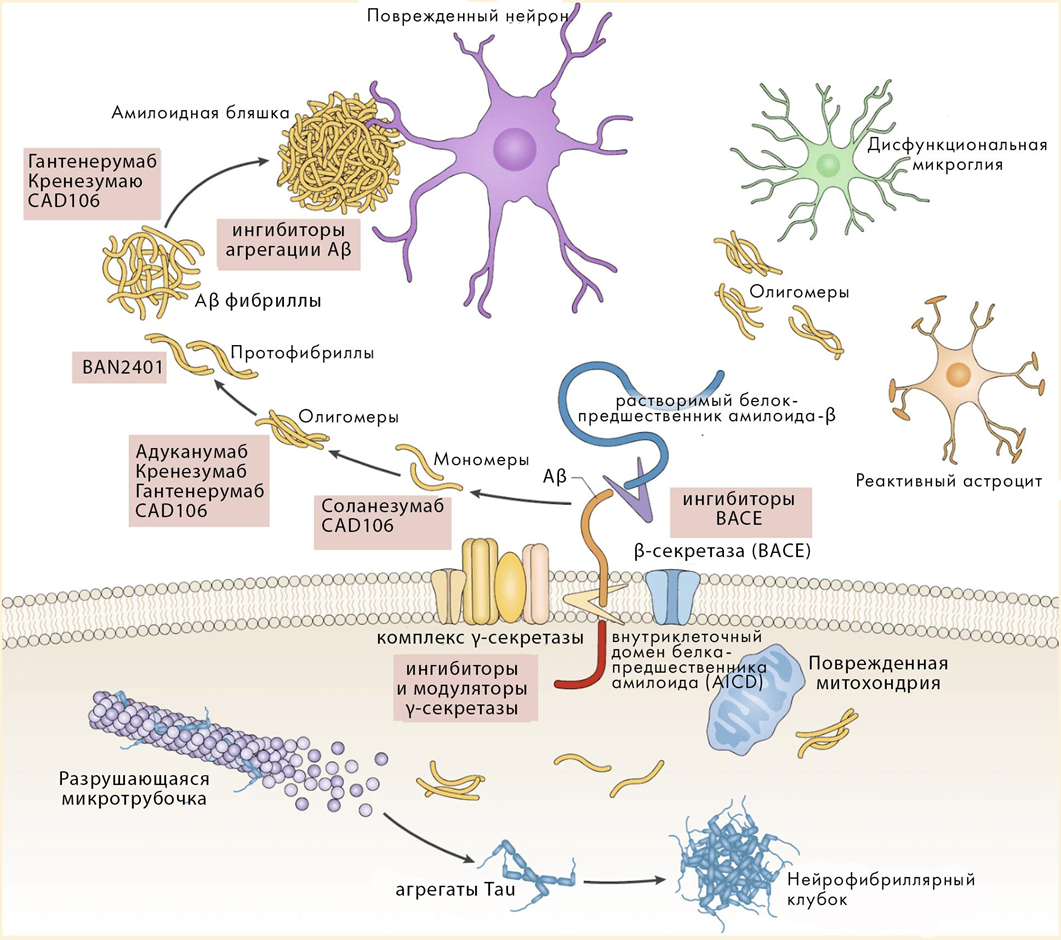
Рисунок 10. Молекулярные основы патогенеза болезни Альцгеймера.
Мы не будем подробно останавливаться на до сих пор плохо изученном патогенезе болезни Альцгеймера, потому что ему посвящено множество публикаций на «Биомолекуле»: «Болезнь Альцгеймера: ген, от которого я без ума» [24], «На руинах памяти: настоящее и будущее болезни Альцгеймера» [25], «β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера» [26].
Болезнь Паркинсона и другие синуклеинопатии
Следующее место по распространенности после болезни Альцгеймера занимают две «главные» синуклеинопатии — болезнь Паркинсона и деменция с тельцами Леви. Синуклеинопатии — это нейродегенерации, вызванные патологическими изменениями белков-синуклеинов, прежде всего альфа-синуклеина.
Как правило, болезнь Паркинсона развивается в возрасте старше 75 лет, однако иногда она может начаться до 40 лет. И вновь старение — это важнейший фактор увеличения риска заболеть: он равен 1% среди лиц старше 60 лет и 3–4% ― старше 75 лет [1], [4], [27].
Патогенез болезни Паркинсона (рис. 11) [28] и его связь с альфа-синуклеином и другими белками подробно рассматривался раньше на «Биомолекуле» («Болезнь Паркинсона: что изучать? как изучать?» [29], «Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний» [30], «Белок альфа-синуклеин — важный участник проявления болезни Паркинсона?» [31]), поэтому подробно мы здесь на нем останавливаться не будем.
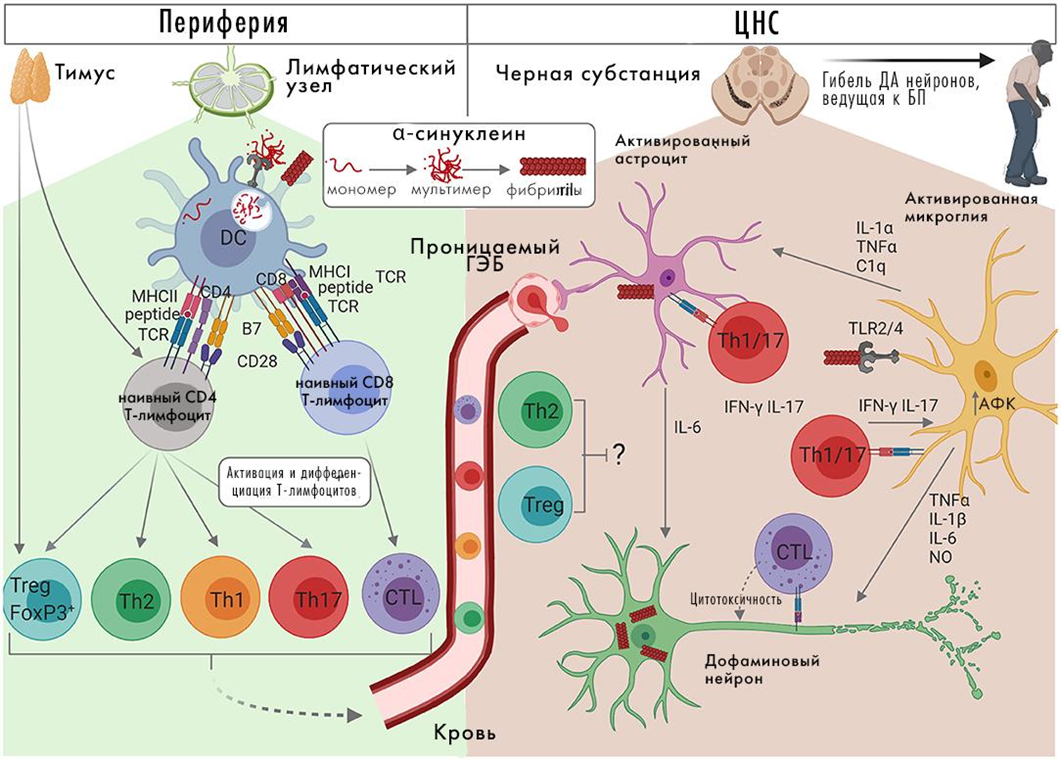
Рисунок 11. Молекулярный патогенез болезни Паркинсона. ДА — дофаминэргические.
«Чисто прионные» нейродегенерации
Выше мы не раз обсуждали «прионоподобный» механизм распространения нейродегенераций — подчеркивая, что он напоминает прионную инфекцию, но ей не является. Теперь стоит обсудить настоящие прионные заболевания, которые одновременно можно назвать нейродегенеративными заболеваниями и инфекциями в полном смысле этого слова. Действительно, они передаются от одного организма другому, вызывая заразную болезнь, но не вызваны при этом ни вирусом, ни бактерией, ни паразитом, и вообще не несут в себе генетического материала (нуклеиновой кислоты).
Прионы представляют собой белковые молекулы патологической конформации. Они способны передавать ее другим белкам, причем не только внутри того организма, в котором находятся, но и другим организмам того же или даже другого вида. Все известные прионы поражают нервную ткань (прежде всего — мозг) и вызывают формирование амилоидов, а также используют для распространения прионный белок PrP [32]. Он экспрессируется в нервной системе и, по-видимому, нужен для транспорта ионов меди (рис. 12).
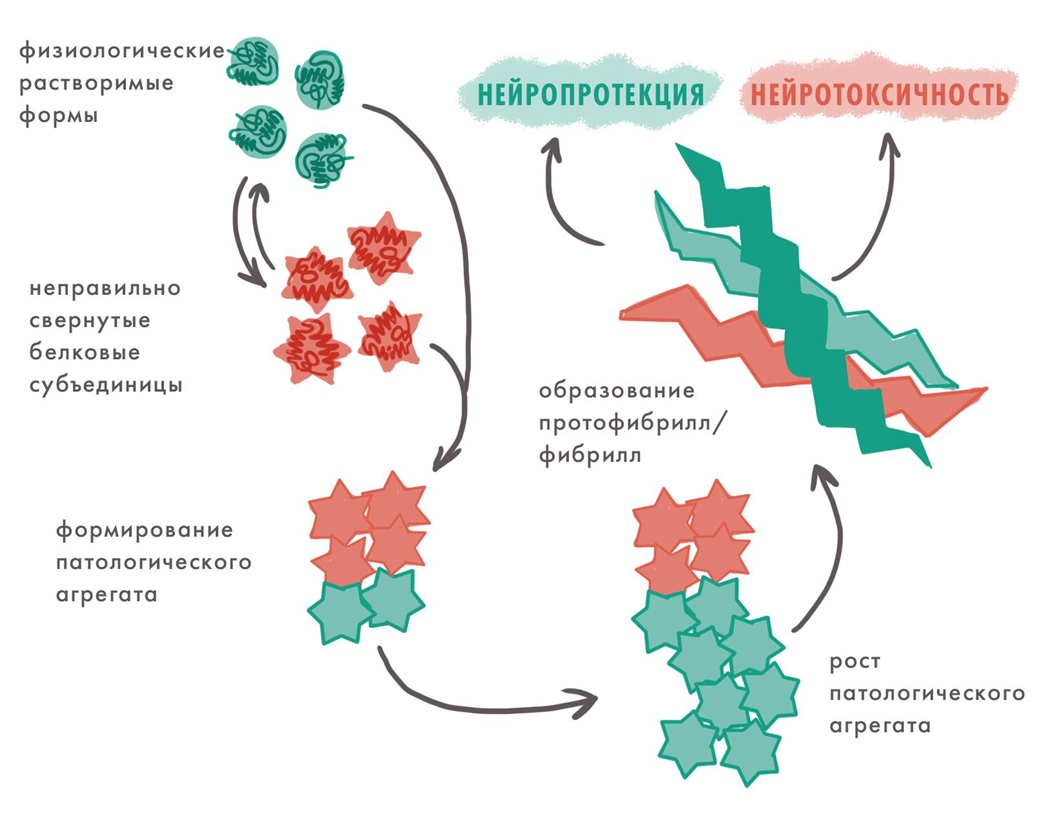
Рисунок 12. Механизм распространения прионной инфекции.
иллюстрация Елены Беловой, адаптировано из [32]
Известно множество прионных заболеваний — это трансмиссивные губчатые энцефалопатии (ТГЭ) млекопитающих, включая губчатую энцефалопатию крупного рогатого скота («коровье бешенство»). Люди болеют болезнью Крейтцфельдта—Якоба и ее вариантной формой (vCJD), синдромом Герстмана—Штраусслера—Шейнкера, фатальной семейной бессонницей и куру. Все эти болезни не поддаются лечению, быстро прогрессируют и приводят к смерти.
Прионные болезни могут быть заразны, но могут и возникать спорадически из-за мутаций в гене, кодирующем PrP, а также иметь наследственную природу. Болезнь быстро распространяется по мозгу, превращая его в пористую «губку». Опасные и важные для биологов сами по себе, прионные инфекции также стали важной моделью нейродегенераций [1], [33].
Здесь стоит упомянуть недавно опубликованный случай «заражения» болезнью Альцгеймера в результате медицинского вмешательства — из-за использования гормона роста, полученного из умерших людей. В этом случае болезнь действительно передалась от одного человека другому без нуклеиновых кислот, и ее можно назвать прионной в полном смысле слова [34].
Рассеянный склероз — «аутоиммунная нейродегенерация»
Рассеянный склероз (РС) — это нейродегенерация, которая представляет собой также демиелинизирующее аутоиммунное заболевание. Это означает, что оно вызывает потерю миелиновой оболочки нейронов — «обмотки» из клеток глии (в мозге — олигодендроцитов), а также нарушение быстрой и эффективной сальтаторной проводимости нерва (с «перескакиванием» нервного импульса). Причины связаны с аутоиммунным расстройством — «нападением» иммунитета на олигодендроциты. В результате те разрушаются [35], работа нервной системы (как ЦНС, так и периферической) страдает, а сами нейроны оказываются уязвимы и могут гибнуть. Важное значение в патогенезе имеет вирус Эпштейна—Барр EBV, который как раз-таки укрывается в клетках глии, вызывая на нее «дружеский огонь» иммунной системы. При этом болезнь обычно поражает людей в молодом возрасте, а ее распространение зависит от близости к экватору — чем севернее мы живем, тем больше риск заболеть рассеянным склерозом (рис. 13) [36–38].
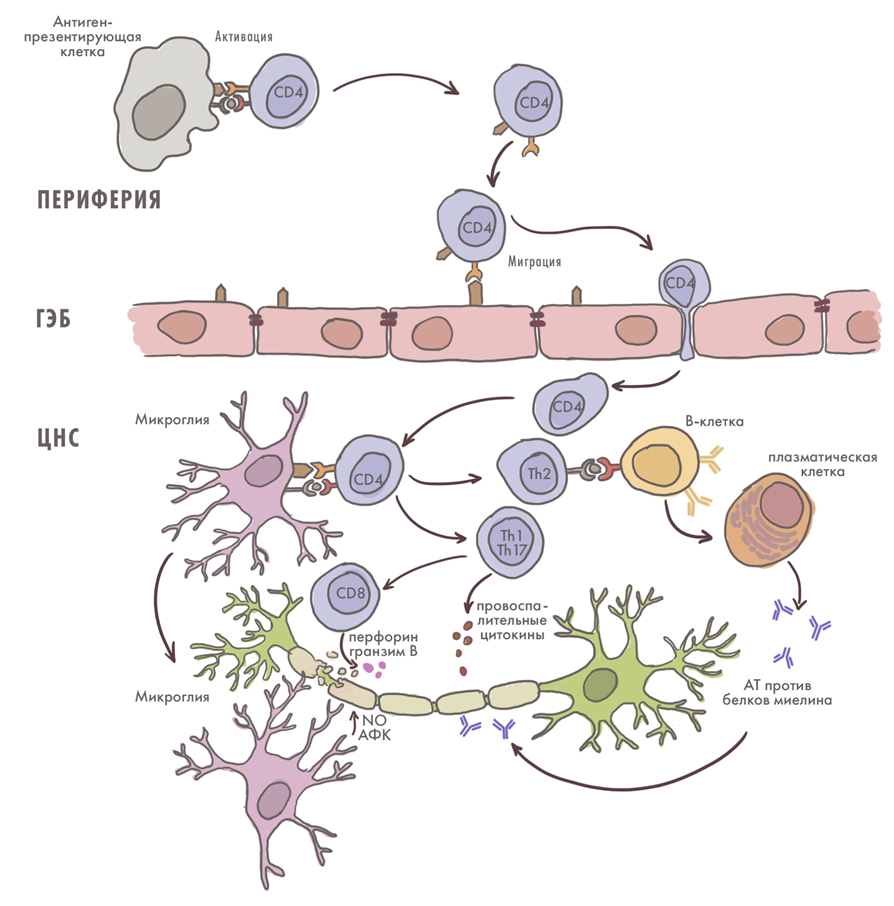
Рисунок 13. Роль иммунных клеток в патогенезе рассеянного склероза.
иллюстрация Елены Беловой, адаптировано из [38]
Поскольку РС — это прежде всего аутоиммунное расстройство, мы рассмотрим его подробнее в другой статье нашего спецпроекта, посвященной аутоиммунным и воспалительным заболеваниям ЦНС. Здесь же отметим только, что в силу своих особенностей мы умеем лечить рассеянный склероз гораздо лучше, чем прочие нейродегенерации.
Болезни, вызванные экспансиями коротких повторов ДНК
Для некоторых болезней — таких известно свыше 40, это главным образом нейродегенерации, — первопричиной является экспансия коротких тандемных повторов [15]. Их обычно называют «тринуклеотидными экспансиями», хотя повторяющейся единицей может быть ди-, тетрануклеотид и более длинные фрагменты ДНК. Сюда относятся болезнь Хантингтона, обширная группа спиноцеребеллярных атаксий (SCA), атаксия Фридрейха, некоторые виды БАС и другие.
Болезни возникают из-за динамических мутаций — быстрого неконтролируемого разрастания (экспансии) областей коротких тандемных повторов ДНК. Если размер области повторов перевалит за предельное значение (40–60 копий), то в дальнейшем они теряют стабильность и быстро растут, вызывая множество негативных эффектов — то есть нейродегенеративный процесс. Экспансии могут возникнуть в различных генах. Для того, чтобы вызвать патологию, им совершенно необязательно попасть в кодирующую область гена — чаще они локализованы в некодирующих областях ДНК, в том числе регуляторных (например, промоторах). Если же область экспансии повторов транскрибируется и далее транслируется, в получившемся белке оказывается весомая лишняя вставка. Это характерно для полиглутаминовых (polyQ) болезней [39], возникающих из-за экспансии тринуклеотидных повторов CAG (триплет, кодирующий глутамин) в тех или иных генах. В этом случае возникает патологический белок, вызывающий различные проблемы, и развивается протеинопатия (рис. 14).
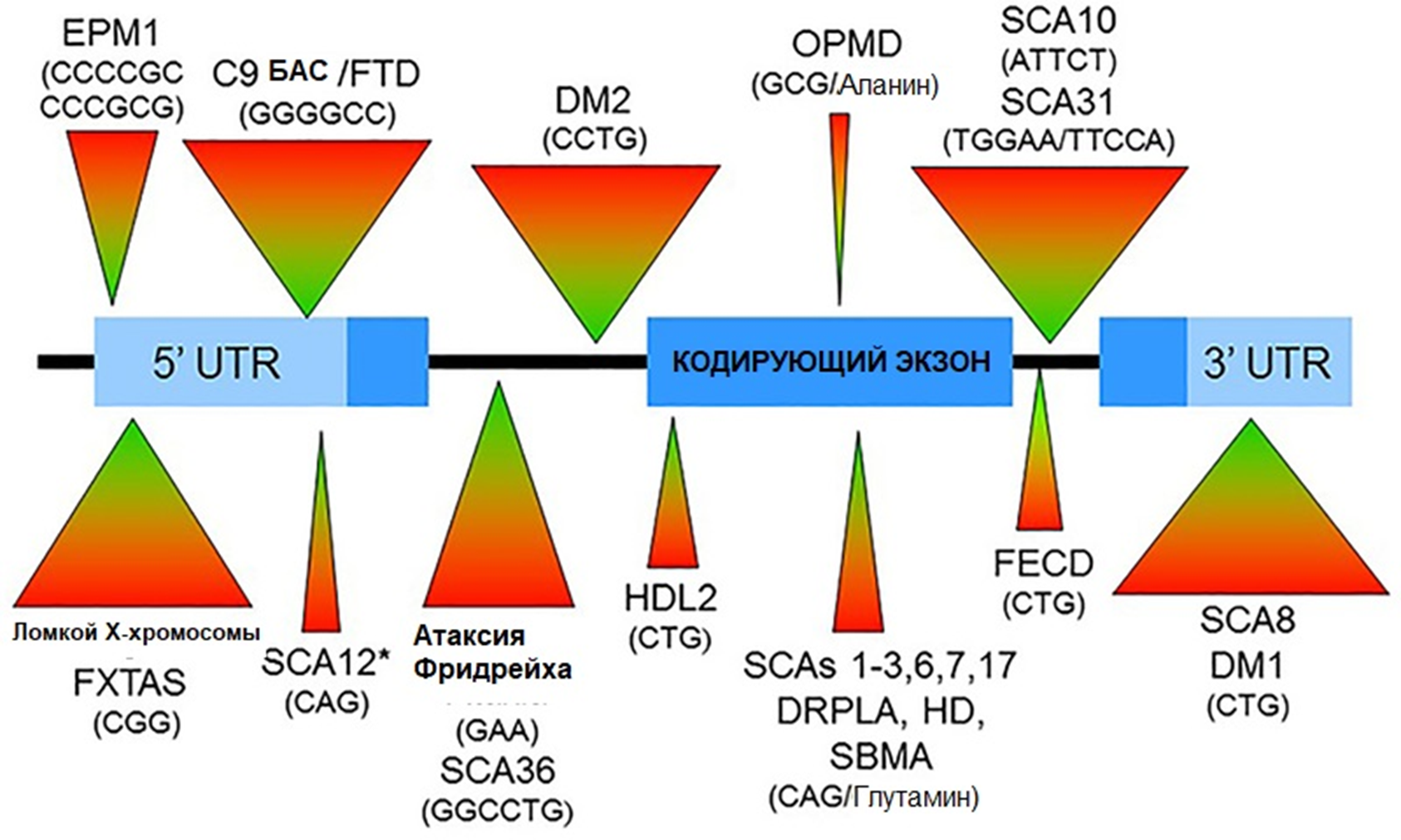
Рисунок 14. Локализация экспансий нуклеотидных повторов в гене при различных болезнях в разных областях ДНК.
5’-UTR — нетранслируемая область на 5’-конце; 3’-UTR — нетранслируемая область на 3’-конце; coding exon — кодирующий белок экзон;
заболевания: EPM1 — Болезнь Унферрихта—Лундборга; Fragile X — синдром ломкой X-хромосомы; ALS/FTD — БАС/лобно-височная деменция; SCA 12/10/31/8 и т.д. — различные типы спиноцеребеллярных атаксий; Friedreich Ataxia — атаксия Фридрейха; DM1 и DM2 — миотоническая дистрофия 1 и 2 типа; HDL2 — хантингтоноподобное заболевание 2 типа; OPMD — окулофарингеальная мышечная дистрофия; DRPLA — дентато-рубро-паллидо-льюисова атрофия; HD — болезнь Хантингтона; SBMA — спинально-бульбарная мышечная атрофия; FECD — эндотелиальная роговичная дистрофия Фукса.
В скобках указана повторяющаяся единица.
Среди этой группы особенно известна болезнь Хантингтона (хорея Хантингтона), при которой экспансия затрагивает кодирующую область гена хантингтина Htt. В норме хантингтин играет важную, но плохо понятную роль в жизни нейронов — по-видимому, участвует в аксональном транспорте и взаимодействует с огромным множеством других белков. В норме он содержит 6–35 остатков глутамина подряд, однако при экспансии область CAG-повторов гораздо длиннее. Чем длиннее область тринуклеотидных повторов, тем тяжелее симптомы болезни. Хантингтин теряет нормальные функции и приобретает новую — токсичность. В клетке патологический удлиненный белок склонен расщепляться на фрагменты, которые имеют патологическую конформацию и тоже распространяют патологию по прионоподобному механизму. В компании стандартных для нейродегенерации процессов они вызывают в мозге быстрые разрушения. Болезнь Хантингтона неизлечима [40] и неизбежно заканчивается гибелью пациента через 15–20 лет после начала.
Следующий важный пример нуклеоитидных экспансий и полиглутаминовых заболеваний — это многие представители группы спиноцеребеллярных атаксий (SCA). В нее входит ряд генетических болезней, которые объединяет наследование по аутосомно-доминантному типу. Они затрагивают различные гены, которые у больных имеют нуклеотидные экспансии. В результате развивается прогрессирующая атаксия (нарушение согласованности движений), связанная с атрофией мозжечка — части мозга, необходимой для чувства равновесия, — и изменениями в спинном мозге [36].
Остальные нейродегенерации
Упомянутые выше болезни экспансий нуклеотидов от «классических» нейродегенераций отличает их моногенный характер. Действительно, в их основе — конкретные гены и известные мутации, что делает их хорошей моделью для изучения более «сложных» нейродегенеративных расстройств. То же можно сказать и о других редких болезнях — так называемых орфанных, — которые с одной стороны относятся к нейродегенерациям, а с другой — к редким заболеваниям нервной системы. В каком-то смысле это хорошая новость: моногенные проще понять и научиться лечить с помощью генотерапии [41], поскольку терапевтическая мишень очевидна.
Скажем, нейромоторные заболевания — нейродегенеративные расстройства, при которых страдают двигательные (моторные) нейроны ЦНС. В результате развивается слабость мышц и потеря подвижности, приводящие к инвалидизации и смерти. Среди болезней этой группы особенно известны боковой амиотрофический склероз (БАС) и спинальная мышечная атрофия (СМА) [8].
При БАС избирательно гибнут моторные нейроны спинного мозга, ствола головного мозга и первичной моторной коры. Сигналы не доходят до скелетных мышц, те атрофируются, и пациент теряет подвижность, способность говорить и в результате умирает — как правило, из-за дыхательной недостаточности.
Спинальная мышечная атрофия (СМА) [8] — другое нейромоторное генетическое заболевание, которое поражает двигательные нейроны передних рогов спинного мозга. Болезнь проявляется в детстве прогрессирующей потерей мышц конечностей и туловища, нарушениями осанки, утратой подвижности и, из-за разрушения дыхательной мускулатуры, дыхательной функции.
Стоит также упомянуть лизосомные болезни накопления, которые приводят к нейродегенерации. При этом происходит «поломка» ряда белков, участвующих в метаболизме липидов, гликопротеинов и направленном транспорте внутри клетки. Это прежде всего нейрональные цероидные липофусцинозы (НЦЛ, нейрональные восковидные липофусцинозы), в которые в виде одной из форм входит болезнь Баттена. В мозге заболевших действительно обнаруживают липофусцин — флуоресцирующий «пигмент старения», хотя пациенты — это главным образом дети или даже младенцы. НЦЛ — самые распространенные нейродегенерации детского возраста, — красноречиво показывают, что «нейродегенерации все возрасты покорны». Болезнь проявляется потерей зрения из-за дегенерации сетчатки, тяжелыми неврологическими проявлениями (эпилептические приступы, деменция), быстро прогрессирует и приводит к летальному исходу.
Другой важный пример «орфанных» нейродегенераций — нейродегенерации с накоплением железа в мозге (ННЖМ). В этом случае мозг пациентов действительно содержит включения из отложений железа в виде бурых пятен, что иногда характерно и при «больших» нейродегенерациях [42]. Такая «ржавчина» образуется в нервной ткани из-за генетических дефектов в белках, которые в норме обеспечивают метаболизм железа — кодируют белки-переносчики металлов трансферрин, церулоплазмин и т. д. Описаны мутации в ряде генов, которые нарушают отдельные этапы обмена железа — им соответствуют более 10 разных форм ННЖМ.
«Железные» нейродегенерации также поражают главным образом подростков и детей. Болезнь проявляется нарушениями движения, речи, когнитивными и психическими расстройствами, прогрессирует и плохо поддается лечению.
Время дорого: методы ранней диагностики
Одна из причин, по которой нейродегенерации очень плохо поддаются лечению (а точнее, за редкими исключениями, вообще не лечатся) — это запоздалое медицинское вмешательство. Обычно оно начинается, когда нейронов, которые нужно спасать, уже почти не осталось. Поэтому особое значение имеет раннее выявление болезни, для которого можно использовать целый ряд методик. Важно, что отдельные способы диагностики нейродегенераций имеют низкую специфичность, так что диагноз лучше ставить на основании нескольких подходов сразу. Тем не менее, зачастую точно узнать, что именно произошло с мозгом, возможно лишь при вскрытии.
Рассмотрим основные инструменты диагностики нейродегенерации — от самых простых к более сложным и точным. Обычно именно в таком порядке к ним прибегают врачи.
Многие признаки нейродегенерации на доклинической стадии можно подметить, просто наблюдая за общим состоянием и обликом человека. Так, медленная походка, сгорбленная осанка, тихая речь, бедная мимика, ухудшение почерка, депрессия, тревожность и утомляемость могут сигнализировать о начавшейся болезни Паркинсона. У заболевших ранней стадией болезни Альцгеймера отмечают небольшие нарушения обучаемости, памяти и эмоциональные расстройства [4].
Нейропсихологическое тестирование и осмотр проводит на приеме врач, который оценивает характер и глубину различных дефицитов, то есть функциональных нарушений. Доступны тесты для оценки кратковременной памяти, исполнительной функции (решение задач, например, сортировка карточек) и другие. Обычно с этой целью используют целые батареи (наборы) тестов, которые также позволяют оценить прогрессирование симптоматики.
Для нейропсихологических тестов все чаще используют новые технологии: например, приложение на смартфоне, которое к тому же само фиксирует результат. Другой вариант — переносные датчики, которые крепят к пациенту, или виртуальная реальность, например тест «4 горы», который оценивает пространственную память (рис. 15) [43]. Плюсы такого подхода очевидны: тесты обходятся совсем недорого и имеют нулевую инвазивность при полной безопасности.
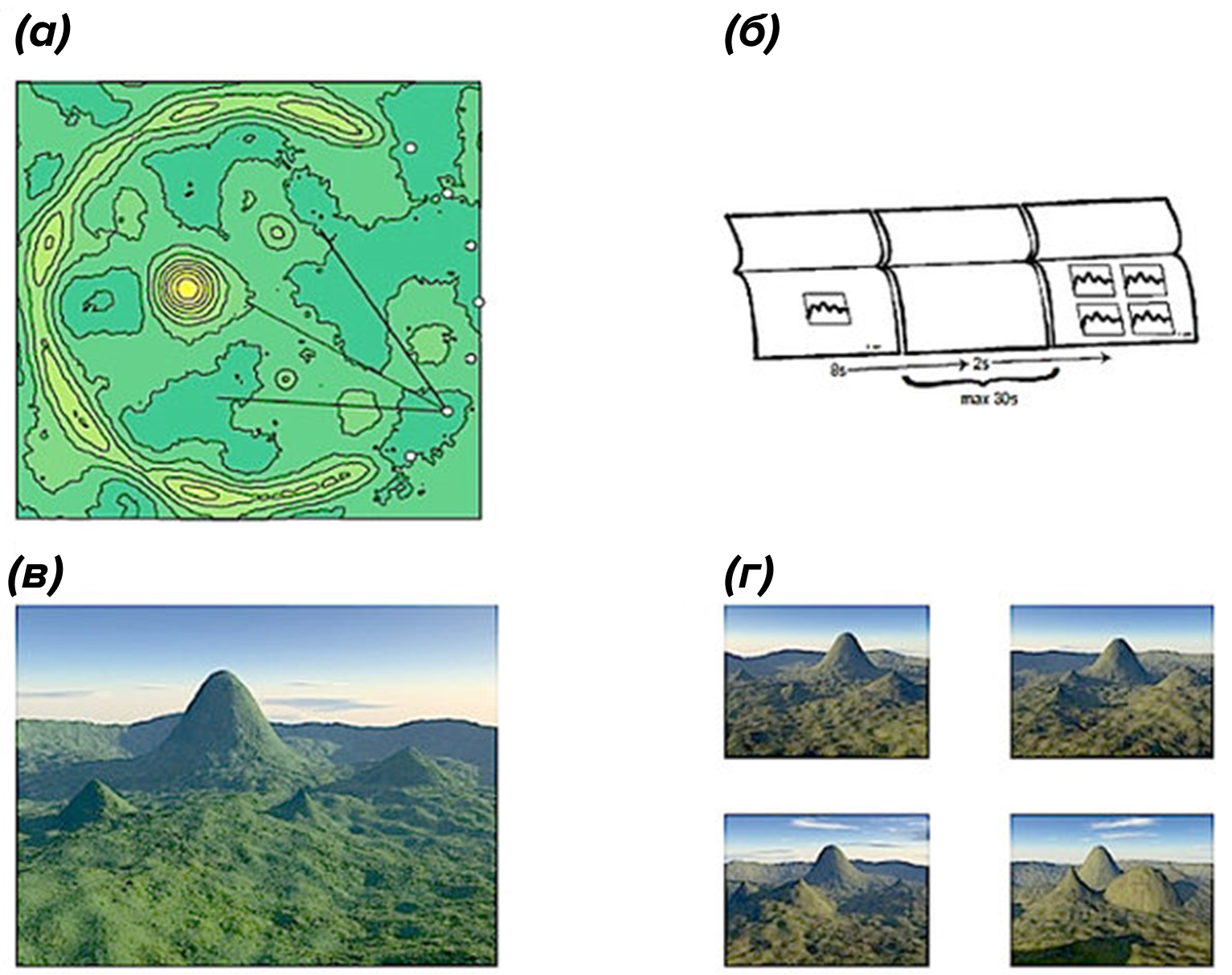
Рисунок 15. Красивый пейзаж, который рассматривают пациенты в виртуальной реальности при оценке пространственной памяти в тесте «4 горы» (4 mountains test). Задача пациента — узнать увиденный ранее ландшафт (а) на изображении среди нескольких других (панель б и г).
Также используют биомаркеры нейродегенеративных расстройств, которые можно обнаружить в крови. Дело в том, что нейродегенерации не ограничиваются эффектом на ЦНС — от них также страдает периферическая нервная система и различные внутренние органы, включая железы внутренней секреции, что сказывается на составе спинномозговой жидкости и крови. Например, по циркулирующим в кровотоке бета-амилоиду или фосфорилированному тау-белку можно распознать болезнь Альцгеймера. Содержание в крови фрагментов нейрофиламентов, бета-синуклеина, тРНК и других маркеров — менее специфический признак нейродегенеративного процесса, а наличие белков глии говорит о разрушении глиальных клеток. Однако иногда пробы крови не информативны, и приходится прибегать к люмбальной пункции — забору ликвора через прокол на уровне поясницы. Это дает более уверенный результат, но связано с риском осложнений.
Другой доступный диагностический подход — генотипирование [44], то есть выявление патологических мутаций в генах, связанных с нейродегенерацией. Его прогресс связан с многократным удешевлением получения последовательности ДНК благодаря высокопроизводительному секвенированию (NGS). Это прежде всего способ выявить людей из группы риска и провести дифференциальную диагностику редких заболеваний [45].
Однако последнее слово при постановке диагноза — за методами нейровизуализации. Они выявляют локализацию патологического процесса в головном мозге и его динамику. Применяют магнитно-резонансную томографию (МРТ) и позитронно-эмиссионную томографию (ПЭТ). ПЭТ оценивает интенсивность метаболизма глюкозы и наличие нейрофибриллярных клубков в мозге, а также функциональное состояние специфических нейронов и уровень нейротоксинов в отдельных областях мозга. При ПЭТ-диагностике используют короткоживущие радиоактивно меченные молекулярные маркеры, в том числе предшественники синтеза нейромедиаторов.
Реже для ранней диагностики нейродегенераций используется МРТ. Метод «видит» повреждения белого вещества и уменьшение локального объема различных отделов мозга. Он позволяет, например, выявить болезнь Альцгеймера за несколько лет до первых клинических признаков — по атрофии базальных отделов переднего мозга и энторинальной коры. Функциональная МРТ также различает гемодинамику и помогает судить об активности отделов мозга, необходимых для специфических функций.
Есть и другие неинвазивные методы инструментальной диагностики. Скажем, используемая также для терапии транскраниальная магнитная стимуляция (ТМС) [46], основанная на ультразвуке транскраниальная сонография и изучение паттернов электроэнцефалографии (ЭЭГ). Однако для диагностики нейродегенерации ЭЭГ плохо подходит из-за низкой точности.
Итак, среди арсенала методов диагностики нейродегенераций есть очень доступные, но не очень точные. И есть дорогостоящие, но требующие сложного оборудования при гораздо большей надежности. По-видимому, оптимально сочетать их друг с другом — начиная с дешевых и заканчивая, если потребуется, более достоверными [4], [46].
Всё начинается с модели
Чтобы найти действенное патогенетическое лечение для некоторой болезни и точно понять механизмы ее развития, совершенно необходимы валидные модели. Идеальная модель (если бы она была возможна) воспроизводила бы детали патогенеза на всех уровнях организации живой материи — от молекул до целых органов (прежде всего мозга) и поведения. Она помогла бы найти надежные маркеры для ранней диагностики и действенные методы лечения. Между тем, используемые на практике модели от этого очень далеки, ведь они плохо воспроизводят разрушение стареющего мозга реального человека. С другой стороны, таких моделей чрезвычайно много, и они очень разнообразные.
Удивительно, но нейродегенерации сейчас моделируют даже с помощью бактерий — которые, казалось бы, никогда не страдали от деменции и тремора. Так, прокариоты служат для изучения механизмов экспансии нуклеотидных повторов и путей борьбы с ними [47], а также для наработки патологических форм белка. Прокариотические модели посложнее воспроизводят систему «мозг—микробиом»: в соответствии с современными представлениями, нейродегенерации (как и очень многие другие патологии) связаны с нарушением микробиома в кишечнике [48].
Далее следуют дрожжи Saccharomyces cerevisiae. Это эукариоты — а значит, несмотря на свою одноклеточность, намного ближе к человеку с точки зрения биохимика или генетика. С дрожжами нас роднят и многие метаболические процессы, и солидный набор гомологичных генов. Изучать молекулярно-генетические основы болезней в дрожжах можно, мутировав в их геноме соответствующие патогенетические гены или внося новые.
Преимущества многоклеточных моделей очевидны: они воспроизводят более сложные процессы развития, взаимодействия и регенерации в тканях и в полной мере могут стареть. Среди таких моделей проще беспозвоночные животные (рис. 16) [49]. Хотя они совсем не родственны человеку, на молекулярном и клеточном уровне нематода Caenorhabditis elegans или плодовая мушка Drosophila melanogaster имеет очень сходные с человеческими нейроны, синапсы и их морфогенез. С помощью этих насекомых изучают, например, роль сигнальных Wnt-белков в метаболизме бета-амилоида.
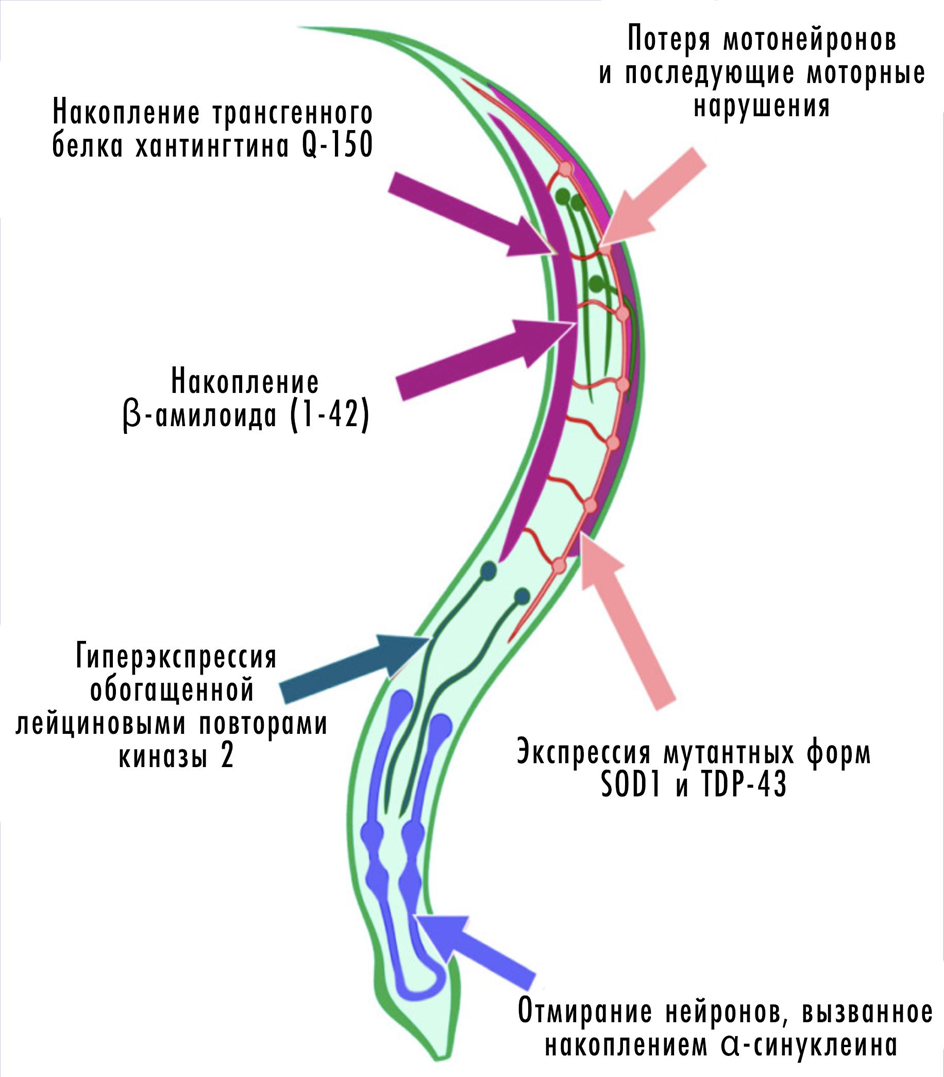
Рисунок 16. Моделирование нейродегенерации на черве C. elegans.
Более того, животные (включая беспозвоночных) подвижны и активно взаимодействуют со средой. А значит, мы можем изучать их поведение — поиск пищи, формирование пространственной памяти и т. д. — и связать его с тем, что происходит на молекулярном уровне. Главный «лабораторный червь» — C. elegans — очень хорошо подходит для изучения клеточной смерти и аутофагии. Тело животного состоит из считанных (буквально) 959 соматических клеток и ровно 302 нейронов. Судьбу каждой клетки — включая рождение и гибель, — в прозрачном существе легко проследить. К тому же описаны все связи между нейронами C. elegans, поэтому это также отличная модель для изучения коннектома — совокупности всех синаптических контактов между нейронами.
Модели на позвоночных — это прежде всего млекопитающие, которые родственны человеку и во всех отношениях на него похожи: старением, сложным мозгом, иммунной системой, а также поведением. Особую ценность имеют модели на приматах, которые особенно близки человеку, — вот только работать с ними очень дорого и требует трудоемких согласований.
Животные модели особенно разнообразны и воспроизводят более сложные аспекты нейродегенерации. Для того, чтобы сделать животное «больным нейродегенерацией», можно вводить в его мозг какой-то токсин, который избирательно убивает нейроны. Скажем, МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридин) или хлорид алюминия (III) [14]. Они воспроизводят патологические процессы при болезни Паркинсона и Альцгеймера, соответственно. Второй токсин, к тому же, воспроизводит ряд характерных признаков старения, в контексте которого обычно и происходит нейродегенерация.
Далее, модель можно создать с помощью хирургического повреждения в мозге — например, ольфакторной бульбэктомии, то есть удаления обонятельных луковиц у грызунов. Изменения в их мозге и поведении в определенной степени моделируют болезнь Альцгеймера [50], а также депрессию.
Большой популярностью пользуются трансгенные модели, то есть введение в геном животного генов с характерными для заболевших людей мутациями. Разумный подход, и все же нейродегенерация в обычном случае — это полигенное расстройство с большим значением негенетических факторов. Впрочем, можно использовать несколько мутаций, как в случае мышей линии 5xFAD, которые имеют три мутации в гене APP и еще две — в PSEN1 (всего пять).
Производными от животных моделей можно считать первичные клеточные культуры — выращиваемые в клеточных флаконах нейроны, сами по себе или вперемешку с глией. В таких конструкциях можно воспроизводить сложное сочетание патогенетических факторов [10] — например, использовать выделяющие токсичную форму тау-белка клетки и добавлять к ним фибриллярный бета-амилоид.
В целом, прочие модели сейчас уступают более современным органоидным — включая знаменитые «мини-мозги» (mini-brains). Их тоже культивируют in vitro и получают из стволовых клеток, воспроизводя структуру реального органа или связь между тканями. Модель максимально приближается к мозгу заболевшего и учитывает роль микроокружения клетки.
С другой стороны, мини-мозги не имеют поведения, эмоций и обучаемости, которые важны при нейродегенерации. Обойти это ограничение можно, перенеся органоид в мозг животного и тем совместить преимущества животной и органоидной моделей (рис. 17) [4], [49].
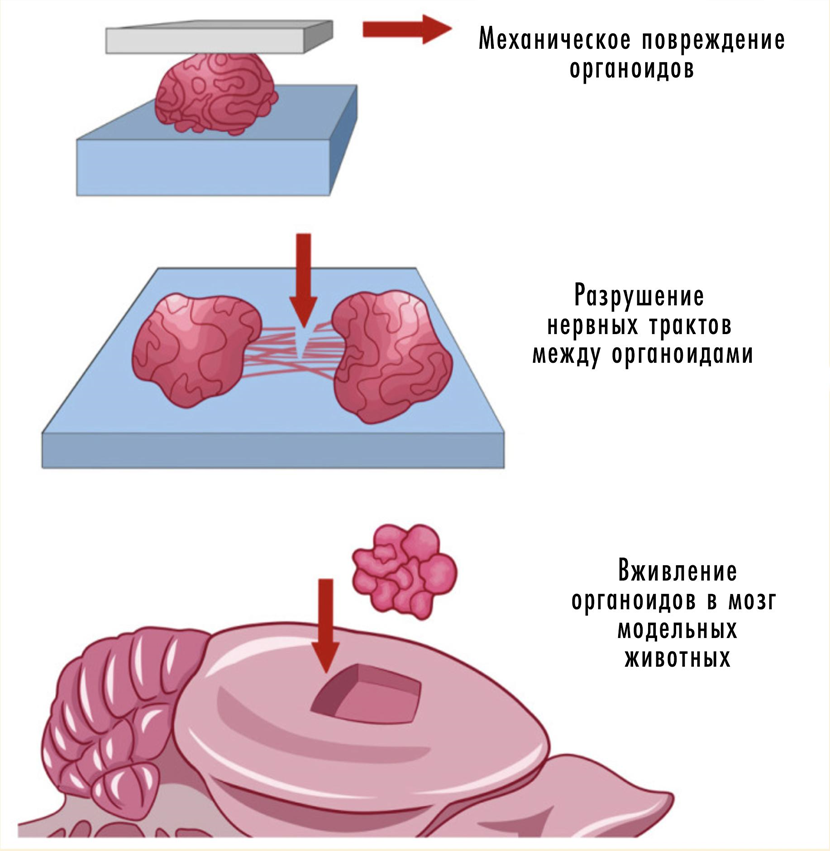
Рисунок 17. Совмещение органоидов и животной модели.
Лекарство, которого нет
Всё сказанное подводит нас к самому важному вопросу, касающемуся нейродегенеративных болезней: как их лечить? И как их лечат сейчас? С сожалением необходимо признать, что современная медицина по-прежнему очень плохо справляется с нейродегенерациями.
Болезнь Альцгеймера
Существующее лечение
На сегодняшний день для использования при болезни Альцгеймера FDA (Управление по пищевым продуктам США) одобрило всего несколько препаратов. Среди них три — ингибиторы ацетилхолинэстеразы, которые способствуют холинергической передаче нервного импульса: донепезил (Donepezil), галантамин (Galantamine) и ривастигмин (Rivastigmine). Четвертый, мемантин (Memantine), — это антагонист NMDA-рецепторов. Все эти препараты способны лишь немного и временно улучшить когнитивные возможности пациентов с умеренной или тяжелой болезнью Альцгеймера, то есть являются чисто симптоматическим лечением. Считают, что сочетание ингибитора ацетилхолинэстеразы с мемантином имеет более высокую эффективность.
В случае тяжелых психических расстройств, депрессии и нарушениях сна, которые часто возникают при болезни Альцгеймера, назначают антидепрессанты и атипичные антипсихотики. Однако психотропные лекарства могут вызвать тяжелые нежелательные явления, так что их применяют с большой осторожностью [4], [51].
Долгое время (с 2003 года) этот список из четырех препаратов не пополнялся, хотя десятки препаратов начинали путь к нему. В частности, большие надежды возлагались на амилоидную гипотезу и антитела, которые связывают амилоид, а также малые молекулы, которые блокируют его образование. Среди 63 препаратов, направленных на модификацию болезни (то есть не симптоматических), которые провалились в разработке в фазах 2 и 3, 23 были направлены на амилоид [52]. Из них почти половина были антителами против бета-амилоида. Однако разработчики не сдавались, и в 2021 г. FDA в ускоренном порядке одобрило адуканумаб (Aducanumab) — моноклональное антитело к бета-амилоиду в форме бляшек и олигомеров. Одобрило несмотря на то, что в двух регистрационных исследованиях лекарство не вызвало значимого улучшения состояния больных, а независимая комиссия проголосовала против одобрения. Тем не менее, компания Biogen предоставила данные, что у пациентов, получавших препарат в высшей дозе, наблюдается значимое снижение количества амилоидных бляшек. Положительный эффект адуканумаба изначально был невелик, что едва ли простительно для препарата с очень серьезными нежелательными явлениями.
С этим и подобными антителами связаны так называемые амилоидные аномалии нейровизуализации (ARIA, Amyloid-related imaging abnormalities), различимые с помощью МРТ. Они наблюдались примерно у трети получавших адуканумаб пациентов, которые также жаловались на головную боль, изменения психического состояния, дезориентацию, тошноту, рвоту, тремор и нарушение походки. Более того, ARIA чреваты опасным для жизни отеком мозга или небольшими кровоизлияниями в мозг. В результате в 2024 году от клинического использования препарата пришлось отказаться.
В январе 2023 года был одобрен новый препарат — леканемаб (Lecanemab), — гуманизированное моноклональное антитело, связывающее растворимые формы агрегированного бета-амилоида (олигомеры, протофибриллы), а также нерастворимые фибриллы. Разработчик сразу подал в FDA заявку на ускоренное одобрение препарата на основании резкого сокращения числа бляшек во 2 фазе испытаний. Показано, что леканемаб положительно влияет на биомаркеры нейродегенерации при ранней болезни Альцгеймера, а также несколько замедляет потерю когнитивных способностей. Препарат получил полное одобрение в 2023 году. Однако это лекарство, подобно адуканумабу, тоже вызывает тяжелое осложнение — ARIA.
Терапия в разработке
Вероятно, вскоре к одобренным моноклональным антителам присоединятся и другие. Ближе прочих к этому донанемаб (Donanemab), который таргетирует модифицированный пироглутаматом N-конец бета-амилоида в бляшках и способствует их удалению с участием микроглии. В январе FDA отклонило заявку на ускоренную регистрацию лекарства на основании данных фазы 2 в связи с недостаточным числом пациентов. Решение FDA по донанемабу пока (на май 2024 года) не принято.
И все же настоящий провал многих новых препаратов — которые зачастую имеют сомнительную эффективность при опасных осложнениях, — заставляет уделять всё большее внимание другим, не связанным с амилоидом мишеням терапии (рис. 18) [53]. Это прежде всего методы лечения, направленные на тау-белок. Например, препарат E2814, который представляет собой гуманизированное моноклональное антитело к последовательности HVPGG на связывающем микротрубочки домене белка тау. Он влияет на распространение патологии: таргетирует внеклеточный тау-белок, предотвращает его передачу между клетками, а также стимулирует удаление патологических форм тау-белка микроглией. Препарат проходит клинические испытания, которые должны завершиться к 2027 году.
Трендом фармакологии стало использование одобренных ранее лекарств с другой целью — например, антидиабетических средств при нейродегенерации. Это разумно, ведь о таких препаратах мы уже многое знаем и уж точно могли убедиться в их безопасности. Связь диабета с нейродегенерациями хорошо известна: она состоит в нарушениях работы митохондрий. Поэтому метаболизм глюкозы и инсулинорезистентность — это перспективные мишени терапии болезни Альцгеймера и прочих нейродегенераций. Здесь на первый план выходит семаглутид (Semaglutide) — один из крупнейших успехов медицины за последние годы. Это пептид, агонист рецептора глюкагоноподобного пептида-1 (GLP-1), который применяют для лечения диабета II и ожирения, а также снижения риска заболеваний сердца и сосудов. Известно, что агонисты рецепторов GLP-1 оказывают нейропротекторное действие. Более того, получены данные об их положительном действии при болезни Альцгеймера. Сейчас семаглутид проходит клинические испытания эффективности у пациентов с таким диагнозом — они завершатся в 2026 году.
Другой случай использования лекарства «по новому назначению» — тертомотид (Tertomotide или GV1001), который создавался как вакцина от онкологических заболеваний. Это пептид длиной 16 аминокислот, соответствующий фрагменту каталитической субъединицы hTERT — человеческой теломеразы-обратной транскриптазы (фермента, обеспечивающего иммортализацию клеток опухоли). Оказалось, что тертомотид еще и блокирует токсичность бета-амилоида в клетках крыс и увеличивает выживаемость нейронов при окислительном стрессе. Одно клиническое испытание показало безопасность препарата при улучшении когнитивных возможностей у пациентов с умеренной и тяжелой болезнью Альцгеймера.
Среди перспективных лекарств — не только крупные антитела и полипептиды, но и множество малых молекул. На 2023 год среди всех препаратов в третьей фазе клинических испытаний, которые призваны повлиять на патогенез болезни Альцгеймера, таковых было 36 (42%). Среди них стоить отметить гидрализин (Hydralazine), имеющий также антиоксидантные и нейропротекторные свойства и одобренный ранее для лечения гипертензии; омега-3-ненасыщенные кислоты; малую молекулу ALZ-801, которая ингибирует токсический эффект бета-амилоида; гидрометилтионина месилат (Hydromethylthionine mesylate), подавляющий агрегацию тау-белка, и агонист мелатониновых и серотониновых рецепторов пиромелатин (Piromelatine). В ближайшие годы станет ясно, какие из этих «неамилоидных» подходов оправдали себя и заслуживают дальнейшего развития [51], [54].
Рисунок 18. Препараты, которые претендовали на то, чтобы стать лекарством от болезни Альцгеймера в 2018 году.
Болезнь Паркинсона
Существующее лечение
Второй по распространенности нейродегенерации также посвящено множество исследований. Здесь достигнут значительный успех с симптоматическим лечением, а вот с патогенетическим похвастаться нечем, хотя ученые продолжают исследовать целый ряд перспективных мишеней.
Говоря о симптоматической терапии болезни Паркинсона, ее следует для начала разделить на две группы: действующая на характерные моторные нарушения (паркинсонизм) и на прочие симптомы. Для коррекции двигательных расстройств пациентам уже более полувека назначают леводопу (или L-dopa), — предшественник дофамина, который, в отличие от самого нейромедиатора, проникает через ГЭБ. В свое время создание препарата доказало, что мы в принципе можем повлиять на состояние больного при нейродегенерации. Леводопа эффективно восполняет дефицит дофамина и на время улучшает двигательную активность пациентов. Для того, чтобы добиться постоянных и стабильных концентраций дофамина, леводопу сейчас используют в сочетании с карбидопой (ингибирует декарбоксилирование леводопы в крови) в виде препарата с замедленным высвобождением и даже в форме геля, вводимого в кишечник через имплантированный зонд. Сейчас исследователи разрабатывают все новые способы доставки и модификации лекарственных форм леводопы.
На дофаминергическую систему также воздействуют с помощью агонистов дофаминовых рецепторов — например, апоморфина (Apomorphine), используемого в том числе подкожно и с введением имплантированными устройствами. Для большей эффективности и безопасности такие препараты сочетают, дополняя лечение ингибиторами катехол-O-метилтрансферазы, такими как энтакапон (Entacapone) и толкапон (Tolcapone), и ингибиторами моноаминооксидазы типа B — селегилином (Selegiline) и расагилином (Rasagiline).
В случае выраженных когнитивных нарушений при болезни Паркинсона используют те же ингибиторы ацетилхолинэстеразы, что и при болезни Альцгеймера. Для уменьшения непроизвольных движений (дискинезий) применяют амантадин (Amantadine) и клозапин (Clozapine). Более молодым пациентам с преобладанием тремора назначают антихолинергические препараты. Психические расстройства и нарушения сна корректируют с помощью антидепрессантов, атипичных антипсихотиков и мелатонина. Отдельного внимания могут требовать запоры (лечат слабительными и пробиотиками), а также нарушение глотания (орофарингеальная дисфагия) — в этом случае эффективны дыхательные упражнения.
При болезни Паркинсона большое значение имеют нефармакологические методы лечения. Широко применяется (особенно на поздних стадиях болезни) глубокая стимуляция мозга (Deep brain stimulation) в области ядер базальных ганглиев. Метод положительно сказывается на дискинезии, моторных функциях и в целом на качестве жизни, а также позволяет снизить дозу принимаемых лекарств, но требует хирургического вмешательства и потому связан с нежелательными эффектами. Ученые работают над тем, чтобы сделать DBS более эффективной и безопасной. Также пациентам полезны физические упражнения на развитие баланса, координации (например, йога) и изменение походки. Большое значение имеет коррекция кишечного микробиома, поэтому надежды возлагают на фекальную трансплантацию [4], [55].
Терапия в разработке
Ученые упорно пытаются создать патогенетические лечение болезни Паркинсона с использованием различных подходов. Самая главная и очевидная мишень для него — это агрегированный альфа-синуклеин. Тут во многом повторяется история с болезнью Альцгеймера: моноклональные антитела к патологическому белку хорошо показали себя на клеточных и животных моделях, но не в клинических испытаниях. Впрочем, продолжаются исследования экспериментального лекарства UB-312, которое перешло в фазу 2 клинических испытаний. Эффект UB-312 определяется связыванием C-концевой части молекулы альфа-синуклеина, входящего в состав олигомеров. Та же ситуация — с прасинезумабом (Prasinezumab), который предположительно замедляет прогрессию моторных нарушений у пациентов. Два антитела, действующие на мономерный и агрегированный альфа-синуклеин — MEDI1341 и AF82422, — перешли во вторую фазу испытаний на пациентах с мультисистемной атрофией.
На патологию альфа-синуклеина также пытаются подействовать с помощью антисмысловых олигонуклеотидов. Один из них — ION464, который таргетирует кодирующую этот белок мРНК, — находится на фазе 1 клинических испытаний у больных мультисистемной атрофией. Стоит отметить, что полученные для этой синуклеинопатии результаты вполне могут помочь с лечением болезни Паркинсона.
Есть и малые молекулы-кандидаты в лекарства, таргетирующие агрегацию альфа-синуклеина. Это пероральный препарат из группы дифенилпиразолов Аnle138b, а также NPT200-11, который связывает C-концевую область альфа-синуклеина. NPT200-11, был эффективен на мышиной модели болезни Паркинсона, а его клинические испытания продолжаются.
Следующая важная терапевтическая мишень — нейровоспаление, на которое можно подействовать с помощью иммуномодуляторов и противовоспалительных средств. К сожалению, ряд препаратов этой группы оказались неэффективны, однако работы в этом направлении не прекращены. Сейчас продолжаются клинические испытания фасудила (Fasudil), снижающего число провоспалительных цитокинов и ингибирующего Rho-киназу, который действует на цитоскелет. Также предстоят клинические исследования азотиоприна (Azathioprine), подавляющего пролиферацию T- и B-лимфоцитов и тем самым снижающего воспалительные процессы.
Как и в случае болезни Альцгеймера, большие надежды связаны с использованием антидиабетических препаратов при болезни Паркинсона. Пероральный прием агониста GLP-1 экзенатрида (Exenatide) прошел 2 фазу клинических испытаний на пациентах с умеренной тяжестью заболевания и уже показал эффективность.
Как и в случае болезни Альцгеймера, большие надежды связаны с использованием антидиабетических препаратов при болезни Паркинсона. Пероральный прием агониста GLP-1 экзенатрида (Exenatide) прошел 2 фазу клинических испытаний на пациентах с умеренной тяжестью заболевания и уже показал эффективность.Следующая мишень — нарушение способности клетки удалять поврежденные митохондрии (митофагии), связанное с генами PRKN (кодирует паркин) и PINK1. Однако два действующие на митохондрии соединения (инозин, Inosine, и пиоглитазон, Pioglitazone) не оправдали ожидания в клинических испытаниях, исследования третьего — урсодезоксихолиевой кислоты (Ursodeoxycholic acid) — продолжаются.
Далее, перспективно ингибирование еще одного важного для болезни Паркинсона гена LRRK2 или его продукта — богатой лейциновыми повторами киназы-2 (см. рис. 16). Соединения, которые подавляют активность фермента, тем самым усиливают аутофагию и подавляют воспаление. Среди них выделяется DNL151, который проходит клинические исследования на пациентах, имеющих мутации в соответствующем гене. Та же ситуация — с антисмысловым олигонуклеотидом BIIB094.
Другая мишень — лизосомный фермент глюкоцереброзидаза, мутации в гене которого часто отмечают у заболевших. Амброксол (Ambroxol), который служит шапероном для этого фермента, уже показал эффект в клинических испытаниях и перешел в фазу 3 [56].
Также перспективны блокаторы кальциевых каналов L-типа (например, исрадипин, Isradipine), которые используют для лечения гипертензии. Они имеют нейропротекторный эффект, по-видимому, связанный с нормализацией кальциевого гомеостаза, а их безопасность показана в клинических испытаниях на пациентах с болезнью Паркинсона [55].
На более ранней стадии находятся подходы регенеративной медицины, например, индуцированные плюрипотентные стволовые клетки (iPSCs), которые способны дифференцироваться в нужные нейроны, заменять погибшие клетки и оказывать другие эффекты на мозг — в частности, за счет выделяемых ими факторов. В опытах на мышиной модели нейродегенерации iPSC усилили нейрогенез, работу синапсов и снизили нейровоспаление. Такие стволовые клетки не вызывают сильного иммунного ответа и не склонны трансформироваться в злокачественные. Эффективность и безопасность iPSC показана на ряде животных моделей, включая приматов, однако клинические испытания на людях пока находятся на ранней стадии [55], [56].
Огромное значение приобретают методы генной терапии нейродегенеративных расстройств. Они используют главным образом вирусные векторы (прежде всего аденоассоциированные вирусы, AAV [57]), которые доставляют в нужную часть мозга гены терапевтических белков (в том числе антител), а также последовательности для редактирования генов, микроРНК и малые интерферирующие РНК (siRNA). С помощью генной терапии мы можем повлиять на мутации в важных для нейродегенерации генах. Скажем, восстановить синтез дофамина при болезни Паркинсона [58], таргетировать тау-патологию при болезни Альцгеймера с помощью антисмысловых олигонуклеотидов [59] или замедлить нейродегенерацию с помощью векторов с геном глиального нейротрофического фактора (GDNF) [51], [60].
Стоит отдельно обсудить нейротрофический фактор роста (BDNF) — важный участник развития мозга, необходимый и для работы взрослого органа. BDNF функционирует в связки с нейротрофинами и узнает TrkB (тропомиозиновый тирозинкиназный рецептор). Этот фактор защищает мозг от нейродегенерации и стимулирует его восстановление, в том числе увеличивая жизнеспособность дофаминергических нейронов. Поэтому BDNF кажется идеальной мишенью [61] для терапии болезни Паркинсона. Однако его клинические испытания — будь то прямое введение экзогенного фактора в мозг пациента или усиление экспрессии собственного BDNF — не повлияли на симптомы [62].
Есть еще один перспективный способ целевой доставки в мозг и терапии нейродегенераций — наночастицы [63]. Они могут быть органическими (из природных или искусственных полимеров) и неорганическими (на основе золота, серебра или оксида церия), служить вектором для доставки или, как в случае оксида церия, оказывать собственное антиоксидантное действие. Во всех таких случаях необходимо учитывать проницаемость ГЭБ для векторов и наночастиц.
Боковой амиотрофический склероз
Существующее лечение
При БАС одобрено к использованию совсем мало препаратов — прежде всего рилузол (Riluzole), одобренный FDA еще в 1995 году. Препарат увеличивает продолжительность жизни пациентов с БАС. Его действие связано с уменьшением эксайтотоксичности, в особенности связанной с глутаматом. Рилузол блокирует натриевые каналы на пресинаптической мембране, активирует ионные каналы астроцитов (EAAT2), а также AMPA- и NMDA-глутаматные рецепторы на постсинаптической мембране и ингибирует обратный захват ГАМК.
Следующим и намного позже (в 2017 году) одобрение FDA получил эдаравон (Edaravone). Это мощный антиоксидант, защищающий нейроны от окислительного стресса и апоптоза. Есть данные клинических исследований, в которых препарат заметно замедлил развитие симптомов БАС, хотя другие работы ставят их результат под сомнение. Отмечают также серьезные нежелательные явления — нарушения походки, головные боли и другие.
В 2022 году биофарма-сообщество обрадовала новость о новом препарате Албриоза (Albriosa), который состоит из двух веществ: фенилбутирата натрия (Sodium Phenylbutyrate) и таурурсодиола (Taurursodiol). Оба соединения подавляют апоптоз нейронов и должны совместно уменьшить окислительный стресс за счет улучшения состояния эндоплазматического ретикулума и митохондрий. Препарат показал скромную эффективность в фазе 2 и был условно одобрен FDA, во многом под давлением пациентского сообщества. К сожалению, по результатам фазы 3 клинических испытаний Албриоза оказался неэффективным и больше не применяется.
В 2023 году условное одобрение FDA получил первый препарат для патогенетического лечения БАС — тоферсен (Tofersen) [64]. Это антисмысловой олигонуклеотид, нацеленный на супероксиддисмутазу 1 (SOD1). Соответственно, препарат применяют в тех случаях, когда БАС связан именно с этим геном — таковых примерно 2–3% (в общей сложности болезнь определяют около 30 разных генов). Тоферсен не улучшил симптомы БАС, но снизил концентрацию в плазме крови легких цепей нейрофиламентов (NfL), биомаркера повреждения аксонов и нейродегенерации в целом. В ликворе пациентов препарат уменьшил содержание SOD1 — своего целевого белка [64]. Если препарат не покажет клинических улучшений при более длительном наблюдении, он может быть также выведен с рынка.
Терапия в разработке
Разрабатываемые в настоящее время методы лечения БАС можно разделить на четыре группы. Первая — это малые молекулы, оказывающие эффект на различные аспекты патогенеза. Например, продолжаются клинические испытания каннабионоидов и мемантина, которые подавляют эксайтотоксичность. На окислительный стресс призваны повлиять ряд исследуемых препаратов. Это перешедший в 3 фазу испытаний на пациентах с БАС антидепрессант тразодон (Trazodone), который также ингибирует протеинкиназу эндоплазматического ретикулума PERK и тем самым снижает токсичность белка TDP-43. Сюда же относится придопидин (Pridopidine) — агонист сигма-1-рецепторов, усиливающий секрецию BDNF, аксональный транспорт и в целом выживаемость нейронов. Препарат пока проверен только на мышиной модели. Находящийся на 3 фазе клинических испытаний деферипрон (Deferiprone) является хелатором, который снижает число отложений железа и за счет этого действует на уровень АФК.
Следующая группа — методы геноспецифичной терапии, таргетирующие различные гены в основе патогенеза БАС (к ним относится упомянутый выше тоферсен). В третью фазу клинических испытаний перешел препарат ION363 — антисмысловой олигонуклеотид, действующий на FUS, другой ген в основе патогенеза БАС. Вскрытия пациентов показали, что ION363 снизил патологические изменения в их мозге. Препарат перешел в третью фазу клинических испытаний.
Среди моноклональных антител выделяются препарат AL001, который подходит для лечения БАС, связанного с геном C9orf72. Антитело связывает рецептор-сортилин и увеличивает у пациентов концентрацию белка-програнулина, концентрация которого снижена при нейродегенеративном процессе. Продолжается фаза 3 клинических испытаний AL001. Во второй фазе находится AP-101 — человеческое антитело, которое высокоспецифично связывает неправильно свернутый SOD1.
Как и в случае других нейродегенераций, при БАС могут быть эффективны стволовые клетки [65]. Продолжается фаза 3 клинических испытаний препарата лензуместроцел (Lenzumestrocel) — это полученные на основе красного костного мозга мезенхимальные стволовые клетки. Во второй фазе лекарство уже показало эффективность у пациентов с БАС, значительно уменьшив симптомы. На более ранних стадиях разработки находятся еще несколько методов терапии на основе стволовых клеток [65].
Остальные нейродегенерации
А как обстоят дела с лечением прочих нейродегенераций, гораздо менее распространенных, но зачастую имеющих более простой и понятный патогенез?
В силу специфики рассеянного склероза эта нейродегенерация/аутоиммунное заболевание лечится довольно успешно (по меркам нейродегенеративных расстройств) [36]. Подробнее об этом будет рассказано в следующей статье спецпроекта.
Пожалуй, самый большой успех в патогенетическом лечении нейродегенераций получен в случае спинальной мышечной атрофии (СМА) [8]. Это прежде всего одобренный FDA в 2019 году препарат золгенсма (Zolgensma) [66], который используется в виде инъекции однократно. Он представляет собой вектор на основе аденоассоциированного вируса [57], который доставляет в клетку нормальный ген SMN1.
Спинраза (Nusinersen) появилась еще 2016 году — это антисмысловой олигонуклеотид, который влияет на сплайсинг того же гена и увеличивает синтез белка SMN в клетке. Третий одобренный препарат — эврисди или рисдиплам (Risdiplam) — работает примерно так же, при этом проходит через ГЭБ и потому назначается перорально. Два последних препарата необходимо принимать всю жизнь. Все три лекарства от СМА возмещают дефицит белка SMN и значительно улучшают состояние пациентов, действуя при этом на причину их болезни.
Несмотря на все усилия, лекарств для лечения прионных инфекций создать так и не удалось. Они по-прежнему оказываются фатальны для пациентов вскоре после постановки диагноза. Отдельные симптомы можно временно снижать антидепрессантами, атипичными антипсихотиками или клоназепамом [37].
Cимптомы спиноцеребеллярных атаксий (SCA) подавляют с помощью рилузола (Riluzole), вальпроевой кислоты (Valproic acid), варениклина (Varenicline) и карбоната лития (Lithium carbonate). Такие препараты действуют на различные аспекты патологических процессов — например, ускоряют расщепление патологических белков или ингибируют образование их токсичных фрагментов. Также используют кордицепин (Cordycepin), который снижает синтез мутантного атаксина-3 у мышей и уменьшает связанные с ним симптомы, включая двигательные нарушения. Трегалоза (Trehalose) и ибупрофен (Ibuprofen) эффективны при спиноцеребеллярных атаксиях за счет своих нейропротекторных свойств. Патогенетического лечения SCA пока нет, однако ученые работают над созданием методов терапии на основе стволовых клеток, которые в будущем, возможно, смогут затормозить развитие полиглутаминовых спиноцеребеллярных атаксий.
Болезнь Хантингтона также остается неизлечимой. Характерные гиперкинезы и нарушения поведения корректируют с помощью тетрабеназина (Tetrabenazine), психические расстройства — используя антипсихотики и антидепрессанты. Продолжается разработка генотерапии, направленной на единственный ген-виновник болезни Htt — она призвана подавить активность мутантного гена [67], в частности, с помощью антисмысловых олигонуклеотидов или за счет воздействия на репарацию ДНК.
При нейрональных восковидных липофусцинозах поддерживающая терапия проводится с помощью психотропных, противоэпилептических средств и бензодиазепинов, а также тригексифенидила (Trihexyphenidyl), который уменьшает дистонию и слюноотделение. Есть и прогресс в создании патогенетического лечения нейронального цероидного липофусциноза (НЦЛ) — это заместительная ферментная терапия, при которой вводят аналог недостающего белка. Так, церлипоназа альфа (Cerliponase alfa) — предшественник трипептидилпептидазы 1 — одобрена при болезни Янского—Бильшовского (НЦЛ 2 типа). Исследуют возможность лечения разных форм нейронального липофусциноза стволовыми клетками и с помощью генной терапии.
ВОЗ и ныне там
Таким образом, сейчас врачи назначают заболевшим нейродегенерацией в клинике почти исключительно симптоматическую терапию, которая влияет только на отдельные симптомы и не может изменить ход болезни. Действенных лекарств против большинства нейродегенераций — включая наиболее значимые болезнь Альцгеймера и болезнь Паркинсона — до сих пор нет. Разумеется, не потому, что ученые не трудились над ними — исследования нейродегенерации стали одной из самых активно развивающихся и хорошо финансируемых областей. Почему же так вышло?
Среди причин стоит назвать прежде всего сложный и недостаточно изученный патогенез, а также длительную доклиническую фазу нейродегенерации. Это годы и десятки лет, за которые в мозге человека необратимо гибнут клетки, разрушаются связи между нейронами и теряются функции мозга. Сам человек может этого не замечать и ничего не предпринимать, обратившись к врачу по поводу нейродегенерации лишь после драматической манифестации. Возможно, он также на приеме впервые услышит про болезнь Альцгеймера или Паркинсона, как и о том, что они долго развиваются бессимптомно. Между тем, к тому времени в мозге человека уже «вымерла» большая часть специфической популяции нейронов и истощены компенсаторные механизмы.
Каковы возможные решения? Во-первых, это уже упомянутая ранняя диагностика (за счет массовой диспансеризации) и соответствующая превентивная терапия — сейчас их не существует. Чтобы их начать, нужно изменить систему оказания медицинской помощи и широко популяризировать эту проблему среди населения — которое, собственно, и предстоит диспансеризовать.
Если продлить доклиническую фазу нейродегенерации на многие годы, заболевание останется слабо выраженным или даже бессимптомным все это время. В идеале — вплоть до естественной смерти от каких-то других причин. Подсчитано, что если продлить бессимптомную стадию болезни Альцгеймера всего на 5 лет, то число пациентов с деменцией упадет на 57%, а расходы на их лечение и реабилитацию сократятся почти вдвое. Дело в том, что очень пожилых людей в действительности поджидает множество других недугов — и они в этом случае перейдут в разряд пациентов с другими, более понятными и управляемыми болезнями [4].
Другой, более прямолинейный подход — радикальное излечение нейродегенераций, требующее детального понимания патогенеза. В этом случае нам действительно предстоит многое выяснить и во многом разобраться, признав, что путь, по которому наука о нейродегенерации шла так долго, пока никуда не привел.
Несомненно, накоплен огромный багаж знаний, мы многое знаем об отдельных аспектах развития болезней. Однако понимаем мы их по-прежнему плохо — отсюда и множество конкурирующих противоречивых гипотез, многие из которых не оправдали себя, и вопиющее отсутствие лекарств. Это заставляет задуматься о смене подхода.
Размышляя об этом, можно сравнить процесс нейродегенерации с хитроумной забавой — машиной Голдберга, — подобные любят собирать энтузиасты. Это механическое устройство, в котором происходит цепочка из множества разнородных событий, последовательно запускающих друг друга. Скажем, боксерская перчатка толкает кеглю, та открывает дверцу клетки, падают бруски, топор разрубает веревку... (рис. 19).

Рисунок 19. Машина Голдберга.
Машину Голдберга приводит в действие всегда какое-то одно небольшое движение, а затем зрители наблюдают динамичное шоу. События усиливаются и развиваются по сценарию каскада. Нечто похожее, видимо, мы видим и при нейродегенерации — только речь скорее об уже сработавшей и остановившейся машине Голдберга или ее работе (читай: разрушении) на полном ходу. Чего мы не видим, так это первопричины, запустившей весь процесс, и вероятно — также многих ключевых причинно-следственных связей. А то, что находится в фокусе внимания, явно пока не позволяет решить проблему глобально.
С этим связана и недавняя очень неблаговидная, опасная по своим последствиям история (лучшее сказать, скандал), с разоблачением «амилоидной» мафии. Ей посвящена статья в журнале Science в июле 2022 года [68], которая, в свою очередь, описывает разбирательства вокруг статьи в Nature за 2006 год (A specific amyloid-β protein assembly in the brain impairs memory). Ее первый автор — Сильван Лесне (Sylvain Lesne), нейробиолог из Университета Миннесоты (США), который тогда был восходящей звездой среди исследователей болезни Альцгеймера.
Старую статью вспомнили из-за проблем с одним из бесчисленных новых лекарств от болезни Альцгеймера — симуфиламом (Simufilam) компании Cassava. Важную роль в разбирательстве сыграл Мэтью Шрег (Matthew Schrag) из Университета Вандербильта (США), ставший своего рода разоблачителем Лесне и его сторонников. В нем также приняли участие авторитеты по болезни Альцгеймера с мировым именем, включая Денниса Селько (Dennis Selkoe). Они выявили многочисленные подделки изображений, использованных в научных статьях. Речь о сотнях (!) изображений: только в работах Лесне таких оказалось более 70, в том числе иллюстрирующие результаты вестерн-блота, с помощью которого выделяли белки. Фото редактировали, меняя местами их части. Под вопросом оказались свыше 20 публикаций ученого, включая десять, которые касаются Aβ*56 — якобы особенно важной для патогенеза болезни Альцгеймера формы бета-амилоида.
Science назвал Лесне и его подельников «амилоидной мафией». Предполагается, что они действовали сообща и руководствовались общими корыстными интересами. Ущерб от них трудно оценить — это огромное финансирование, выделенное на заведомо бессмысленные исследования, потеря времени и сил, которые могли быть использованы на развитие других гипотез патогенеза болезни Альцгеймера — прежде всего ставящих в центр тау-белок. Неприятная история также стала ударом по престижу науки в целом.
Остается надеяться, что разоблачение «амилоидной мафии» наряду с длительной историей бесплодных поисков лекарств заставит наконец отказаться от «амилоидоцентричной модели» и переключиться на другие. И тогда, возможно, болезнь Альцгеймера, — «флагманская» нейродегенерация, которая во многом задает тон исследованиям остальных, — поддастся лечению. Действительно, при современном уровне развитии биотехнологии и генетики создать эрлиховскую «волшебную пулю», уничтожающую причину болезни, не составит труда. Однако, чтобы ее создать, нужно для начала знать, в кого стрелять.
Литература
- David M. Wilson, Mark R. Cookson, Ludo Van Den Bosch, Henrik Zetterberg, David M. Holtzman, Ilse Dewachter. (2023). Hallmarks of neurodegenerative diseases. Cell. 186, 693-714;
- Ликбез по ЦНС;
- Evangelia Kesidou, Paschalis Theotokis, Olympia Damianidou, Marina Boziki, Natalia Konstantinidou, et. al.. (2023). CNS Ageing in Health and Neurodegenerative Disorders. JCM. 12, 2255;
- Фельдман Т. Б. Нейродегенеративные заболевания: от генома до целостного организма. М.: «Научный мир», 2014. — 580 с.;
- Старость — упущение иммунной системы или ее предательство?;
- Lyn Xuan Tay, Siew Chin Ong, Lynn Jia Tay, Trecia Ng, Thaigarajan Parumasivam. (2024). Economic Burden of Alzheimer’s Disease: A Systematic Review. Value in Health Regional Issues. 40, 1-12;
- Заговор с целью нейродегенерации: бета-амилоид и тау-белок;
- СМА: три буквы — три лекарства;
- Miguel Chin-Chan, Juliana Navarro-Yepes, Betzabet Quintanilla-Vega. (2015). Environmental pollutants as risk factors for neurodegenerative disorders: Alzheimer and Parkinson diseases. Front. Cell. Neurosci.. 9;
- A. N. Klenyaeva, R. N. Chuprov-Netochin, E. I. Marusich, O. G. Tatarnikova, M. A. Orlov, N. V. Bobkova. (2014). Development of mouse fibroblast cell line expressing human tau protein and evaluation of tau-dependent cytotoxity. Biochem. Moscow Suppl. Ser. A. 8, 232-239;
- Танец знамений: убиквитин и протеасома в судьбе внутриклеточных белков;
- Магнитоуправляемая перестройка цитоскелета: история о том, как ученые крутили клетки на магнитах;
- Daniel A. Fletcher, R. Dyche Mullins. (2010). Cell mechanics and the cytoskeleton. Nature. 463, 485-492;
- Плывущий в лабиринте Морриса: тернистый путь моделирования нейродегенерации;
- Повтор, еще повтор!;
- Guoqi Liu, Michael Leffak. (2012). Instability of (CTG)n•(CAG)n trinucleotide repeats and DNA synthesis. Cell & Bioscience. 2, 7;
- Henry Paulson. (2018). Repeat expansion diseases. Neurogenetics, Part I. 105-123;
- Сквозь тернии к нервам: особенности доставки лекарств в нервную систему;
- Микроглия: роль «иммунных» клеток центральной нервной системы в здоровом мозге и при нейродегенеративных заболеваниях;
- Hannah Franklin, Benjamin E. Clarke, Rickie Patani. (2021). Astrocytes and microglia in neurodegenerative diseases: Lessons from human in vitro models. Progress in Neurobiology. 200, 101973;
- Апоптоз, или Путь самурая;
- Кошачий Альцгеймер — как кошкам изменяет память;
- Francesco Panza, Madia Lozupone, Giancarlo Logroscino, Bruno P. Imbimbo. (2019). A critical appraisal of amyloid-β-targeting therapies for Alzheimer disease. Nat Rev Neurol. 15, 73-88;
- Болезнь Альцгеймера: ген, от которого я без ума;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Vignayanandam Ravindernath Muddapu, S. Akila Parvathy Dharshini, V. Srinivasa Chakravarthy, M. Michael Gromiha. (2020). Neurodegenerative Diseases – Is Metabolic Deficiency the Root Cause?. Front. Neurosci.. 14;
- Adina N. MacMahon Copas, Sarah F. McComish, Jean M. Fletcher, Maeve A. Caldwell. (2021). The Pathogenesis of Parkinson's Disease: A Complex Interplay Between Astrocytes, Microglia, and T Lymphocytes?. Front. Neurol.. 12;
- Болезнь Паркинсона: что изучать? как изучать?;
- Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний;
- Белок альфа-синуклеин — важный участник проявления болезни Паркинсона?;
- Rufai S., Gupta A., Sarman S. (2019). Prion Diseases: A Concern for Mankind. In: Pathogenicity and Drug Resistance of Human Pathogens / ed. by Hameed S., Fatima Z. Singapore: Springer.;
- Инге-Вечтомов С.Г. (2011). Прионы дрожжей как модель нейродегенеративных инфекционных амилоидозов человека. Онтогенез. 42, 337–345;
- Mathias Jucker, Lary C. Walker. (2024). Evidence for iatrogenic transmission of Alzheimer’s disease. Nat Med. 30, 344-345;
- Рассеянный склероз: иммунная система против мозга;
- Madeline Bross, Melody Hackett, Evanthia Bernitsas. (2020). Approved and Emerging Disease Modifying Therapies on Neurodegeneration in Multiple Sclerosis. IJMS. 21, 4312;
- Sumera Zaib, Hira Javed, Imtiaz Khan, Fadi Jaber, Ali Sohail, et. al.. (2023). Neurodegenerative Diseases: Their Onset, Epidemiology, Causes and Treatment. ChemistrySelect. 8;
- Aya A. Elkhodiry, Hend M. El Tayebi. (2021). Scavenging the hidden impacts of non-coding RNAs in multiple sclerosis. Non-coding RNA Research. 6, 187-199;
- Hueng-Chuen Fan, Li-Ing Ho, Ching-Shiang Chi, Shyi-Jou Chen, Giia-Sheun Peng, et. al.. (2014). Polyglutamine (PolyQ) Diseases: Genetics to Treatments. Cell Transplant. 23, 441-458;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Генная терапия нейромоторных болезней;
- Jun-Lin Liu, Yong-Gang Fan, Zheng-Sheng Yang, Zhan-You Wang, Chuang Guo. (2018). Iron and Alzheimer’s Disease: From Pathogenesis to Therapeutic Implications. Front. Neurosci.. 12;
- Dennis Chan, Laura Marie Gallaher, Kuven Moodley, Ludovico Minati, Neil Burgess, Tom Hartley. (2016). The 4 Mountains Test: A Short Test of Spatial Memory with High Sensitivity for the Diagnosis of Pre-dementia Alzheimer's Disease. JoVE;
- Julio-César García, Rosa-Helena Bustos. (2018). The Genetic Diagnosis of Neurodegenerative Diseases and Therapeutic Perspectives. Brain Sciences. 8, 222;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Natalia Shusharina, Denis Yukhnenko, Stepan Botman, Viktor Sapunov, Vladimir Savinov, et. al.. (2023). Modern Methods of Diagnostics and Treatment of Neurodegenerative Diseases and Depression. Diagnostics. 13, 573;
- V. I. Hashem. (2004). Chemotherapeutic deletion of CTG repeats in lymphoblast cells from DM1 patients. Nucleic Acids Research. 32, 6334-6346;
- Микробиом человека;
- Viacheslav Igorevich Pasko, Aleksandra Sergeevna Churkina, Anton Sergeevich Shakhov, Anatoly Alexeevich Kotlobay, Irina Borisovna Alieva. (2022). Modeling of Neurodegenerative Diseases: ‘Step by Step’ and ‘Network’ Organization of the Complexes of Model Systems. IJMS. 24, 604;
- Shlomo Yehuda, Sharon Rabinovitz. (2014). Olfactory bulbectomy as a putative model for Alzheimer’: The protective role of essential fatty acids. PharmaNutrition. 2, 12-18;
- Orlov M. (2019). Alzheimer's disease therapy: challenges and perspectives. Успехи геронтологии. 32, 639–651;
- C. Kwon Kim, Yin Rui Lee, Lynnett Ong, Michael Gold, Amir Kalali, Joydeep Sarkar. (2022). Alzheimer’s Disease: Key Insights from Two Decades of Clinical Trial Failures. JAD. 87, 83-100;
- Jeffrey Cummings, Garam Lee, Aaron Ritter, Kate Zhong. (2018). Alzheimer's disease drug development pipeline: 2018. A&D Transl Res & Clin Interv. 4, 195-214;
- Francesca R. Buccellato, Marianna D’Anca, Gianluca Martino Tartaglia, Massimo Del Fabbro, Elio Scarpini, Daniela Galimberti. (2023). Treatment of Alzheimer’s Disease: Beyond Symptomatic Therapies. IJMS. 24, 13900;
- Ryan Wang, Ludy C. Shih. (2023). Parkinson's disease – current treatment. Current Opinion in Neurology. 36, 302-308;
- Andreas Wolff, Nicolas U. Schumacher, Dominik Pürner, Gerrit Machetanz, Antonia F. Demleitner, et. al.. (2023). Parkinson’s disease therapy: what lies ahead?. J Neural Transm. 130, 793-820;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Omkar Dumbhare, Sagar S Gaurkar. (2023). A Review of Genetic and Gene Therapy for Parkinson’s Disease. Cureus;
- Catherine J. Mummery, Anne Börjesson-Hanson, Daniel J. Blackburn, Everard G. B. Vijverberg, Peter Paul De Deyn, et. al.. (2023). Tau-targeting antisense oligonucleotide MAPTRx in mild Alzheimer’s disease: a phase 1b, randomized, placebo-controlled trial. Nat Med. 29, 1437-1447;
- E. V. Melnikova, V. A. Merkulov, O. V. Merkulova. (2023). Gene therapy of neurodegenerative diseases: achievements, developments, and clinical implementation challenges. Biological Products. Prevention, Diagnosis, Treatment. 23, 127-147;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Ewelina Palasz, Adrianna Wysocka, Anna Gasiorowska, Malgorzata Chalimoniuk, Wiktor Niewiadomski, Grazyna Niewiadomska. (2020). BDNF as a Promising Therapeutic Agent in Parkinson’s Disease. IJMS. 21, 1170;
- Richard N. L. Lamptey, Bivek Chaulagain, Riddhi Trivedi, Avinash Gothwal, Buddhadev Layek, Jagdish Singh. (2022). A Review of the Common Neurodegenerative Disorders: Current Therapeutic Approaches and the Potential Role of Nanotherapeutics. IJMS. 23, 1851;
- Hannah A. Blair. (2023). Tofersen: First Approval. Drugs. 83, 1039-1043;
- Laura Tzeplaeff, Sibylle Wilfling, Maria Viktoria Requardt, Meret Herdick. (2023). Current State and Future Directions in the Therapy of ALS. Cells. 12, 1523;
- Самое дорогостоящее лекарство в мире;
- Sarah J Tabrizi, Carlos Estevez-Fraga, Willeke M C van Roon-Mom, Michael D Flower, Rachael I Scahill, et. al.. (2022). Potential disease-modifying therapies for Huntington's disease: lessons learned and future opportunities. The Lancet Neurology. 21, 645-658;
- Piller C. (2022). Blots on a field? Science.377;
- Sylvain Lesné, Ming Teng Koh, Linda Kotilinek, Rakez Kayed, Charles G. Glabe, et. al.. (2006). A specific amyloid-β protein assembly in the brain impairs memory. Nature. 440, 352-357.