Старость — упущение иммунной системы или ее предательство?
23 февраля 2023
Старость — упущение иммунной системы или ее предательство?
- 1539
- 4
- 3
Клеточная сенесценция отражается в старении всего организма.
Рисунок в полном размере.
иллюстрация автора
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Старение всего организма тесно связано с накоплением стареющих, или сенесцентных, клеток. Причина заключается в том, что подобные клетки теряют способность к пролиферации и начинают выделять факторы воспаления, что может привести к развитию возрастных патологий. В норме этот процесс сдерживается иммунной системой, которая элиминирует сенесцентные клетки. С возрастом эффективность ее работы падает, и проявляются признаки старения. Однако последние исследования показали, что стареющая иммунная система не только допускает накопление сенесцентных клеток, но и сама способна «подталкивать» клетки к старению.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Люди рождаются, растут, развиваются, после чего стареют и умирают. Но почему после нескольких десятилетий здоровья и процветания наш организм вдруг начинает ломаться? Что вызывает старение — и можно ли его избежать?
Клетки не бессмертны
В 1961 году Леонард Хейфлик и Пол Мурхэд на культуре клеток фибробластов человека впервые экспериментально показали, что клетки имеют ограниченное число делений, исчерпав которые, они прекращают расти [1]. Данное открытие показало, что клетки не бессмертны, а, следовательно, их старение может быть причиной старения и всего организма. Позднее Алексей Оловников свяжет подобное явление с укорочением теломерных участков хромосом и невозможностью нормальной передачи генетической информации, а Блэкберн, Грейдер и Шостак получат Нобелевскую премию по физиологии или медицине за экспериментальное подтверждение данной теории (рис. 1). В итоге изучение молекулярных основ клеточного старения станет ключевым вопросом геронтологии, а для расширяющегося перечня его механизмов будет введен новый термин — сенесценция.
- Сенесценция
- репликативное старение клеток, в результате которого клетка не может больше делиться.

Рисунок 1. Алексей Матвеевич Оловников (годы жизни: 10 октября 1936–6 декабря 2022) (а) и лауреаты Нобелевской премии по физиологии или медицине за 2009 год: Кэрол Грейдер (б), Элизабет Блэкберн (в), Джек Шостак (г).
«Элементы»
Для чего клетки стареют и как это связано со старением всего организма?
Со временем стало ясно, что причины клеточного старения не ограничиваются укорочением теломер в ходе пролиферации. Данный процесс может запускаться в ответ на окислительный стресс, активацию онкогенов, воздействие ионизирующего излучения и другие повреждения [2], [3]. Подобное поведение — вовсе не ошибка или поломка организма, а взвешенная жертва, которую он приносит для защиты собственной целостности. Почему? Ответ прост: благодаря активации сенесценции поврежденные, стареющие или раковые клетки, которые могут нанести вред организму, прекращают делиться, после чего элиминируются. И хоть молекулярные или морфологические характеристики этого процесса могут варьировать в зависимости от способа активации, основной механизм не меняется: в клетке активируются молекулярные каскады, действие которых выражается в ингибировании циклинзависимых киназ, из-за чего происходит остановка клеточного цикла. Ключевыми фигурами в этом процессе являются белки p16 и p21, экспрессия которых является надежным маркером сенесцентных клеток (рис. 2) [4], [5].
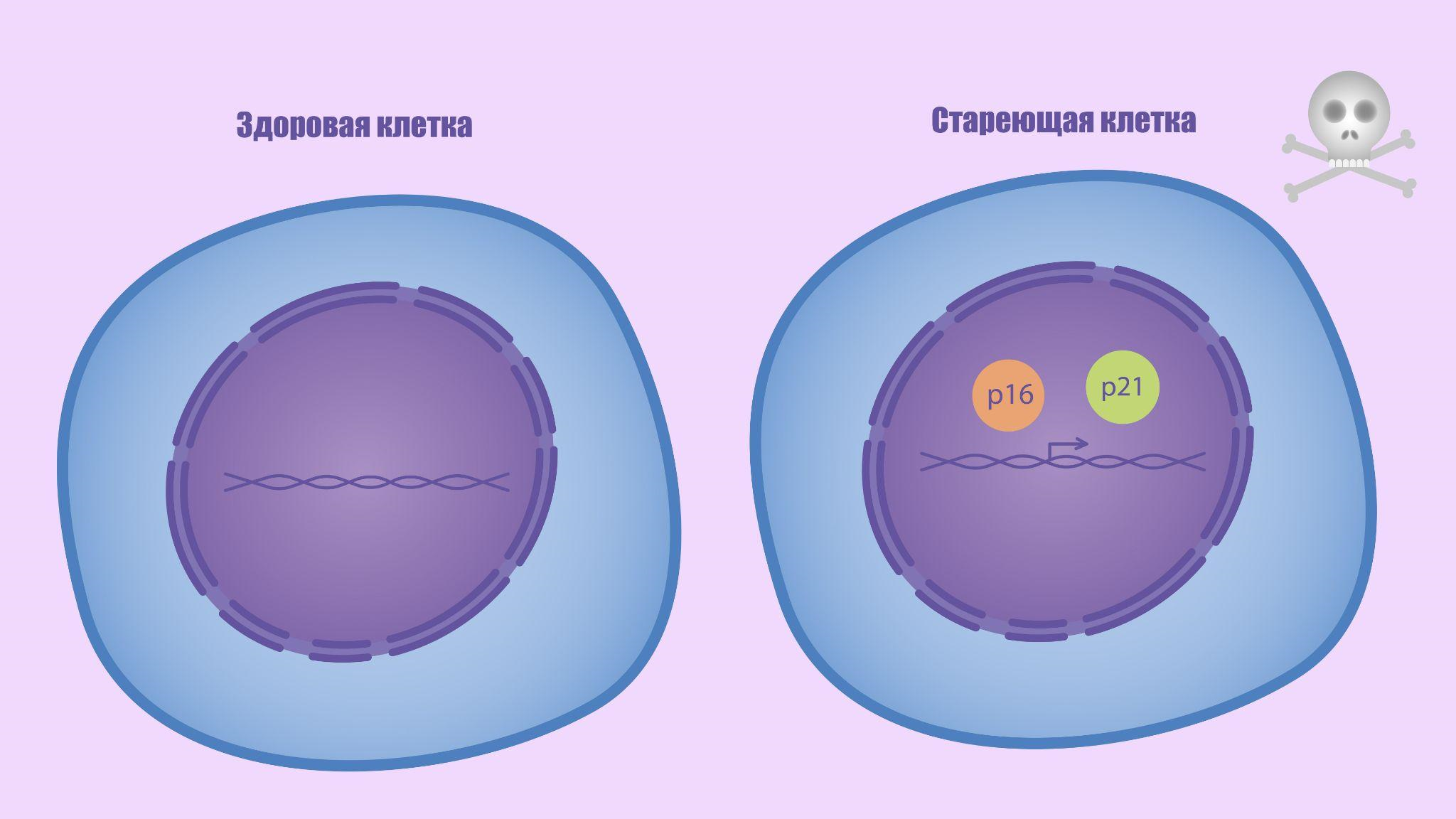
Рисунок 2. p16 и p21 — маркеры сенесцентных клеток.
рисунок автора
Кроме того, стареющие клетки проявляют особый секреторный фенотип — Senescence-associated secretory phenotype, или SASP, состоящий из провоспалительных цитокинов, хемокинов, факторов роста и протеаз [6–9]. Комбинация этих веществ формирует очаг воспаления вокруг сенесцентных клеток, после чего идет ремоделирование внеклеточного матрикса и привлечение иммунных клеток, которые элиминируют стареющие клетки [6–10]. На этом избавление от потенциально опасных элементов завершается.
Но с возрастом данный процесс нарушается. Число сенесцентных клеток в организме растет, а в тканях явно детектируются факторы воспаления SASP [10]. В итоге проявляются признаки хронического воспаления и поражения здоровых тканей, что может выражаться в атеросклерозе, остеопорозе, фиброзе легких, болезнях сердца и других патологиях [11–14].
Как лечить старость?
В молодом организме в норме не накапливаются сенесцентные клетки. Это легло в основу идеи о том, что направленное удаление «излишков» стареющих клеток поможет в противодействии старости. Но как ее проверить?
Одним из подходов является получение и изучение линий трансгенных мышей, у которых клетки, экспрессирующие маркер сенесценции p16, могут быть избирательно элиминированы [15], [16]. Другим, более универсальным и применимым к человеку методом является применение сенолитических и сеноморфных фармакологических средств для воздействия на стареющие клетки. Сенолитики их уничтожают, а сеноморфы модулируют их свойства без элиминации. В результате, применение описанных подходов на модельных организмах подтвердило состоятельность идеи удаления сенесцентных клеток для противодействия старости. У животных наблюдалось улучшение общего состояния организма, увеличение продолжительности жизни и редукцию проявлений старости (рис. 3) [15], [17–19]. Этот эффект уже достаточно явно показан на животных, и на данный момент планируется переход к клиническим испытаниям на людях [20].

Рисунок 3. Эффект сеноморфного препарата на разные таксоны.
Почему стареющие клетки необходимы нашему организму, а их полное удаление — не выход?
Однако в идее удаления всех сенесцентных клеток из организма есть загвоздка. Сенесценция может активироваться не только в старых или поврежденных клетках, которые и так нужно уничтожить, но и в здоровых, нормально функционирующих. Факторы SASP, выделяемые такими клетками, участвуют в заживлении ран и эмбриональном развитии [21], [22]. Таким образом, клетки в состоянии сенесценции обладают двойственной ролью. С одной стороны, это дефектные клетки, подлежащие уничтожению, с другой стороны, часть из них необходима для нормального функционирования организма (рис. 4) [23].
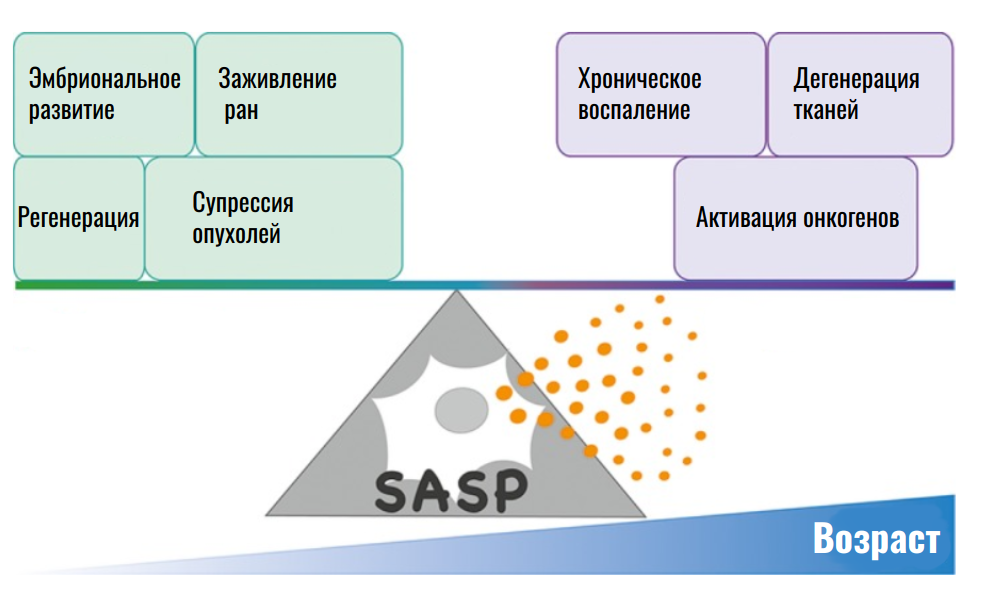
Рисунок 4. Двойная роль SASP как индуктора воспалительных процессов и участника ключевых процессов организма.
Из этого следует, что бездумное уничтожение сенесцентных клеток вряд ли приведет к положительным результатам.
Избежать негативных эффектов помогли бы прицельный поиск и уничтожение тех сенесцентых клеток, которые вносят наибольший вклад в разрушение организма, сохраняя при этом «полезные». Другим, более фундаментальным подходом мог бы стать поиск глобальной причины появления сенесцентных клеток в стареющем организме [19].
В чем основная причина старения: упущение или предательство иммунной системы?
Вопрос о том, кто является главным индуктором клеточного старения, рассматривается в недавней статье Мэтью Юсефзаде и Рафаэля Флореса с соавторами [24].
Широко известно, что с возрастом иммунная система хуже справляется с различными патогенами или проблемами в функционировании собственных клеток, что приводит к старческим патологиям и заболеваниям [10]. Существует гипотеза о том, что накопление сенесцентных клеток с возрастом также связано с ослаблением эффективности иммунной системы, что говорит о важной роли иммунной системы в контроле старения [25]. Однако новые данные показывают, что иммунная система с возрастом не только хуже справляется со своими функциями, но и сама становится причиной старения всего организма. А именно, стареющие клетки иммунной системы способны активировать сенесценцию в здоровых тканях.
Но как удалось узнать эту неожиданную функцию иммунной системы?
Исследователи создали трансгенных мышей, у которых клетки иммунной системы преждевременно стареют. Этого удалось достичь путем селективного нокаута эндонуклеазы ERCC1 в предшественниках иммунных клеток. Подобное выключение эндонуклеазы должно вызывать нарушение работы систем репарации ДНК, накопление повреждений и постоянный генотоксический стресс клетки, что в конечном итоге может приводить к клеточному старению.
Но это нужно было доказать. Кроме того, необходимо было подтвердить, что разработанный подход действительно моделирует нормальное старение иммунной системы и пригоден для дальнейших исследований.
Для получения трансгенных мышей, нокаутных по гену ERCC1, исследователи применили систему редактирования генома Cre-LoxP. Суть этой системы заключается в том, что рекомбиназа Cre распознает два сайта loxP (locus of crossing-over of P1), фланкирующих таргетную последовательность, после чего осуществляет рекомбинацию между ними. Таким образом, с помощью Cre-LoxP можно контролировать экспрессию того или иного гена [26].
Исследователи осуществляли скрещивание родительских особей, у одной из которых ген рекомбиназы ERCC1 был фланкирован LoxP-участками, а у другой экспрессия рекомбиназы Cre контролировалась промотором Vav1, специфичным для клеток лимфоидной линии. У потомства таких мышей в предшественниках лимфоидных клеток рекомбиназа Cre узнавала ген ERCC1 и вырезала его по LoxP-сайтам, тем самым подавляя его экспрессию в клетках этой линии (рис. 5).
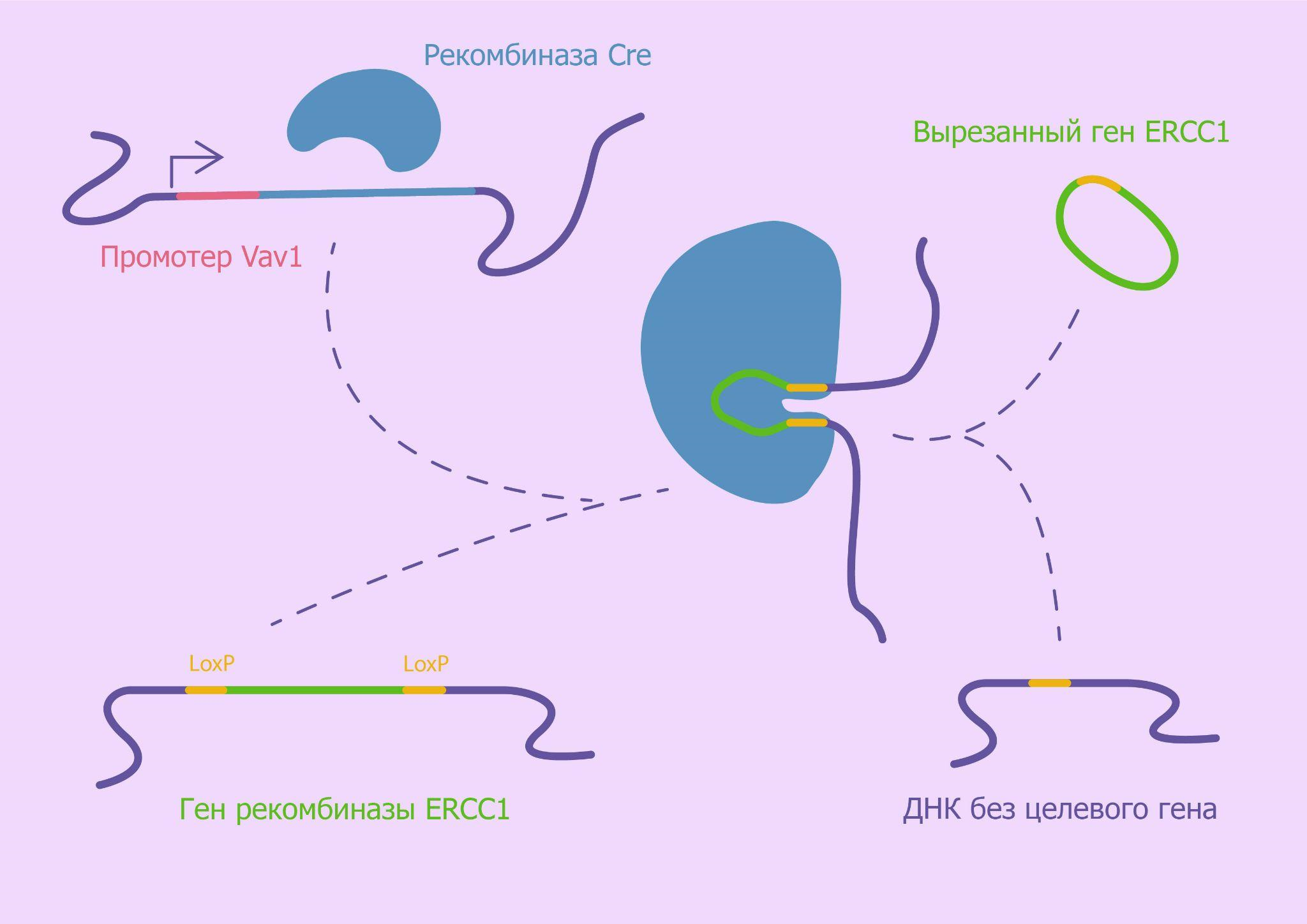
Рисунок 5. Механизм селективного нокаута эндонуклеазы ERCC1.
рисунок автора
Итак, в органах иммунной системы трансгенных мышей действительно снизился уровень экспрессии эндонуклеазы (рис. 6) и стали проявляться признаки ускоренного старения. Так, уже в возрасте восьми месяцев в лимфоидных органах проявлялись маркеры генотоксического стресса (например, γH2AX — маркер двойного разрыва нити ДНК, p16 и p21), редуцировались лимфоузлы и ухудшился иммунный ответ. Для сравнения, подобные нарушения, как правило, наблюдаются у старых мышей.

Рисунок 6. Экспрессия эндонуклеазы ERCC1 в тканях контрольных и трансгенных мышей. Наблюдается достоверное снижение уровня экспрессии эндонуклеазы в органах иммунной системы трансгенных мышей по сравнению с контрольными. В остальных органах достоверные различия не наблюдаются.
Механизм формирования нарушений в организме трансгенных мышей также схож с нормальным старением. Со временем у экспериментальных животных наблюдалось плавное снижение числа лимфоцитов, что подтверждает общий дегенеративный механизм нарушений иммунной системы. Причем, как и у старых мышей, в иммунной системе трансгенных животных активируется механизм сенесценции, но происходит это значительно раньше. Так, маркеры сенесцентных клеток — p16 и p21 — были обнаружены в клетках иммунной системы трансгенных мышей начиная уже с пятимесячного возраста, что подтверждает роль сенесценции в развитии нарушений.
Полученные результаты подтверждают пригодность данной модели для изучения старения иммунной системы. Трансгенные мыши демонстрируют нарушения иммунной системы, при этом экспериментальное воздействие не затронуло остальной организм. Теперь нужно понять, отразится ли старение иммунной системы на общем состоянии организма?
Как было установлено, да. У трансгенных животных действительно проявляются нарушения вне иммунной системы. Так, патологические изменения демонстрируют поджелудочная железа, печень и почки, даже тонус мышц падает. При этом срок жизни трансгенных мышей также сокращается, что свидетельствует об ускоренном старении (рис. 7).
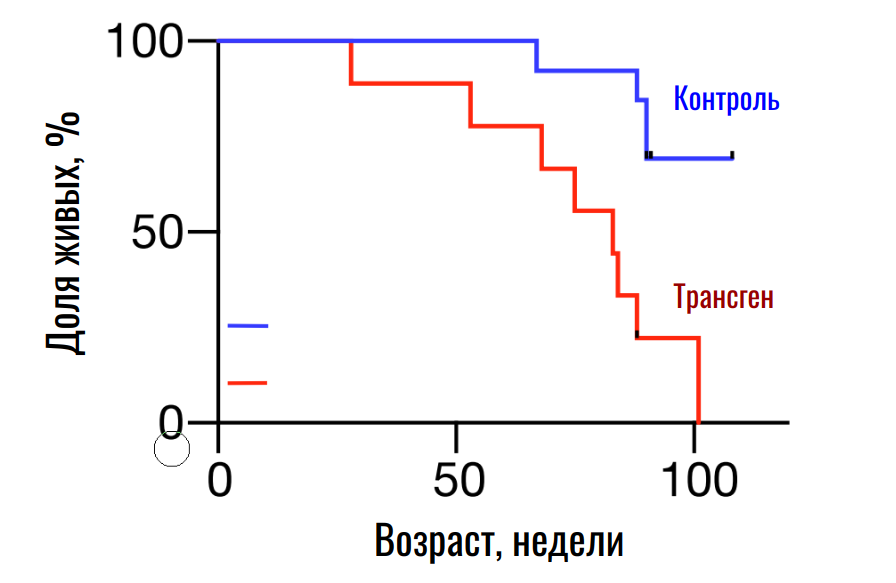
Рисунок 7. Продолжительность жизни контрольных и трансгенных мышей.
Но почему так происходит? Можно предположить, что стареющая иммунная система хуже защищает организм от внешних и внутренних воздействий, но в контролируемых лабораторных условиях эту гипотезу удалось опровергнуть. Однако авторы заметили, что у трансгенных мышей искусственное состаривание иммунной системы приводит к более быстрому старению других органов. Здесь и проявляется основная идея: сенесценция неиммунных клеток может активироваться под влиянием стареющего иммунитета.
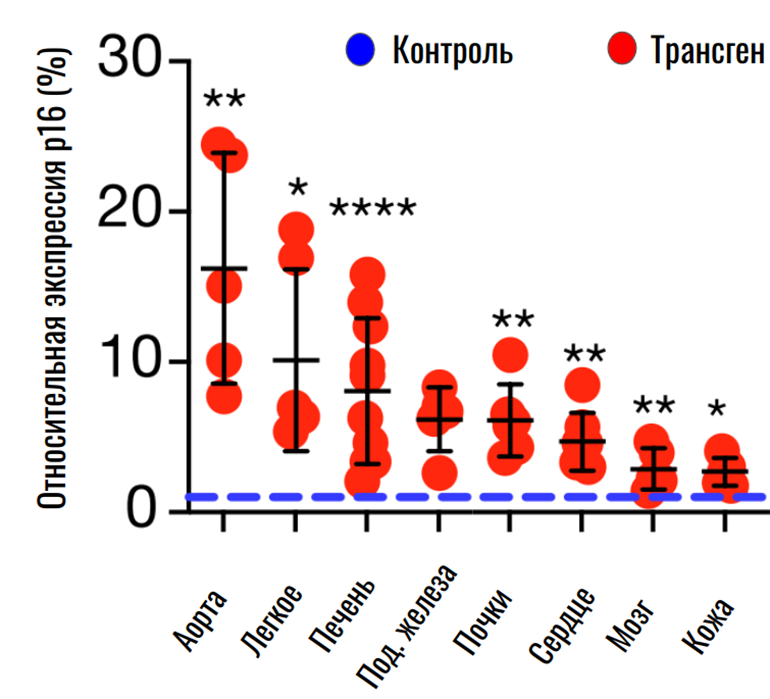
Рисунок 8. Относительная экспрессия маркера сенесцентных клеток p16 в тканях контрольных и трансгенных мышей.
Чтобы подтвердить значительный вклад иммунной системы в активацию сенесценции и старения всего организма, иммунные клетки из селезенки восьмимимесячных трансгенных мышей и старых мышей (возраст 2 года) были трансплантированы здоровым молодым мышам. Спустя неделю после трансплантации у реципиентов начинает детектироваться значительное увеличение числа сенесцентных клеток как в органах иммунной системы, так и в нелимфоидных органах (рис. 9 а, б). Кроме того, в сыворотке начали определяться провоспалительные факторы, ассоциированные с клеточным старением, а срок жизни мышей-реципиентов резко сократился (рис. 9 в).

Рисунок 9. Влияние трансплантированных клеток иммунной системы контрольных (синий), трансгенных (красный) либо старых (желтый) мышей на организм реципиента.
(а) — визуализация экспрессии маркера сенесценции p16 в организме мыши-реципиента после трансплантации клеток иммунной системы. Для визуализации клеток, экспрессирующих ген p16, используются трансгенные мыши-реципиенты, где экспрессия целевого гена сопряжена с экспрессией люциферазы. При работе люциферазы появляется свечение, которое и детектируется в организме мыши.
(б) — относительная экспрессия маркера сенесценции p16 в различных тканях после трансплантации клеток иммунной системы. Можно видеть, что число сенесцентных клеток возрастает как в иммунной системе, так и в остальных органах организма.
(в) — график продолжительности жизни мышей-реципиентов после трансплантации иммунных клеток контрольных и трансгенных мышей.
Важно отметить, что в обратном эксперименте по трансплантации иммунных клеток от молодых мышей к старым наблюдалось снижение маркеров сенесценции в тканях реципиентов.
Таким образом, эксперименты по трансплантации показали, что иммунная система регулирует процесс старения всего организма. Так, сенесцентные иммунные клетки способствуют старению, в то время как «молодые» иммунные клетки ему противодействуют.
Заключение
Результаты Мэттью с соавторами позволяют по новому взглянуть на взаимосвязь иммунной системы и старения. С малых лет мы слышим, что иммунная система стоит на страже нашего здоровья, оберегает нас от внешних и внутренних угроз. И это действительно так. Однако даже такая надежная система защиты не вечна и подвержена старению. В свете новых данных становится ясно, что в норме иммунная система блокирует накопление большого числа сенесцентных клеток, но со временем, старея, сама начинает индуцировать сенесценцию в остальных тканях. Механизм и причины данного процесса еще только предстоит узнать. Однако, несмотря на неутешительные выводы, мы получили довольно важные знания. Терапия, направленная на предотвращение старения клеток иммунной системы, может быть эффективной в снижении темпов накопления сенесцентных клеток в других органах. Цель определена, осталось только придумать подход!
Литература
- L. Hayflick, P.S. Moorhead. (1961). The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621;
- Francis Rodier, Judith Campisi. (2011). Four faces of cellular senescence. Journal of Cell Biology. 192, 547-556;
- Junyue Xing, Yongquan Ying, Chenxi Mao, Yiwei Liu, Tingting Wang, et. al.. (2018). Hypoxia induces senescence of bone marrow mesenchymal stem cells via altered gut microbiota. Nat Commun. 9;
- C. M. Beausejour. (2003). Reversal of human cellular senescence: roles of the p53 and p16 pathways. The EMBO Journal. 22, 4212-4222;
- Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, et. al.. (2009). Expression ofp16INK4ain peripheral blood T-cells is a biomarker of human aging. Aging Cell. 8, 439-448;
- Juan C. Acosta, Ana O'Loghlen, Ana Banito, Maria V. Guijarro, Arnaud Augert, et. al.. (2008). Chemokine Signaling via the CXCR2 Receptor Reinforces Senescence. Cell. 133, 1006-1018;
- Jean-Philippe Coppé, Christopher K Patil, Francis Rodier, Yu Sun, Denise P Muñoz, et. al.. (2008). Senescence-Associated Secretory Phenotypes Reveal Cell-Nonautonomous Functions of Oncogenic RAS and the p53 Tumor Suppressor. PLoS Biol. 6, e301;
- Jean-Philippe Coppé, Christopher K. Patil, Francis Rodier, Ana Krtolica, Christian M. Beauséjour, et. al.. (2010). A Human-Like Senescence-Associated Secretory Phenotype Is Conserved in Mouse Cells Dependent on Physiological Oxygen. PLoS ONE. 5, e9188;
- Thomas Kuilman, Chrysiis Michaloglou, Liesbeth C.W. Vredeveld, Sirith Douma, Remco van Doorn, et. al.. (2008). Oncogene-Induced Senescence Relayed by an Interleukin-Dependent Inflammatory Network. Cell. 133, 1019-1031;
- Judith Campisi. (2014). The beginning of the end. Nature. 505, 35-36;
- G P Dimri, X Lee, G Basile, M Acosta, G Scott, et. al.. (1995). A biomarker that identifies senescent human cells in culture and in aging skin in vivo.. Proc. Natl. Acad. Sci. U.S.A.. 92, 9363-9367;
- Douglas E. Vaughan, Rahul Rai, Sadiya S. Khan, Mesut Eren, Asish K. Ghosh. (2017). Plasminogen Activator Inhibitor-1 Is a Marker and a Mediator of Senescence. ATVB. 37, 1446-1452;
- Chang-Meng Wu, Lei Zheng, Qian Wang, Yan-Wei Hu. (2021). The emerging role of cell senescence in atherosclerosis. Clinical Chemistry and Laboratory Medicine (CCLM). 59, 27-38;
- Abdoulaye Sene, Aslam A. Khan, Douglas Cox, Rei E.I. Nakamura, Andrea Santeford, et. al.. (2013). Impaired Cholesterol Efflux in Senescent Macrophages Promotes Age-Related Macular Degeneration. Cell Metabolism. 17, 549-561;
- Darren J. Baker, Tobias Wijshake, Tamar Tchkonia, Nathan K. LeBrasseur, Bennett G. Childs, et. al.. (2011). Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479, 232-236;
- Marco Demaria, Naoko Ohtani, Sameh A. Youssef, Francis Rodier, Wendy Toussaint, et. al.. (2014). An Essential Role for Senescent Cells in Optimal Wound Healing through Secretion of PDGF-AA. Developmental Cell. 31, 722-733;
- Joan B. Mannick, Melody Morris, Hans-Ulrich P. Hockey, Guglielmo Roma, Martin Beibel, et. al.. (2018). TORC1 inhibition enhances immune function and reduces infections in the elderly. Sci. Transl. Med.. 10, eaaq1564;
- Thomas Weichhart. (2018). mTOR as Regulator of Lifespan, Aging, and Cellular Senescence: A Mini-Review. Gerontology. 64, 127-134;
- Bennett G Childs, Matej Durik, Darren J Baker, Jan M van Deursen. (2015). Cellular senescence in aging and age-related disease: from mechanisms to therapy. Nat Med. 21, 1424-1435;
- James L. Kirkland, Tamara Tchkonia. (2017). Cellular Senescence: A Translational Perspective. EBioMedicine. 21, 21-28;
- Daniel Muñoz-Espín, Marta Cañamero, Antonio Maraver, Gonzalo Gómez-López, Julio Contreras, et. al.. (2013). Programmed Cell Senescence during Mammalian Embryonic Development. Cell. 155, 1104-1118;
- Mekayla Storer, Alba Mas, Alexandre Robert-Moreno, Matteo Pecoraro, M. Carmen Ortells, et. al.. (2013). Senescence Is a Developmental Mechanism that Contributes to Embryonic Growth and Patterning. Cell. 155, 1119-1130;
- Sugiko Watanabe, Shimpei Kawamoto, Naoko Ohtani, Eiji Hara. (2017). Impact of senescence-associated secretory phenotype and its potential as a therapeutic target for senescence-associated diseases. Cancer Sci. 108, 563-569;
- Matthew J. Yousefzadeh, Rafael R. Flores, Yi Zhu, Zoe C. Schmiechen, Robert W. Brooks, et. al.. (2021). An aged immune system drives senescence and ageing of solid organs. Nature. 594, 100-105;
- Tae-Won Kang, Tetyana Yevsa, Norman Woller, Lisa Hoenicke, Torsten Wuestefeld, et. al.. (2011). Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479, 547-551;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники.