
Метаболизм и эпигеном
22 апреля 2022
Метаболизм и эпигеном
- 1902
- 0
- 12
Ацетилтрансфераза CLOCK использует ацетил-КоА для ацетилирования гистонов и регулирует циркадные ритмы
иллюстрация Михаила Гурьева по [42]
-
Автор
-
Редакторы
-
Рецензенты
-
Иллюстратор
Метаболизм — совокупность химических реакций, протекающих внутри клетки, — тесно связан с эпигенетикой. Метаболиты могут влиять на молекулы, задействованные в эпигенетической регуляции, а следовательно, на все ее аспекты. В продолжении cпецпроекта об эпигенетике мы рассмотрим влияние метаболитов на организацию ядра, наследование эпигенетической информации и эпигенетические процессы. Как мы узнаем, метаболиты могут влиять как на половые, так и на соматические клетки взрослого организма (например, перепрограммировать мозг).
Эпигенетика
Эпигенетика — с одной стороны, молодая и бурно развивающаяся наука. С другой стороны, в этой науке уже сложился фундамент основных понятий и концепций. Цель спецпроекта — рассказать об основных концепциях эпигенетики просто, но в то же время со всех сторон. Читатель узнает, какие молекулы и структуры стоят за передачей наследственной информацией и какими механизмами осуществляется эта передача. Часть контента позаимствована из блога автора Friends of Chromatin.

Генеральный партнер спецпроекта — компания «Диаэм».
Это крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
В предыдущих статьях спецпроекта об эпигенетике мы рассказали об организации хроматина и хроматиновых доменов [1], законах наследования эпигенетической информации [2] и процессах, протекающих на хроматине [3]. Здесь мы рассмотрим часть эпигенетического пазла, включающую метаболиты и их влияние на хроматиновую «жизнь». В нашем организме существует множество взаимосвязанных цепочек превращений одних маленьких молекул — метаболитов — в другие. Многие из них влияют на белки эпигенетической регуляции:
- Они могут быть их кофакторами: например, S-аденозилметионин (SAM) является донором метильной группы для гистонметилтрансфераз — белков, навешивающих метильные метки на гистоны [4], — а следовательно, его недостаток или избыток повлияет на метилирование.
- Они могут ингибировать эпигенетические молекулы, как, например, 2-гидроксиглутарат ингибирует некоторые гистондеметилазы — белки, снимающие метильные группы с гистонов [5].
- Они могут влиять на эпигенетические регуляторы, не будучи при этом кофакторами: например, О-ацетил-АДФ-рибоза у млекопитающих является лигандом для варианта гистона макроH2A1.1 [4], [6].
Соответственно, влияя на эпигенетические регуляторы, эти метаболиты могут запускать целые цепочки процессов на хроматине. Если всё это происходит в половых клетках, изменения передаются — как бы в противоречии идеям Дарвина — сквозь поколения! А значит, то, как мы питаемся, занимаемся ли спортом, курим и употребляем ли алкоголь — всё это может привести к эпигенетическим изменениям в наших собственных клетках, в том числе половых, и передаться детям.
Метаболиты могут влиять на клетку прямо или косвенно [4]. В первом случае они действуют на эпигенетические регуляторы непосредственно — например, кортизол (который является гормоном, но мы на него смотрим в контексте метаболизма) связывается с глюкокортикоидными рецепторами и запускает транскрипцию определенных генов; или изменение уровня SAM влияет на активность метилтрансфераз. Но может быть и непрямое влияние: метаболиты связываются с рецепторами на поверхности клеток, и тогда уже транскрипционные факторы активируются через сигнальные каскады. В этой статье мы будем говорить в основном про «прямые» метаболиты.
Многие ингибиторы эпигенетических факторов используются в исследованиях и терапии заболеваний, в том числе и разных видов рака, являясь, по сути, лекарствами [7].
В качестве введения мы кратко рассмотрим основные цепочки метаболизма, происходящие в эукариотах, и более подробно сконцентрируемся на соединениях, важных в эпигенетике.
Шпаргалка по биохимии — как меняются вещества в нашем организме
Мы рассмотрим основные цепочки превращения одних метаболитов в другие, подробно останавливаясь на процессах и соединениях, которые мы встретим дальше в статье. Для начала нужно узнать, что такое гликолиз и цикл Кребса (ведь их ингибированием удалось уменьшить эпигенетические нарушения в опухолях мозга у мышей): в ходе этих метаболических процессов получаются соединения, ведущие к другим злокачественным новообразованиям с эпигенетической основой.
Дыхание
Дыхание — это окисление определенных органических соединений до воды и углекислого газа — СО2. Если оно происходит с помощью кислорода (а ведь бывает и не так [8]), то носит название аэробного. Этот процесс включает несколько этапов (рис. 1): гликолиз, цикла Кребса и окислительное фосфорилирование (с переносом электронов в митохондриях). При анаэробном дыхании цепи переноса электронов, встроенные в мембрану, тоже есть, только вот финальным акцептором электронов является не кислород, а другие органические и неорганические молекулы. Оно распространено у бактерий и иногда может активироваться у растений (см. статью «Особая диета: молекулярный водород три раза в день, ионы сульфата перед едой» [8]).
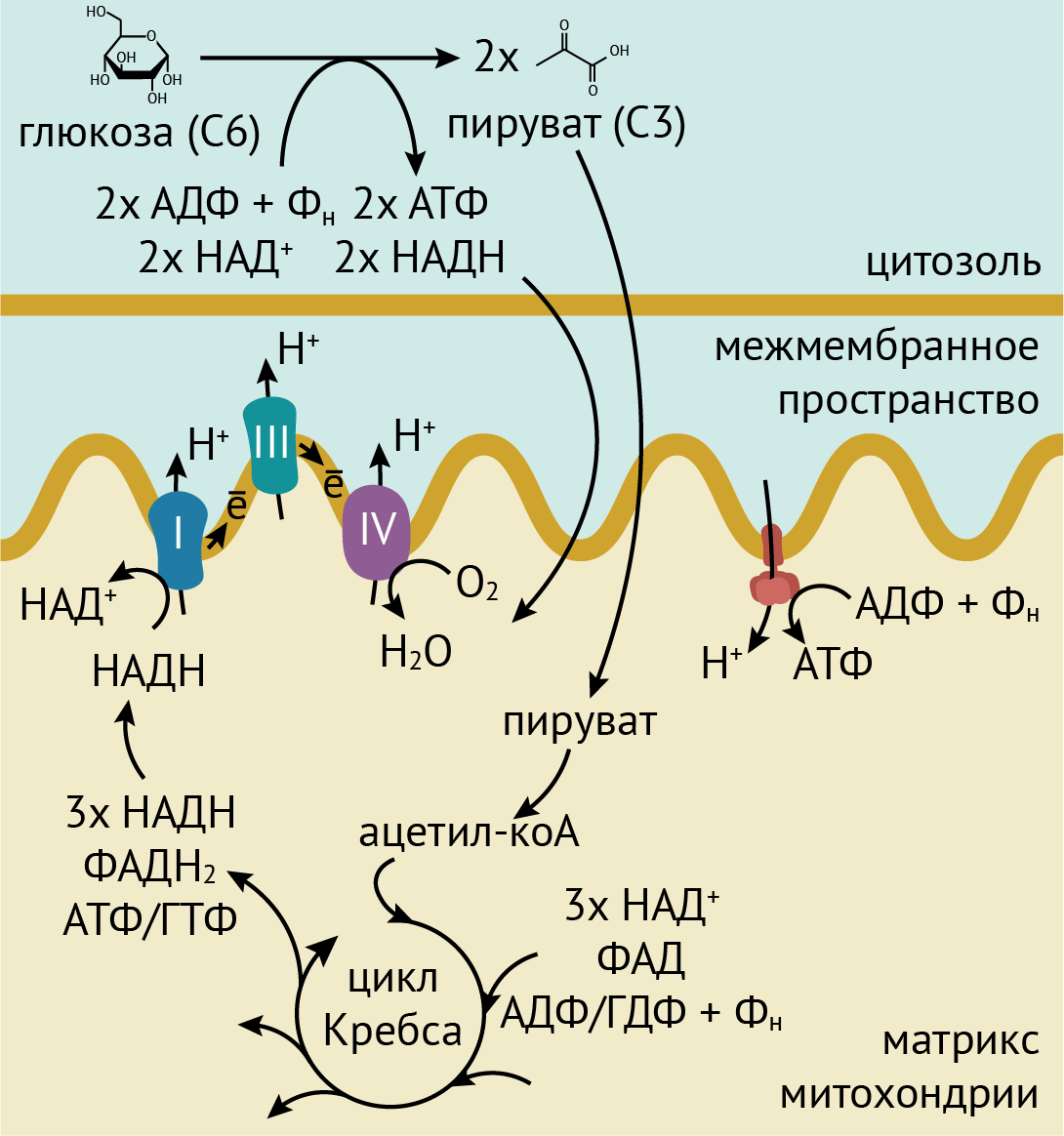
Рисунок 1. Схема дыхания. Сначала глюкоза через ряд превращений в гликолизе превращается в две молекулы пирувата. При этом, в частности, получаются две молекулы АТФ и две молекулы НАДH. Обе молекулы очень важны для энергетических процессов в клетке. Фактически, мы дышим ради получения энергетических молекул. Гликолиз происходит в цитоплазме, после чего пируват импортируется в митохондрии. Там он окисляется до ацетил-кофермента А и вовлекается в цикл Кребса, в ходе которого окисляется до углекислого газа. При этом образуются, в частности, три молекулы НАДН (из НАД+), одна молекула ФАДН (из ФАД — флавинадениндинуклеотида) и одна молекула АТФ или ГТФ. Именно молекулы НАДН и ФАДН важны для следующей стадии дыхания — цепи переноса электронов. Дело в том, что в мембрану митохондрий встроен ряд белков и коферментов, которые могут передавать электроны соседям по цепочке (за счет разности потенциалов). При этом некоторые белки отнимают протоны у НАДН и ФАДН и перекачивают их через одну из двух митохондриальных мембран в межмембранное пространство митохондрий. Последний в цепочке таких белков передает электроны на кислород и превращает его в воду. А протоны накапливаются в межмембранном пространстве митохондрий и закачиваются обратно внутрь митохондрий белком АТФ-синтазой, который, как видно из названия, при этом синтезирует главную энергетическую молекулу клетки — АТФ. Она используется для многих процессов в клетке.
иллюстрация Михаила Гурьева
Гликолиз и цикл Кребса особенно важны для нас, поскольку именно они выходят из строя во многих заболеваниях и вызывают эпигенетические изменения. Они, по сути, не меняются, но меняется баланс метаболитов — одних становится меньше, а других больше, — вот это-то и ведет к эпигенетическим нарушениям. А еще важный продукт цикла Кребса — ацетил-коА — является главным донором ацетильных групп, в том числе и для ацетилирования гистонов, которое, как мы помним, служит меткой активации хроматина.
Отличия метаболизма растений
У растений, помимо аэробного дыхания, есть еще одна цепь переноса электронов, встроенная в мембраны тилакоидов (компартментов внутри хлоропластов) и связанная уже с фотосинтезом. В ней есть два комплекса, способные поглощать свет, причем один из них также разлагает воду до кислорода и протонов (H+). Протоны при этом оказываются внутри тилакоидов, и создаваемое ими напряжение используется АТФ-синтазой, как ротором, для производства АТФ.
А еще растения могут фиксировать углекислый газ, создавая из него органическое вещество. Есть специальный фермент — рибулозобисфосфаткарбоксилаза, который фиксирует CO2 и пришивает его к рибулозобисфосфату [9]. Потом в процессе цикла Кальвина шестиуглеродный продукт расщепляется до двух трехуглеродных, которые затем в цикле превращаются в пятиуглеродную молекулу. В процессе затрачивается много молекул АТФ и НАДН (читается как «НАД-аш»). Таким образом растения фиксируют CO2 и питаются, а еще выделяют кислород, что имеет важнейшее значение для нашей биосферы — откуда его еще брать?
Синтез аминокислот, жиров, углеводов и нуклеотидов
Аминокислоты иногда синтезируются из продуктов гликолиза и цикла Кребса. Например, аланин и некоторые другие получаются из пирувата, а глутамат — из ɑ-кетоглутарата. Некоторые аминокислоты синтезируются из других кислот: например, глутамин — из глутамата; лизин, аспарагин, метионин и некоторые другие — из аспартата; а серин, глицин и цистеин — из 3-фосфоглицерата. В особенности, нам нужно обратить внимание на глутамат и метионин — первого бывает больше или меньше нормы в опухолях, а из второго образуется главный донор метильных групп в клетке.
Жирные кислоты синтезируются в цитоплазме из ацетил-коА, который экспортируется из митохондрий; в обратном процессе ацетил-КоА, наоборот, образуется — и может служить источником ацетильных групп для модификации гистонов. Метаболизм моносахаридов во многом основан на гликолизе и обратном ему процессе — глюконеогенезе.
Метаболиты в эпигенетике
Метаболиты по-разному влияют на эпигенетику. В основном эффект достигается за счет регуляции гистоновых модификаций: ведь чтобы пришить к гистонам химические группы, их необходимо откуда-то взять. Соответственно, ферменты, регулирующие эти метаболиты, регулируют и гистоновые метки. Вот несколько примеров [10]:
- S-аденозилметионин (SAM) синтезируется из АТФ и метионина и служит донором метильной группы для метилтранфераз, которые модифицируют ДНК и разные белки;
- S-аденозилгомоцистеин (SAH), который остается после переноса метильной группы с SAM, ингибирует метилтрансферазы, обеспечивая обратную связь этому процессу;
- фолат и витамины B6 и B12 усиливают производство SAM;
- ɑ-кетоглутарат — промежуточный продукт цикла Кребса — вместе с ионами железа нужен для деметилирования — снятия метильных групп; иногда для деметилирования используется ФАД [11];
- сукцинат и фумарат — другие промежуточные продукты цикла Кребса, — напротив, ингибируют деметилирование;
- ацетил-КоА является донором ацетильной группы для ацетилаз — белков, навешивающих ацетильные группы на гистоны и другие белки, что также меняет активность хроматина, нейтрализует его положительный заряд и увеличивает его рыхлость;
- бетагидроксибутират может синтезироваться в процессе метаболизма жирных кислот, аминокислот, а также других молекул; он ингибирует гистондеацетилазы класса I;
- отношение количества НАД+ к НАДН регулирует гистондеацетилазы класса III, которые также называются сиртуинами;
- НАД+ используется поли-АДФ-рибозополимеразами, которые навешивают цепи поли-АДФ-рибозы на белки, в том числе гистоны; это, в частности, играет роль в починке ДНК [11];
- АТФ является кофактором для многих молекул на хроматине, в частности, ремоделеров, когезинов и конденсинов.
Метаболизм и архитектура хроматиновых доменов
Количество метаболитов, регулирующих гистоновые модификации, должно находиться в равновесии. Их недостаток или избыток меняет паттерн модификации гистонов и других белков — в определенных местах генома или глобально, — влияя на архитектуру хроматиновых доменов и активность транспозонов. Давайте рассмотрим пару примеров такой регуляции для гетерохроматина: конститутивного, отмеченного H3K9me2/3; и факультативного, метка которого — H3K27me3.
Как утихомирить транспозоны при недостатке метаболитов метилирования?
Гетерохроматин, отмеченный ди- или триметилированием гистона H3 по девятому лизину (H3K9me2/3) — самый компактный тип хроматина. Его много на мобильных элементах генома, чтобы они помалкивали и не высовывались (то есть не экспрессировались). Значительная часть гистона H3, прежде чем попасть в такой хроматин, монометилируется по девятому лизину, а уже в нуклеосомах дополнительно ди- и триметилируется [12–14].
Что происходит с таким гетерохроматином при недостатке S-аденозилметионина (рис. 2)? Неудивительно, что метки H3K9me2/3 при этом становится меньше : ведь SAM — это источник метильных групп. Однако это компенсируется монометилированным вариантом этого же гистона, количество которого возрастает в том числе и на мобильных элементах генома, расположенных в гетерохроматине, что не дает им активироваться. Это очень важно, поскольку повышенная экспрессия транспозонов может вести к рекомбинации, мутациям и нестабильности генома — прямая дорога к заболеваниям, в том числе и раку.
На наших гистонах не хватает метильных групп. Пожалуйста, заплатите налоги!
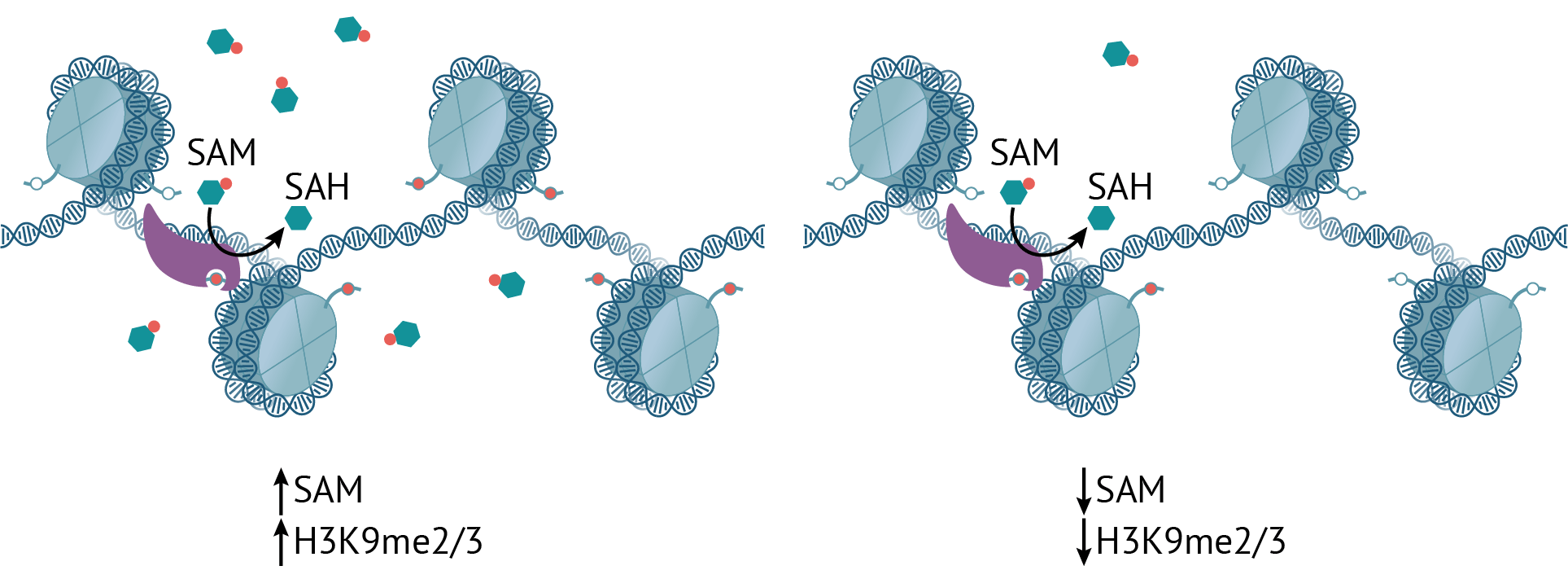
Рисунок 2. При избытке SAM метки H3K9me2/3 становится больше и наоборот. (Однако монометилирование стабильно сохраняется — это важно.)
иллюстрация Михаила Гурьева по [15]
Интересно, что сохранение монометилирования на гистонах нужно не только для подавления активности мобильных элементов, но и чтобы гистоны потом можно было ди- и триметилировать обратно, когда уровень SAM снова поднимется: вообще неметилированный H3K9 восстанавливается до уровня me2/3 крайне неохотно [15].
Метаболиты основных энергетических путей регулируют метку Polycomb
Теперь второй пример. Синтез важных энергетических молекул в клетке может усиливаться благодаря не только соединениям, непосредственно вовлеченным в дыхание, но и их предшественникам. Например, ɑ-кетоглутарат — одно из промежуточных веществ цикла Кребса — может синтезироваться из глутамата, а нарушения его уровня особенно критичны для варолиева моста, приводя к летальным опухолям (глиомам) у детей. В этих опухолях часто происходит гистоновая мутация лизина в метионин H3K27→H3M27 (но не во всех генах гистонов), что не позволяет остатку K27 триметилироваться под влиянием комплекса Polycomb. Более того, присутствие даже небольшого количества H3M27 ингибирует фермент, навешивающий метильные группы на H3K27, и глобально уровень метки падает почти до нуля.
Исследователи сравнили уровни метаболитов в клетках с нормальным гистоном H3 и мутантным H3K27→H3M27 (в клеточных культурах и прямо на пациентах). Выяснилась интересная вещь: при мутации повышались метаболиты гликолиза и цикла Кребса, а также уровень глутамина. Ученые попробовали вышибить клин клином: искусственно снизили метаболизм глутамина и эффективность некоторых стадий гликолиза и цикла Кребса. Что же оказалось? Уровень метки H3K27me3 на остатке лизина K27 (не весь он мутирует в метионин) повышался. А когда мышей с диффузной внутренней глиомой моста мозга кормили ингибиторами метаболизма, их выживаемость увеличивалась — рак отступал [16]. Следовательно, снижение уровня метки H3K27me3 при данной опухоли происходит не только из-за мутации, но и под влиянием сбоя в метаболизме. Более того, поправив метаболизм, можно и восстановить уровень H3K27me3, и подлечить глиому у мышей. Это потенциальный вариант терапии и для опухолей у детей.
База для химиотерапии: как метаболиты убивают раковые клетки, прицельно ингибируя репарацию и репликацию
Мы уже выяснили, что метаболиты могут влиять на гистоновые модификации, а, следовательно, на архитектуру хроматиновых доменов и на процессы, происходящие на хроматине (например, починку ДНК [3]). В частности, ɑ-кетоглутарат (метаболит цикла Кребса) служит кофактором для фермента гистонлизиндеметилазы, которая «сбривает» метильные группы с гистонов. Однако сбой в метаболизме может привести к накоплению не ɑ-кето-, а ɑ-гидроксиглутарата , что застопорит фермент и остановит репарацию ДНК. Последствия у этого могут быть самые тревожные: например, образование опухолей.
Мутации в ключевом ферменте метаболизма ɑ-кетоглутарата — изоцитратдегидрогеназе — могут привести к образованию другого продукта: ɑ-гидроксиглутарата. Схожая по химической структуре с «нормальным» метаболитом, эта молекула выступает уже не кофактором, а ингибитором гистондеметилазы, что повышает фон метильных меток H3K9me3 и ведет к остановке репарации. Помимо этого побочного продукта «сбойного» цикла Кребса, тот же эффект может дать накопление его нормальных метаболитов — сукцината и фумарата, — если мутированы какие-то ферменты, отвечающие за их превращения.
Как мы пояснили в сноске выше, ɑ-гидроксиглутарат, сукцинат и фумарат тормозят репарацию ДНК по образцу гомологичной цепи, ингибируя гистонлизиндеметилазу [17–19]. В результате уровень метки H3K9me3 в области повреждения ДНК остается постоянно высоким, в то время как в норме должен бы кратковременно подскочить сразу после разрыва. Этот «скачок» метилирования H3K9 служит сигналом для белков репарации — ну а когда этого сигнала нет, и репарация идет не так эффективно. А когда нет репарации, остается всего один шаг до мутаций и нестабильности генома, поскольку ошибки в ДНК не исправляются. Возможно, такой переключатель в метаболизме удастся использовать для лечения рака: многие лекарства от рака ингибируют репарацию раковых клеток, убивая их — так действуют некоторые виды химиотерапии [19].
Гидроксимочевина — препарат химиотерапии, назначаемый при многих видах рака, включая меланому и опухоли мозга. Оказывается, во многих раковых клетках не действует гомологичная рекомбинация , [20], а потому гораздо хуже работают репарационные механизмы. Это делает их уязвимыми для лечения гидроксимочевиной, воздействие которой в условиях выключенной репарации ведет к деградации новосинтезированной ДНК, мутациям и нестабильности генома раковых клеток.
В нормальных же клетках гомологичная рекомбинация работает, и новосинтезированная ДНК не деградирует. Конечно, раковые клетки не могут «не понимать» причин своей уязвимости, а потому в ответ на химиотерапию часто возникает резистентность — когда восстанавливается гомологичная рекомбинация, и «химия» перестает действовать.
А дело всё в том, что гидроксимочевина не только ингибирует репликацию. Помимо этого, она еще трансформирует метаболизм на накопление активных форм кислорода, запускающих каскады, приводящие к деградации новосинтезированной ДНК — но только в тех клетках, где нет гомологичной рекомбинации [21].
Влияние метаболизма на эпигеном половых клеток: метаболизм и наследование
Французский ученый Жан-Батист Ламарк постулировал, что приобретенные черты организмов могут передаваться последующим поколениям. Он приводил в пример жирафа, который объедает листья с высоких деревьев, и чья шея постепенно вытягивается в ряду поколений. Обычно ламаркизм противопоставляют общепринятому в биологии дарвинизму — согласно последнему, у жирафа длинная шея не потому, что она удлинилась и передалась по наследству, а потому что вследствие естественной изменчивости появляются особи с чуть более длинными шеями, которые и получают преимущество в конкурентной борьбе, а потому оставляют больше потомства, чем их короткошеие собратья, закрепляя удачный признак в поколениях. Но так ли был неправ Ламарк?
Нужно отметить, что ламаркизм довольно-таки распространен у микроорганизмов (хотя сами они об этом и не подозревают) — речь тут о горизонтальном переносе генов, играющем решающую роль в молекулярной эволюции микроорганизмов [22]. Похоже, отчасти он встречается и у эукариот, хотя его и не стоит понимать настолько буквально, как в примере с жирафом. Дело в том, что воздействие определенных веществ может поменять эпигеном половых клеток и оказать влияние на несколько последующих поколений [23]. Как именно осуществляется такое влияние?
В настоящее время изучено несколько основных «посредников» эпигенома, через которые метаболические влияния передаются потомству (рис. 3).
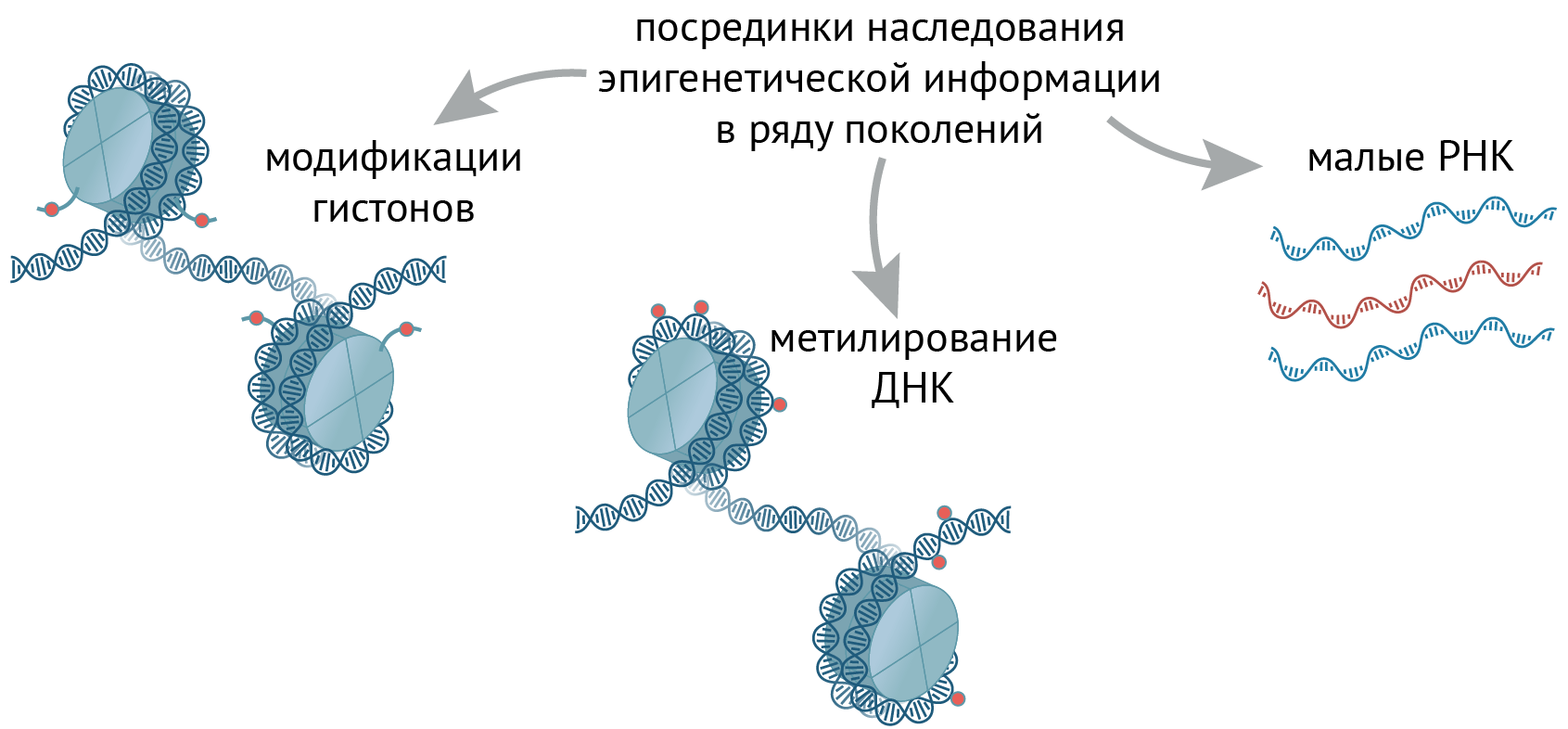
Рисунок 3. Посредники наследования эпигенетической информации в ряду поколений. Эпигенетическая информация может передаваться через модификации гистонов, метилирование ДНК или малые РНК.
иллюстрация Михаила Гурьева по [33]
Во-первых, это гистоны. Несмотря на то, что, например, в сперме большая часть гистонов заменяется другими «упаковочными» белками — протаминами, — 1–15% гистонов всё-таки там остается. Видимо, этого уже достаточно: надежно показано, что манипуляции гистоновыми модификациями в половых клетках оказывают влияние на несколько последующих поколений [23–26]. Как мы уже разобрали, метаболизм может напрямую влиять на модификации гистонов, и избыток или недостаток определенных метаболитов в половых клетках может оказывать влияние на потомство — но только если изменения произойдут в половых клетках; тот же эффект в клетках соматических не отразится на детях.
Например, уровень фолиевой кислоты — витамина, который рекомендуют принимать всем беременным, — влияет на количество S-аденозилметионина (донора метильной группы для метилтрансфераз) и, следовательно, на метилирование гистонов. Также у потомков самцов мышей, в рационе которых не хватало этого витамина, наблюдались аномалии развития скелета, дополнительно усиливавшиеся, если в сперматозоидах активировали деметилирование гистонов . Возможно, именно из-за метилирования гистонов беременным так необходима фолиевая кислота (особенно в первые 6 недель беременности — если ее не принимать, возникает риск врожденных пороков у плода) [27], [28].
Мало того: недостаток фолата снижает уровень метки H3K4me3 только на определенных участках — промоторах и энхансерах, важных для развития эмбриона и передающихся ему через половую клетку [29].
Во-вторых, это метилирование ДНК (рис. 3). С ним всё еще сложнее, чем с гистонами, которых мало остается в сперме. Дело в том, что есть два момента, когда метилирование практически полностью стирается, а потом «пишется» заново: один — во время развития половых клеток, а второй — в раннем развитии эмбриона (и мы рассказывали об этом в статье «Наследование и эпигеном» [2]). Метилирование ДНК в эмбриогенезе остается неизменным только в участках контроля импринтинга (УКИ — и они разные у разных полов) и некоторых повторяющихся элементах генома. Метилирование ДНК в половых клетках может меняться в ответ на определенные метаболические стимулы — например, избыток фталата меняет метилирование ретроэлементов LINE-1 [23], [30] (см. статью «Процессы и эпигеном» [3]).
В-третьих, стоит упомянуть малые РНК (рис. 3) (см. статью «Наследование и эпигеном» [2]). Даже несмотря на то, что у млекопитающих нет РНК-зависимой РНК-полимеразы (и малые РНК не могут копироваться независимо от генома), они влияют на хроматин, экспрессию генов и на фенотип последующих поколений, когда присутствуют в половых клетках. Более того: уровень малых РНК в половых клетках колеблется вслед за концентрациями метаболитов. Например, диета с высоким содержанием жира влияла на содержание некоторых микро-РНК и фрагментов тРНК в сперме самцов мышей и крыс, а еще вызывала нетолерантность их потомства к глюкозе [23], [31–33]. Механизмы влияния метаболизма на РНК могут быть самыми разными — от изменения транскрипции (например, воздействуя на транскрипционные факторы) до влияния на их биогенез и трансляцию [33].
Эпигеном половых клеток очень чувствителен к метаболическим стимулам, и то, как мы питаемся, занимаемся ли спортом, курим ли и употребляем алкоголь, с какими веществами сталкиваемся в течение жизни — всё это влияет на наше потомство. У крыс, например, если самкам перед оплодотворением давать задания на пространственное обучение, это повысит соответствующие навыки потомства женского пола. Получается, сигналы от нейронов каким-то образом достигают и половых клеток (возможно, в форме метаболитов) и перепрограммируют их [34], [35]. Бывает и такое.
Влияние алкоголя на взрослый организм
Интересно, что половыми клетками дело не заканчивается. Вещества, которые мы потребляем, меняют состав крови, и растворенные в ней метаболиты могут влиять на разные органы. Например, после употребления алкоголя в крови много ацетата — он образуется в результате метаболизма спирта в печени. Ацетат проникает в мозг, где конвертируется в ацетил-KоА — субстрат для ацетилирования гистонов. Этот процесс в мозге изменяет транскрипцию (в частности, генов, отвечающих за память). Оказывается, мыши-алкоголики, которые пьют много этанола, быстрее учатся находить комнатку с этаноловой поилкой — налицо зависимость от алкоголя [36]!
Если дать алкоголь беременным мышам, ацетилирование изменится также в мозге у плода (возможно, именно это объясняет фетальный алкогольный синдром). Интересно, что источником этого ацетата может быть не только алкоголизм, но и микробы в кишечнике [37], однако как микробный метаболом влияет на его хозяев, еще только предстоит выяснить.
Как эпигенетика управляет метаболизмом: регуляция транскрипции ферментов
Интересно, что в неблагоприятных условиях среды — при недостатке самых разных метаболитов — клетки млекопитающих реагируют одинаково. Например, если в среде станет недостаточно аминокислот, активируется сигнальный путь, фосфорилирующий транскрипционный фактор (ТФ) ATF4 (не путать с АТФ!), регулирующий ферменты метаболизма аминокислот (и запускающий их синтез). Этот путь часто активируется в опухолях, которым нужно расти в условиях недостатка питательных веществ. Если ATF4 — универсальный «звонок» недостатка питательных веществ, то спусковым крючком недавно найденного транскрипционного фактора ТФ ZBTB1 служит исключительно недостаток аспарагина. Более того, недостаток этого белка приводит и к недостатку аспарагина. Эксперименты показали, что ZBTB1 непосредственно взаимодействует с промотором аспарагинсинтетазы — фермента, конвертирующего аспартат в аспарагин.
Интересно, что лейкозные клетки, в которых отсутствовал ZBTB1, чувствительны к L-аспарагиназе — ферменту, расщепляющему аспарагин и, соответственно, истощающему запасы этой аминокислоты в среде. А если лейкозные клетки без ZBTB1 подсадить мышам и лечить их L-аспарагиназой, то такие мыши живут дольше контроля [38].
Таким образом, хроматиновые белки могут регулировать метаболизм, меняя производство соответствующих ферментов, и возможно, это когда-нибудь удастся использовать в терапии заболеваний.
Как управлять циркадными ритмами, или Опять про гистоновые модификации
Как уже упоминалось, многие метилтрансферазы в качестве донора метильной группы используют S-аденозилметионин (SAM), и чем его больше — тем интенсивнее идет метилирование (и наоборот). Однако в ход идет только метильная группа, а «огрызок» SAM — S-аденозил-L-гомоцистеин (SAH) — утилизируется специальным ферментом — S-аденозил-L-гомоцистеингидролазой, играющим заодно ключевую роль в регуляции генов циркадных ритмов с партнером — транскрипционным фактором. Таким образом метаболические ферменты коллаборируют с эпигенетикой и регулируют циркадные ритмы.
Цикл сна и бодрствования регулируют циркадные ритмы. Специальные сенсорные белки реагируют на такие внешние стимулы, как свет и температура, и запускают цепочку химических превращений, приводящую к циклическому колебанию концентраций определенных метаболитов. Интересно, что белки циркадных ритмов тесно связаны с хроматином [39–41].
Транскрипция циркадных генов запускается ТФ CLOCK и BMAL1. Они функционируют в виде гетеродимера и связаны с изменением хроматина. Кроме того, CLOCK — это ацетилтрансфераза, ацетилирующая гистоны и другие белки (в том числе и BMAL1). Ей противостоит деацетилаза — сиртуин SIRT1, активность которого осциллирует в течение дня вослед за кофактором НАД+ [11].
S-аденозил-L-гомоцистеингидролаза взаимодействует с ТФ BMAL1, который регулирует активность циркадных генов со строгой периодичностью; в комплексе они взаимодействуют с промоторами генов. Достигается это колебанием уровня метки H3K4me3 — важной модификации активных генов на их промоторах. Интересно, что мыши, у которых эта гидролаза ингибирована в гипоталамусе, показывают уменьшенную циркадную двигательную активность, а еще у них нарушена транскрипция циркадных генов в супрахиазматическом ядре гипоталамуса (рис. 4).
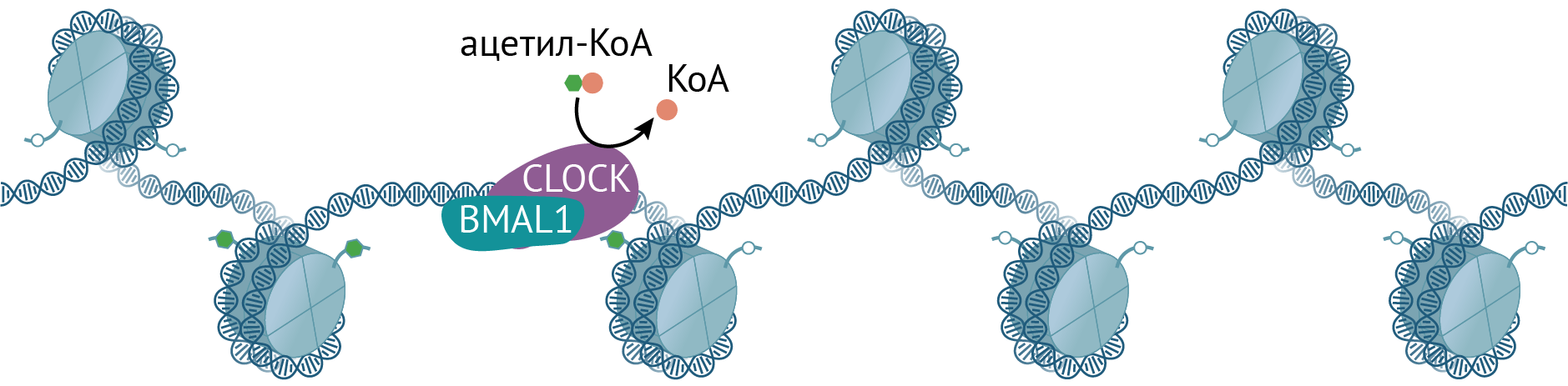
Рисунок 4. CLOCK и BMAL1 запускают транскрипцию генов как стандартные транскрипционные факторы, а CLOCK в дополнение работает ацетилтрансферазой и использует ацетил-КоА, чтобы навешивать ацетильные метки на гистоны.
иллюстрация Михаила Гурьева по [42]
Заключение
После краткого напоминания путей метаболизма мы с вами убедились, что метаболизм и эпигеном тесно связаны. Мы узнали, как замалчиваются транспозоны при недостатке метаболитов метилирования и как гомологичная рекомбинация влияет на устойчивость раковых клеток к химиотерапии. Мы узнали, что ламаркизм имеет право на существование, и что метаболиты могут влиять на половые клетки и взрослый организм, изменяя эпигенетику. Наконец, мы разобрали, как эпигеном управляет метаболизмом и как метаболизм через эпигеном регулирует цикл сна и бодрствования. В следующей, последней статье спецпроекта мы расскажем, как нарушения в эпигенетике ведут к заболеваниям.
Литература
- Молекулы и эпигеном ;
- Наследование и эпигеном;
- Процессы и эпигеном;
- Upasna Sharma, Oliver J. Rando. (2017). Metabolic Inputs into the Epigenome. Cell Metabolism. 25, 544-558;
- Rasheduzzaman Chowdhury, Kar Kheng Yeoh, Ya‐Min Tian, Lars Hillringhaus, Eleanor A Bagg, et. al.. (2011). The oncometabolite 2‐hydroxyglutarate inhibits histone lysine demethylases. EMBO Rep. 12, 463-469;
- Georg Kustatscher, Michael Hothorn, Céline Pugieux, Klaus Scheffzek, Andreas G Ladurner. (2005). Splicing regulates NAD metabolite binding to histone macroH2A. Nat Struct Mol Biol. 12, 624-625;
- Пилюли для эпигенома;
- Особая диета: молекулярный водород три раза в день, ионы сульфата перед едой;
- Волонтер фотосинтеза;
- Giacomo Cavalli, Edith Heard. (2019). Advances in epigenetics link genetics to the environment and disease. Nature. 571, 489-499;
- Shelley L. Berger, Paolo Sassone-Corsi. (2016). Metabolic Signaling to Chromatin. Cold Spring Harb Perspect Biol. 8, a019463;
- Alejandra Loyola, Tiziana Bonaldi, Danièle Roche, Axel Imhof, Geneviève Almouzni. (2006). PTMs on H3 Variants before Chromatin Assembly Potentiate Their Final Epigenetic State. Molecular Cell. 24, 309-316;
- Alejandra Loyola, Hideaki Tagami, Tiziana Bonaldi, Danièle Roche, Jean Pierre Quivy, et. al.. (2009). The HP1α–CAF1–SetDB1‐containing complex provides H3K9me1 for Suv39‐mediated K9me3 in pericentric heterochromatin. EMBO Rep. 10, 769-775;
- Carlos Rivera, Francisco Saavedra, Francisca Alvarez, César Díaz-Celis, Valentina Ugalde, et. al.. (2015). Methylation of histone H3 lysine 9 occurs during translation. Nucleic Acids Res. 43, 9097-9106;
- Spencer A. Haws, Deyang Yu, Cunqi Ye, Coral K. Wille, Long C. Nguyen, et. al.. (2020). Methyl-Metabolite Depletion Elicits Adaptive Responses to Support Heterochromatin Stability and Epigenetic Persistence. Molecular Cell. 78, 210-223.e8;
- Chan Chung, Stefan R. Sweha, Drew Pratt, Benita Tamrazi, Pooja Panwalkar, et. al.. (2020). Integrated Metabolic and Epigenomic Reprograming by H3K27M Mutations in Diffuse Intrinsic Pontine Gliomas. Cancer Cell. 38, 334-349.e9;
- Parker L. Sulkowski, Christopher D. Corso, Nathaniel D. Robinson, Susan E. Scanlon, Karin R. Purshouse, et. al.. (2017). 2-Hydroxyglutarate produced by neomorphic IDH mutations suppresses homologous recombination and induces PARP inhibitor sensitivity. Sci. Transl. Med.. 9;
- Parker L. Sulkowski, Ranjini K. Sundaram, Sebastian Oeck, Christopher D. Corso, Yanfeng Liu, et. al.. (2018). Krebs-cycle-deficient hereditary cancer syndromes are defined by defects in homologous-recombination DNA repair. Nat Genet. 50, 1086-1092;
- Parker L. Sulkowski, Sebastian Oeck, Jonathan Dow, Nicholas G. Economos, Lily Mirfakhraie, et. al.. (2020). Oncometabolites suppress DNA repair by disrupting local chromatin signalling. Nature. 582, 586-591;
- MingRen Toh, Joanne Ngeow. (2021). Homologous Recombination Deficiency: Cancer Predispositions and Treatment Implications. The Oncologist. 26, e1526-e1537;
- Kumar Somyajit, Julian Spies, Fabian Coscia, Ufuk Kirik, Maj-Britt Rask, et. al.. (2021). Homology-directed repair protects the replicating genome from metabolic assaults. Developmental Cell. 56, 461-477.e7;
- Эволюция между молотом и наковальней, или Как микробиология спасла эволюцию от поглощения молекулярной биологией;
- Carolina Galan, Marina Krykbaeva, Oliver J. Rando. (2020). Early life lessons: The lasting effects of germline epigenetic information on organismal development. Molecular Metabolism. 38, 100924;
- Motomasa Ihara, Mirella L. Meyer-Ficca, N. Adrian Leu, Shilpa Rao, Fan Li, et. al.. (2014). Paternal Poly (ADP-ribose) Metabolism Modulates Retention of Inheritable Sperm Histones and Early Embryonic Gene Expression. PLoS Genet. 10, e1004317;
- Bluma J Lesch, Zuzana Tothova, Elizabeth A Morgan, Zhicong Liao, Roderick T Bronson, et. al.. (2019). Intergenerational epigenetic inheritance of cancer susceptibility in mammals. eLife. 8;
- Keith Siklenka, Serap Erkek, Maren Godmann, Romain Lambrot, Serge McGraw, et. al.. (2015). Disruption of histone methylation in developing sperm impairs offspring health transgenerationally. Science. 350;
- T. Edelstein, K. Stevens, N. Baumslag, J. Metz. (1968). FOLIC ACID AND VITAMIN B12 SUPPLEMENTATION DURING PREGNANCY IN A POPULATION SUBSISTING ON A SUBOPTIMAL DIET*. BJOG:An international journal of O&G. 75, 133-137;
- A. Milunsky. (1989). Multivitamin/folic acid supplementation in early pregnancy reduces the prevalence of neural tube defects. JAMA: The Journal of the American Medical Association. 262, 2847-2852;
- Ariane Lismer, Vanessa Dumeaux, Christine Lafleur, Romain Lambrot, Julie Brind’Amour, et. al.. (2021). Histone H3 lysine 4 trimethylation in sperm is transmitted to the embryo and associated with diet-induced phenotypes in the offspring. Developmental Cell. 56, 671-686.e6;
- Meiping Tian, Liangpo Liu, Jie Zhang, Qingyu Huang, Heqing Shen. (2019). Positive association of low-level environmental phthalate exposure with sperm motility was mediated by DNA methylation: A pilot study. Chemosphere. 220, 459-467;
- Thais de Castro Barbosa, Lars R. Ingerslev, Petter S. Alm, Soetkin Versteyhe, Julie Massart, et. al.. (2016). High-fat diet reprograms the epigenome of rat spermatozoa and transgenerationally affects metabolism of the offspring. Molecular Metabolism. 5, 184-197;
- Nicole O. McPherson, Julie A. Owens, Tod Fullston, Michelle Lane. (2015). Preconception diet or exercise intervention in obese fathers normalizes sperm microRNA profile and metabolic syndrome in female offspring. American Journal of Physiology-Endocrinology and Metabolism. 308, E805-E821;
- Upasna Sharma, Oliver J. Rando. (2017). Metabolic Inputs into the Epigenome. Cell Metabolism. 25, 544-558;
- Javad Riyahi, Behrouz Abdoli, Francesca Gelfo, Laura Petrosini, Rasoul Rezaei, Abbas Haghparast. (2021). Maternal spatial training before fertilization improves the spatial learning process in female offspring. NeuroReport. 32, 1106-1112;
- Jennifer C. Chan, Christopher P. Morgan, N. Adrian Leu, Amol Shetty, Yasmine M. Cisse, et. al.. (2020). Reproductive tract extracellular vesicles are sufficient to transmit intergenerational stress and program neurodevelopment. Nat Commun. 11;
- P. Mews, G. Egervari, R. Nativio, S. Sidoli, G. Donahue, et. al.. (2019). Alcohol metabolism contributes to brain histone acetylation. Nature. 574, 717-721;
- Irene de Diego, Annika Müller-Eigner, Shahaf Peleg. (2020). The Brain Epigenome Goes Drunk: Alcohol Consumption Alters Histone Acetylation and Transcriptome. Trends in Biochemical Sciences. 45, 93-95;
- Robert T. Williams, Rohiverth Guarecuco, Leah A. Gates, Douglas Barrows, Maria C. Passarelli, et. al.. (2020). ZBTB1 Regulates Asparagine Synthesis and Leukemia Cell Response to L-Asparaginase. Cell Metabolism. 31, 852-861.e6;
- Снова о циркадных ритмах;
- Прообраз биологических часов;
- Тик-так по-шведски. Нобелевская премия за циркадные ритмы;
- Masao Doi, Jun Hirayama, Paolo Sassone-Corsi. (2006). Circadian Regulator CLOCK Is a Histone Acetyltransferase. Cell. 125, 497-508.







