
Снова о циркадных ритмах
16 марта 2021
Снова о циркадных ритмах
- 6966
- 0
- 13
Научные данные указывают на то, что распорядок дня, согласованный с циркадными ритмами, — это важный аспект здоровой жизни.
Рисунок в полном размере.
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Современный человек окружен множеством соблазнов, мешающих ему вовремя лечь спать: полистать инстаграм, посмотреть новый эпизод любимого сериала, поработать, когда все домашние наконец-то спят, сходить в клуб (если пандемия не вносит свои коррективы). Однако сейчас уже не только бабушка, но и ученые говорят о том, что всему свое время. Мы живем на планете Земля, которая вращается и создает для всех нас циркадный ритм. Ученые крайне заинтересованы в его изучении. В исследовании циркадных ритмов живых организмов можно выделить два основных направления: 1) Механизмы клеточных часов — за их открытие уже присудили в 2017 году Нобелевскую премию. 2) Работа вестника ночи — мелатонина, в исследовании которого остается много белых пятен (об этом и поговорим подробно в этой статье).
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Клеточные часы — Нобелевская премия 2017
Хронобиология — наука, изучающая биологические ритмы, — выделяет дневные, приливные, недельные, сезонные и годовые ритмы. В этой статье мы затронем вопросы, связанные с циркадными (от лат. circa — «около, кругом» + dies — «день») ритмами. Циркадные ритмы возникли в результате ежедневных изменений освещенности, вызванных вращением Земли. Циркадные ритмы есть у цианобактерий, грибов, растений и животных. У человека можно наблюдать суточные изменения физиологических параметров: температуры тела, синтеза гормонов (например, кортизола) и ферментов, циклы сна и бодрствования [1], [2].
К середине ХХ века было накоплено уже много данных о циркадных ритмах, и поэтому темой ежегодного симпозиума по количественной биологии в Колд Спринг Харбор в 1960 году стали «Биологические часы». В следующие десятилетия случились главные события в исследовании молекулярных основ циркадных ритмов, за что в 2017 году Джеффри Холл, Майкл Росбаш и Майкл Янг были удостоены Нобелевской премии по физиологии и медицине [3].
На модели плодовой мушки ученые показали, что существуют гены, то есть физические носители информации, имеющие влияние не просто на признак (как, например, цвет человеческих глаз или окраска цветков фасоли), а на поведение целого организма — когда ложиться спать; сколько секунд петь брачную песню. Они выделили эти гены (per, tim, dbt) и научились вносить в них изменения, тем самым влияя на поведение. Им удалось распутать полный цикл реакций, которые происходят вокруг ядра и позволяют клетке вести свой собственный внутренний отсчет времени с помощью авторегуляции белковой машины.
Таким образом, на данный момент известно, что суточные ритмы организма поддерживаются работой внутренних клеточных часов. А как же факторы среды?
Факторы среды — водители ритма
Существует связка между внутренними процессами и тем, что происходит вовне, — это водители ритма, синхронизаторы (zeitgebers). Это факторы внешней среды, которые помогают внутренним часам подстраиваться под ее изменения. Наиболее важным водителем ритма является, конечно же, свет. Также к водителям ритма относятся температура, атмосферное давление; для человека важными факторами становятся пищевые привычки, физические упражнения, прием медикаментов.
При быстрой значительной смене часовых поясов (более 4 часов) у человека может возникнуть джетлаг (физиологический синдром, который проявляется в виде бессонницы, усталости, головной боли, потери аппетита и/или расстройств ЖКТ). Причиной этого является рассогласование внутренних суточных часов человека с солнечными часами в новом для него часовом поясе. Состояние джетлага продолжается до тех пор, пока внутренние часы организма не синхронизируются с местным временем благодаря внешним водителям ритма.
И тут мы переходим к следующему направлению исследования циркадных ритмов. Его масштаб — скорее уже весь организм, нежели клетка. Эта история затрагивает смену режимов сна и бодрствования, джетлаг. И важный герой тут — мелатонин.
N.B. Интересно, что в научных публикациях эти направления практически не пересекаются: в статьях про клеточные часы обычно нет упоминаний мелатонина, и наоборот, в статьях, посвященных изучению влияния мелатонина на организм/ткани/клетки, не упоминается белковая машина клеточных часов.
Из истории мелатонина
Параллельно изучению внутренних часов клетки развивались исследования работы водителей ритма. Но здесь по-прежнему остается много вопросов по механизмам этой работы. Сама по себе история открытия мелатонина замечательна:
1917 год. МакКорд и Аллен решили посмотреть, что будет если капнуть экстракт из эпифиза быков на лягушек и головастиков [4]. Удивительно, как ученым приходят в голову такие идеи? Было обнаружено, что кожа подопытных животных мгновенно осветляется. Предположили, что некое вещество, содержащееся в эпифизе быков, приводит к тому, что меланин агрегируется вокруг клеточного ядра.
Меланины — высокомолекулярные пигменты, влияющие на цвет кожи.
1958 год. А.Б. Лернер, дерматолог из Йельского университета, вместе с коллегами выделил из эпифиза быков вышеописанное вещество, изменяющее цвет кожи лягушек [5]. Они рассчитывали, что это вещество будет полезно при лечении кожных болезней. Назвали вещество «мелатонин». Слова «мелатонин» и «меланин» имеют общий греческий корень melos — черный. Дерматологические надежды Лернера и коллег на мелатонин не оправдались, но это открытие не осталось незамеченным.
1968 год. Барри Рид в Австралии изучал суточное (циркадное) изменение окраски рыбок нанностомус Бекфорда (Nannostomus anomalus Steindachner) [6]. Примечательность этой рыбки заключается в том, что на ее теле наблюдается яркая темная полоса днем, а ночью рыбка становится практически прозрачной; на теле проступают три темных овальных пятна: посередине тела, возле анального плавника и у корня хвостового плавника. Рид исследовал периодичность появления полос-пятен у нормальных и ослепленных рыбок, помещал их в условия постоянного освещения и постоянной темноты. Результаты экспериментов представлены в таблице 1. Из результатов эксперимента стало понятно, что на смену окраски скорее влияла освещенность, чем способность рыбок видеть. Изменение окраски занимало 15–30 минут.
| Рыбка | Режим освещения | Дневная полоса  |
Ночные пятна  |
|---|---|---|---|
| здоровая | обычный режим день–ночь | днем — есть, ночью — нет | днем — нет, ночью — есть |
| здоровая | постоянная ночь | появляется — исчезает по 24-часовому циклу: в настоящий день — есть, в настоящую ночь — нет | присутствуют постоянно, то есть в настоящий день происходит наложение полос на пятна  |
| здоровая | постоянный день | присутствуют постоянно | никогда не появляются |
| ослепленная | обычный режим день–ночь | смена окраски полностью соответствует режиму здоровых рыбок, неотличима ни по одному из параметров | |
| ослепленная | постоянная ночь | смена окраски соответствует режиму здоровых рыбок в обычном режиме день–ночь | |
| ослепленная | постоянный день | присутствуют постоянно | никогда не появляются |
| здоровая, и ослепленная | постоянная ночь более 1–2 недель | изменения цвета стали беспорядочными и неясными | |
Далее Рид добавлял в аквариум различные соединения с целью найти вещество, которое будет приводить к появлению ночных пятен. Среди исследуемых веществ были мелатонин, серотонин, N-ацетилсеротонин, гармин и другие. Только добавление мелатонина приводило к появлению ночных пятен и исчезновению дневной полосы. Рид предположил, что именно мелатонин отвечает за циркадное появление ночного рисунка на теле нанностомуса in vivo.
В 1975 г. Линч с соавторами, исследуя мелатонин в моче 6 здоровых добровольцев, обнаружили циркадный ритм его наработки эпифизом — концентрация мелатонина значительно отличалась у разных людей, но все они демонстрировали многократное повышение концентрации мелатонина в ночные часы по сравнению с дневными значениями [7]. Видимо, мелатонин умеет не только изменять пятнышки на теле рыбки: циклы концентрации мелатонина оказались универсальны для всех известных животных, растений и грибов. Возникает вопрос: а что делает мелатонин и зачем повышается его концентрация в организме?
Как мелатонин стал вестником ночи
Мелатонин — это очень древняя молекула. Ученые предполагают, что изначальная функция мелатонина в цианобактериях и альфа-протеобактериях заключалась в том, чтобы нейтрализовать активные формы кислорода, которые образовывались в этих одноклеточных в результате их жизнедеятельности. Существует гипотеза, что ранние прокариоты поглотили цианобактерии и альфа-протеобактерии, и в результате последовавшего симбиоза превратились в хлоропласты и митохондрии, соответственно — так мелатонин проник в клетки эукариот [8–10]. У простейших одноклеточных активные формы кислорода активнее вырабатывались в дневное время. Поэтому простейшим бактериям, вероятно, днем требовалось больше мелатонина, а ночью — меньше; так возник суточный ритм мелатонина. При переходе к многоклеточности, когда большинство клеток организма оказывалось буквально погружено внутрь тела и не видело света, потребовалось сообщать всем клеткам внутри организма информацию о том, что происходит снаружи: день или ночь. И многоклеточные организмы приняли цикл мелатонина в качестве сигнальной системы для этой цели.
Свет является главным водителем ритма, влияющим на циркадные ритмы в организме. Вот как система светового оповещения работает у млекопитающих, в том числе у человека. Свет попадает на сетчатку глаза. Кроме всем известных со школы колбочек и палочек, в сетчатке есть ганглиозные клетки, содержащие пигмент меланописин [11]. Сигналы с этих клеток поступают в супрахиазматическое ядро (СХЯ) по зрительному нерву. СХЯ — это главный генератор циркадных ритмов у млекопитающих, расположенный в передней области гипоталамуса. СХЯ передает сигнал в эпифиз (шишковидное тело), где регулируется выработка мелатонина. Есть только одно большое «но»: у млекопитающих (и дневных, и ночных) синтез мелатонина скорее обратно пропорционален освещенности (много мелатонина вырабатывается ночью, а не днем), в отличие от древних одноклеточных, которых мелатонин защищал от свободных радикалов [12]. Связано это с тем, что в темное время суток СХЯ посылает сигнал, который активирует ключевой фермент синтеза мелатонина — арилалкиламин-N-ацетилтрансферазу (AANAT) в шишковидном теле. Фермент начинает энергично синтезировать мелатонин, осуществляя первую реакцию ацетилирования. В качестве субстрата AANAT использует другой индол со знакомым многим названием — серотонин (рис. 1). Таким образом, в шишковидном теле наблюдаются колебания двух индолов: днем в эпифизе много серотонина, а с наступлением ночи и включением фермента AANAT этот серотонин превращается в мелатонин и выделяется в кровь [13], [14].

Рисунок 1. Схема синтеза мелатонина из серотонина в клетках эпифиза.
адаптировано по материалам сайта Medi.ru
Соответственно, длительное чрезмерное освещение приводит к сильно сниженному уровню мелатонина, что неблагоприятно сказывается на состоянии организма. Поэтому физиологи рекомендуют спать ночью, приглушать свет, выключать мониторы/телефоны/гаджеты за час до сна, а утром выходить на яркий солнечный свет.
Рецепторы мелатонина и его рецепторонезависимые эффекты
Что известно о молекулярных механизмах действия мелатонина в организме? По крайней мере часть работы мелатонина осуществляется через его специфические рецепторы. В настоящий момент клонированы три рецептора мелатонина. Эти рецепторы относятся к семейству сопряженных с G-белком рецепторов (G-protein-coupled receptors, GPCRs), функция которых заключается в активировании внутриклеточных путей передачи сигнала. У млекопитающих обнаружены два трансмембранных рецептора — МТ1 и МТ2 (рис. 2) — их кристаллическая структура была опубликована в 2019 году в журнале Nature [15], [16].
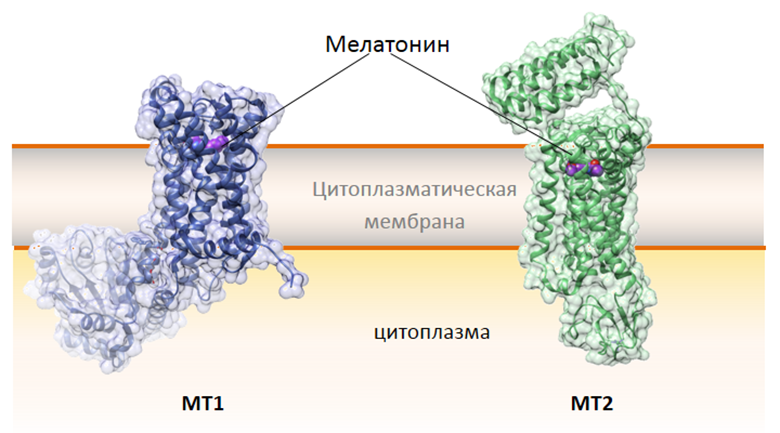
Рисунок 2. Структура рецепторов мелатонина MT1 (синий) ) и MT2 (зеленый). Вторичная структура белков (альфа-спирали, бета-слои и петли) выделена более насыщенным цветом. Рецепторы погружены в цитоплазматическую мембрану. Мелатонин (фиолетовый) связывается с рецепторами, что приводит к передаче сигнала в клетку. Рисунок получен на основе структур 6me2 (MT1) и 6me7 (MT2) в программе UCSF Chimera.
МТ1 обнаружены в гипофизе, сетчатке, СХЯ, а чаще всего встречаются на коже человека. МТ1 модулируют активность нейронов, сужение артериальных сосудов, пролиферацию раковых клеток, репродуктивную и метаболическую функции [17], [18]. МТ2 экспрессируются в сетчатке и эпителии. Показано, что активация МТ2 ассоциирована с несколькими функциями в организме: с ингибированием высвобождения дофамина в сетчатке, с индукцией релаксации гладкой мускулатуры в стенках кровеносных сосудов, с усилением иммунного ответа. Что касается циркадных ритмов, то тут роль МТ2 заключается в сдвиге фазы циркадных ритмов возбуждения нейронов в СХЯ [17], [18]. У амфибий и птиц найден третий рецептор — МТ3, который у млекопитающих пока не обнаружен [19]. Плюс, что примечательно, существуют ядерные рецепторы мелатонина: они принадлежат к ROR/RZR подсемействам; посредством ядерных рецепторов мелатонин может влиять на иммунную и центральную нервную системы [20].
Кроме влияния на процессы в клетке через трансмембранные рецепторы, мелатонин обладает способностью проникать внутрь самой клетки. Происходит это благодаря химической природе вещества, которая позволяет проходить и через гематоэнцефалический барьер, и через мембрану клетки. Такой путь проникновения и работы мелатонина в литературе обобщается под размытым понятием «рецептор-независимые эффекты мелатонина» [21]. Как раз с этими эффектами связывают многочисленные воздействия мелатонина на физиологические процессы: на кровяное давление, на иммунную систему, противоопухолевую защиту и т.д. Из молекулярных механизмов рецептор-независимых эффектов мелатонина известно, что в цитозоле мелатонин взаимодействует с определенными редуктазами, например, с хинон-редуктазой-2. Показано, что этот фермент обеспечивает антиоксидантное воздействие [22]. Другой обнаруженный партнер для связывания мелатонина — кальмодулин. Этот небольшой, высококонсервативный кальций-связывающий белок играет ключевую роль в управлении метаболизмом клетки. Поскольку структуры мелатонина и кальмодулина филогенетически консервативны, взаимодействие кальмодулин—мелатонин, вероятно, представляет собой важный механизм регуляции и синхронизации физиологии клетки [23].
Подведем итоги
Наступила ночь, и вот в эпифизе образовался гормональный сигнал времени — мелатонин. Попробуем ответить на поставленный выше вопрос: а что делает мелатонин и зачем повышается его концентрация в организме?
Первое. Для мелатонина показана способность поддерживать и корректировать внутриклеточные циркадные ритмы: доказана эффективность приема мелатонина в уменьшении и сокращении джетлага [24]. При сбое ритма мелатонин помогает привести внутренние часы в соответствие солнечным часам. Как он это делает? Видимо, влияя на СХЯ и осуществляя обратную связь. Для механизма этой обратной связи показано, что прием мелатонина днем вызывает активацию СХЯ [25]. Значительную роль в этой активации, по-видимому, играют рецепторы мелатонина, MT1 и MT2, которые находятся на мембране клеток СХЯ. Так что тут мы видим, что мелатонин действительно является активным участником циркадных ритмов.
Второе. С наступлением ночи мелатонин, кроме переключения фазы циркадных ритмов в нервной системе, выделяется в кровь и разносится по всему организму. Мы знаем, что молекула теоретически способна проникнуть в любую клетку организма и провести там некую работу. И все эти влияния мелатонина не только убирают усталость и обеспечивают качественный сон, но и участвуют в защите от злокачественных новообразований [26]. И наоборот, сбой ритмов, видимо, провоцирует развитие онкологических и нейродегенеративных заболеваний [27], [28]. К сожалению, молекулярные механизмы этих эффектов мелатонина и циркадных ритмов в целом изучены гораздо слабее.
Одно можно сказать точно: циркадные ритмы, их водители (в том числе мелатонин) и физиологические проявления (например, сон и отдых), видимо, гораздо сильнее связаны с благополучной работой нашего тела, чем мы привыкли думать. Есть над чем поразмыслить современному человеку, пренебрегающему здоровым сном и жертвующему ночными часами ради работы или просмотра фильмов.
Литература
- Miguel Debono, Cyrus Ghobadi, Amin Rostami-Hodjegan, Hiep Huatan, Michael J. Campbell, et. al.. (2009). Modified-Release Hydrocortisone to Provide Circadian Cortisol Profiles. The Journal of Clinical Endocrinology & Metabolism. 94, 1548-1554;
- Найдена связь между обменом веществ и циркадным ритмом;
- Тик-так по-шведски. Нобелевская премия за циркадные ритмы;
- Carey Pratt McCord, Floyd P. Allen. (1917). Evidences associating pineal gland function with alterations in pigmentation. J. Exp. Zool.. 23, 207-224;
- Aaron B. Lerner, James D. Case, Yoshiyata Takahashi, Teh H. Lee, Wataru Mori. (1958). ISOLATION OF MELATONIN, THE PINEAL GLAND FACTOR THAT LIGHTENS MELANOCYTES1. J. Am. Chem. Soc.. 80, 2587-2587;
- C. Cajochen, K. Kräuchi, A. Wirz-Justice. (2003). Role of Melatonin in the Regulation of Human Circadian Rhythms and Sleep. Journal of Neuroendocrinology. 15, 432-437;
- H. Lynch, R. Wurtman, M. Moskowitz, M. Archer, M. Ho. (1975). Daily rhythm in human urinary melatonin. Science. 187, 169-171;
- Dun-Xian Tan, Lucien C. Manchester, Xiaoyan Liu, Sergio A. Rosales-Corral, Dario Acuna-Castroviejo, Russel J. Reiter. (2013). Mitochondria and chloroplasts as the original sites of melatonin synthesis: a hypothesis related to melatonin's primary function and evolution in eukaryotes. J. Pineal Res.. 54, 127-138;
- Russel J. Reiter, Sergio Rosales-Corral, Dun Xian Tan, Mei Jie Jou, Annia Galano, Bing Xu. (2017). Melatonin as a mitochondria-targeted antioxidant: one of evolution’s best ideas. Cell. Mol. Life Sci.. 74, 3863-3881;
- Burkhard Poeggeler, Russel J. Reiter, Dun-Xian Tan, Li-Dun Chen, Lucien C. Manchester. (1993). Melatonin, hydroxyl radical-mediated oxidative damage, and aging: A hypothesis. J Pineal Res. 14, 151-168;
- Maria Bonmati-Carrion, Raquel Arguelles-Prieto, Maria Martinez-Madrid, Russel Reiter, Ruediger Hardeland, et. al.. (2014). Protecting the Melatonin Rhythm through Circadian Healthy Light Exposure. IJMS. 15, 23448-23500;
- Amnon Brzezinski. (1997). Melatonin in Humans. N Engl J Med. 336, 186-195;
- Surajit Ganguly, Steven L. Coon, David C. Klein. (2002). Control of melatonin synthesis in the mammalian pineal gland: the critical role of serotonin acetylation. Cell Tissue Res. 309, 127-137;
- George C. Brainard, Mark D. Rollag, John P. Hanifin. (1997). Photic Regulation of Melatonin in Humans: Ocular and Neural Signal Transduction. J Biol Rhythms. 12, 537-546;
- Benjamin Stauch, Linda C. Johansson, John D. McCorvy, Nilkanth Patel, Gye Won Han, et. al.. (2019). Structural basis of ligand recognition at the human MT1 melatonin receptor. Nature. 569, 284-288;
- Linda C. Johansson, Benjamin Stauch, John D. McCorvy, Gye Won Han, Nilkanth Patel, et. al.. (2019). XFEL structures of the human MT2 melatonin receptor reveal the basis of subtype selectivity. Nature. 569, 289-292;
- Margarita L. Dubocovich, Magdalena Markowska. (2005). Functional MT1 and MT2 Melatonin Receptors in Mammals. ENDO. 27, 101-110;
- Margarita L. Dubocovich. (2007). Melatonin receptors: Role on sleep and circadian rhythm regulation. Sleep Medicine. 8, 34-42;
- Mucahit Emet, Halil Ozcan, Lutfu Ozel, Muhammed Yayla, Zekai Halici, Ahmet Hacimuftuoglu. (2016). A Review of Melatonin, Its Receptors and Drugs. Eurasian J Med. 48, 135-141;
- A. N. Smirnov. (2001). Nuclear melatonin receptors Biochemistry (Moscow). 66, 19-26;
- Russel J. Reiter, Dun Xian Tan, Annia Galano. (2014). Melatonin: Exceeding Expectations. Physiology. 29, 325-333;
- Dun-Xian Tan, Lucien C. Manchester, M. Pilar Terron, Luis J. Flores, Hiroshi Tamura, Russel J. Reiter. (2007). Melatonin as a naturally occurring co-substrate of quinone reductase-2, the putative MT3melatonin membrane receptor: hypothesis and significance. J Pineal Res. 43, 317-320;
- G. Benítez-King, F. Antón-Tay. (1993). Calmodulin mediates melatonin cytoskeletal effects. Experientia. 49, 635-641;
- Andrew Herxheimer, Keith J Petrie. (2002). Melatonin for the prevention and treatment of jet lag. Cochrane Database of Systematic Reviews;
- Nava Zisapel. (2018). New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation. British Journal of Pharmacology. 175, 3190-3199;
- Lawrence Tamarkin, Osborne F. X. Almeida, David N. Danforth. (2008). Melatonin and Malignant Disease. Ciba Foundation Symposium 117 - Photoperiodism, Melatonin and the Pineal. 284-310;
- Einas Yousef, Noha Mitwally, Noha Noufal, Muhammad Ramzan Tahir. (2020). Shift work and risk of skin cancer: A systematic review and meta-analysis. Sci Rep. 10;
- Lani R. Wegrzyn, Rulla M. Tamimi, Bernard A. Rosner, Susan B. Brown, Richard G. Stevens, et. al.. (2017). Rotating Night-Shift Work and the Risk of Breast Cancer in the Nurses' Health Studies. American Journal of Epidemiology. 186, 532-540.







