Лаборатория структурного анализа и инжиниринга мембранных систем МФТИ: в любой непонятной ситуации — моделируй!
27 декабря 2019
Лаборатория структурного анализа и инжиниринга мембранных систем МФТИ: в любой непонятной ситуации — моделируй!
- 1458
- 1
- 6
Если бы рост структурных биологов был сравним с толщиной липидного бислоя и равнялся приблизительно 5 нм, они бы моделировали АТФ-синтазу как-то так!
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Темы
Несколько лет назад мы опубликовали спецпроект, рассказывающий о биологических исследованиях в Физтехе. Пришло время продолжить его: в этой статье мы расскажем о лаборатории структурного анализа и инжиниринга мембранных систем, основанной в 2016 году; о том, чем занимаются структурные биологи и как устроена их лабораторная жизнь; о биологических мембранах и мембранных белках; об оптогенетике, белковом дизайне, кристаллографии, молекулярной динамике... И это еще не всё!
Биология в Московском физтехе
XXI век называют «веком живых систем», изучение которых возможно только на стыке наук — математики, физики, химии и биологии. «Биомолекула» представляет серию материалов о том, как занимаются биологией в Московском физико-техническом институте (МФТИ).
Структурная биология — наука интересная и невероятно сложная. В ней пригодятся знание и физики, и биологии, и химии, и математического моделирования, и программирования. Специалистов, сильных сразу во всех этих науках, мало, поэтому для структурного биолога очень важно уметь работать в команде, сотрудничать с другими исследователями, обсуждать результаты, быть активным и продуктивным. В награду за труды исследователь сможет увидеть, как танцует сенсорный белок, заглянуть в ротор АТФ-синтазы, проверить за неделю тысячи разных белков и выбрать самый лучший из них — и многое, многое другое. Мы привели эти примеры не просто так: все эти задачи были решены сотрудниками лаборатории структурного анализа и инжиниринга мембранных систем. Звучит впечатляюще, не так ли?
Мы поговорили с ее заведующим Иваном Гущиным (рис. 1) и выяснили подробности новых работ и лабораторной жизни. Забегая вперед, отметим: одна из сильных сторон этой лаборатории — открытость к совместной работе и хорошие контакты с другими научными центрами.

Рисунок 1. Иван Гущин, заведующий лабораторией структурного анализа и инжиниринга мембранных систем в МФТИ
Евгений Пелевин, фотограф пресс-службы МФТИ
Другая особенность — опыт, который получили старшие научные сотрудники лаборатории. Наверное, каждый студент, планирующий заниматься наукой, сталкивается с выбором: уезжать ли в аспирантуру в другую страну или остаться на родине, в России. Некоторые отказываются от возможности зарубежной стажировки, объясняя это тем, что карьеру нужно строить там, где собираешься жить. Но пример Ивана Гущина говорит об обратном. По его словам, в России сейчас происходит переход от советской к западной системе науки: в советской системе человек мог прийти в институт и проработать там всю жизнь. На Западе, особенно в начале научной карьеры, ученый должен сменить несколько мест работы. Это помогает исследователю расширить свой кругозор и спектр навыков. Итак, давайте познакомимся поближе.
Знакомство
Как мы сказали уже несколько раз, Иван Гущин — заведующий лабораторией. Он учился в Физтехе, занимался научной работой в лаборатории Валентина Ивановича Горделия, с которым активно сотрудничает и сейчас. Валентин Иванович — биофизик, профессор Университета Аахена (Германия), руководил лабораторией мембранных исследований в Исследовательском центре Юлиха (Германия). В 2015 году он помог создать в МФТИ Центр изучения молекулярных механизмов старения и возрастных заболеваний (о нем мы уже писали в статье «Лаборатория перспективных исследований мембранных белков: от гена к ангстрему» [1]).
После окончания Физтеха Иван Гущин отправился в аспирантуру в Гренобль (Франция), в Институт структурной биологии. Это замечательное место: синхротрон для структурных исследований находится в сотне метров от лаборатории, что очень удобно для экспериментаторов.
После Гренобля Иван занимал позицию постдока в упомянутом Исследовательском центре Юлиха и после снова вернулся в Физтех — думал, чем заниматься. Примерно в то же время был объявлен конкурс на создание молодежных лабораторий в Физтехе, в котором Иван поучаствовал и выиграл. Так в МФТИ была образована лаборатория структурного анализа и инжиниринга мембранных систем, ставшая частью Центра исследований молекулярных механизмов старения и возрастных заболеваний. Это было начало 2016 года.
Сейчас в лаборатории работает 12 человек — шесть «сухих» и шесть «мокрых» биологов. Для непосвященных разъясним: «сухими» называют тех биологов, которые занимаются проведением экспериментов на компьютере. И шутливое название «сухие» пошло именно от того, что такие исследователи не соприкасаются с реактивами, многие из которых жидкие и мокрые. «Мокрыми» же называют всех остальных биологов. Они вооружены пипетками, пробирками, плашками, чашками Петри и прочим добром (на рис. 2 можно видеть, как Настя Смоленцева и Вера Назаренко из лаборатории Ивана Гущина практикуют «мокрую» биологию).
Подробнее о методах «сухой» биологии можно узнать из нашего спецпроекта «12 методов в картинках» [2].

Рисунок 2. Настя Смоленцева (на переднем плане), студентка лаборатории, и аспирантка Вера Назаренко. Очень часто подготовка биологического образца и эксперименты с ним разнесены во времени. Чтобы образец не испортился, его хранят в холодильнике или морозильнике. Если образец просто положить в морозильник, то он будет замерзать медленно, и с большой вероятностью повредится: белок выпадет в осадок, клетки умрут. Поэтому замораживают обычно образцы в жидком азоте. Чтобы потом не замораживать еще раз, обычно делят образец на несколько частей и пользуются ими по мере надобности. Соответственно, Вера готовит аликвоты (части) образца, а Настя замораживает их в жидком азоте.
Евгений Пелевин, фотограф пресс-службы МФТИ
Сотрудников, обладающих ученой степенью, помимо Ивана Гущина в лаборатории двое: это Алина Ремеева и Павел Буслаев (рис. 3). Павел был студентом Физтеха и занимался научной работой под удаленным руководством Ивана, пока тот был в Гренобле. Ну а потом, когда Иван уже вернулся в Россию, ученые начали гораздо активнее работать вместе.

Рисунок 3. Иван Гущин и Павел Буслаев
Евгений Пелевин, фотограф пресс-службы МФТИ
История Алины чуть сложнее. Она училась в аспирантуре в Гренобле, в лаборатории Валентина Горделия, затем была на позиции постдока в Бельгии, а после — какое-то время в декрете. Вернувшись к работе, Алина переехала в Долгопрудный и пришла работать в лабораторию вместе с Иваном и Павлом. Алина и Иван к тому моменту были знакомы уже девять лет и работали вместе, но числились в разных дружественных лабораториях.
Побеждает дружба
Наука необъятна, и особенно необъятна биология. Только в какой-нибудь простенькой бактерии — кишечной палочке — находится около 5000 разных белков. Даже если мы изучим 10 белков, всё равно не поймем эту бактерию. Более того, каждый из этих 5000 белков может взаимодействовать с другим из этих 5000. Так получается почти 12,5 миллионов возможных взаимодействий! А если мы возьмемся за человека? Мало того, что он сам состоит из огромного количества клеток, так еще внутри него живут миллионы бактерий. Как всё это изучить?
Здесь на помощь приходит дружба взаимовыгодное сотрудничество. Внутри лаборатории — это сотрудничество между «сухими» и «мокрыми» биологами. На более высоком уровне оно возникает, когда возможности лабораторий дополняют друг друга. Например, одни исследователи могут измерить оптические свойства белка, а другие — определить его структуру.
Всё это верно и для лаборатории Ивана Гущина. Аспиранты и старшие сотрудники регулярно ездят в заграничные командировки и на стажировки — в частности, активно сотрудничают с учеными из Института структурной биологии в Гренобле, Исследовательского центра Юлиха и Рейнско-Вестфальского технического университета Ахена. Но иногда и ехать никуда не надо. Лаборатории Центра исследований молекулярных механизмов старения и возрастных заболеваний сильно интегрированы друг в друга: у них общее офисное пространство и общее оборудование. Студенты часто делают межлабораторные проекты или же переключаются — один проект здесь, другой там. Например, скоро будет опубликована работа, основной вклад в которую был сделан сотрудниками лаборатории В.И. Горделия, а Иван Гущин помог с кристаллографической частью и структурным анализом. В статье идет речь о семействе гелиородопсинов, обнаруженных недавно учеными из Израиля и Японии.
Построить дерево, вырастить бактерии, найти гомологи
В биологии почти всегда первые идеи появляются на основе экспериментов. Часто после этого применяют вычислительные методы: либо в экспериментах сгенерировано настолько большое количество данных, что в анализе не обойтись без компьютера, либо сформулированные гипотезы можно хотя бы грубо проверить при помощи моделирования. Однако после того как данные проанализированы и моделирование проведено, снова требуется экспериментальная проверка, потому что биологические системы настолько сложны, что обычно ни одно моделирование не оказывается на 100% верным.
Задачи лаборатории чрезвычайно разные и калейдоскопичные — выбирай любую! Можно изучать мембранные белки (например, попытаться заглянуть внутрь ротора АТФ-синтазы [3]) и сенсорные системы бактерий. Можно изучать липиды, из которых сделаны мембраны клеток, — и моделировать их методом молекулярной динамики. Можно искать новые интересные белки с помощью биоинформатических методов — например, легкую и устойчивую белковую метку, которая пригодится в экспериментах по флуоресцентной микроскопии и оптогенетике.

Рисунок 4. Сотрудники лаборатории структурного анализа и инжиниринга мембранных систем
Евгений Пелевин, фотограф пресс-службы МФТИ
Практически над каждой задачей «сухие» и «мокрые» биологи работают в тандеме (рис. 4), дополняя друг друга и стремясь к тому, чтобы теория сошлась с экспериментом. Чем же конкретно они занимаются?
Экспериментальная часть работы начинается с того, чтобы вырастить большое количество бактерий, производящих нужный белок, очистить его и рассмотреть со всех сторон.
Генетическая инженерия помогает решить самую первую задачу: наработать нужное количество белка для всех последующих экспериментов. В этот метод входят выделение необходимых генов, внесение мутаций и введение генов исследуемых белков в бактерии, которые будут вырабатывать этот белок [4]. Этот процесс называется экспрессией.
Методом хроматографии очищают белки, находящиеся в растворе, от посторонних примесей и агрегатов [5].
Оптическая поглощающая и флуоресцентная спектроскопии — методы оценки оптических свойств изучаемых белков [6]. Их используют для окрашенных или флуоресцентных белков, определяя, как различные мутации и компоненты системы способны повлиять на спектр.
Методы структурной биологии используются для восстановления трехмерной структуры белка [7]. Рентгеноструктурный анализ позволяет определить ее по картине дифракции рентгеновских лучей на белковых кристаллах. Этот метод активно применяется как для водорастворимых, так и для мембранных белков. По рассеянию рентгеновского излучения в растворе белка определяется размер и форма молекул. Недавно команда лаборатории начала осваивать метод криоэлектронной микроскопии. Он подходит для изучения трехмерной структуры больших белков и комплексов, а также молекул с большими неупорядоченными участками — в общем, в тех случаях, где получить кристаллы технически нельзя.
Методы секвенирования и получения последовательностей ДНК различных организмов развились так хорошо, что очень часто ученые не знают, какие именно организмы секвенируют. Они берут природный образец (например, воду из океана или почву), где живут неизвестные микроорганизмы, и выясняют, какие там есть гены.
Эти данные копятся с огромной скоростью — быстрее, чем исследователи успевают их анализировать. Поэтому сейчас в геномных базах данных скрыто огромное богатство, но, чтобы его открыть, нужны люди, которые смогут разглядеть в этом море информации новые интересные гены, белки и биосинтетические пути. Чтобы потом экспериментаторы могли охарактеризовать эти находки и сделать что-то полезное.
В компьютерной части [2] работы лаборатории Гущина есть два больших подраздела: геномная биоинформатика и структурная биоинформатика. Геномная биоинформатика занимается поиском новых генов, анализом бактериальных геномов и семейств белков, построением филогенетических деревьев и моделей эволюции этих белков. А для структурной биологии пригодятся методы молекулярного моделирования и докинга [8].
Выравнивание последовательностей позволяет найти гомологи и построить филогенетические деревья [2].
Моделирование методом молекулярной динамики используются для того, чтобы охарактеризовать движение молекулярных систем [9].
Есть и другие методы, к которым прибегают «сухие» биологи лаборатории, но основные — те, что мы перечислили. Подробнее о каждом из методов можно прочитать в нашем спецпроекте «12 методов в картинках».
Самый стабильный, самый эффективный, самый-самый!
Объясняя, чем же все-таки занимаются исследователи в лаборатории, Иван приводит в пример поиск ферментов для производства современных стиральных порошков. Описанная ситуация далека от реальной деятельности лаборатории, но наглядно иллюстрирует взаимоотношения «сухих» и «мокрых» биологов, работающих над одной задачей.
Большинство стиральных порошков содержат ферменты липазы, которые разрушают жиры и липиды. Производители таких порошков хотят, чтобы эти ферменты работали как можно быстрее — ведь они дорогие, и чем меньше нужно фермента на килограмм порошка, тем он дешевле. Также важна температура, при которой работает порошок. Все мы знаем, что шелковые, шерстяные и хлопковые ткани нужно стирать при разной температуре. Поэтому и ферменты должны уметь работать и в холодной воде, и в теплой, и в горячей.
Обычно история начинается так: кто-то изучал какую-нибудь бактерию и нашел в ней фермент, способный разрушать липиды — скажем, он отделяет полярную голову от гидрофобного хвоста. Казалось бы, отличная находка — возьми и сделай стиральный порошок! Но вдруг выясняется, что для того, чтобы этот фермент хорошо работал в стиральном порошке, на 1 кг порошка нужно добавить 1 кг фермента. И этот 1 кг фермента стоит 10 миллионов долларов! Конечно, такой порошок никто не купит.
Тогда за дело берутся биоинформатики. И вопрос, который они ставят, звучит так: «А вдруг в природе уже есть более эффективный фермент, просто у другой бактерии?» Зная последовательность известного фермента, биоинформатик запускает поиск по базам данных (подробнее о базах данных можно прочитать в статье нашего спецпроекта «12 методов», посвященной «сухой» биологии [2]) и в результате получает список из тысячи похожих генов.
Здесь биоинформатик мог бы остановиться и отдать эту тысячу генов экспериментаторам, чтобы они вручную проверили каждый фермент и сказали, какие из них разрушают липиды эффективнее всего. Но экспериментальная биологическая работа очень дорогая и длительная. Операция по клонированию простого гена может занимать неделю (а то и не одну). А мы хотим проверить тысячу! Это слишком долго и дорого.
Поэтому биоинформатик не останавливается и идет дальше. Теперь он должен выбрать разумное количество кандидатов из этой тысячи — например, десять. Он делает кластеризацию и разделяет эти гены на группы по похожести. И тут получается, что, хотя генов нашлась целая тысяча, среди них можно выделить всего несколько групп — скажем, шесть. Теперь можно проверить по одному белку из каждой группы, чтобы увидеть их основные свойства. И вот теперь биоинформатик отдает эти шесть белков экспериментатору.
Наконец, экспериментатор должен синтезировать ДНК, вставить каждый ген в бактерию и проверить, как он будет работать. И в результате выбрать наилучший.
What is LOV? Baby don’t hurt me!
Другой интересный пример, который привел Иван, гораздо дальше от стирального порошка, но зато ближе к деятельности лаборатории. Хотя что значит «гораздо ближе»? Это и есть их работа, опубликованная в июле 2019 года в журнале Photochemical & Photobiological Sciences [10]. Речь в ней идет о флуоресцентных белках.
Метод флуоресценции основан на том, что некоторые вещества (в том числе, белки), поглощая свет одной длины волны, тут же излучают более длинноволновый свет. За ними очень удобно наблюдать: можно просто посмотреть во флуоресцентный микроскоп, увидеть, где находится белок, и оценить его количество. Если нужный нам белок сам по себе не флуоресцирует, к нему можно генетически присоединить флуоресцентный белок-метку, который будет всю дорогу светить нам, как фонарик.
Походники поймут: на разные случаи жизни нужны разные фонарики. Байдарочникам — водонепроницаемый, альпинистам — легкий, а тем, кто ходит в долгие походы, — такой фонарик, который держит заряд как можно дольше.
Точно так же флуоресцентные белки нужны на все случаи жизни [11]. Например, знаменитый зеленый флуоресцентный белок (GFP) [12] и GFP-подобные белки довольно громоздкие (представьте себе походный фонарик весом 5 кг!), распадаются под действием тепла и, самое главное, не работают в анаэробных условиях (то есть в условиях, когда кислорода в среде нет).
К счастью, есть другой класс белков, реагирующих на ультрафиолетовое и синее освещение, основанных на так называемых LOV-доменах. LOV — это аббревиатура, которая означает, что эти белки чувствуют свет, кислород и напряжение: light, oxygen, voltage. Функции этих белков очень многогранны: они регулируют циркадные ритмы [13] и экспрессию генов [14].
Впервые белки с LOV-доменами были обнаружены в конце 1990-х как регуляторы фототропизма растений (способности поворачиваться к свету) [15], [16]. Позднее оказалось, что белки, вооруженные этими доменами, есть и у бактерий, грибов и архей [17]. Примечательно, что с LOV связаны и другие домены, например, киназы, фосфодиэстеразы, цинковые пальцы. Так они регулируются с помощью голубого света, одного из мощнейших внешних стимулов.
Голубой свет запускает фотохимический процесс формирования ковалентной связи между флавинмононуклеотидом и цистеиновым остатком, в результате чего LOV-домен теряет способность флуоресцировать [18]. Эта связь потом рвется при комнатной температуре в течение иногда нескольких секунд, а иногда нескольких часов, и цикл возобновляется (рис. 5).

Рисунок 5. Как работает LOV-домен. Голубой свет запускает фотохимический процесс формирования ковалентной связи между флавинмононуклеотидом и цистеиновым остатком, в результате чего LOV-домен теряет способность флуоресцировать. Эта связь потом рвется при комнатной температуре в течение иногда нескольких секунд, а иногда нескольких часов, и цикл возобновляется. Условные обозначения: FMN — флавинмононуклеотид; Cys — цистеин; FMN-Cys adduct — продукт прямого присоединения (аддукт).
Для экспериментов нужно, чтобы белковый «фонарик» мог светиться долго. Может быть, если убрать аминокислоты, которые образуют эту ковалентную связь, белок будет лучше флуоресцировать [19]? Идея сработала, но новые белки всё еще были недостаточно хороши, чтобы их можно было рутинно применять в микроскопических исследованиях.
Эти белки интересны сами по себе, потому что задействованы в жизнедеятельности многих бактерий и грибов, отвечают за циркадные ритмы у растений [20]. Также они нашли важное практическое применение: модифицированные LOV-домены могут использоваться как особые флуоресцентные белки, так называемые flavin-binding fluorescent proteins. Они не требуют кислорода для корректной сборки и флуоресценции, начинают флуоресцировать сразу после фолдинга и имеют относительно небольшой размер, таким образом являясь многообещающей альтернативой флуоресцентным белкам GFP и их аналогам. Многие из наших проектов направлены на поиск и разработку новых флуоресцентных белков семейства LOV с улучшенными свойствами.
Следующая итерация заключалась в геномном поиске — подобном тому, что был описан в примере со стиральными порошками. Биоинформатики начали искать LOV-домены во всех известных геномах. В результате опубликовали теоретическое исследование, результат которого можно сформулировать одной строкой: «В базах данных найдено 6700 LOV-доменов» [21]. Вклад сотрудников лаборатории Ивана Гущина был такой: они посмотрели, в каких организмах найдены эти 6700 белков. Что же они искали? Самый стабильный белок.
Стабильный белок — понятие размытое. Стабильность очень многогранна. Белок может быть термостабильный, то есть его можно нагревать и он не разрушается. Белок можно концентрировать, и он не выпадает в осадок даже при очень высоких концентрациях. Белок можно долго освещать, и он не выцветает. Для флуоресцентного белка важно, чтобы на него можно было долго смотреть в микроскоп, то есть чтобы он не выгорал от освещения, которое задает картинку в микроскопе.
Самое простое, что биоинформатики могут посмотреть, — это термостабильность (рис. 6).

Рисунок 6. Выравнивание последовательности LOV-белков различных термофильных организмов
У нас есть список из 6700 генов, и мы знаем организмы, из которых эти гены. У нас также есть другая база данных, в которой записана информация о том, какой организм где живет. Из этих 6700 генов мы ищем гены, которые принадлежат теплолюбивым организмам. Ведь если какая-то бактерия живет в горячем источнике при температуре 60 градусов, то, наверное, и она, и каждый белок внутри нее чувствует себя хорошо. Иначе как она сможет там жить?
Таких организмов оказалось около 20 — соответственно, мы должны были проверить в эксперименте 20 найденных белков. Но нам повезло: мы проверили два, и один из них оказался особенно хорош. Мы написали об этом статью.
Найденный белок оказался миниатюрным и термостабильным — разрушается только при 68 °C (бактерия Chloroflexus aggregans, в которой его нашли, живет при температуре 60 °C в горячих источниках Японии [22]). Как и все остальные LOV-белки, этот белок умеет светиться в бескислородных условиях (рис. 7).

Рисунок 7. Символ МФТИ, написанный Escherichia coli с флуоресцентным белком из Chloroflexus aggregans
Eще этот белок замечательно кристаллизуется, а это значит, что исследователи могут сделать эксперимент по рентгеновской дифракции и определить его атомарную структуру (рис. 8). «Когда мы знаем его структуру, можем попытаться заняться рациональным дизайном, то есть попробовать внести в его структуру мутации, которые сделают его еще лучше, — добавила Алина Ремеева . — “Лучше” в данном случае — то, что в условиях эксперимента работает эффективнее первоначального белка» [10], [23].
На проведение этой работы Алина Ремеева получила грант РНФ 18-74-00092 «Разработка улучшенных генетически кодируемых флуоресцентных меток на основе LOV-доменов».
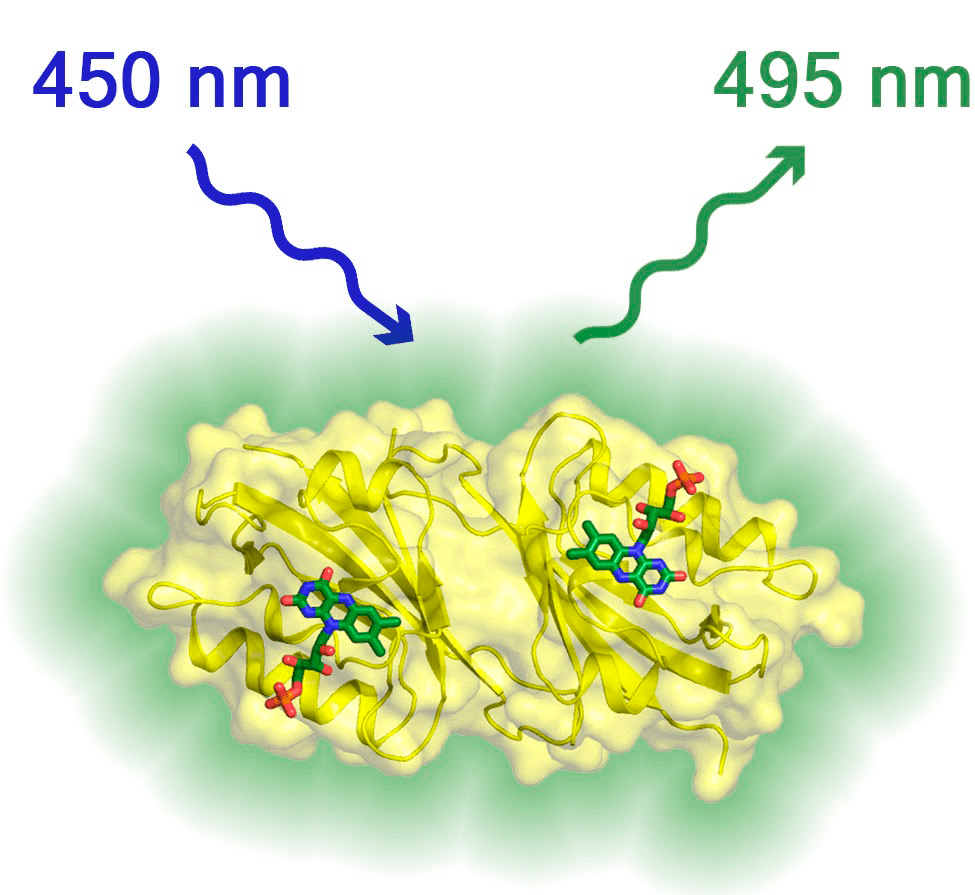
Рисунок 8. Трехмерная структура флуоресцентного белка Chloroflexus aggregans
Найденный белок — это не только ценная флуоресцентная метка, но и новые возможности в экспериментах по оптогенетике, пояснил Иван Гущин: «Ранее, в других лабораториях, их успешно использовали в экспериментах по оптогенетике — для управляемого запуска процесса апоптоза модельных клеток HEK293 или нейронов дрозофилы in vivo [24]; для управляемой экспрессии флуоресцентного белка в рыбке Danio rerio [25]; для контроля малой ГТФазы Rac1 с целью индукции клеточной подвижности в человеческих клетках HeLa [26], [27]. Поскольку у нас есть большой опыт в создании оптогенетических инструментов на базе микробных родопсинов [28], мы также рассчитываем, что сможем сделать интересную работу и с LOV».
Увидеть, как танцует сенсорный белок
Мы привыкли к тому, что ощущаем прикосновения кожей, свет — глазами, звук — ушами, вкус — языком, запахи — носом. А каково приходится бактериям? Ведь их мембрана — это толстая оболочка, подобная скафандру космонавта или даже корпусу батискафа. Полная изоляция от внешнего мира: ничего не слышно, ничего не видно. К счастью (для бактерий), на поверхности этого «скафандра» есть специальные сенсорные белки, которые улавливают сигналы из внешнего мира и передают внутрь бактерии.
Разные сенсоры работают по-разному, и никто до конца не понимает, как именно. А значит, для исследователей в этой области открывается целое поле интересных задач. Ниже мы приводим иллюстрацию из обзора Ивана Гущина и Валентина Горделия [29] — просто чтобы показать, сколько удивительных устройств придумали бактерии для прощупывания внешнего мира из своих маленьких батискафов (рис. 9).

Рисунок 9. Разнообразие трансмембранных сенсорных двухкомпонентных систем. Все белки гомодимерны (то есть у каждого белка, показанного на картинке, есть брат-близнец, связанный с ним множеством нековалентных взаимодействий), но на рисунке показаны только мономеры.
Наиболее распространенные сигнальные системы бактерий, архей и растений — это двухкомпонентные системы (ДКС), в состав которых входят сенсорный белок (или белковый комплекс) и белок — регулятор ответа. Большинство сенсоров ДКС является мембранными белками, сенсорный домен которых расположен в периплазме (желеобразном веществе между цитоплазматической мембраной и внешней бактериальной мембраной) или в мембране. Белок-сенсор фосфорилирует (или дефосфорилирует, в зависимости от сигнала) белок-регулятор, который, в свою очередь, регулирует клеточные процессы — в основном, экспрессию генов.
Конечно, было бы здорово посмотреть, как двигается сенсорный белок. Но его размеры (около 10 нм) гораздо меньше длины волны света, поэтому в обычный световой микроскоп мы никогда это не увидим. Приходится пользоваться другими методами [30]. И один из них — метод кристаллографии. Как можно угадать из названия, он основан на способности некоторых белков образовывать кристаллы. Для этого нужен особый талант, которым обладает не каждый белок, особенно мембранный.
Белок выделяют, очищают и затем постепенно высушивают растворитель. Если повезет, это приводит к тому, что молекулы белка начинают складываться в регулярную структуру — кристалл. Его облучают рентгеновским излучением, длина волны которого на два-четыре порядка меньше длины волны оптического излучения. В результате получается картина, подобная рисунку 10, — так называемая картина дифракции. По ней можно установить трехмерную структуру белковой молекулы, формирующей кристалл.

Рисунок 10. Дифракция рентгеновских лучей на миоглобине
Проблема этого метода заключается в том, что таким образом можно получить сведения о белке не в обычном состоянии, а в кристалле. Разница между ними — как между групповой фотографией сборной России по футболу и съемками футболистов во время игры.
Если мы хотим узнать что-то о механизме работы белка, мы должны «сфотографировать» хотя бы его начальное и конечное состояния. Так можно предположить, как именно работает белок при переключении между ними.
Подобный эксперимент провели сотрудники лаборатории Ивана Гущина (в том числе и сам Иван, и уже знакомый нам Павел Буслаев) вместе с коллегами из Исследовательского центра Юлиха, Института структурной биологии в Гренобле и Европейского центра синхротронного излучения, изучая киназу NarQ из кишечной палочки. По результатам эксперимента в 2017 году в журнале Science вышла статья Mechanism of transmembrane signaling by sensor histidine kinases [31]. Журналисты окрестили ее «статьей про обоняние бактерий».
Киназа NarQ чувствует ионы нитратов (NO2− и NO3−) в окружающей среде и передает сигнал о них через клеточную мембрану. «Фотографировали» NarQ в двух состояниях. Первое — неактивное: белок с нитратами не связан и, соответственно, сигнал внутрь клетки не передает. Второе состояние — активное: нитрат захвачен, и киназа сообщает своей хозяйке-бактерии: «Обнаружен нитрат!»
Для фотографии в сигнальном состоянии позировал натуральный, «дикий» белок. А для съемки в неактивном состоянии понадобился специальный мутированный белок, к которому перестал присоединяться нитрат, а остальная часть осталась нетронутой.
Оказалось, что в месте связывания сигнальная и неактивная формы отличаются совсем немного: спирали в сенсорном домене сдвигаются на 0,5–1 ангстрема, что соответствует примерно ⅕ иона самого нитрата (см. анимацию 11). Присоединение этого иона нитрата запускает изменения в белке: трансмембранные части белка немного сдвигаются, зато части, которые находятся внутри бактерии, раздвигаются на целых 7 ангстрем! Таким образом, первоначальный сигнал усиливается примерно в 10 раз.

Рисунок 11. Механизм работы киназы NarQ кишечной палочки. Киназа захватывает нитраты (NO2− и NO3−) из окружающей среды и передает сигнал о них через клеточную мембрану.
Комментируя полученную анимацию, Иван Гущин отметил, что она просто подчеркивает те структурные изменения, которые происходят при переходе из одного состояния в другое. Скорее всего, это хаотический процесс, и спирали белка при переходе ведут себя как-то по-другому. Чтобы понять, как именно, сотрудники лаборатории уже получили несколько других промежуточных структур этого же рецептора.
Исторически сложилось так, что в лаборатории Ивана Гущина работают с сенсорными системами бактерий, но не с человеческими рецепторами. Поэтому создание лекарств и медицина оставались вне поля деятельности исследователей. Но описанная в этом разделе работа — изучение сенсорных систем бактерий — в будущем может помочь в разработке лекарств, заменяющих антибиотики. Это особенно актуально, когда проблема резистентности к антибиотикам приобретает мировой масштаб. Работа продолжается и сейчас. Более того, самый большой грант РНФ, который сейчас есть у лаборатории, получен на исследование бактериальных сенсорных систем.
NMRlipids: открытая наука
Представьте себе, что Розалинд Франклин и Джеймс Уотсон живут в наше время, сидят на форуме для структурных биологов и обсуждают снимки ДНК, которые сделала Розалинд. «Мне кажется, похоже на двойную спираль», — пишет Джеймс. «Да, пожалуй. Но мне хочется сделать еще пару снимков», — отвечает Розалинд. А через несколько месяцев они вместе публикуют статью, в которой указаны все, кто участвовал в дискуссии на форуме.
Звучит здорово, но нереалистично , не так ли? Но некоторые сейчас так и делают, и пример тому — статья, опубликованная этой осенью [32], среди авторов которой есть и Иван Гущин, и Павел Буслаев, и другие ученые, многие из которых даже не были до этого знакомы друг с другом. Но напишем по порядку — так, как рассказал Иван Гущин.
Как известно, рентгенографический снимок, сделанный Розалинд, был показан Джеймсу Уотсону без ее разрешения. В итоге Нобелевской премии за открытие структуры ДНК были удостоены Уилкинс, Уотсон и Крик, а сама Франклин осталась на долгое время в тени. Об этой истории можно узнать больше из книги Джеймса Уотсона «Двойная спираль». В ней Уотсон, несмотря на предвзятое отношение к Франклин, признает, что именно ее прекрасные снимки послужили основой для прорывного открытия.
В 2013 году биофизики Самули Оллила и Маркус Меттинен проводили вычислительные эксперименты с модельными биомембранами. Исследователи обнаружили, что их расчеты очень плохо описывают данные ядерно-магнитного резонанса липидов. Может, взяли не те параметры? Это легко исправить: взяли другие параметры. Тоже не получилось. Тогда ученые начали читать литературу, и оказалось, что есть много разных подходов к тому, как моделировать мембрану. Применить все эти параметры самостоятельно было бы сложно, поэтому они решили создать такую открытую коллаборацию, где каждый, кто занимается моделированием мембран, мог бы внести свой вклад. Проект назвали NMRlipids — по английской аббревиатуре ядерно-магнитного резонанса — NMR — с добавлением lipids («липиды»). Вдохновлен он был проектом Polymath, в котором на всеобщее обсуждение выдвигаются математические задачи.
Сайт проекта создали на платформе blogspot в формате блога (если вы застали эпоху «Живого журнала», этот формат должен быть вам хорошо знаком). Автор начинает обсуждение записью в этом блоге, а любой читатель может написать комментарий и таким образом включиться в проект и привнести что-то свое. Таким образом, к моменту написания этой статьи в проекте NMRlipids набралось 47 участников. Как только материала в обсуждении набирается достаточно, чтобы написать статью, все авторы, когда-либо участвовавшие в нем, приглашаются в соавторы.
Одно из таких обсуждений выросло в статью, опубликованную в октября этого года в журнале Journal of Physical Chemistry B., в которой Иван Гущин и Павел Буслаев выступают в качестве соавторов [32].
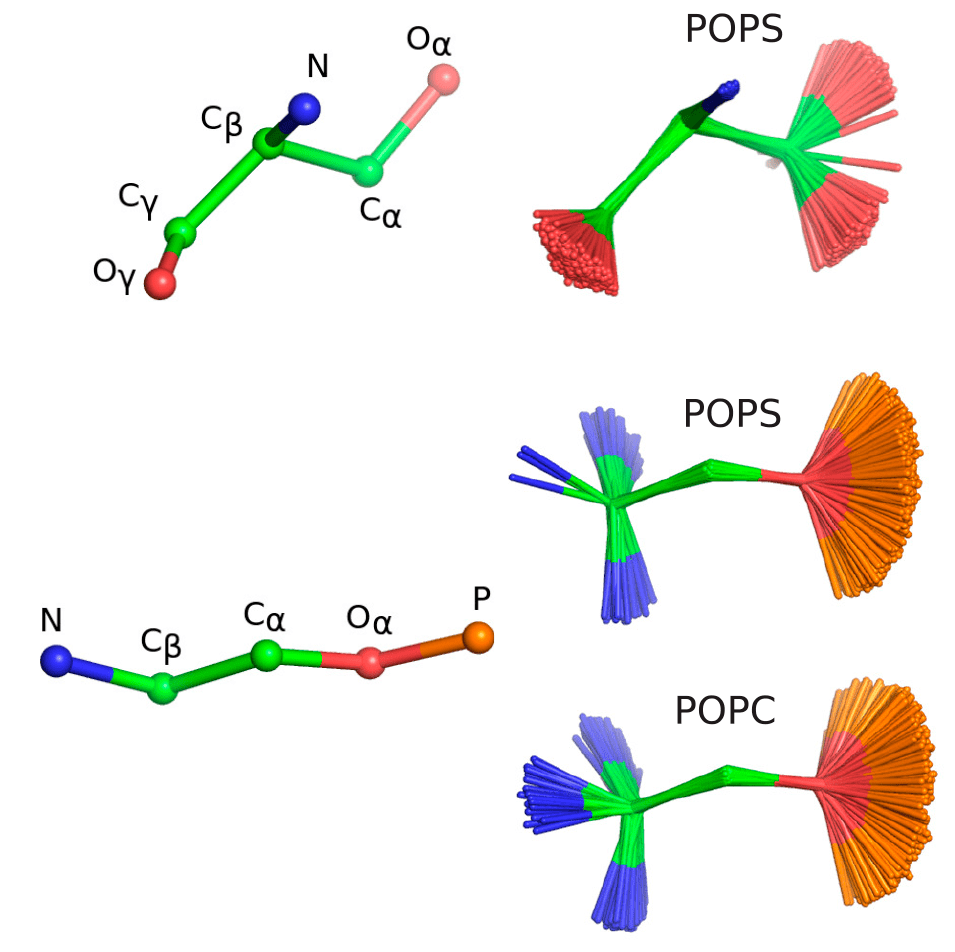
Работа посвящена фосфатидилсерину, элементу мембран эукариотических клеток, играющему важную роль в апоптозе [33]. Фосфатидилсерин отрицательно заряжен и взаимодействует с белками посредством неспецифических электростатических взаимодействий, а также посредством специфического связывания. Кроме того, в присутствии ионов кальция он может вызывать слияние мембран и разделение фаз. Механизм этих процессов остается плохо понятым, отчасти потому, что еще не были разработаны достаточно точные модели интерпретации экспериментальных данных. Авторы работы сравнили результаты моделирования с использованием различных существующих наборов параметров с экспериментальными данными. В результате они смогли отсортировать эти наборы параметров от менее правдоподобных к более, а значит, сообщество доблестных ученых, моделирующих мембраны, теперь может сразу выбрать наилучший и не тратить время зря (рис. 12).
Заключение
Если вы, дорогой читатель, не знакомы с методами моделирования в биологии [9], [34], опубликованные результаты могут показаться вам слишком хардкорными. Но подумайте — может быть, пришла пора эти методы освоить?
Без методов молекулярной динамики в наше время никуда: их используют для изучения свойств растворов, малых молекул (что особенно ценно в разработке лекарств), полимеров, олигонуклеотидов и белков. Такие расчеты особенно полезны в изучении мембранных систем, где с их помощью можно охарактеризовать поведение мицелл, бислоев, везикул, моделировать физиологические процессы, такие как формирование поры в мембране, слияние и разделение клеток и многое, многое другое.
Однако для этого придется многому научиться — от математики и программирования до квантовой химии. Недаром говорят, что физика — это такая сложная математика, химия — это сложная физика, а биология — это такая сложная химия.
Литература
- Лаборатория перспективных исследований мембранных белков: от гена к ангстрему;
- 12 методов в картинках: «сухая» биология;
- Olga Novitskaia, Pavel Buslaev, Ivan Gushchin. (2019). Assembly of Spinach Chloroplast ATP Synthase Rotor Ring Protein-Lipid Complex. Front. Mol. Biosci.. 6;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Флуоресцентные репортеры и их молекулярные репортажи;
- 12 методов в картинках: структурная биология;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Молекулярная динамика биомолекул. Часть I. История полувековой давности;
- Vera V. Nazarenko, Alina Remeeva, Anna Yudenko, Kirill Kovalev, Anton Dubenko, et. al.. (2019). A thermostable flavin-based fluorescent protein from Chloroflexus aggregans: a framework for ultra-high resolution structural studies. Photochem. Photobiol. Sci.. 18, 1793-1805;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Флуоресцирующая Нобелевская премия по химии;
- Reena Saini, Mariusz Jaskolski, Seth J. Davis. (2019). Circadian oscillator proteins across the kingdoms of life: structural aspects. BMC Biol. 17;
- Sebastian Metz, Andreas Jäger, Gabriele Klug. (2012). Role of a short light, oxygen, voltage (LOV) domain protein in blue light- and singlet oxygen-dependent gene regulation in Rhodobacter sphaeroides. Microbiology. 158, 368-379;
- E. Huala. (1997). Arabidopsis NPH1: A Protein Kinase with a Putative Redox-Sensing Domain. Science. 278, 2120-2123;
- Michael Salomon, John M. Christie, Elke Knieb, Ulrika Lempert, Winslow R. Briggs. (2000). Photochemical and Mutational Analysis of the FMN-Binding Domains of the Plant Blue Light Receptor, Phototropin†,‡. Biochemistry. 39, 9401-9410;
- Sean Crosson, Sudarshan Rajagopal, Keith Moffat. (2003). The LOV Domain Family: Photoresponsive Signaling Modules Coupled to Diverse Output Domains†. Biochemistry. 42, 2-10;
- Josiah P. Zayner, Tobin R. Sosnick. (2014). Factors That Control the Chemistry of the LOV Domain Photocycle. PLoS ONE. 9, e87074;
- Estella F. Yee, Ralph P. Diensthuber, Anand T. Vaidya, Peter P. Borbat, Christopher Engelhard, et. al.. (2015). Signal transduction in light–oxygen–voltage receptors lacking the adduct-forming cysteine residue. Nat Commun. 6;
- Тик-так по-шведски. Нобелевская премия за циркадные ритмы;
- Spencer T. Glantz, Eric J. Carpenter, Michael Melkonian, Kevin H. Gardner, Edward S. Boyden, et. al.. (2016). Functional and topological diversity of LOV domain photoreceptors. Proc Natl Acad Sci USA. 113, E1442-E1451;
- S. HANADA, A. HIRAISHI, K. SHIMADA, K. MATSUURA. (1995). Chloroflexus aggregans sp. nov., a Filamentous Phototrophic Bacterium Which Forms Dense Cell Aggregates by Active Gliding Movement. International Journal of Systematic Bacteriology. 45, 676-681;
- «Физтехи создали флуоресцентный белок с уникальными свойствами». (2019). МФТИ;
- Ashley D. Smart, Roland A. Pache, Nathan D. Thomsen, Tanja Kortemme, Graeme W. Davis, James A. Wells. (2017). Engineering a light-activated caspase-3 for precise ablation of neurons in vivo. Proc Natl Acad Sci USA. 114, E8174-E8183;
- Laura B Motta-Mena, Anna Reade, Michael J Mallory, Spencer Glantz, Orion D Weiner, et. al.. (2014). An optogenetic gene expression system with rapid activation and deactivation kinetics. Nat Chem Biol. 10, 196-202;
- Бессмертные клетки Генриетты Лакс;
- Yi I. Wu, Daniel Frey, Oana I. Lungu, Angelika Jaehrig, Ilme Schlichting, et. al.. (2009). A genetically encoded photoactivatable Rac controls the motility of living cells. Nature. 461, 104-108;
- «Биофизики расшифровали подлинную структуру оптогенетического белка — родопсина KR2». (2019). МФТИ;
- Ivan Gushchin, Valentin Gordeliy. (2018). Transmembrane Signal Transduction in Two-Component Systems: Piston, Scissoring, or Helical Rotation?. BioEssays. 40, 1700197;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Ivan Gushchin, Igor Melnikov, Vitaly Polovinkin, Andrii Ishchenko, Anastasia Yuzhakova, et. al.. (2017). Mechanism of transmembrane signaling by sensor histidine kinases. Science. 356, eaah6345;
- Hanne Antila, Pavel Buslaev, Fernando Favela-Rosales, Tiago M. Ferreira, Ivan Gushchin, et. al.. (2019). Headgroup Structure and Cation Binding in Phosphatidylserine Lipid Bilayers. J. Phys. Chem. B. 123, 9066-9079;
- Липидный фундамент жизни;
- Пространственно-временное моделирование в биологии;
- Aba Losi. (2013). LOV Proteins: Photobiophysics. Encyclopedia of Biophysics. 1312-1316.