
Драг-дизайн: как в современном мире создаются новые лекарства
07 июня 2004
Драг-дизайн: как в современном мире создаются новые лекарства
- 31636
- 20
- 37
сайт rosser.bio.ed.ac.uk
-
Автор
-
Редакторы
Статья дает базовое представление о том, как в современном мире создаются лекарства. Рассмотрены история драг-дизайна, основные понятия, термины и технологии, применяющиеся в этой сфере. Особое внимание уделено роли вычислительной техники в этом наукоемком процессе. Описаны методы поиска и валидации биологических мишеней для лекарственных препаратов, высокопроизводительный скрининг, процессы клинических и доклинических испытаний лекарств а также применение компьютерных алгоритмов.
Драг-дизайн: история
Индустрия направленного конструирования новых лекарственных препаратов, или, как этот процесс называют, калькируя с английского за неимением такого же короткого и удобного русского термина, драг-дизайн (drug — лекарственный препарат, design — проектирование, конструирование) — сравнительно молодая дисциплина, но все же не настолько молодая, как это принято считать [1].

Рисунок 1. Пауль Эрлих, впервые выдвинувший гипотезу о существовании хеморецепторов и их возможного использования в медицине.
Национальная библиотека медицины США
К концу девятнадцатого века химия достигла значительной степени зрелости. Была открыта таблица Менделеева, разработана теория химической валентности, теория кислот и оснований, теория ароматических соединений. Этот несомненный прогресс дал толчок и медицине. Новые химические продукты — синтетические краски, производные смол, начали использоваться в медицине для дифференциального окрашивания биологических тканей. В 1872–1874 годах в Страсбурге, в лаборатории известного анатома Вильгельма Валдеера, студент-медик Пауль Эрлих (рис. 1), изучавший селективную окраску тканей, впервые выдвинул гипотезу о существовании хеморецепторов — специальных тканевых структур, специфически взаимодействующих с химическими веществами, и постулировал возможность использования этого феномена в терапии различных заболеваний. Позже, в 1905 году, эта концепция была расширена Дж. Лэнгли, предложившим модель рецептора как генератора внутриклеточных биологических импульсов, который активируется агонистами и инактивируется антагонистами.
Этот момент можно считать рождением хемотерапии и новым витком в фармакологии, и в 20-м веке это привело к беспрецедентному успеху в клинической медицине. Одним из самых громких достижений фармакологической промышленности 20-го века можно по праву назвать пенициллин, антибиотик, открытый в 1929 году Александром Флемингом и исследованный впоследствии Чейном и Флори. Пенициллин, обладающий антибактериальным действием, сослужил человечеству незаменимую службу в годы Второй мировой войны, сохранив жизни миллионам раненых.
Пораженные успехом пенициллина, многие фармацевтические компании открыли собственные микробиологические подразделения, возлагая на них надежды по открытию новых антибиотиков и других лекарств. Последовавшие успехи биохимии привели к тому, что стало возможным теоретически предсказывать удачные мишени для терапевтического воздействия, а также модификации химических структур лекарств, дающих новые соединения с новыми свойствами. Так, антибиотик сульфаниламид в результате ряда исследований дал начало целым семействам гипогликемических, диуретических и антигипертензивных препаратов. Драг-дизайн поднялся на качественно новый уровень, когда разработка новых лекарственных соединений стала не просто плодом работы воображения химиков, а результатом научного диалога между биологами и химиками.
Новый прорыв был связан с развитием молекулярной биологии, позволившей привлечь к разработкам информацию о геноме, клонировать гены, кодирующие терапевтически важные биологические мишени и экспрессировать их белковые продукты.
Завершение ознаменовавшего начало нового тысячелетия проекта «геном человека», в результате которого была прочитана полная информация, содержащаяся в ДНК человека, явилось настоящим триумфом раздела биологической науки, получившей название «геномика». Геномика дает совершенно новый подход к поиску новых терапевтически важных мишеней, позволяя искать их непосредственно в нуклеотидном тексте генома.
Геном человека содержит 12000–14000 генов, кодирующих секретируемые белки. На данный момент в фармацевтической промышленности используется не более 500 мишеней. Существуют исследования, говорящие, что многие заболевания являются «мультифакторными», то есть обуславливаются дисфункцией не одного белка или гена, а 5–10 связанных между собой белков и кодирующих их генов. Исходя из этих соображений можно заключить, что количество исследуемых мишеней должно увеличиться минимум в 5 раз.
Биохимическая классификация исследуемых в настоящее время биологических мишеней и их численное соотношение представлены на рисунке 2. Особо следует отметить, что бóльшую (>60%) долю рецепторов составляют мембранные G-белок сопряженные рецепторы (GPCR, G-protein coupled receptors), а суммарный объем продаж лекарств, направленных на взаимодействие с ними, равняется 65 млрд. долл. ежегодно, и продолжает расти.

Рисунок 2. Классификация молекулярных мишеней в современной фармацевтической индустрии, согласно биохимическому критерию.
Основные понятия
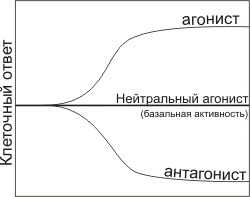
Рисунок 3. Три типа влияния лигандов на клеточный ответ: увеличение ответа (положительный агонгист), постоянство ответа, но конкурирование за связывании с другими лигандами (нейтральный агонист) и уменьшение ответа (антагонист).
Основные понятия, используемые в драг-дизайне — это мишень и лекарство. Мишень — это макромолекулярная биологическая структура, предположительно связанная с определенной функцией, нарушение которой приводит к заболеванию и на которую необходимо совершить определенное воздействие. Наиболее часто встречающиеся мишени — это рецепторы и ферменты. Лекарство — это химическое соединение (как правило, низкомолекулярное), специфически взаимодействующее с мишенью и тем или иным образом модифицирующее клеточный ответ, создаваемый мишенью.
Если в качестве мишени выступает рецептор, то лекарство будет, скорее всего, его лигандом, то есть соединением, специфическим образом взаимодействующим с активным сайтом рецептора. В отсутствие лиганда рецептор характеризуется собственным уровнем клеточного ответа — так называемой базальной активностью.
По типу модификации клеточного ответа лиганды делят на три группы (рис. 3):
- Агонисты увеличивают клеточный ответ.
- Нейтральные агонисты связываются с рецептором, но не изменяют клеточный ответ по сравнению с базальным уровнем.
- Обратные агонисты, или антагонисты понижают клеточный ответ.
Степень взаимодействия лиганда с мишенью измеряют аффинностью, или сродством. Аффинность равна концентрации лиганда, при которой половина мишеней связана с лигандом. Биологической же характеристикой лиганда является его активность, то есть та концентрация лиганда, при которой клеточный ответ равен половине максимального.
Определение и валидация мишени
Один из самых ранних и самых важных этапов драг-дизайна — выбрать правильную мишень, воздействуя на которую можно специфическим образом регулировать одни биохимические процессы, по возможности не затрагивая при этом другие. Однако, как уже было сказано, такое не всегда возможно: далеко не все заболевания являются следствием дисфункции только одного белка или гена.
С наступлением постгеномной эры, определение мишеней происходит с использованием методов сравнительной и функциональной геномики. На основании филогенетического анализа в геноме человека выявляются гены, родственные генам, функции чьих белковых продуктов уже известны, и эти гены могут быть клонированы для дальнейшего исследования.
Однако мишени, чьи функции определены лишь гипотетически, не могут служить отправной точкой для дальнейших исследований. Необходима многоступенчатая экспериментальная валидация, в результате которой может быть понята конкретная биологическая функция мишени применительно к фенотипическим проявлениям исследуемой болезни.
Существует несколько методов экспериментальной валидации мишеней:
- геномные методы заключаются в подавлении синтеза мишени в тестовой системе путем получения мутантов с генным нокаутом (в которых ген мишени попросту отсутствует) или использования РНК-антисмысловых последовательностей, «выключающих» тот или иной ген;
- мишени можно инактивировать с помощью моноклональных антител или облучая мишень, модифицированную хромофором, лазерным излучением;
- мишени можно инактивировать с помощью низкомолекулярных лигандов-ингибиторов;
- также можно непосредственно производить валидацию мишени, устанавливая ее взаимодействие с тем или иным соединением методом плазмонного резонанса.
Уровень валидации мишени повышается с числом модельных животных (специальных генетических линий лабораторных животных), в которых модификация мишени приводит к желаемому фенотипическому проявлению. Высшим уровнем валидации является, несомненно, демонстрация того, что модификация мишени (например, блокирование или нокаут рецептора или ингибирование фермента) приводит к клинически идентифицируемым и воспроизводимым симптомам у человека, однако, понятно, такое можно наблюдать достаточно редко.
Кроме того, при выборе мишени не следует забывать о таком явлении, как полиморфизм — то есть о том, что ген может существовать в разных изоформах у разных популяций или рас людей, что приведет к разному эффекту лекарства на разных больных.
Когда мишень уже найдена и проверена на валидность, начинаются непосредственные исследования, результатом которых являются многочисленные структуры химических соединений, лишь немногим из которых суждено стать лекарствами.
Исследование всех возможных с химической точки зрения лигандов («химическое пространство») невозможно: простая прикидка показывает, что возможно не менее 1040 различных лигандов, в то время как с момента возникновения вселенной прошло лишь ~1017 секунд. Поэтому на возможную структуру лигандов накладывается ряд ограничений, который существенно сужает химическое пространство (оставляя его, тем не менее, совершенно необъятным). В частности, для сужения химического пространства накладываются условия подобия лекарству (drug-likeness), которые в простом случае можно выразить правилом пяти Липинского, согласно которому соединение, чтобы «быть похожим» на лекарство, должно:
- иметь менее пяти атомов-доноров водородной связи;
- обладать молекулярным весом менее 500;
- иметь липофильность (log P — коэффициент распределения вещества на границе раздела вода-октанол) менее 5;
- иметь суммарно не более 10 атомов азота и кислорода (грубая оценка количества акцепторов водородной связи).
В качестве стартового набора лигандов, исследуемых на способность связываться с мишенью, обычно используют так называемые библиотеки соединений, либо поставляемые на коммерческой основе специализирующимися на этом компаниями, либо содержащиеся в арсенале фармацевтической компании, проводящей разработку нового лекарства или заказавшей его у сторонней фирмы. Такие библиотеки содержат тысячи и миллионы соединений. Этого, конечно, совершенно недостаточно для тестирования всех возможных вариантов, но этого, как правило, и не требуется. Задачей на этом этапе исследования является выявление соединений, способных после дальнейшей модификации, оптимизации и тестирования дать «кандидат» — соединение, предназначенное для тестирования на животных (доклинические исследования) и на людях (клинические исследования).
Этот этап осуществляется с помощью высокопроизводительного скрининга (in vitro) или его компьютерного (in silico) анализа — высокопроизводительного докинга.
Комбинаторная химия и высокопроизводительный скрининг
Скринингом называется оптимизированная конвейеризованная процедура, в результате которой большое количество химических соединений (>10 000) проверяется на аффинность или активность по отношению к специальной тестовой (имитирующей биологическую) системе. По производительности различают разные виды скрининга:
- низкопроизводительный (10000–50000 образцов);
- среднепроизводительный (50000–100000 образцов);
- высокопроизводительный (100000–5000000+ образцов).
Для скрининга как для «промышленной» процедуры очень критична эффективность, стоимость и время, потраченное на операцию. Как правило, скрининг производится на роботизированных установках, способных работать в круглосуточном и круглогодичном режиме (рис. 4).

Рисунок 4. Аппаратура, используемая для высокопроизводительного скрининга. А — Роботизированная пипетка, в автоматическом высокопроизводительном режиме наносящая образцы тестируемых соединений в плашку с системой для скрининга. Типичное количество углублений на плашке — тысячи. Объем системы в одной лунке — микролитры. Объем вносимого образца — нанолитры. Б — Установка для высокопроизводительного скрининга и считывания флуоресцентного сигнала Mark II Scarina. Работает с плашками, содержащими 2048 углублений (NanoCarrier). Полностью автоматическая (работает в круглосуточном режиме). Производительность — более 100 000 лунок (образцов) в день.
Принцип скрининга достаточно прост: в плашки, содержащие тестовую систему (например, иммобилизованная мишень или специальным образом модифицированные целые клетки), робот раскапывает из пипетки исследуемые вещества (или смесь веществ), следуя заданной программе. Причем на одной плашке могут находиться тысячи «лунок» с тестовой системой, и объем такой лунки может быть очень мал, так же как и объем вносимой пробы (микро- или даже нанолитры).
Потом происходит считывание данных с плашки, говорящее о том, в какой лунке обнаружена биологическая активность, а в какой — нет. В зависимости от используемой технологии детектор может считывать радиоактивный сигнал, флюоресценцию (если система построена с использованием флуоресцентных белков), биолюминесценцию (если используется люциферин-люциферазная система или ее аналоги), поляризацию излучения и многие другие параметры.
Обычно в результате скрининга количество тестируемых соединений сокращается на 3–4 порядка. Соединения, для которых в процессе скрининга выявлена активность выше заданного значения, называются прототипами. Однако следует понимать, что такие «удачи» еще очень и очень далеки от конечного лекарства. Лишь те из них, которые сохраняют свою активность в модельных системах и удовлетворяют целому ряду критериев, дают предшественников лекарств, которые используются для дальнейших исследований.
Как уже было сказано, даже библиотеки, содержащие более миллиона соединений, не в состоянии представить все возможное химическое пространство лигандов. Поэтому при проведении скрининга можно выбрать две различные стратегии: диверсификационный скрининг и сфокусированный скрининг [3]. Различие между ними заключается в составе используемых библиотек соединений: в диверсификационном варианте используют как можно более непохожие друг на друга лиганды с целью охватить как можно большую область химического пространства, при сфокусированном же, наоборот, используют библиотеки родственных соединений, полученных методами комбинаторной химии, что позволяет, зная приблизительную структуру лиганда, выбрать более оптимальный его вариант. Здравый смысл подсказывает, что в масштабном проекте по созданию нового лекарственного препарата следует использовать оба этих подхода последовательно — сначала диверсификационный, с целью определения максимально различных классов удачных соединений, а потом — сфокусированный, с целью оптимизации структуры этих соединений и получения рабочих прототипов.
Если для мишени известно так называемое биологическое пространство, то есть какие-либо характеристики лигандов (размер, гидрофобность и т.д.), которые могут с ней связываться, то при составлении библиотеки тестируемых соединений выбирают лиганды, попадающие в «пересечение» биологического и химического пространств, так как это заведомо повышает эффективность процедуры.
Структуры прототипов, полученные в результате скрининга, далее подвергаются разнообразным оптимизациям, проводимым в современных исследованиях, как правило, в тесном сотрудничестве между различными группами исследователей: молекулярными биологами, фармакологами, моделистами и медицинскими химиками (рис. 5).

Рисунок 5. Фармакологический цикл. Группа молекулярной биологии отвечает за получение мутантных мишеней, группа фармакологии — за измерение данных по активности и аффинности синтезированных лигандов на мишенях дикого типа и мутантных, группа моделирования — за построение моделей мишеней, предсказание их мутаций и предсказание структур лигандов, группа медицинской химии — за синтез лигандов.
С каждым оборотом такого «фармакологического цикла» прототип приближается к предшественнику и затем к кандидату, который уже тестируется непосредственно на животных (доклинические испытания) и на людях — в процессе клинических испытаний.
Таким образом, роль скрининга заключается в существенном сокращении (на несколько порядков) выборки прототипов (рис. 6).

Рисунок 6. Роль высокопроизводительного скрининга в разработке нового лекарственного препарата. Скрининг, будь то его лабораторный (in vitro) или компьютерный (in silico) вариант, — главная и наиболее ресурсоемкая процедура по выбору стартовых структур лекарств (прототипов) из библиотек доступных соединений. Выходные данные скрининга часто являются отправной точкой для дальнейшего процесса разработки лекарства.
Клинические исследования
Медицина — это область, в которой ни в коем случае не следует спешить. В особенности, если речь идет о разработке новых лекарственных препаратов. Достаточно вспомнить историю с препаратом Талидамидом, разработанным в конце 50-х в Германии, применение которого беременными женщинами приводило к рождению детей с врожденными пороками конечностей, вплоть до их полного отсутствия. Этот побочный эффект не был вовремя выявлен во время клинических исследований в силу недостаточно тщательного и аккуратного тестирования.
Поэтому в настоящее время процедура тестирования лекарств достаточно сложна, дорога и требует значительного времени (2–7 лет тестирования в клинике и от 100 миллионов долларов на одно соединение-кандидат, см. рис. 7).
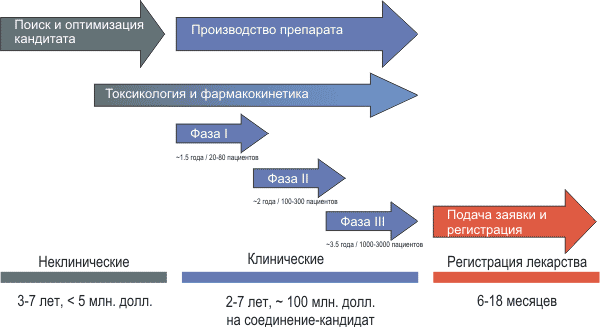
Рисунок 7. Процесс разработки нового лекарства занимает от 5 до 16 лет. Затраты на клиническое тестирование одного соединения-кандидата составляют более 100 миллионов долларов США. Суммарная стоимость разработки, с учетом препаратов, не достигших рынка, часто превышает 1 миллиард долларов.
Прежде всего, еще до поступления в клинику, препараты исследуются на токсичность и канцерогенность, причем исследования должны проводиться, кроме систем in vitro, как минимум на двух видах лабораторных животных. Токсичные препараты, само собой, в клинику не попадают, за исключением тех случаев, когда они предназначены для терапии особо тяжелых заболеваний и не имеют пока менее токсичных аналогов.
Кроме того, препараты подвергаются фармакокинетическим исследованиям, то есть тестируются на такие физиологические и биохимические характеристики, как поглощение, распределение, метаболизм и выведение (по-английски обозначается аббревиатурой ADME — Absorption, Distribution, Metabolism and Extraction). Биодоступность, например, является подхарактеристикой введения препарата в организм, характеризующая степень потери им биологических свойств при введении в организм. Так, инсулин, принимаемый перорально (через рот), имеет низкую биодоступность, так как, будучи белком, расщепляется желудочными ферментами. Поэтому инсулин вводят либо подкожно, либо внутримышечно. По этой же причине часто разрабатывают препараты, действующие аналогично своим природным прототипам, но имеющие небелковую природу.
Юридически процесс клинических исследований новых препаратов имеет очень много нюансов, так как они требуют огромного количества сопроводительной документации (в сумме несколько тысяч страниц), разрешений, сертификаций и т.д. Кроме того, многие формальные процедуры сильно разнятся в разных странах в силу различного законодательства. Поэтому, для решения этих многочисленных вопросов, существуют специальные компании, принимающие от крупных фармацевтических компаний заказ на проведение клинических испытаний и перенаправляющие их в конкретные клиники, сопровождая весь процесс полной документацией и следя, чтобы никакие формальности не были нарушены.
Роль вычислительной техники в драг-дизайне
В настоящее время в драг-дизайне, как и в большинстве других наукоемких областей, продолжает увеличиваться роль вычислительной техники. Следует сразу оговорить, что современный уровень развития компьютерных методик не позволяет разработать новый лекарственный препарат, используя только компьютеры. Основные преимущества, которые дают вычислительные методы в данном случае — это сокращение времени выпуска нового лекарства на рынок и снижение стоимости разработки.
Основные компьютерные методы, используемые в драг-дизайне, это:
- молекулярное моделирование (ММ);
- виртуальный скрининг;
- дизайн новых лекарственных препаратов de novo;
- оценка свойств «подобия лекарству»;
- моделирование связывания лиганд-мишень.
Методы ММ, основывающиеся на структуре лиганда
В случае, если ничего не известно про трехмерную структуру мишени (что случается достаточно часто), прибегают к методикам создания новых соединений исходя из информации о структуре уже известных лигандов и данных по их активности.
Подход основывается на общепринятой в химии и биологии парадигме, гласящей, что структура определяет свойства. Основываясь на анализе корреляций между структурой известных соединений и их свойствами, можно предсказать структуру нового соединения, обладающего желаемыми свойствами (или же, наоборот, для известной структуры предсказать свойства). Причем, этот подход используется как при модификации известных структур с целью улучшения их свойств, так и при поиске новых соединений используя скрининг библиотек соединений.
Методы определения похожести молекул (или методы отпечатков пальцев) состоят в дискретном учете определенных свойств молекулы, называемых дескрипторами (например, число доноров водородной связи, число бензольных колец, наличие определенного заместителя в определенном положении и т.д.) и сравнивании получившегося «отпечатка» с отпечатком молекулы с известными свойствами (используемой в качестве образца). Степень похожести выражается коэффициентом Танимото, изменяющимся в диапазоне 0–1. Высокая похожесть предполагает близость свойств сравниваемых молекул, и наоборот.
Методы, основывающиеся на известных координатах атомов лиганда, называются методами количественной связи между структурой и активностью (QSAR, Quantitative Structure-Activity Relationship). Один из наиболее используемых методов этой группы — метод сравнительного анализа молекулярных полей (CoMFA, Comparative Molecular Field Analysis). Этот метод заключается в приближении трехмерной структуры лиганда набором молекулярных полей, отдельно характеризующих его стерические, электростатические, донорно-акцепторные и другие свойства. CoMFA модель строится на основании множественного регрессионного анализа лигандов с известной активностью и описывает лиганд, который должен хорошо связываться с исследуемой мишенью, в терминах молекулярных полей. Полученный набор полей говорит, в каком месте у лиганда должен быть объемный заместитель, а в каком — маленький, в каком полярный, а в каком — нет, в каком донор водородной связи, а в каком — акцептор, и т.д.
Модель может использоваться в задачах виртуального скрининга библиотек соединений, выступая в данном случае аналогом фармакофора. Самым главным недостатком этого метода является то, что он обладает высокой предсказательной силой лишь на близких классах соединений; при попытке же предсказать активность соединения другой химической природы, чем лиганды, использовавшиеся для построения модели, результат может оказаться недостаточно достоверным.
Схема возможного процесса создания нового лекарства, основывающегося на структуре лиганда, приведена на рисунке 8.

Рисунок 8. Пример молекулярного моделирования, основывающегося на структуре лиганда. Для циклического пептида уротензина II (внизу слева) определена трехмерная структура методом ЯМР спектроскопии водного раствора (вверху слева). Пространственное взаиморасположение аминокислотных остатков мотива ТРП-ЛИЗ-ТИР, являющегося важным для биологической функции, было использовано для построения модели фармакофора (вверху справа). В результате виртуального скрининга найдено новое соединение, демонстрирующее биологическую активность (внизу справа).
Очевидно, что достоверность моделирования, как и эффективность всего процесса конструирования нового лекарства, можно существенно повысить, если учитывать данные не только о структуре лигандов, но и о структуре белка-мишени. Методы, учитывающие эти данные, носят общее название «драг-дизайн, основывающийся на структурной информации» (SBDD, Structure-Based Drug Design).
Методы ММ, основывающиеся на структуре белка
В связи с растущим потенциалом структурной биологии, все чаще можно установить экспериментальную трехмерную структуру мишени, или построить ее молекулярную модель, основываясь на гомологии с белком, чья трехмерная структура уже определена.
Наиболее часто используемые методы определения трехмерной структуры биомакромолекул с высоким разрешением (Часто, когда экспериментальная структура мишени все же недоступна, прибегают к моделированию на основании гомологии — методу, для которого показано, что построенная им модель обладает достаточно высоким качеством, если гомология между структурным шаблоном и моделируемым белком не ниже 40%.
Особенно часто к моделированию по гомологии прибегают при разработке лекарств, направленных на G-белок сопряженные рецепторы, так как они, будучи мембранными белками, очень плохо поддаются кристаллизации, а методу ЯМР пока недоступны такие большие белки. Для этого семейства рецепторов известна структура только одного белка — бычьего родопсина, полученная в 2000 г. в Стэнфорде, которая и используется в качестве структурного шаблона в подавляющем числе исследований [6].
Обычно при исследовании, базирующемся на структурных данных, учитывают также данные по мутагенезу мишени, чтобы установить, какие аминокислотные остатки наиболее важны для функционирования белка и связывания лигандов. Эти сведения особенно ценны при оптимизации построенной модели, которая, будучи лишь производной от структуры белка-шаблона, не может учитывать всей биологической специфики моделируемого объекта.
Трехмерная структура мишени, кроме того, что может объяснить молекулярный механизм взаимодействия лиганда с белком, используется в задачах молекулярного докинга, или компьютерном моделировании взаимодействия лиганда с белком. Докинг использует в качестве стартовой информации трехмерную структуру белка (на данном этапе развития технологии, как правило, конформационно неподвижную), и структуру лиганда, конформационная подвижность и взаиморасположение с рецептором которого моделируется в процессе докинга. Результатом докинга является конформация лиганда, наилучшим образом взаимодействующая с белковым сайтом связывания, с точки зрения оценочной функции докинга, приближающей свободную энергию связывания лиганда. Реально, в силу множества приближений, оценочная функция далеко не всегда коррелирует с соответствующей экспериментальной энергией связывания.
Докинг позволяет сократить затраты средств и времени за счет проведения процедуры, аналогичной высокопроизводительному скринингу, на компьютерных комплексах. Эта процедура называется виртуальным скринингом, и основным ее преимуществом является то, что для реальных фармакологических испытаний нужно приобретать не целую библиотеку, состоящую из миллиона соединений, а только «виртуальные прототипы». Обычно же, с целью избежания ошибок, скрининг и докинг используются одновременно, взаимно дополняя друг друга (рис. 9).

Рисунок 9. Два варианта совместного использования высокопроизводительного скрининга и молекулярного моделирования. Сверху: последовательный итеративный скрининг. На каждом шаге процедуры используется сравнительно небольшой набор лигандов; по результатам скрининга строится модель, объясняющая связь между структурой и активностью. Модель используется для выбора следующего набора лигандов для тестирования. Снизу: «разовый» скрининг. На каждом шаге модель строится по обучающей выборке и используется для предсказаний на тестовой выборке.
С увеличением компьютерных мощностей и появлением более корректных и физичных алгоритмов, докинг будет лучше оценивать энергию связывания белка с лигандом, начнет учитывать подвижность белковых цепей и влияние растворителя. Однако, неизвестно, сможет ли виртуальный скрининг когда-нибудь полностью заменить реальный биохимический эксперимент; если да — то для этого необходим, очевидно, качественно новый уровень алгоритмов, неспособных на сегодняшний день абсолютно корректно описать взаимодействие лиганда с белком.
Одно из явлений, иллюстрирующих несовершенство алгоритмов докинга, — парадокс похожести. Этот парадокс заключается в том, что соединения, структурно совсем немного различающиеся, могут иметь драматически различную активность, и в то же время с точки зрения алгоритмов докинга быть практически неразличимыми.
Прототипы лекарства можно получать не только выбирая из уже подготовленной базы данных соединений. Если есть структура мишени (или хотя бы трехмерная модель фармакофора), возможно построение лигандов de novo, используя общие принципы межмолекулярного взаимодействия. При этом подходе в сайт связывания лиганда помещается один или несколько базовых молекулярных фрагментов, и лиганд последовательно «наращивается» в сайте связывания, подвергаясь оптимизации на каждом шаге алгоритма. Полученные структуры, так же, как и при докинге, оцениваются с помощью эмпирических оценочных функций.
Ограничения применения компьютерных методов
Несмотря на всю свою перспективность, компьютерные методы имеют ряд ограничений, которые необходимо иметь ввиду, чтобы правильно представлять себе возможности этих методов.
Прежде всего, хотя идеология in silico подразумевает проведение полноценных компьютерных экспериментов, то есть экспериментов, результаты которых ценны и достоверны сами по себе, необходима обязательная экспериментальная проверка полученных результатов. То есть, подразумевается тесное сотрудничество научных групп, проводящих компьютерный эксперимент, с другими экспериментальными группами (рис. 5).
Кроме того, компьютерные методы пока не в силах учесть всего разнообразия влияния лекарственного препарата на организм человека, поэтому эти методы не в силах ни упразднить, ни даже существенно сократить клиническое тестирование, занимающее основную долю времени в разработке нового препарата.
Таким образом, на сегодняшний день роль компьютерных методов в драг-дизайне сводится к ускорению и удешевлению исследований, предшествующих клиническим испытаниям.
Перспектива драг-дизайна
Очевидно, что драг-дизайн — это будущее фармакологической промышленности. Направленное конструирование новых лекарственных препаратов уже сейчас стало важнейшей частью современного общества, позволяя победить многие болезни, излечение которых ранее не представлялось возможным. В перспективе, новые наукоемкие приложения смогут поднять драг-дизайн на еще более высокий уровень, когда будут, наконец, побеждены такие тяжелые заболевания, как рак, СПИД, болезнь Альцгеймера и другие недуги человечества.
Адаптированная версия этой статьи вышла в июльском номере журнала «Популярная механика» за 2007 год [8], а также в январском номере «Косметики & медицины» за 2008-й.
Литература
- J. Drews. (2000). Drug Discovery: A Historical Perspective. Science. 287, 1960-1964;
- Brunton L., Chabner B.A., Knollman B. Goodman & Gilman's the pharmacological basis of therapeutics. NY: McGraw Hill Medical, 2011. — 1808 p.;
- Martin J. Valler, Darren Green. (2000). Diversity screening versus focussed screening in drug discovery. Drug Discovery Today. 5, 286-293;
- Murray D.D. and Shimkets R. (2003). Discovery and development of a genomic drug. Curr. Drug. Discov. 6: 27–33;
- Stefanie Flohr, Michael Kurz, Evi Kostenis, Alexandre Brkovich, Alain Fournier, Thomas Klabunde. (2002). Identification of Nonpeptidic Urotensin II Receptor Antagonists by Virtual Screening Based on a Pharmacophore Model Derived from Structure−Activity Relationships and Nuclear Magnetic Resonance Studies on Urotensin II. J. Med. Chem.. 45, 1799-1805;
- K. Palczewski. (2000). Crystal Structure of Rhodopsin: A G Protein-Coupled Receptor. Science. 289, 739-745;
- Thomas Lengauer, Christian Lemmen, Matthias Rarey, Marc Zimmermann. (2004). Novel technologies for virtual screening. Drug Discovery Today. 9, 27-34;
- Чугунов А. (2007). Драг-дизайн: как создают современные лекарства. «Популярная механика»;
- Thomas Klabunde, Gerhard Hessler. (2002). Drug Design Strategies for Targeting G-Protein-Coupled Receptors. ChemBioChem. 3, 928-944;
- W. L. Jorgensen. (2004). The Many Roles of Computation in Drug Discovery. Science. 303, 1813-1818;
- Bajorath J. (2002). Virtual screening in drug discovery: Methods, expectations and reality. Curr. Drug. Disc. 3: 24–28.






