Кодирующие некодирующие РНК
31 июля 2018
Кодирующие некодирующие РНК
- 5632
- 0
- 17
Несмотря на многолетние усилия, мир некодирующих РНК еще таит в себе немало загадок
-
Автор
-
Редактор
Темы
Среди всех областей и без того бурно развивающейся молекулярной биологии одной из наиболее процветающих является биология некодирующих РНК — РНК, которые никогда не «переводятся» в белки. Каждый год становятся известны всё новые и новые виды некодирующих РНК, участвующих в самых замысловатых молекулярных процессах. Кроме того, накапливается всё больше свидетельств того, что некоторые некодирующие РНК все-таки транслируются, правда, не в большие белки, а в короткие пептиды. Как же так получается? Каковы функции кодируемых этими РНК пептидов? Пока на эти вопросы нет исчерпывающего ответа. Тем не менее, что-то все-таки начинает проясняться, и об этом мы сегодня и поговорим.
Как известно, геном эукариотических организмов активно транскрибируется, однако только ничтожная часть транскриптов приходится на матричные РНК (мРНК), которые кодируют белки. Так, у большинства млекопитающих транскрипции подвергается около 85% генома, но лишь 4% приходится на последовательности, кодирующие белки [1]. Большинство транскриптов так и остаются РНК, хотя и могут подвергаться различным модификациям. Эти транскрипты называют некодирующими РНК (нкРНК). Наиболее изучены такие нкРНК, как рибосомные (рРНК) и транспортные (тРНК), однако известно множество других типов некодирующих РНК, которые, как правило, участвуют в различных процессах, регулирующих экспрессию генов . К их числу относятся как совсем небольшие молекулы, например, микроРНК, так и вполне солидные, длиной больше 200 нуклеотидов — их объединяют в группу длинных некодирующих РНК (днкРНК). Некоторые нкРНК представляют собой не линейные молекулы, а ковалентно замкнутые в кольцо; такие молекулы составляют группу кольцевых РНК.
«Биомолекула» не раз писала о разных аспектах биологии некодирующих РНК: об РНК-интерференции — важнейшем механизме регуляции экспрессии генов, ключевую роль в котором играют некодирующие РНК [2]; об РНК-регуляторах [3]; о двухцепочечных РНК [4] и о применении антисмысловых РНК в медицине [5].
Хотя ученые постоянно открывают всё новые и новые типы некодирующих РНК, наши старые знакомые, давно известные нкРНК, совсем недавно начали открываться с новой стороны. Оказывается, некоторые из них не такие уж и некодирующие, а могут подвергаться трансляции с образованием вполне функциональных пептидов. Пока возможность трансляции удалось доказать только для длинных некодирующих РНК, предшественников микроРНК и кольцевых РНК. Наш обзор посвящен именно этой таинственной и малоизученной стороне биологии (не)кодирующих РНК.
Длинные некодирующие РНК
К числу длинных некодирующих РНК относят нкРНК, длина которых превышает 200 нуклеотидов. В клетках днкРНК вовсе не являются диковинкой: по оценкам, в человеческом геноме имеется около 16 тысяч генов, которые в общей сложности кодируют 28 тысяч длинных некодирующих РНК. Таких РНК больше, чем генов, которые их кодируют, потому что транскрипт, считанный с одного гена, разрезается на несколько самостоятельных молекул, каждая из которых функционирует как днкРНК. Группа длинных некодирующих РНК очень разнородна: некоторые ее представители являются антисмысловыми РНК (то есть транскриптами, считанными с белок-кодирующих генов, но в обратном направлении); другие соответствуют вырезанным из мРНК интронам; наконец, третьи считываются с длинных межгенных промежутков.
Функции, которые могут выполнять длинные некодирующие РНК, также в высшей степени разнообразны. Они могут регулировать транскрипцию белок-кодирующих генов, связываться с различными белками, влияя на их функционирование, а также контролировать процессы созревания других РНК, их экспорт из ядра и синтез белка. Кажется логичным, что в некоторых длинных некодирующих РНК могут найтись хотя бы совсем короткие открытые рамки считывания: длинная последовательность будет содержать рамку считывания с бóльшей вероятностью, чем короткая. Кроме того, длинные некодирующие РНК локализуются преимущественно в цитоплазме, где и происходит трансляция, и созревают так же, как мРНК: они транскрибируются РНК-полимеразой II, подвергаются сплайсингу, имеют кэп и поли(А)-хвост. Действительно, недавно подсчитали, что более 40% днкРНК потенциально могут транслироваться в пептиды, состоящие более чем из десяти аминокислотных остатков. Каким же образом удалось это установить? Как правило, применяли метод, известный как рибосомное профилирование (хотя, заметим, часто используют не совсем правильный перевод термина — «рибосомальный профилинг» — прим. ред.) [1].
Функциональные пептиды пока известны только для четырех длинных некодирующих РНК. У дрозофилы есть днкРНК pncr003:2L, которая содержит две открытые рамки считывания, соответствующие пептидам длиной менее 30 аминокислотных остатков. Оба этих пептида обнаруживаются в диадах — местах соединения Т-трубочек и цистерн саркоплазматического ретикулума в мышечных клетках. При нокауте или нокдауне соответствующего гена у мух наблюдается повышенная аритмия сердечных сокращений. Вероятнее всего, оба пептида участвуют в обмене кальция в мышечных клетках и взаимодействуют с кальциевой АТФазой саркоплазматического ретикулума, которая откачивает ионы кальция из цитозоля в саркоплазматический ретикулум в ходе расслабления мышцы [1].
О нокауте и нокдауне читайте в статье нашего спецпроекта «12 методов в картинках» «Генная инженерия. Часть II: инструменты и техники» [8].
У мышей есть пептид миорегулин (MLN), состоящий из 46 аминокислотных остатков и считывающийся с длинной некодирующей РНК. Он синтезируется в скелетных мышцах, но не в сердечной и гладких мышцах. Миорегулин связывается с изоформой кальциевой АТФазы саркоплазматического ретикулума, специфичной для скелетных мышц, и подавляет её работу, препятствуя откачке кальция из цитоплазмы в саркоплазматический ретикулум. Мыши, нокаутные по миорегулину, оказываются выносливее мышей дикого типа и имеют бóльшее содержание кальция в саркоплазматическом ретикулуме [1].
Мышиная длинная некодирующая РНК, известная как DWORF, тоже специфична для мышечной ткани и содержит открытую рамку считывания из 34 кодонов. Соответствующий пептид также взаимодействует с кальциевой АТФазой саркоплазматического ретикулума, препятствуя ее связыванию с миорегулином и другими пептидами, подавляющими ее активность, и таким образом способствует ее активной работе [1].
Человеческая длинная некодирующая РНК LINC00961 кодирует пептид из 90 аминокислотных остатков, получивший название SPAR. У мышей тоже есть этот пептид, однако он состоит из 75 аминокислот. SPAR локализуется в поздних эндосомах и лизосомах и взаимодействует с лизосомной АТФазой. У мышей, нокаутных по SPAR’у, наблюдается повышенная способность к регенерации мышц за счет усиленной работы сигнального пути mTORC1, который у мышей дикого типа подавляется SPAR’ом [1].
Предшественники микроРНК
МикроРНК представляют собой короткие одноцепочечные РНК длиной от 18 до 22 нуклеотидов. Процессинг микроРНК включает два основных этапа. На первом этапе длинный транскрипт, считанный с гена микроРНК и обозначаемый «при-микроРНК», разрезается на более короткие предшественники — пре-микроРНК. Далее пре-микроРНК выходят из ядра в цитоплазму и разрезаются на собственно микроРНК. Понятно, что микроРНК слишком коротки, чтобы что-то кодировать. А вот предшественники, например, при-микроРНК, вполне могут содержать открытые рамки считывания. Кроме того, при-микроРНК имеют кэп на 5′-конце и поли(А)-хвост на 3′-конце, как мРНК.
Пока что только у растений удалось выявить белковые продукты при-микроРНК. Первичный транскрипт miR171b люцерны усеченной содержит две рамки считывания, соответствующие пептидам длиной 20 и 5 аминокислотных остатков. Наиболее длинный пептид (miPEP171b) удалось выявить в зачатках боковых корней растения. Выяснилось, что miPEP171b способствует накоплению микроРНК, соответствующей тому же гену. Хотя бы одна открытая рамка считывания имеется у примерно 50 при-микроРНК резуховидки Таля — популярного модельного объекта. Удалось показать, что один из кодируемых ими пептидов, miPEP165a, консервативен среди всех капустноцветных и тоже повышает накопление микроРНК, считываемой с того же гена. Обработка проростков искусственным miPEP165a приводила к увеличению длины корней. Аналогичный эффект на соответствующие микроРНК показан для ряда других пептидов, считываемых с при-микроРНК, однако конкретный механизм, лежащий в основе этого эффекта, остается загадкой [1].
Кольцевые РНК
Кольцевые РНК — это молекулы РНК, ковалентно замкнутые в кольцо . Большинство кольцевых РНК содержит экзоны, однако типичная трансляция в их случае невозможна. Дело в том, что для посадки рибосомы на обычную мРНК необходим 5′-концевой кэп — видоизмененный гуаниновый нуклеотид. У кольцевых РНК нет концов, поэтому у них не может быть и кэпа. Однако некоторые клеточные и многие вирусные РНК транслируются без помощи кэпа. Для посадки рибосомы на них необходим особый элемент вторичной структуры, известный как IRES (англ. internal ribosome entry site), поэтому теоретически кольцевые РНК, содержащие IRES, могут транслироваться. Действительно, удалось экспериментально показать трансляцию искусственной кольцевой РНК, содержащей IRES, причем трансляция проходила по механизму катящегося кольца.
Кольцевым РНК посвящен обзор «Власть колец: всемогущие кольцевые РНК» [9].
Благодаря отсутствию концов трансляция кольцевых РНК, число нуклеотидов в которых кратно трем, может приводить к образованию длинных полипептидов (теоретически бесконечной длины), состоящих из повторяющихся блоков одних и тех же аминокислот. В этом случае ограничение длины пептида будет связано лишь с процессивностью (то есть способностью функционировать, не отсоединяясь от матрицы) рибосомы. Если же число нуклеотидов в кольцевой РНК не кратно трем, то каждый оборот трансляции будет сопровождаться сдвигом рамки считывания, и продуктом будет цепочка из повторов трех различных полипептидов. Нечто похожее происходит у некоторых вироидов — субвирусных агентов, геном которых представлен кольцевой молекулой РНК. У них три разных полипептида образуются с одной и той же кольцевой РНК за счет сдвигов рамки считывания. Однако свидетельств в пользу существования такой «бесконечной» трансляции в клетках пока нет [10].
Пока совсем немного экспериментальных свидетельств и в целом трансляции клеточных кольцевых РНК. У дрозофилы удалось «поймать» рибосому с помощью профилирования на 37 кольцевых РНК, однако для большинства РНК соответствующие им пептиды не идентифицированы. Удалось, однако, выделить пептид, считываемый с кольцевой РНК circMbl. Другая кольцевая РНК, circ-ZNF609, содержит открытую рамку считывания длиной 753 нуклеотида, и многие молекулы этой РНК выделены в составе полисомных комплексов (то есть связанными с несколькими рибосомами). Кроме того, в ней содержится последовательность, соответствующая IRES. С помощью искусственных конструктов удалось показать возможность трансляции открытой рамки считывания из circ-ZNF609, однако сам пептид не выделили. У человека обнаружили 250 кольцевых РНК, связанных с полисомами, и идентифицировали 33 пептида, закодированных кольцевыми РНК [1].
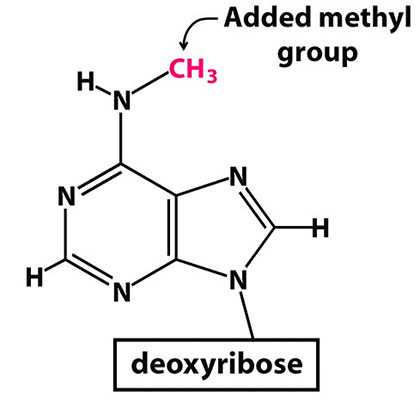
Рисунок 2. Метилированный аденозин (m6A)
Catalytic strategies outline, рисунок с изменениями
Многие мРНК (как клеточные, так и вирусные) подвергаются особой модификации — метилированию аденозина (сокращенное обозначение m6A). Метилирование аденозина заключается в присоединении метильной группы к атому азота у шестого атома углерода аденина (рис. 2).
Функциональное значение этой модификации состоит в создании сайтов связывания для различных белков. Мотивы, которые наиболее часто подвергаются метилированию аденозина, выявлены и во многих кольцевых РНК. Чтобы проверить, влияет ли метилирование аденозина на трансляцию кольцевых РНК, проанализировали интенсивность трансляции искусственных кольцевых РНК, кодирующих зеленый флуоресцентный белок (GFP) . Оказалось, что кольцевые РНК, содержащие по крайней мере один метилированный остаток аденозина, транслируются активнее, а мутации, делающие метилирование невозможным, отрицательно сказываются на эффективности трансляции [1].
Зеленый флуоресцентный белок стал верным помощником ученых в изучении самых разнообразных клеточных процессов. Об открытии и применении GFP можно прочитать в нашей статье «Флуоресцирующая Нобелевская премия по химии» [11]
На что может влиять трансляция некодирующих РНК
Наряду со специфическими эффектами, связанными с трансляцией конкретных некодирующих РНК, трансляция нкРНК в целом также может иметь значение для физиологии клетки и развития болезней. Даже нефункциональные пептиды могут сказываться на жизнедеятельности клетки, например, могут выступать в роли аутоантигенов, вызывающих аутоиммунный ответ . Стоит также отметить, что методы, которыми мы сейчас располагаем, не позволяют идентифицировать редкие или быстро разрушаемые пептиды, которые, тем не менее, могут быть физиологически значимы. Кроме того, многие некодирующие РНК транслируются только в клетках определенного типа или при особых условиях. Наконец, сама трансляция может иметь эффекты, не связанные с образованием новых белков. В некоторых случаях трансляция запускает разрушение транслируемого транскрипта, например, по пути нонсенс-опосредованного распада (англ. nonsense-mediated decay, NMD). Подавление NMD в мышиных эмбриональных стволовых клетках привело к повышению экспрессии (более чем в полтора раза) 46 из 265 проанализированных длинных некодирующих РНК. Трансляция днкРНК также может сказываться на их локализации [1], [10].
Различным аспектам аутоиммунитета посвящен спецпроект «Биомолекулы» «Аутоиммунные заболевания».
Подводя итог, можно сказать, что мы только-только начали приоткрывать завесу тайны над трансляцией некодирующих РНК и знаем совсем немного, поэтому будем с нетерпением ждать новых открытий в этой интереснейшей области молекулярной биологии.
Литература
- Lian-Ju Li, Rui-Xue Leng, Yin-Guang Fan, Hai-Feng Pan, Dong-Qing Ye. (2017). Translation of noncoding RNAs: Focus on lncRNAs, pri-miRNAs, and circRNAs. Experimental Cell Research. 361, 1-8;
- Обо всех РНК на свете, больших и малых;
- Большие дела небольших молекул: как малые РНК дирижируют генами бактерий;
- Двухцепочечная РНК защищает трансгенные растения только от нежелательных насекомых;
- Есть ли смысл в антисенсах?;
- 12 методов в картинках: полимеразная цепная реакция;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Власть колец: всемогущие кольцевые РНК;
- Lesca M. Holdt, Alexander Kohlmaier, Daniel Teupser. (2017). Molecular roles and function of circular RNAs in eukaryotic cells. Cell. Mol. Life Sci.;
- Флуоресцирующая Нобелевская премия по химии.