Есть ли смысл в антисенсах?
03 октября 2017
Есть ли смысл в антисенсах?
- 5425
- 0
- 12
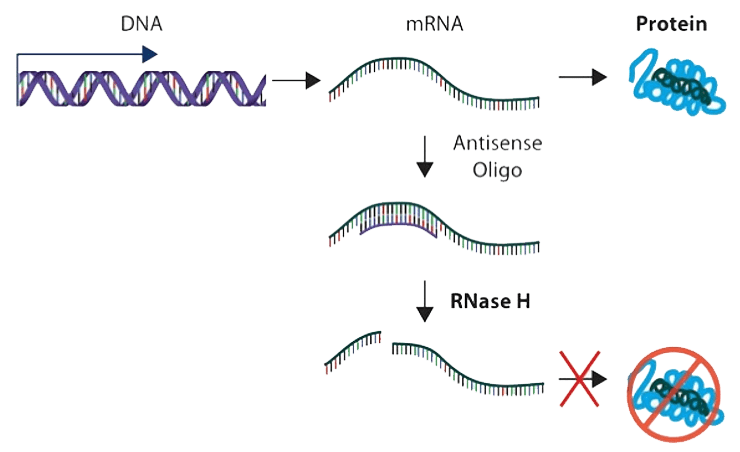
Схема действия ДНК-антисенсов.
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Что такое антисенсы, каков их механизм действия, в чем отличия этого класса лекарств? Как модификации антисенсов позволяют добиться приемлемых лекарственных свойств? Как им удалось выйти на рынок и какие антисенсы могут появиться на рынке в ближайшее время? Есть ли вообще будущее у антисенсов? Ответы на эти и многие другие вопросы вы найдете в статье.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Антисенсы (antisense oligonucleotides, антисмысловые олигонуклеотиды) — это класс лекарственных препаратов, представляющих собой относительно короткие нуклеотидные цепочки (как правило, 16–20 нуклеотидов). Это могут быть как немодифицированные РНК и ДНК, так и олигонуклеотиды, содержащие всевозможные модификации самих звеньев или концов цепочки. Антисмысловыми они называются потому, что комплементарны смысловой последовательности нуклеотидов, кодирующей белковую цепь, то есть последовательности мРНК.
В простейшем случае антисенсы связываются с мРНК и блокируют трансляцию белка, не позволяя рибосоме продвигаться по кодирующей цепи. Более сложные механизмы используют клеточные средства деградации дуплексов ДНК–РНК и РНК–РНК. Так, РНКаза Н с высокой специфичностью расщепляет РНК, находящуюся в комплексе с ДНК (заглавный рисунок) [1]. А, например, механизм РНК-интерференции позволяет направить на деградацию комплекс РНК–РНК (рис. 1) [2].

Рисунок 1. Схема РНК-интерференции. Двухцепочечная РНК процессируется ферментом Dicer, затем короткие фрагменты включаются в нуклеопротеиновый комплекс RISC, который разрушает мРНК, содержащую участки, комплементарные РНК в составе комплекса.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Также антисенсы могут связываться с малыми интерферирующими РНК (миРНК) и тем самым модулировать экспрессию не одного, а сразу нескольких белков. Еще одна возможность — регулировать процесс сплайсинга или трансляции мРНК таким образом, чтобы вместо дефектного белка получался функциональный (см. далее описание препаратов eteplirsen и nusinersen).
Очевидная идея — использовать описанные подходы для снижения или увеличения уровня экспрессии белков, участвующих в развитии патологии, — привела к разработке ряда препаратов класса антисенсов.
Рациональный дизайн традиционных лекарств обычно долог и дорогостоящ. Он начинается с поиска мишени — чаще всего белка, участвующего в патологическом процессе. Затем, если речь идет об обычных лекарственных средствах, представляющих собой не очень большие химические молекулы, нужно найти ряд соединений, которые будут связываться с этой мишенью — они называются hits (хиты). Это, как правило, делается в процессе высокопроизводительного скрининга. Сейчас часть работы проводят расчетными способами, на компьютерах. Следующая стадия — hit-to-lead optimization — предполагает выбор из хитов тех структур, которые связываются с мишенью наиболее специфично, селективно, и удовлетворяют ряду правил. На каждой стадии может не получиться найти нужную структуру, а иногда полученную структуру очень сложно синтезировать.
Антисенсы лишены всех этих недостатков: после того, как мишень определена, нужно лишь синтезировать олигонуклеотид, поведение которого во многом известно заранее. Если у вас уже есть платформа, которая доказала свою эффективность в каком-то показании, не составит труда сделать антисенс против новой мишени. По сравнению с малыми молекулами снижаются риски того, что не удастся найти подходящий лекарственный кандидат, ускоряются сроки ранней разработки и снижается ее стоимость. Еще одно из преимуществ антисенсов — их более предсказуемое поведение в организмах различных видов по сравнению с малыми молекулами и белками.
Так все это выглядело в теории, и ряд компаний принялся за разработку и оптимизацию антисенсных технологий. Но на этом пути ученые сразу столкнулись с проблемами.
Первая проблема, которую пришлось решать исследователям в начале 1990-х годов, когда началась клиническая разработка антисенсов, — плохая растворимость и нестабильность природных олигонуклеотидов, особенно РНК, при физиологических условиях. И в клетках, и во внеклеточной среде присутствуют нуклеазы, расщепляющие антисенсы за минуты. Сразу стало понятно, что необходима модификация «природных» олигонуклеотидов для защиты от ферментов.
Типы модификаций
Модификации подвергается как основная цепь (включение бора или серы вместо кислорода фосфатных остатков), так и сахарные остатки и нуклеотиды (применение неприродных аналогов нуклеотидов). Все эти модификации делают нуклеотидную цепь устойчивой к расщеплению нуклеазами и повышают период полувыведения до нескольких часов или даже дней.
Первая модификация, которая привела к получению стабильных антисенсов и позволила валидировать технологию у лабораторных животных и людей — добавление фосфоротиоата (PS) в основную цепь (замена одного из кислородных остатков фосфатной цепи на серу, рис. 2). Эта замена позволила повысить полианионные свойства антисенсов, увеличив их сродство к белкам плазмы, что привело к росту периода полувыведения. Такие антисенсы (например, fomivirsen, о котором ниже) получили название антисенсов первого поколения.
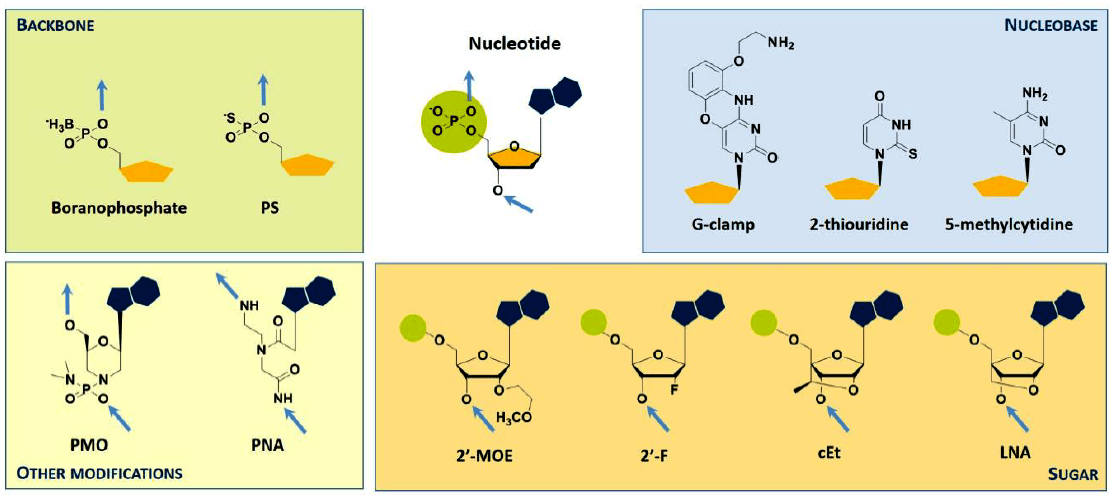
Рисунок 2. Примеры модификаций олигонуклеотидов. Голубыми стрелками показано положение элонгации цепи. Условные обозначения: PS — фосфоротиоатная связь; PMO — фосфоролиамидатно-морфолиновые олигонуклеотиды; PNA — пептидные нуклеиновые кислоты; MOE — метоксиэтил; сEt — «связанный» этил; LNA — «скрепленная» нуклеиновая кислота (locked nucleic acid).
Чтобы увидеть рисунок в полном размере, нажмите на него.
Множество других модификаций было разработано для дальнейшего улучшения растворимости, стабильности и фармакокинетических свойств. Особенно стоит отметить введение 2’-О-метоксиэтильной группировки (МОЕ) в остаток рибозы, что позволило повысить сродство антисенса к РНК и дополнительно увеличить устойчивость к расщеплению нуклеазами по сравнению с антисенсами первого поколения [3].
Еще один способ повысить стабильность олигнонуклеотидов, который можно сочетать с предыдущим — это их конъюгация с другими химическими веществами: пептидами, липидами, углеводами, малыми молекулами.
Другая проблема — для того чтобы оказать терапевтический эффект, препарат должен достичь целевого органа и попасть внутрь клетки. Свободные олигонуклеотиды накапливаются в почках, печени и селезенке. Если требуется воздействовать на другие органы, для создания там достаточно высокой концентрации нужно было бы вводить очень большие количества препарата, токсичные для печени и почек. Кроме того, немодифицированной нуклеиновой кислоте, заряженной отрицательно, трудно проникнуть через гидрофобный липидный бислой клеточной мембраны. Большинство немодифицированных антисенсов попадают в клетку с помощью эндоцитоза [4] и оказываются из-за этого не в том внутриклеточном компартменте. Для решения проблем адресной доставки необходимо сочетание модификаций антисенсов и других подходов: в первую очередь, конъюгация с другими химическими веществами (пептидами, липидами, углеводами, малыми молекулами) или использование носителей — липосом, наночастиц, вирусных векторов (рис. 3) [5], [6].
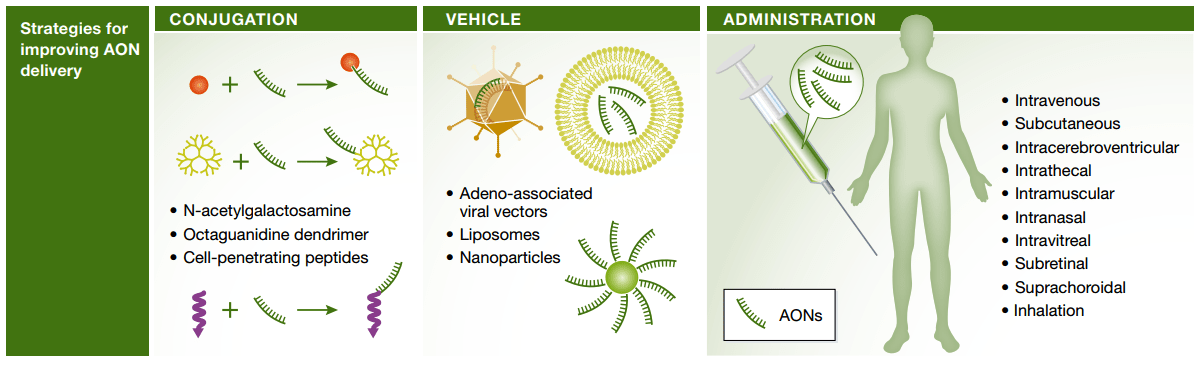
Рисунок 3. Стратегии доставки антисенсов.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Наконец, большой проблемой остается специфичность и селективность антисенсов. Во-первых, мРНК образуют вторичные и третичные структуры, тем самым скрывая часть последовательностей. Поэтому требуется тщательный анализ и скрининг последовательности целевой мРНК для определения оптимального места связывания антисмысловой цепи. Во-вторых, антисенс, несмотря на все модификации, может частично деградировать, его фрагменты будут связываться не с мРНК мишени, а с мРНК других белков, что может привести к токсичности. Многие ДНК, особенно модифицированные фосфоротиоатом, связываются с рядом белков, что также может служить причиной токсичности. Наконец, в-третьих, ДНК и РНК для иммунной системы являются сигналом опасности, поэтому их введение часто вызывает воспаление — у пациентов наблюдаются реакции в месте введения и гриппоподобные симптомы [7]. Есть и более сложные механизмы развития токсичности: антисенсы активируют систему комплемента, что может приводить к васкулитам (воспалению эндотелия) и гломерулонефриту (воспалению почечных клубочков) [7]. Правда, в основном, эти эффекты пока наблюдались у приматов, отличных от человека.
В итоге все вышеуказанные проблемы могут привести (и приводят, как мы увидим ниже) либо к недостаточной эффективности, либо к недостаточной безопасности антисенсов: основными потенциально опасными токсическими проявлениями всего класса антисенсов являются печеночная и почечная токсичности и тромбоцитопения. Помимо этого, каждый антисенс может обладать своей собственной токсичностью, зависящей от его индивидуальной структуры и от того, с какими мишенями в организме он связывается. Сейчас, по мере накопления опыта, ученые уже научились предсказывать на основе теоретических расчетов и экспериментов на животных, какие структуры будут наиболее токсичны, причем точность прогноза в этой области выше, чем в случае малых молекул. Однако, несмотря на это, в клинических исследованиях наблюдаются неожиданные эффекты, из-за чего большинство антисенсов пока что провалились. Упомянем несколько самых заметных провалов.
Провалы
Строго говоря, первый антисенс, вышедший на рынок, нельзя назвать полностью провальным, однако сейчас он уже больше не применяется.
Антисенсы синтезировали и опробовали на клетках еще в 1978 году [4]. Однако только в 1998 был зарегистрирован fomivirsen (Novartis) — фосфоротиоатная ДНК, комплементарная последовательности мРНК цитомегаловируса (CMV), кодирующей белки, необходимые для репликации вируса. Препарат предназначался для местного применения (инъекции в глаз) при воспалении сетчатки, вызванном CMV у пациентов с ВИЧ. Перечень его побочных эффектов довольно велик, в первую очередь это: местное воспаление, ухудшение зрения, катаракта, кровотечение конъюнктивы, боль, повышение глазного давления, отек и отслоение сетчатки, а также более редкие системные эффекты, такие как анемия, диарея, астения, головная боль, пневмония, сепсис и другие. В связи с разработкой эффективной антиретровирусной терапии против ВИЧ проблема ретинита отошла на второй план, поэтому препарат отозвали в Европе и США в 2002 и 2006 году соответственно.
Разработка антисенса alicaforsen (Atlantic) началась еще в 1995 году. Это антисенс против мРНК рецептора ICAM-1 — одного из рецепторов на поверхности эндотелия, который отвечает за проникновение в ткани лейкоцитов во время воспаления (рис. 4) [8], [9]. Поэтому разработчики пытались использовать аликафорсен для лечения тяжелых форм аутоиммунных воспалительных заболеваний — ревматоидного артрита, псориаза, болезни Крона (одного из воспалительных заболеваний кишечника). Однако в фазе 3 он оказался недостаточно эффективен в терапии болезни Крона [10], после чего остальные разработки были также остановлены. Тем не менее, сейчас разработку возобновили — вместо подкожного и внутривенного введения решено использовать местное (в виде клизмы), — и начали исследования фазы 3 по язвенному колиту и резервуарному илеиту (еще двух разновидностей воспалительных заболеваний кишечника).
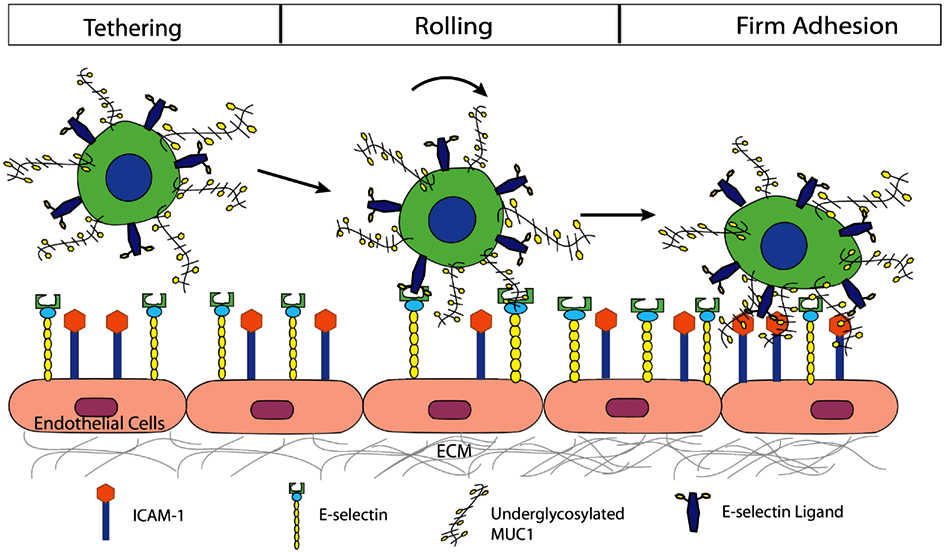
Рисунок 4. Роль ICAM-1 во взаимодействии Т-лимфоцитов (зеленые клетки сверху) с эндотелием. ICAM-1 играет роль на поздней стадии взаимодействия, обеспечивая плотное прикрепление лимфоцита перед проникновением за эндотелий.
Чтобы увидеть рисунок в полном размере, нажмите на него.
В области онкологии на антисенсы возлагали довольно большие надежды, так как требования к безопасности лекарств для раковых больных не такие строгие, как в других областях. Так, долгое время в разработке по ракам легкого, простаты и молочной железы находился custirsen (Oncogenex) — антисенс против белка кластерина. Кластерин — секретируемый белок, который экспрессируется на повышенном уровне при многих раках, особенно устойчивых к терапии, и способствует эпителиально-мезенхимальному переходу , метастазированию опухоли, повышает устойчивость раковых клеток к апоптозу. Данные исследований фазы 2 выглядели весьма обнадеживающе: например, медиана общей выживаемости у пациентов с метастатическим раком простаты оказалась 23,8 месяцев в опытной группе и 16,9 в контрольной. Однако вслед за этим последовали провалы исследований фазы 3 по раку легкого и раку простаты, связанные с недостаточной эффективностью, и программу закрыли.
ЭМП является критическим процессом запуска метастазирования. В ходе ЭМП изначально поляризованные эпителиальные клетки приобретают свойства мезенхимальных и начинают инвазию в ткани. Аналогичные процессы наблюдаются в эмбриогенезе, например, во время гаструляции и миграции клеток нервного гребня. ЭМП характеризуется утратой клеточной полярности и снижением экспрессии эпителиальных белков — прежде всего, Е-кадерина, а также окклюдина, клаудина, цитокератинов и катеининовых белков. Кадерины и катенины участвуют в регуляции клеточной адгезии клеток. В результате, клетки приобретают веретенообразный вид, усиливается клеточная миграция, начинают экспрессироваться мезенхимальные белки — N-кадгерин, виментин, тенасцин С, ламинин-бета 1, коллаген типа IV, различные протеиназы [11].
Еще один антисенс в области онкологии — trabedersen (Autotelic) против TGF-β2. В данном случае сам выбор мишени довольно сомнителен — данный цитокин принимает участие во множестве процессов, связанных с воспалением, фиброзом, онкогенезом, причем его роль и роль рецепторов, на которые он действует, очень сильно зависит от конкретного типа клеток. Так, на ранних стадиях развития опухоли TGF-β2 является ингибитором роста опухоли и онкосупрессором, а на поздних — стимулятором прогрессии рака [12], [13]. Трабедерсен разрабатывали против глиомы, меланомы и рака поджелудочной железы, и в первых, несравнительных клинических исследованиях, он показал неплохие результаты. Однако фаза 3 по глиомам была остановлена из-за медленного набора пациентов. С 2013 года новостей о других клинических исследованиях не поступало.
Антисенс aganirsen (Gene Signal), связывающийся с мРНК IRS-1, разрабатывали по множеству показаний (в основном, офтальмологическим) — диабетической ретинопатии, окклюзии вен сетчатки, диабетическому макулярному отеку, неоваскуляризации роговицы , псориазу. По всем показаниям, кроме неоваскуляризации роговицы, разработка остановлена. Причина не сообщается, но, скорее всего, это неэффективность. IRS-1 (Insulin Receptor Substrate 1) — внутриклеточный белок, участвующий в передаче сигнала от инсулинового рецептора через каскад фосфорилирующих белков-киназ к факторам транскрипции (рис. 5) [14]. Таким образом, он играет ключевую роль в ответе клеток на инсулин, а также участвует в образовании новых сосудов, увеличивая выработку сосудистого фактора роста VEGF и интерлейкина-1β. Кроме того, IRS-1 играет важную роль в опухолевой прогрессии, как напрямую, стимулируя подвижность и выживаемость раковых клеток, так и опосредованно, способствуя прорастанию новых сосудов в опухоль. В фазе 3 по неоваскуляризации роговицы не удалось достичь главной цели — достоверного различия в остроте зрения между экспериментальной и плацебо-группами, хотя по некоторым другим показателям различие наблюдалось [15]. Несмотря на то, что такие данные не позволяют зарегистрировать препарат на рынке, компания Gene Signal, которая его разрабатывает, считает, что не все потеряно и продолжает исследования [16].
Неоваскуляризация — образование новых кровеносных сосудов. Этот процесс может привести к отторжению роговицы после пересадки.

Рисунок 5. Инсулин активирует инсулиновый рецептор, что приводит к фосфорилированию IRS-1. Это запускает ряд сигнальных путей внутри клетки.
Успехи
Когда речь идет об успехах в области антисенсов, мы, к сожалению, все время должны говорить с оговорками и с осторожностью. Например, препарат mipomersen (Sanofi) подавал большие надежды в лечении патологий, связанных с повышенным содержанием липопротеинов низкой плотности (LDL) в крови. LDL являются основными переносчиками холестерина, и их часто называют «плохим холестерином» из-за связи с риском атеросклероза, ведущего к повышению риска инсульта, инфаркта миокарда и других сердечно-сосудистых осложнений. Мипомерсен связывается с мРНК, кодирующей белок ApoB-100 — один из основных компонентов LDL, — и снижает его экспрессию. Как было показано в клинических исследованиях у пациентов с наследственной гомо- и гетерозиготной гиперхолестеринемией, мипомерсен действительно снижал LDL в сыворотке пациентов, однако значимо повышал риск гепатотоксичности [17]. Поэтому FDA (Food and Drug Administration, Управление США по контролю за лекарствами и пищевыми продуктами) одобрило препарат только для ограниченного использования (в сертифицированных центрах и аптеках), а ЕМА (Европейское медицинское агентство) отказало ему в регистрации.
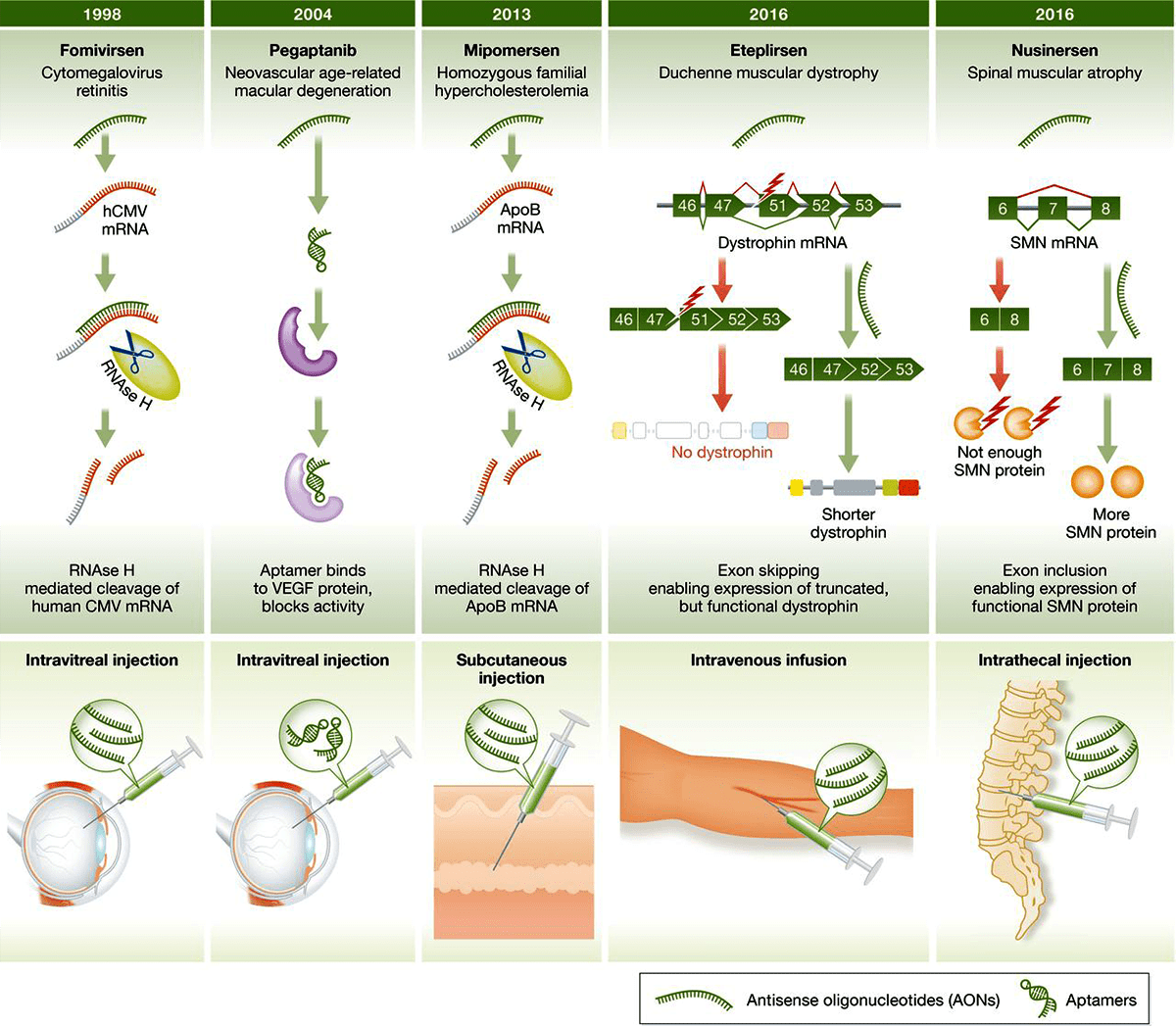
Рисунок 6. Одобренные FDA антисенсы: механизм действия, природа, год регистрации.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Eteplirsen (Sarepta) — наиболее скандальный препарат класса антисенсов, разработан для лечения миодистрофии Дюшенна (DMD). DMD возникает при дефектах в гене дистрофина — структурного белка мышечных клеток, защищающего мышцы от повреждений, вызванных растягиванием (рис. 7) [18]. При DMD наступает прогрессирующая мышечная слабость скелетных мышц, которая к 12 годам приводит к глубокой инвалидности. Средний срок жизни больных составляет 20–30 лет. Этеплирсен — это РНК-олигонуклеотид, комплементарный участку гена дистрофина в районе экзона 51, который, связываясь с пре-мРНК дистрофина, заставляет рибосому пропустить экзон и таким образом синтезировать неполный, но работающий белок (рис. 8). Такой тип терапии получил называние exon-skipping therapy [19].
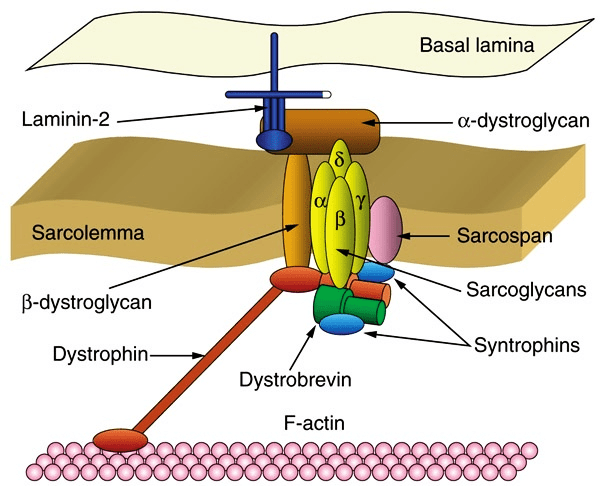
Рисунок 7. Дистрофин соединяет актиновые филаменты с белковым комплексом в мембране мышечной клетки.
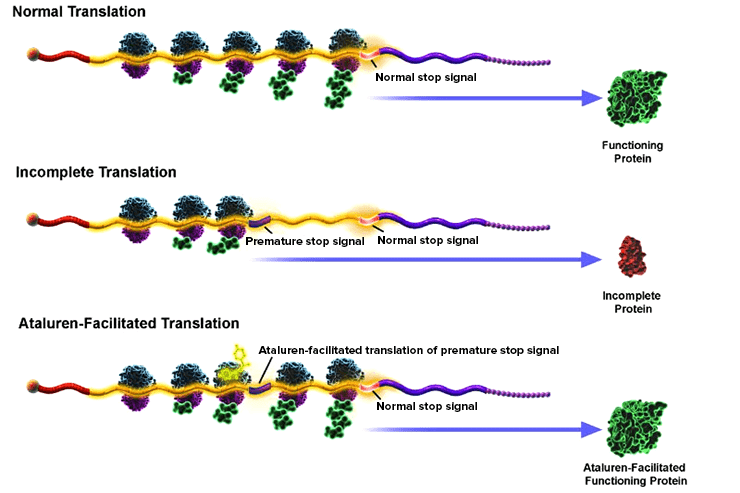
Рисунок 8. В результате генетического дефекта нормальная трансляция белка (верхняя картинка) не доходит до конца и обрывается, поэтому получается нефункциональный белок (средняя картинка). Препараты, относящиеся к классу exon-skipping therapy, связываются с мРНК и заставляют рибосому пропускать дефектный участок. В результате получается функционирующий белок (нижняя картинка).
Этеплирсен исследовали на 12 пациентах и показали увеличение количества функционального дистрофина в мышцах по сравнению с уровнем до лечения. По функциональному показателю — тест 6-минутной ходьбы — у пациентов в среднем почти не наблюдалось ухудшений. Однако небольшое количество пациентов и отсутствие прямого сравнения не позволяет с уверенностью интерпретировать эти данные. Компания подала заявку на регистрацию в FDA еще в 2015 году, и после нескольких заседаний, в июне 2016, агентство потребовало предоставить больше данных об экспрессии дистрофина в мышцах. Данные из нового исследования показали, что у 13 пациентов средний прирост дистрофина составил с 0,16% до 0,44% от нормального. Причем прирост наблюдался менее чем у половины пациентов [20]. Самый большой вопрос заключается в том, достаточно ли такого небольшого повышения количества дистрофина для замедления прогрессии заболевания. Под давлением общественности eteplirsen все-таки был зарегистрирован FDA вопреки отрицательному заключению панели экспертов. Однако FDA потребовало проведения клинического исследования для подтверждения того, что лекарство улучшает физиологические функции больных, а не только повышает уровень дистрофина в мышцах. Например, антисенс drisapersen (BioMarin) показал похожие результаты в раннем исследовании на 12 пациентах, а потом в фазе 3 на 300 пациентах статистически значимых различий с плацебо не было, и программу закрыли. Если исследование этеплирсена не покажет физиологических улучшений, лекарство будет отозвано.
В FDA в связи с этеплирсеном разгорелся нешуточный скандал: предыдущий глава комиссии по одобрению новых лекарств, который был против препарата, и некоторые другие чиновники уволились после заседания комиссии, а большую роль в одобрении лекарства сыграла нынешняя директор комиссии Джанет Вудкок (Janet Woodcock) вопреки открытой критике со стороны и начальства, и подчиненных. Официальные лица в FDA настоятельно рекомендуют другим компаниям не следовать примеру Sarepta и предоставлять только качественные данные для обоснования регистрации своих продуктов.
Антисенс nusinersen (Biogen) — пожалуй, единственный антисенс, получивший на настоящий момент одобрение в Европе, США и других странах, и пока не скомпрометировавший себя ни скандалами, ни отказами, ни побочными действиями. Это первый препарат, доказавший свою эффективность при спинальной мышечной атрофии у взрослых и детей. Спинальная мышечная атрофия — редкое, зачастую смертельное заболевание, связанное с дефектами гена SMN1 (Survival Motor Neuron 1). Белок, который кодируется этим геном, входит в состав внутриклеточных комплексов, которые необходимы для выживания моторных нейронов. Первыми страдают нейроны спинного мозга, что приводит к мышечной атрофии и гибели от дыхательной недостаточности, причем это заболевание — причина большинства детских смертей от врожденных заболеваний. Спинальная мышечная атрофия — уникальное генетическое заболевание, в том смысле, что у человека есть еще одна копия гена, SMN2, но производимый ею белок SMN∆7 не содержит одного из важных экзонов (номер 7), и поэтому не полностью функционален. Ученым удалось создать такой антисенс, который связывается с мРНК SMN2 и так модулирует сплайсинг, что седьмой экзон включается в состав белка (рис. 9) [21], [22]. Несколько клинических исследований показали высокую безопасность и эффективность нового препарата: в ключевом исследовании улучшение наступило у 40% пациентов в опытной группе и у 0% — в контрольной. В другом исследовании смертность составила 15% в опытной группе против 32% в контрольной. На этом основании нусинерсен в 2016 зарегистрировали в США, ЕС и Японии.

Рисунок 9. Механизм действия нусинерсена.
Перспективы
В разработке на фазе 3 сейчас находится 12 антисенсов (табл. 1), на фазе 2 — 62 препарата. Упомянем наиболее перспективные из них.
| Название | Тип | Мишень | Показание | Компания |
|---|---|---|---|---|
| alicaforsen | PS-ДНК | ICAM1 | Резервуарный илеит | Atlantic Healthcare |
| aganirsen | PS-ДНК | IRS-1 | Неоваскуляризация роговицы | Gene Signal |
| mongersen | PS-ДНК | Smad7 | Болезнь Крона | Celgene |
| trabedersen | PS-ДНК | TGF-β2 | Глиобластома, меланома, рак поджелудочной железы | Autotelic |
| volanesorsen | 2’-MOE-ДНК | ApoCIII | Наследственная гиперлипопротеинемия | Akcea Therapeutics |
| QPI-1002 | Двухцепочечная 2’-MOE-РНК | p53 | Отторжение почечного транспланта | Quark Pharmaceuticals |
| QPI-1007 | Двухцепочечная 2’-MOE-РНК | каспаза-2 | Оптическая нейропатия | Quark Pharmaceuticals |
| inotersen | 2’-MOE-ДНК | TTR | Наследственные амилоидные нейропатии | Ionis |
| patisiran | Двухцепочечная РНК в липидной наночастице | TTR | Наследственные амилоидные нейропатии | Alnylam |
| SYL-1001 | Двухцепочечная РНК | TRPV1 | Синдром сухого глаза с синдромом Съегрена | Sylentis |
| golodirsen | exon-skipping PMO-РНК | дистрофин | Мышечная дистрофия Дюшенна | Sarepta |
| SRP-4045 | exon-skipping PMO-РНК | дистрофин | Мышечная дистрофия Дюшенна | Sarepta |
Patisiran (компания Alnylam) представляет собой упакованную в липосомы малую интерферирующую РНК (siRNA, или миРНК), комплементарную гену белка TTR. Препарат находится на фазе 3 клинических исследований по TTR-амилоидозу. TTR — это основной транспортный белок витамина А. В норме TTR образует тетрамеры, однако мутации могут приводить к образованию мономерной формы TTR, что вызывает амилоидные внеклеточные отложения белка в жизненно важных органах, например, в сердце и нервных волокнах. Это может в итоге привести к сердечной недостаточности, полинейропатиям и смерти [22]. Антисенс снижает синтез TTR в печени и тем самым уменьшает депонирование мутантного белка в органах. Поскольку, как уже говорилось, антисенсы имеют более высокое сродство к печени, чем к другим органам, есть основания полагать, что концентрации препарата будет достаточно для оказания терапевтического эффекта. В фазе 2 препарат показал снижение экспрессии TTR на 80–90%, снижение амилоидных отложении на 78% и улучшение показателей у пациентов с нейропатиями. Буквально в процессе подготовки этой статьи, 20 сентября 2017 года, опубликовали результаты фазы 3, в которой препарат достиг всех первичных и вторичных конечных точек. По сравнению с плацебо он достоверно улучшал показатели по нейропатической шкале и качество жизни пациентов. Теперь его шансы выйти на рынок очень велики, и тогда это будет первый зарегистрированный препарат, работающий на принципе РНК-интерференции. Препарат против той же мишени, но на основе ДНК-антисенса, inotersen, разрабатывает компания Ionis.
На препарат fitusiran (Alnylam) до последнего времени возлагались очень большие надежды. Он представляет собой двухцепочечную РНК для ингибирования экспрессии серпина С1 (антитромбина), чем способствует увеличению активированного фактора Х, необходимого для перехода протромбина в тромбин (рис. 10) [23]. Тем самым препарат повышает сворачиваемость крови и может быть показан при обоих типах гемофилии (А и В). На рынке есть ряд плазматических и рекомбинантных внутривенных факторов свертывания крови (фактор VIII применяется при гемофилии А, а фактор IX — при гемофилии В), однако у фитусирана есть несколько преимуществ перед ними. Помимо удобства применения (препарат вводится подкожно один раз в месяц), белковые препараты обладают и важным недостатком — у многих пациентов развиваются нейтрализующие антитела, и препараты перестают действовать. Поскольку фитусиран имеет небелковую природу и действует по другому механизму, он потенциально будет помогать и тем пациентам, у которых выработались подобные нейтрализующие антитела.
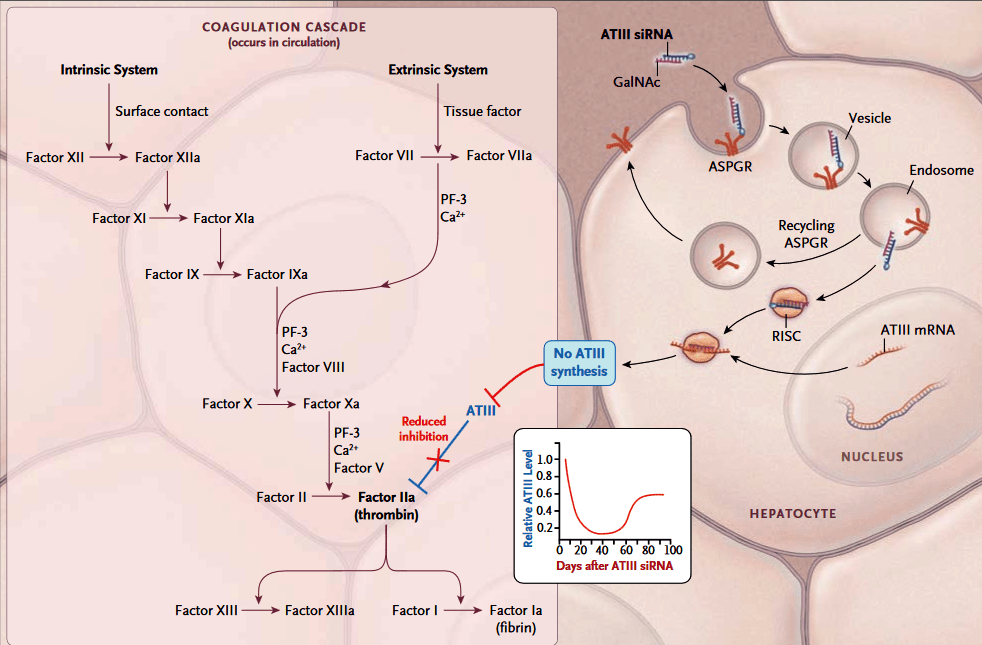
Рисунок 10. Механизм действия фитусирана.
Чтобы увидеть рисунок в полном размере, нажмите на него.
По данным фазы 1/2 препарат показал признаки эффективности и безопасности: у половины пациентов вообще не было кровотечений, а у 69% не было спонтанных кровотечений в течение периода наблюдения. Но в сентябре 2017 года произошло то, чего все опасались: один из пациентов в исследовании скончался от тромбоза после применения фитусирана. К сожалению, найти баланс между терапевтической и опасной дозой препарата в каждом случае довольно сложно. Сейчас компания приостановила все исследования фитусирана и проводит тщательный анализ случившегося в поисках возможности продолжения исследований.
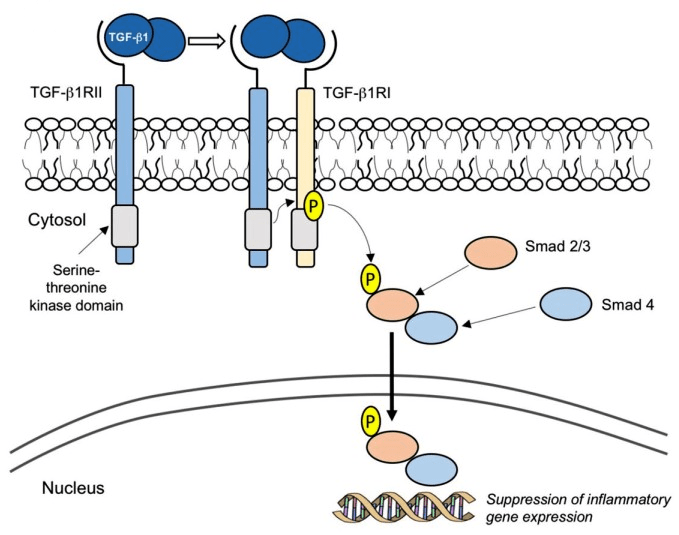
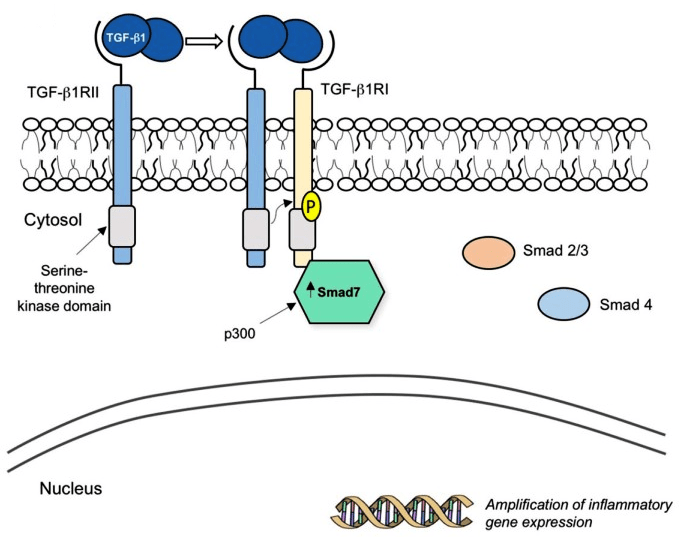
Препарат mongersen (Celgene) направлен против гена, кодирующего Smad7 — внутриклеточный белок, который связывается с рецептором TGF-β1 и прерывает противовоспалительный сигнальный каскад (рис. 11). В норме TGF-β1 подавляет активность эффекторных Т-клеток и макрофагов и способствует периферической дифференцировке FOXP3+ Tregs (regulatory T cells) — подтипа Т-клеток, обеспечивающего снижение воспаления. При воспалительных заболеваниях кишечника (болезни Крона, язвенном колите) наблюдается сверхэкспрессия и повышенная активация Smad7, что приводит к дальнейшему развитию хронического воспаления и повреждению тканей. В фазе 2 по болезни Крона монгерсен в высоких дозах показал значительное превосходство над плацебо по показателю доли пациентов с клинической ремиссией через 15 дней — 55–65% в экспериментальной группе против 10% в плацебо-группе [24]. Сейчас идет фаза 3, и в течение ближайших трех лет мы узнаем, воспроизведутся ли результаты на большем количестве пациентов.
Выводы
Несмотря на весь первоначальный оптимизм по отношению к антисенсам, приходится признать, что вопреки прекрасным теоретическим предпосылкам и первоначальным данным, лекарства класса антисенсов пока не оправдывают возлагаемых на них надежд. На рынке сейчас находится всего три препарата, один из которых (mipomersen) довольно токсичен и поэтому используется мало, второй (eteplirsen) пока недостаточно исследован и, если он не покажет эффективности в крупных исследованиях, может быть отозван, и только nusinersen пользуется успехом благодаря очень удачному выбору показания и мишени.
Из препаратов на фазе 3 хорошие перспективы просматриваются для анти-TTR препаратов по системному амилоидозу. Опять же, локализация мишени в печени и выбор показания дают надежды на высокую эффективность и безопасность препаратов.
У антисенсов очень богатая история провалов — разработка более 400 молекул остановлена из-за недостаточной эффективности или безопасности.
Отвечая на вопрос, поставленный в заголовке, можно сказать, что разработка антисенсов имеет смысл, но сфера их применения сильно ограничена специальными случаями — редкими заболеваниями, при которых именно манипуляции с мРНК позволяют добиться терапевтического эффекта. Казалось бы, привлекательными показаниями являются вирусные и бактериальные инфекции, так как в этом случае исключается on-target токсичность (токсичность, связанная с воздействием на целевую мишень, в отличие от off-target токсичности, связанной с воздействием на все остальные мишени). Однако в разработке на фазе 3 находится всего лишь несколько антисенсов против гепатитов В и С.
У ученых накапливается все больше данных о том, как повысить безопасность и эффективность антисенсов, однако до сих пор из них не получилось настолько универсального инструмента разработки лекарств, какими являются малые молекулы или, например, антитела (хотя у тех и других также есть масса ограничений).
Литература
- Zaman M. (2015). Role of antisense and RNAi-based gene silencing in crop improvement. Slideshare;
- Staveley B.E. Molecular & developmental biology (BIOL3530). Memorial University of Newfoundland;
- Faqi A.S. A comprehensive guide to toxicology in preclinical drug development. Academic Press, 2013. — 904 p.;
- Daniel P. Potaczek, Holger Garn, Sebastian D. Unger, Harald Renz. (2016). Antisense molecules: A new class of drugs. Journal of Allergy and Clinical Immunology. 137, 1334-1346;
- Eric Valeur, Stéphanie M. Guéret, Hélène Adihou, Ranganath Gopalakrishnan, Malin Lemurell, et. al.. (2017). New Modalities for Challenging Targets in Drug Discovery. Angew. Chem. Int. Ed.. 56, 10294-10323;
- Caroline Godfrey, Lourdes R Desviat, Bård Smedsrød, France Piétri‐Rouxel, Michela A Denti, et. al.. (2017). Delivery is key: lessons learnt from developing splice‐switching antisense therapies. EMBO Mol Med.. 9, 545-557;
- Kendall S. Frazier. (2015). Antisense Oligonucleotide Therapies. Toxicol Pathol. 43, 78-89;
- Hosten. (2014). Alicaforsen: An Emerging Therapeutic Agent for Ulcerative Colitis and Refractory Pouchitis. Gastroenterology Research;
- Yue Geng, Kimberly Yeh, Tait Takatani, Michael R. King. (2012). Three to Tango: MUC1 as a Ligand for Both E-Selectin and ICAM-1 in the Breast Cancer Metastatic Cascade. Front. Oncol.. 2;
- Yacyshyn B.R., Chey W.Y., Goff J., Salzberg B., Baerg R., Buchman A.L. et al. (2002). Double blind, placebo controlled trial of the remission inducing and steroid sparing properties of an ICAM-1 antisense oligodeoxynucleotide, alicaforsen (ISIS 2302), in active steroid dependent Crohn’s disease. Gut. 51, 30–36;
- Thomas R. Geiger, Daniel S. Peeper. (2009). Metastasis mechanisms. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1796, 293-308;
- Pucci S., Mazzarelli P., Nucci C., Ricci F., Spagnoli L.G. (2009). CLU “in and out”: looking for a link. Adv. Cancer Res. 105, 93–113;
- Ge Jin, Philip H. Howe. (1997). Regulation of Clusterin Gene Expression by Transforming Growth Factor β. J. Biol. Chem.. 272, 26620-26626;
- Insulin signaling: advanced look. The Virtual Cell Animations Project;
- Claus Cursiefen, Eric Viaud, Felix Bock, Bernard Geudelin, Antoine Ferry, et. al.. (2014). Aganirsen Antisense Oligonucleotide Eye Drops Inhibit Keratitis-Induced Corneal Neovascularization and Reduce Need for Transplantation. Ophthalmology. 121, 1683-1692;
- Caroll J. (2014). PhIII eye drug failure? Not at all, says an optimistic gene signal. FierceBiotech;
- Wong E. and Goldberg T. (2014). Mipomersen (kynamro): a novel antisense oligonucleotide inhibitor for the management of homozygous familial hypercholesterolemia. Pharm. Ther. 39, 119–122;
- Duchenne muscular dystrophy. Quora;
- Ataluren (Translarna™) for genetic disorders. PTC Therapeutics;
- Annemieke Aartsma-Rus, Arthur M. Krieg. (2017). FDA Approves Eteplirsen for Duchenne Muscular Dystrophy: The Next Chapter in the Eteplirsen Saga. Nucleic Acid Therapeutics. 27, 1-3;
- Eric W. Ottesen. (2017). ISS-N1 makes the first FDA-approved drug for spinal muscular atrophy. Unknown journal title.. 8, 1-6;
- F. L. Ruberg, J. L. Berk. (2012). Transthyretin (TTR) Cardiac Amyloidosis. Circulation. 126, 1286-1300;
- Margaret V. Ragni. (2015). Targeting Antithrombin to Treat Hemophilia. N Engl J Med. 373, 389-391;
- Sandro Ardizzone, Gerolamo Bevivino, Giovanni Monteleone. (2016). Mongersen, an oral Smad7 antisense oligonucleotide, in patients with active Crohn’s disease. Therapeutic Advances in Gastroenterology. 9, 527-532.