
Большие дела небольших молекул: как малые РНК дирижируют генами бактерий
03 октября 2013
Большие дела небольших молекул: как малые РНК дирижируют генами бактерий
- 5473
- 3
- 8
Фаги не пройдут! Малые РНК-регуляторы выполняют у бактерий множество функций. Одна из важнейших — борьба с фагами, представляющими смертельную угрозу для бактериальной клетки. РНКовые защитники всегда готовы нейтрализовать главное оружие вирусов — стремительно «размножающуюся» внутри бактерий фаговую ДНК.
рисунок автора статьи и Копаевой Е.А.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В последние годы РНК — а особенно ее «неклассические» разновидности — приковывает внимание биологов всего мира. Выяснилось, что регуляция с помощью некодирующих РНК широко распространена — начиная от вирусов и бактерий и заканчивая человеком. Изучение разнообразия малых бактериальных РНК-регуляторов ясно показало их важную роль как в промежуточном метаболизме, так и в адаптивных реакциях. В этой статье описаны разновидности малых РНК бактерий и механизмы регуляции, осуществляемые с их помощью. Особый акцент сделан на роли этих молекул в жизнедеятельности бактериальных агентов, вызывающих особо опасные инфекции.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
РНК: больше, чем просто копия ДНК
Со школьной скамьи большинству читателей этого сайта известны основные механизмы работы живой клетки. В курсе биологии, начиная с законов Менделя и заканчивая ультрасовременными проектами по секвенированию геномов, красной нитью проходит идея магистральной генетической программы развития организма, известная профессиональным биологам как центральная догма молекулярной биологии. Она гласит, что молекула ДНК выступает носителем и хранителем генетической информации, которая через посредника — матричную РНК (мРНК), и при участии рибосомальной (рРНК) и транспортной РНК (тРНК), — реализуется в виде белков. Последние определяют видовой и индивидуальный фенотип.
Несложно заметить, что РНК при таком подходе отводится второстепенная роль: проводя юридическую аналогию, можно сказать, что РНК (матричная, в частности) — что-то вроде копии важного документа, не имеющей самостоятельной законной силы. На общем фоне выделяются некоторые вирусы (например, ВИЧ, вирусы простуды и гриппа, а также вызывающие кишечные инфекции энтеровирусы) — самые настоящие генетические «еретики», хранящие генетическую информацию в форме РНК (а не ДНК, как положено). Но вирусы — форма жизни сама по себе весьма экстравагантная и, благодаря крайней степени паразитизма, часто очень несуразная. В частности, они лишены клеточного строения, неизменно присутствующего у всех остальных организмов. По этой причине можно относиться к ним просто как к органическому веществу, хотя и сложно устроенному — нуклеопротеиду, способному к самовоспроизведению при попадании в клетку.
Такое положение дел и отведение РНК роли второстепенного участника молекулярного спектакля сохранялось в научной среде вплоть до 80-х годов прошлого века. Пристальнее присмотреться к РНК заставили работы Т. Чека, показавшего, что РНК может выступать в роли катализатора химических реакций. Прежде считалось, что ускорение химических процессов в клетке — прерогатива ферментов, имеющих исключительно белковую природу. Открытие каталитической активности у РНК имело далеко идущие следствия — вкупе с более ранними теоретическими работами К. Вёзе [1] и М. Эйгена, оно позволило нарисовать возможную картину пребиотической эволюции на нашей планете. Дело в том, что с момента открытия у ДНК функции носителя генетической информации дилемма о том, что появилось в ходе эволюции раньше — ДНК или белок, необходимый для воспроизводства ДНК, — казалась почти столь же философской (то есть, беспредметной), как и вопрос о первенстве появления курицы или яйца. После открытия Т. Чека решение обрело вполне реальные очертания — была найдена молекула, обладающая свойствами как носителя информации, так и биокатализатора (пусть и в зачаточном виде). Со временем эти исследования переросли в целое направление в биологии, изучающее возникновение жизни через призму так называемого «мира РНК» [2, 3].
Так стало очевидно, что древний мир РНК мог иметь отношение к зарождению и расцвету первичной жизни. Тем не менее, из этого вовсе не следует автоматически, что РНК у современных организмов — не архаизм, адаптированный под нужды внутриклеточных молекулярных систем, а действительно важный участник молекулярного ансамбля клетки. Лишь развитие молекулярных методов — в частности, секвенирования нуклеиновых кислот [4, 5], — показало, что РНК истинно незаменимы в клетке, причем не только в виде канонической троицы «мРНК, рРНК, тРНК». Уже первые обширные данные по секвенированию ДНК указали на показавшийся поначалу труднообъяснимым факт — большая часть ее оказалась некодирующей — то есть, не несущей информацию о молекулах белка или «стандартных» РНК. Конечно, частично это можно приписать «генетическому мусору» — «выключенным» или утративших свою функцию фрагментам генома. Но сохранять такое количество «приданого» для биологических систем, старающихся тратить энергию экономно, кажется нелогичным.
И действительно, более детальные и тонкие методы исследования позволили обнаружить целый класс РНК-регуляторов экспрессии генов, частично заполняющих межгенное пространство. Еще до прочтения полных последовательностей геномов эукариот у круглого червя С. elegans были выделены микроРНК — молекулы небольшой длины (около 20 нуклеотидов), которые могут специфично связываться с участками мРНК по принципу комплементарности [6]. Несложно догадаться, что в таких случаях с мРНК уже не прочесть информацию о кодируемых белках: рибосома просто не может «пробежаться» по такому, внезапно ставшему двухцепочечным, участку. Этот механизм подавления экспрессии гена, называемый РНК-интерференцией, уже был разобран на «биомолекуле» достаточно подробно [7, 8, 9]. На сегодняшний день открыты тысячи молекул микроРНК и других некодирующих РНК (piRNA, snoRNA, nanoRNA и др.). У эукариот (в том числе, и у человека) они расположены в межгенных участках. Установлена важная их роль в клеточной дифференцировке, канцерогенезе, иммунном ответе и других процессах и патологиях [7].
Малые РНК — «троянский конь» для бактериальных белков
Несмотря на то, что некодирующие белок РНК у бактерий были открыты гораздо раньше первых аналогичных регуляторов у эукариот, их роль в метаболизме бактериальной клетки долгое время была завуалирована для научной общественности. Это объяснимо — традиционно бактериальная клетка считалась более примитивной и менее таинственной для исследователя структурой, сложность которой не идет ни в какое сравнение с нагромождением структур в клетке эукариотической. Более того, в геномах бактерий содержание некодирующей информации составляет лишь несколько процентов от общей длины ДНК, достигая максимум 40% у некоторых микобактерий. Но, учитывая, что микроРНК обнаружены даже у вирусов, у бактерий они должны играть важную регуляторную роль и подавно.
Оказалось, у прокариот существует довольно много малых РНК-регуляторов [10]. Условно все они могут быть разделены на две группы:
- Молекулы РНК, которые для осуществления свой функции должны связаться с белками.
- РНК, комплементарно связывающиеся с другими РНК (составляют большинство известных регуляторных молекул РНК).
В первой группе выделяют малые РНК, для которых связывание с белком возможно, но необязательно. Известный пример — РНКаза Р (RNAse P), действующая как рибозим на «созревающую» тРНК. Однако если РНКаза Р может функционировать без белкового компонента, то для других малых РНК в этой группе связывание с белком обязательно (а сами они являются, по сути, кофакторами). Например, tmРНК активирует сложный белковый комплекс, выступая в роли «отмычки» для «застрявшей» рибосомы — в случае, если матричная РНК, с которой ведется считывание, подошла к концу, а стоп-кодон так и не повстречался.
Известен и еще более интригующий механизм непосредственного взаимодействия малых РНК с белками. В любой клетке широко распространены белки, связывающиеся с «традиционными» нуклеиновыми кислотами. Не является исключением и прокариотическая клетка. Например, ее гистоноподобные белки помогают корректно упаковать нить ДНК, а специфичные белки-репрессоры имеют сродство к операторной области бактериальных генов. Показано, что эти репрессоры могут ингибироваться малыми РНК, имитирующими «родные» для этих белков участки посадки на ДНК. Так, на малой РНК CsrB (рис. 1) есть 18 сайтов-«обманок» служащих тому, чтобы белок-репрессор CsrA не смог добраться до своей истинной мишени — гликогенового оперона. Между прочим, среди белков-репрессоров, «заблудившихся» из-за таких малых РНК, встречаются регуляторы глобальных метаболических путей, что позволяет многократно усиливать ингибирующий сигнал малой РНК. К примеру, так делает малая РНК 6S, «имитирующая» белковый фактор σ70. Конфигурационным «обманом» занимая центры связывания РНК-полимеразы с сигма-фактором, она запрещает экспрессию генов «домашнего хозяйства» [10].
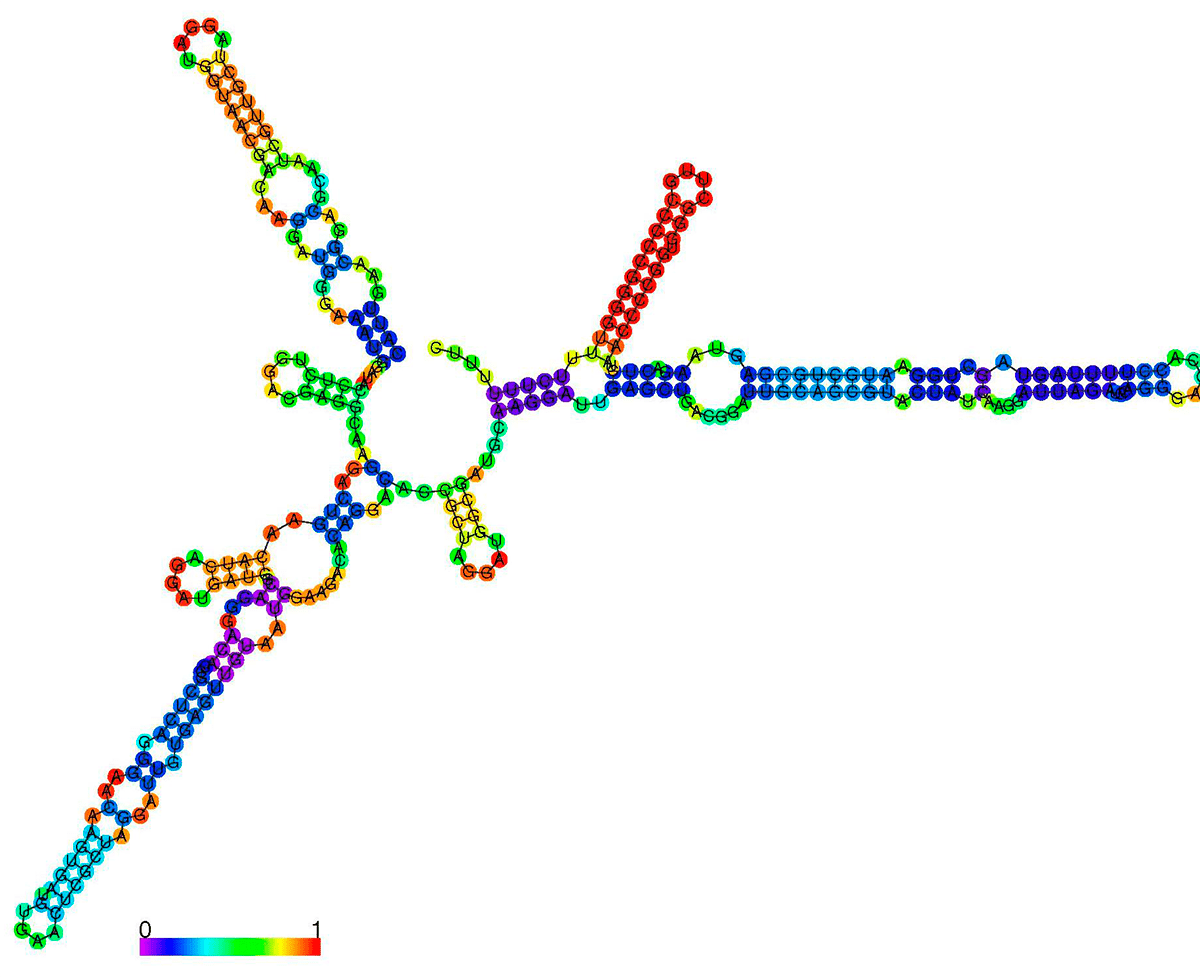
Рисунок 1. Биоинформатически предсказанная вторичная структура малой РНК CsrB из Vibrio cholerae M66-2. Малые РНК — одноцепочечные молекулы, но, как и для других РНК, сворачивание (фолдинг) в стабильную пространственную структуру сопровождается формированием участков, где молекула гибридизуется сама на себя. Многочисленные изгибы на структуре в виде разомкнутых колец называются шпильками. В некоторых случаях комбинация шпилек позволяет РНК играть роль «губки», нековалентно связывая определенные белки. Но чаще молекулы такого типа интерферируют с ДНК или РНК; при этом пространственная структура малой РНК нарушается, и образуются новые участки гибридизации уже с молекулой-мишенью. Тепловая карта отражает вероятность того, что соответствующая пара нуклеотидов действительно будет связана внутримолекулярной водородной связью; для неспаренных участков — вероятность образовать водородные связи с какими-либо участками внутри молекулы. Изображение получено с помощью программы RNAfold.
Малые РНК бактерий интерферируют... и весьма успешно!
Механизм, по которому действуют регуляторы второй группы, в общем-то, схож с таковым у регуляторных РНК эукариот — это та же РНК-интерференция путем гибридизации с мРНК, только сами цепочки малых РНК зачастую подлиннее — до нескольких сотен нуклеотидов (см. рис. 1). В результате, из-за малой РНК рибосомы не могут считать информацию с мРНК. Хотя зачастую, похоже, не доходит и до этого: образовавшиеся комплексы «малая РНК — мРНК» становятся мишенью РНКаз (типа РНКазы Р) [10].
Компактность и плотность упаковки прокариотического генома дает о себе знать: если у эукариот большинство регуляторных РНК записаны в отдельных (чаще всего не кодирующих белок) локусах, то многие малые РНК бактерий могут кодироваться в том же участке ДНК, что и подавляемый ген, но на противолежащей цепи! Такие РНК называются цис-кодируемыми (антисмысловыми), а малые РНК, лежащие на некотором удалении от подавляемого участка ДНК — транс-кодируемыми. По-видимому, расположение цис-РНК можно считать торжеством эргономичности: они могут считываться с противолежащей цепи ДНК в момент ее расплетения одновременно с транскриптом-мишенью, что позволяет тонко управлять количеством синтезируемого белка.
Малые РНК в транс-положении эволюционируют независимо от целевой мРНК, и последовательность регулятора сильнее меняется в результате мутаций. Возможно, такой расклад бактериальной клетке только «на руку», поскольку малая РНК приобретает активность в отношении ранее несвойственных ей мишеней, что сокращает время и энергетические затраты на создание других регуляторов. С другой стороны, давление отбора не позволяет транс-малой РНК мутировать слишком сильно, поскольку она потеряет активность. Тем не менее, для гибридизации с матричной РНК большинству транс-малых РНК необходим помощник — белок Hfq. По-видимому, в противном случае неполная комплементарность малой РНК может создавать проблемы для связывания с мишенью.
По-видимому, потенциально реализуемый механизм регуляции по принципу «одна малая РНК — множество мишеней» помогает интегрировать метаболические сети бактерии, что крайне необходимо в условиях короткой одноклеточной жизни. Можно продолжить спекуляцию на тему и предположить, что с помощью транс-кодируемых малых РНК осуществляется пересылка экспрессионных «предписаний» из функционально связанных, но физически удаленных локусов. Необходимостью в подобного рода генетической «перекличке» логично объясняется большое количество малых РНК, обнаруженных у патогенных бактерий. Например, несколько сотен малых РНК найдено у рекордсмена по этому показателю — холерного вибриона (Vibrio cholerae). Это микроорганизм, который умеет выживать и в окружающей водной среде (как пресной, так и соленой), и на водных моллюсках, и в рыбе, и в кишечнике человека — тут без комплексной адаптации с помощью регуляторных молекул никак не обойтись!
CRISPR на страже бактериального здоровья
Нашлось применение малым РНК и в решении другой насущной для бактерий задаче. Даже самые злостные патогенные кокки и палочки могут оказаться бессильны перед лицом опасности, исходящей от особых вирусов — бактериофагов, способных молниеносно истребить бактериальную популяцию. У многоклеточных организмов для защиты от вирусов существует специализированная система — иммунная, средствами клеток и выделяемых ими веществ охраняющая организм от незваных гостей (в том числе, вирусной природы). Бактериальная клетка — одиночка, но она не так уязвима, как может показаться на первый взгляд. Хранителями рецептов для поддержания противовирусного иммунитета бактерий выступают локусы CRISPR — кластерные регулярно-прерывистые короткие палиндромные повторы (clustered regularly interspaced short palindromic repeats) (рис. 2; [11]). В геномах прокариот каждая CRISPR-кассета представлена лидерной последовательностью длиной несколько сотен нуклеотидов, за которой следует серия из 2–24 (иногда до 400) повторов, разделенных спейсерными участками, схожими между собой по длине, но уникальными по нуклеотидной последовательности. Длина каждого спейсера и повтора не превышает сотню пар нуклеотидов [12].
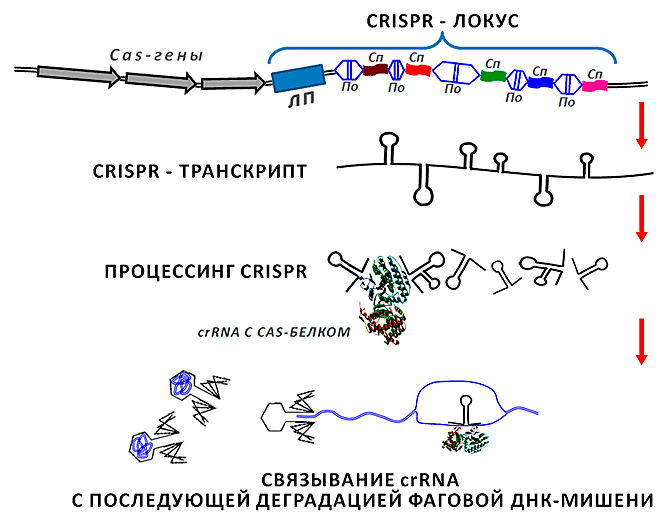
Рисунок 2. CRISPR-локус и процессинг соответствующей ему малой РНК до функционального транскрипта. В геноме CRISPR-кассета представлена перемежающимися между собой спейсерами (на рисунке обозначены как Сп), частично гомологичными участкам фаговой ДНК, и повторами (По) длиной 24–48 п.н., демонстрирующими диадную симметрию. В противоположность повторам, спейсеры внутри одного локуса одинаковы по длине (у разных бактерий это может быть 20–70 нуклеотидов), но отличаются по нуклеотидной последовательности. Участки «—спейсер—повтор—» могут быть достаточно протяженными и состоять из нескольких сотен звеньев. Вся структура фланкируется с одной стороны лидерной последовательностью (ЛП, несколько сотен пар оснований). Неподалеку находятся Cas-гены (CRISPR-associated), организованные в оперон. Белки, считываемые с них, выполняют ряд вспомогательных функций, обеспечивая процессинг транскрипта, считанного с CRISPR-локуса, его успешную гибридизацию с фаговой ДНК-мишенью, встраивание новых элементов в локус и т.д. Образующаяся в результате многоэтапного процессинга СrRNA гибридизуется с участком ДНК (нижняя часть рисунка), впрыскиваемой фагом в бактерию. Это заставляет «замолчать» транскрипционную машину вируса и останавливает его размножение в прокариотической клетке.
Детальный механизм возникновения всего CRISPR-локуса еще предстоит изучить. Но на сегодняшний день предложена принципиальная схема возникновения спейсеров — важнейших структур в его составе. Оказывается, «охотники за бактериями» оказываются биты их же оружием — нуклеиновыми кислотами, а точнее — «трофейной» генетической информацией, полученной бактериями от фагов в прежних сражениях! Дело в том, что не все фаги, попавшие в бактериальную клетку, оказываются гибельными. ДНК таких фагов (возможно, относящихся к умеренным) режется специальными Cas-белками (их гены фланкируют CRISPR) на мелкие фрагменты. Часть этих фрагментов будет встроена в CRISPR-локусы «хозяйского» генома. И когда фаговая ДНК вновь попадает в бактериальную клетку, она встречается с малой РНК из CRISPR-локуса, в тот момент экспрессируемой и обрабатываемой Cas-белками. Вслед за этим происходит инактивация вирусной генетической информации по уже описанному выше механизму РНК-интерференции [12].
Из гипотезы формирования спейсеров неясно, зачем между ними нужны повторы, внутри одного локуса незначительно отличающиеся по длине, но практически идентичные по последовательности? Здесь открывается широкий простор для фантазии. Быть может, без повторов было бы проблематично осуществить разбиение генетических данных на смысловые фрагменты, подобные секторам на жестком диске компьютера, и тогда доступ транскрипционной машины к строго определенным участкам CRISPR-локуса стал бы затруднительным? А быть может, повторы упрощают рекомбинационные процессы при встраивании новых элементов фаговой ДНК? Или же они — «знаки препинания», без которых не обойтись при процессинге CRISPR? Как бы то ни было, биологическая причина, объясняющая поведение бактериальной клетки на манер гоголевского Плюшкина, в свое время будет найдена.
CRISPR, будучи «летописью» взаимоотношений бактерии с фагом, может использоваться в филогенетических исследованиях. Так, недавно осуществленное типирование по CRISPR позволило окинуть взглядом эволюцию отдельных штаммов чумного микроба (Yersinia pestis). Исследование их CRISPR-«родословных» пролило свет на события полутысячелетней давности, когда штаммы проникли в Монголию с территории, в настоящее время относящейся к Китаю [13]. Но не для всех бактерий, и, в частности, патогенов, данный метод применим. Несмотря на недавние сведения о предсказанных CRISPR-обрабатывающих белках у возбудителей туляремии (Francisella tularensis) и холеры, сами CRISPR, если и присутствуют в их геноме, то немногочисленны. Возможно, фаги, учитывая их положительный вклад в приобретение вирулентности патогенными представителями бактериального царства, не так уж вредны и опасны, чтобы обороняться от них с помощью CRISPR? Или же вирусы, атакующие эти бактерии, слишком многообразны, и стратегия «интерферирующего» РНК-иммунитета в отношении них бесплодна?
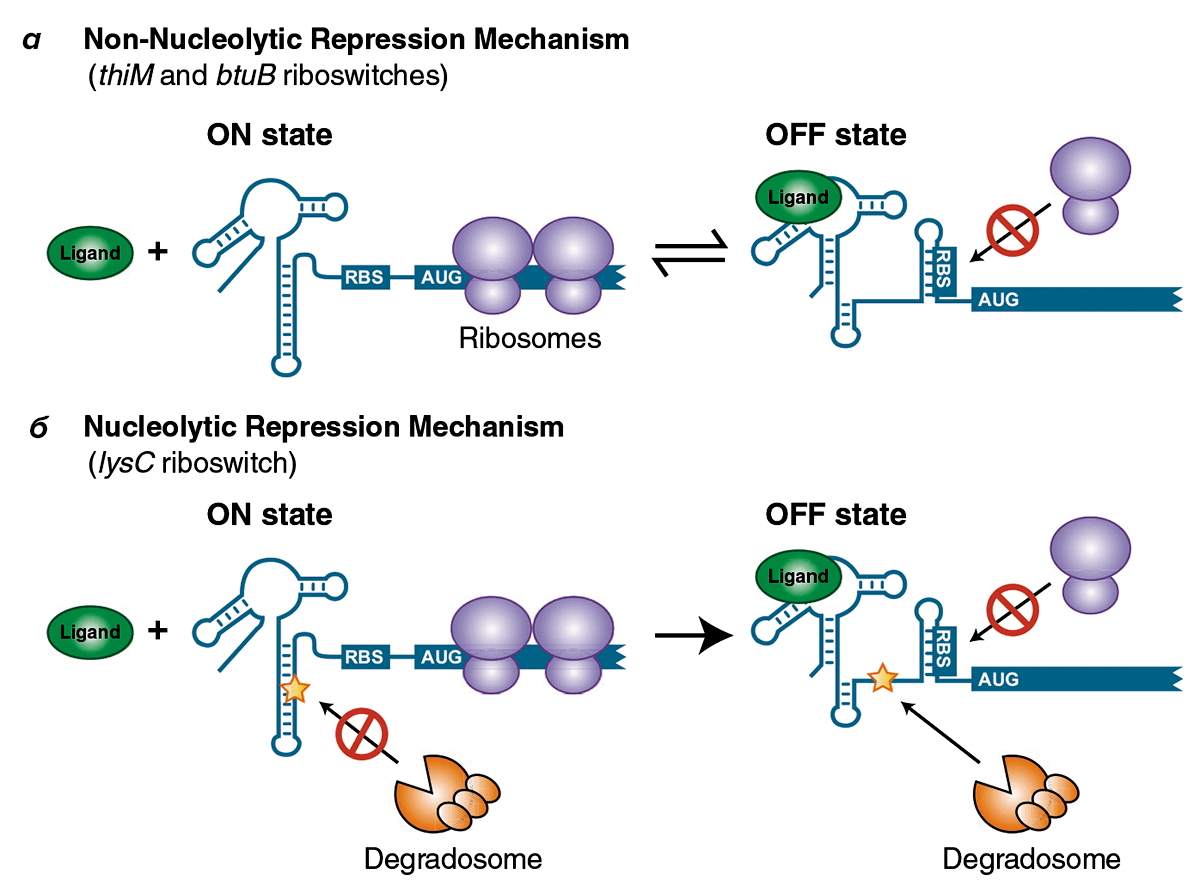
Рисунок 3. Некоторые механизмы работы рибосвитчей. Рибосвитчи (рибопереключатели) встроены в матричную РНК, но отличаются большой свободой конформационного поведения, зависящего от специфичных лигандов, что дает основание считать рибосвитчи самостоятельными единицами малых РНК. Изменение конформации экспрессионной платформы влияет на сайт посадки рибосомы на мРНК (RBS), и, как следствие, определяет доступность всей мРНК для считывания. Рибосвитчи в известной степени аналогичны операторной области в классической модели lac-оперона — но только аптамерные участки обычно регулируются низкомолекулярными веществами и осуществляют переключение работы гена на уровне мРНК, а не ДНК. а — В отсутствие лигандов рибосвитчи btuB (кобаламинового транспортера) и thiM (тиаминпирофосфат-зависимый), осуществляющие ненуклеолитическую репрессию мРНК, «включаются» (ON) и позволяют рибосоме заняться своим делом. Связывание лиганда с рибосвитчем (OFF-положение) приводит формированию шпильки, делающей этот участок недоступным для рибосомы. б — Лизиновый рибосвитч lysC при отсутствии лиганда также включен (ON). Выключение рибосвитча блокирует рибосоме доступ к мРНК. Но в отличие от описанных выше рибосвитчей, в лизиновом при выключении «оголяется» участок, разрезаемый специальным РНКазным комплексом (degradosome), и вся мРНК утилизируется, распадаясь на мелкие фрагменты. Репрессия рибосвитчем в данном случае называется нуклеолитической (nucleolytic) и необратима, поскольку, в отличие от примера (а), обратное переключение (снова в ON) уже невозможно. Важно отметить, что таким образом может достигаться утилизация группы «ненужных» мРНК: рибосвитч похож на деталь детского конструктора, и схожие по структуре переключатели могут иметься у целой группы функционально связанных матричных молекул.
Рибосвитч — датчик для бактерии
Итак, есть белок-ассоциирующие малые РНК, есть малые РНК, интерферирующие с собственными мРНК бактерий, а также РНК, захваченные бактериями из вирусов и подавляющие фаговую ДНК. Разве можно вообразить какой-нибудь еще механизм регуляции с помощью малых РНК? Оказывается, да. Если проанализировать описанное выше, то обнаружится, что во всех случаях антисмысловой регуляции наблюдается интерференция малой РНК и мишени как результат гибридизации двух отдельных молекул. А почему бы не расположить малую РНК в составе самого транскрипта? Тогда можно, изменяя конформацию такого «засланного казачка» внутри мРНК, менять доступность всей матрицы для считывания при трансляции или же, что энергетически еще более целесообразно, регулировать биосинтез мРНК, т.е. транскрипцию!
Такие структуры широко представлены в бактериальных клетках и известны как рибосвитчи (riboswitch). Они располагаются перед началом кодирующей части гена, на 5′-конце мРНК. Условно в составе рибосвитчей можно выделить два структурных мотива: аптамерный участок, ответственный за связывание с лигандом (эффектором), и экспрессионную платформу, обеспечивающую регуляцию экспрессии гена посредством перехода мРНК в альтернативные пространственные структуры [14]. Например, такой переключатель («выключающего» типа) используется для функционирования лизинового оперона: при избытке лизина он существует в виде «запутанной» пространственной структуры, блокирующей считывание с оперона, а при его нехватке рибосвитч «расплетается», и синтезируются белки, необходимые для биосинтеза лизина [10] (рис. 3).
Описанная принципиальная схема устройства рибосвитча — не канон, существуют варианты. Любопытный «включающий» тандемный рибосвитч обнаружен у холерного вибриона: экспрессионной платформе предшествуют сразу два аптамерных участка. Очевидно, это обеспечивает бóльшую чувствительность и более плавный ответ на появление в клетке еще одной аминокислоты — глицина. Возможно, косвенно причастен к высокой выживаемости бактерии схожий по принципу действия, но «двойной» рибосвитч в геноме возбудителя сибирской язвы (Bacillus anthracis). Он реагирует на входящее в состав минимальной среды жизненно важное для этого микроба соединение — тиаминпирофосфат [15].
Помимо переключения метаболических путей в зависимости от доступного для бактериальной клетки «меню», рибосвитчи могут быть датчиками гомеостаза бактерии. Так, они были замечены в регуляции доступности гена для считывания при нарушении функционирования трансляционной системы внутри клетки (например, такие сигналы как появление «незаряженных» тРНК и «неисправных» (stalled) рибосом), либо при изменении факторов внешней среды (например, повышении температуры) [14].
Не нужно белков, дайте нам РНК!
Так что же означает присутствие такого разнообразия малых РНК-регуляторов внутри бактерии? Свидетельствует ли это об отказе от концепции, когда главными «управленцами» являются белки, или мы наблюдаем очередной модный тренд? Видимо, ни то, и ни другое. Конечно, некоторые малые РНК являются глобальными регуляторами метаболических путей — как упомянутая CsrB, участвующая, вкупе с CsrС, в регуляции запасания органического углерода. Но, принимая во внимание принцип дублирования функций в биологических системах, малые РНК бактерий можно сравнить скорее с «антикризисным менеджером», чем с генеральным директором. Так, в условиях, когда для выживания микроорганизма нужно быстро перенастроить внутриклеточный метаболизм, их регуляторная роль может оказаться решающей и более эффективной, чем у белков с аналогичными функциями. Таким образом, РНК-регуляторы отвечают, скорее, за экспресс-реагирование, менее стойкое и надежное, чем в случае с белками: не следует забывать, что малая РНК поддерживает свою 3D-структуру и удерживается на ингибируемой матрице слабыми водородными связями.
Косвенным подтверждением этих тезисов могут стать уже упоминавшиеся малые РНК холерного вибриона. Для этой бактерии попадание в организм человека — не желанная цель, а, видимо, чрезвычайная ситуация. Выработка токсинов и активация других, связанных с вирулентностью, путей в данном случае — всего лишь защитная реакция на агрессивное противодействие среды и клеток организма «чужакам». «Спасателями» здесь выступают малые РНК — например Qrr, помогающие вибриону в стрессовых условиях модифицировать стратегию выживания, изменяя коллективное поведение. Косвенно подтвердить эту гипотезу может также открытие малой РНК VrrA, активно синтезирующейся при нахождении вибрионов в организме и подавляющей наработку мембранных белков Omp [16]. «Спрятанные» мембранные белки в начальной фазе инфицирования, возможно, помогают избежать мощного иммунного ответа со стороны организма человека (рис. 4).
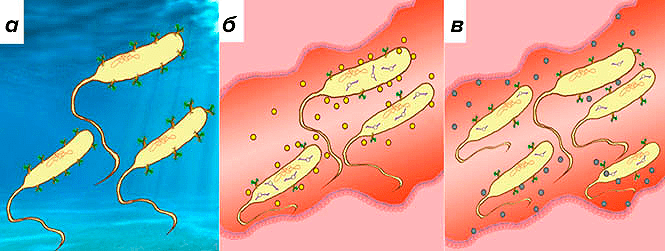
Рисунок 4. Малые РНК в реализации патогенных свойств холерного вибриона. а — Холерный вибрион хорошо чувствует себя и прекрасно размножается в водной среде. Организм человека, вероятно, не является основной экологической нишей для этого микроба. б — Попадая по водному или пищевому пути передачи инфекции в агрессивную среду — тонкий кишечник человека, — вибрионы по организованности поведения начинают напоминать псевдоорганизм, основная задача которого — сдержать иммунный ответ и создать себе благоприятную среду для колонизации. Большое значение в координации действий внутри популяции бактерий и их взаимодействия с организмом отводится мембранным везикулам. До конца неизученные факторы среды в кишечнике являются сигналами для экспрессии в вибрионах малых РНК (например, VrrA). В результате запускается механизм образования везикул, являющихся неиммунногенными при низком числе клеток вибриона в кишечнике. Дополнительно к описанному эффекту малые РНК помогают «спрятать» потенциально провокационные для иммунной системы человека мембранные белки Omp. При косвенном участии малых РНК Qrr1—4 запускается интенсивная выработка холерного токсина (не показано на рисунке), что дополняет спектр адаптивных реакций холерного вибриона. в — Уже через несколько часов количество бактериальных клеток возрастает, а пул малых РНК VrrA уменьшается, что, вероятно, приводит к экспонированию мембранных белков. Количество «пустых» везикул также постепенно уменьшается, и на этом этапе они заменяются на иммунногенные, доставляемые в энтероциты. Видимо, это часть «плана» по реализации комплексного сигнала, смысл которого — спровоцировать эвакуацию вибрионов из организма человека. NB: соотношение размеров бактериальных клеток и энтероцитов не соблюдено.
рисунок автора статьи и Копаевой Е.А.
Видимо, роль малых РНК у всех бактериальных патогенов велика, но в особенности это верно для тех, у которых паразитизм — факультативная экологическая ниша, либо у которых патогенность — эволюционно молодое приспособление. В этом смысле показательным может стать чумной микроб, произошедший от псевдотуберкулезной палочки несколько тысяч лет назад. Установлено высокое сходство геномов псевдотуберкулезной и чумной бактерий, и, в то же время, различия в нуклеотидных последовательностях у более чем половины общих для них малых РНК-регуляторов. Резонно полагать, что малые РНК послужили формированию физиологических механизмов, приведших к появлению высоковирулентного чумного микроба, вызвавшего печально известные эпидемии «черной смерти». Но во многих других случаях малые РНК — все же «актеры второго плана», ведь разнообразие функциональных белковых молекул из 20 типов аминокислот трудно сравнить с аналогичным у РНК, имеющих в своем арсенале лишь четыре типа нуклеотидов.
Интересно проследить, как изменятся наши представления о малых РНК-регуляторах, когда будут получены новые данные на платформах RNAseq, в том числе, по свободноживущим и некультивируемым формам. Недавние работы с использованием «глубокого секвенирования» уже дали неожиданные результаты, указав на наличие микроРНК-подобных молекул у мутантных стрептококков [17]. Конечно, такие данные нуждаются в тщательной перепроверке, но, как бы то ни было, можно с уверенностью утверждать, что изучение малых РНК у бактерий преподнесет немало сюрпризов.
Литература
- Карл Вёзе (1928–2012);
- M. P. Robertson, G. F. Joyce. (2012). The Origins of the RNA World. Cold Spring Harbor Perspectives in Biology. 4, a003608-a003608;
- РНК у истоков жизни?;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Код жизни: прочесть не значит понять;
- Rosalind C. Lee, Rhonda L. Feinbaum, Victor Ambros. (1993). The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 75, 843-854;
- Обо всех РНК на свете, больших и малых;
- МикроРНК впервые обнаружены в одноклеточном организме;
- МикроРНК — чем дальше в лес, тем больше дров;
- Lauren S. Waters, Gisela Storz. (2009). Regulatory RNAs in Bacteria. Cell. 136, 615-628;
- Элементы: «Прокариотическая система иммунитета поможет редактировать геном»;
- Blake Wiedenheft, Samuel H. Sternberg, Jennifer A. Doudna. (2012). RNA-guided genetic silencing systems in bacteria and archaea. Nature. 482, 331-338;
- Julia M. Riehm, Gilles Vergnaud, Daniel Kiefer, Tserennorov Damdindorj, Otgonbaatar Dashdavaa, et. al.. (2012). Yersinia pestis Lineages in Mongolia. PLoS ONE. 7, e30624;
- Laurène Bastet, Audrey Dubé, Eric Massé, Daniel A. Lafontaine. (2011). New insights into riboswitch regulation mechanisms. Molecular Microbiology. 80, 1148-1154;
- R. R. Breaker. (2012). Riboswitches and the RNA World. Cold Spring Harbor Perspectives in Biology. 4, a003566-a003566;
- J. Patrick Bardill, Brian K. Hammer. (2012). Non-coding sRNAs regulate virulence in the bacterial pathogen Vibrio cholerae. RNA Biology. 9, 392-401;
- Heon-Jin Lee, Su-Hyung Hong. (2012). Analysis of microRNA-size, small RNAs in Streptococcus mutans by deep sequencing. FEMS Microbiol Lett. 326, 131-136;
- M.-P. Caron, L. Bastet, A. Lussier, M. Simoneau-Roy, E. Masse, D. A. Lafontaine. (2012). Dual-acting riboswitch control of translation initiation and mRNA decay. Proceedings of the National Academy of Sciences. 109, E3444-E3453.







