Как и почему искусственный интеллект биологический возраст определял
21 февраля 2023
Как и почему искусственный интеллект биологический возраст определял
- 654
- 2
- 3
Человек издавна ищет способы продлить молодость. Пришло время искусственному интеллекту взять часть работы в свои «руки»
рисунок автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Старость преподносит нам много сюрпризов: кто-то проживет ее, лишь слегка сбавив темп, другим повезет меньше. Можно ли узнать расклад заранее, а то и повлиять на него? Разработки пионеров в области искусственного интеллекта в изучении старения говорят: «да». Так как это стало возможно? И какую роль в геронтологии играет определение биологического возраста? Узнаем, что делают сотрудники Gero и Insilico Medicine, чтобы найти ответы на эти вопросы.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Грани жизни» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — Сколтех: университет, который основан в 2011 году командой российских и зарубежных ученых с мировым именем.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Мечта человечества — долгая жизнь и активная, здоровая старость. Писатели-фантасты продолжают придумывать миры, в которых человек побеждает болезни и живет чуть ли не вечно. В реальной жизни найти возможность продлить жизнь и сохранить здоровье до самого конца — задачка не то что со звездочкой, а с целым созвездием. Уж очень много факторов влияет на человека: генетика, эмбриональное развитие, экология, образ и условия жизни… Возможно ли учесть каждый пункт, просчитать всё? Человеческий мозг не сможет удержать столько информации, а на «ручное» исследование ушли бы десятилетия. Однако в эпоху активного развития технологий выход, возможно, найден — компьютерное моделирование, анализ больших данных, искусственный интеллект.
А можем ли мы жить дольше и лучше?
Начнем с определения:
- Старение
- функциональный и многофакторный спад в работе организма, зависящий от времени [1].
Значит, факторы и являются причиной старения, и как раз с частью из них работает искусственный интеллект, чтобы прогнозировать, как именно мы будем стариться.
Недавно численность людей на Земле достигла 8 миллиардов человек [2]. Средняя продолжительность жизни увеличивается, и теперь одной из основных проблем медицины стали так называемые болезни старости. Всё просто — увеличение продолжительности жизни не равно замедлению старения. Теперь большинство смертей наступает по причине хронических заболеваний, которые год за годом подтачивают здоровье (рис. 1) [3]. Поэтому ключевой задачей исследователей стало определение рисков развития ряда заболеваний: диабета, болезни Альцгеймера, сердечно-сосудистых патологий [4]. Другая цель — подобрать набор предиктивных мер и найти лекарства от этих болезней, но это уже совсем другая история…
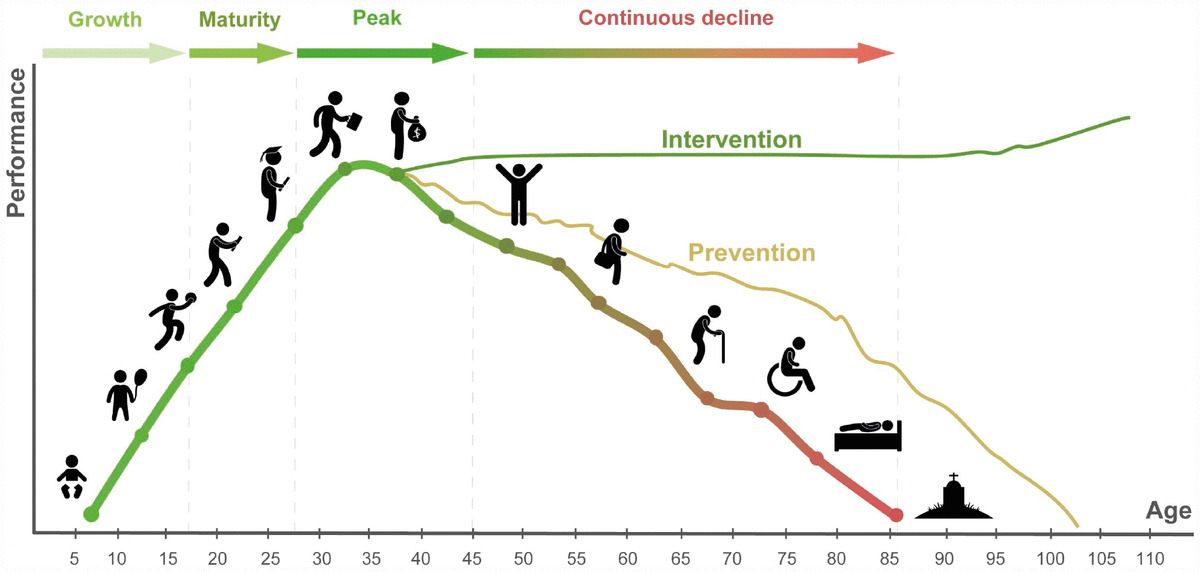
Рисунок 1. Профилактика старения позволит увеличить продолжительность жизни и отсрочить признаки увядания. Кардинальное вмешательство, которое пока что лишь сюжет из научно-фантастических романов, позволит не стареть вовсе.
Среди нас живут такие рекордсмены, как Жаклин Кальман, умершая на 123 году жизни [6], [7]. В чем секрет? Средняя продолжительность жизни достигает отметки в 73 года, как прибавить к ним еще 50? Эта тема вызывает интерес еще и с экономической стороны. Возможно, пожилой человек будущего продолжит работать, помогать близким. Он будет реже попадать в больницу и меньше обращаться к системе здравоохранения. Такие перемены скажутся на экономике: потребуются серьезные изменения в системе охраны труда, социальной сфере.
Однако вернемся к биологии. Определим, какие известные ограничения существуют для продления жизни (рис. 2):
- Предел Хейфлика — ограниченное длиной теломер количество клеточных делений [8]. Фермент теломераза способен восстанавливать концы теломер, и в теории воздействие на него может в некоторой степени сохранять их длину. Так, вовсю идут исследования по теломеразной генной терапии рака, ведь дисфункция этого фермента — частое явление при онкологии [9].
- Злокачественное перерождение клеток может возникнуть по разным причинам — например, воздействие внешних факторов (радиация, канцерогены) или ошибки в работе клеток. Человек может свести на нет негативное воздействие промышленности, машин, фонового излучения, пестицидов, лекарственных средств и многого другого, что так или иначе порой становится пусковым механизмом для онкологии.
- Накопление мутаций в геноме приводит к дальнейшему каскаду ошибок в синтезе белков и их функционировании. Успехи в редактировании геномов, например при помощи системы CRISPR-Cas9, позволяют надеяться на возможность исправить досадные промахи [10].
- Эпигенетические метки. Данные о метилировании ДНК и механизме регуляции активности генов могут многое сказать исследователю об организме. Например, довольно точно определить его биологический возраст, что позволило развить концепцию эпигенетических часов [11], [12]. К эпигенетическим изменениям может относится потеря ряда меток, которые защищают некоторые участки генома, или возникновение их в неположенном месте, что станет причиной дисфункции гена. В перспективе, воздействие на эпигеном может сыграть роль в омоложении клеток [1], [13].
- Митохондриальный метаболизм — у старых клеток уровень окислительного стресса выше, чем в молодых [14], [15]. Однако, большинство мутаций в митохондриальном геноме, которые приводят к сбою в работе органелл, возникают из-за ошибок репликации. Так или иначе, но количество митохондрий с возрастом снижается, как и их функциональная активность, что также способствует старению организма.
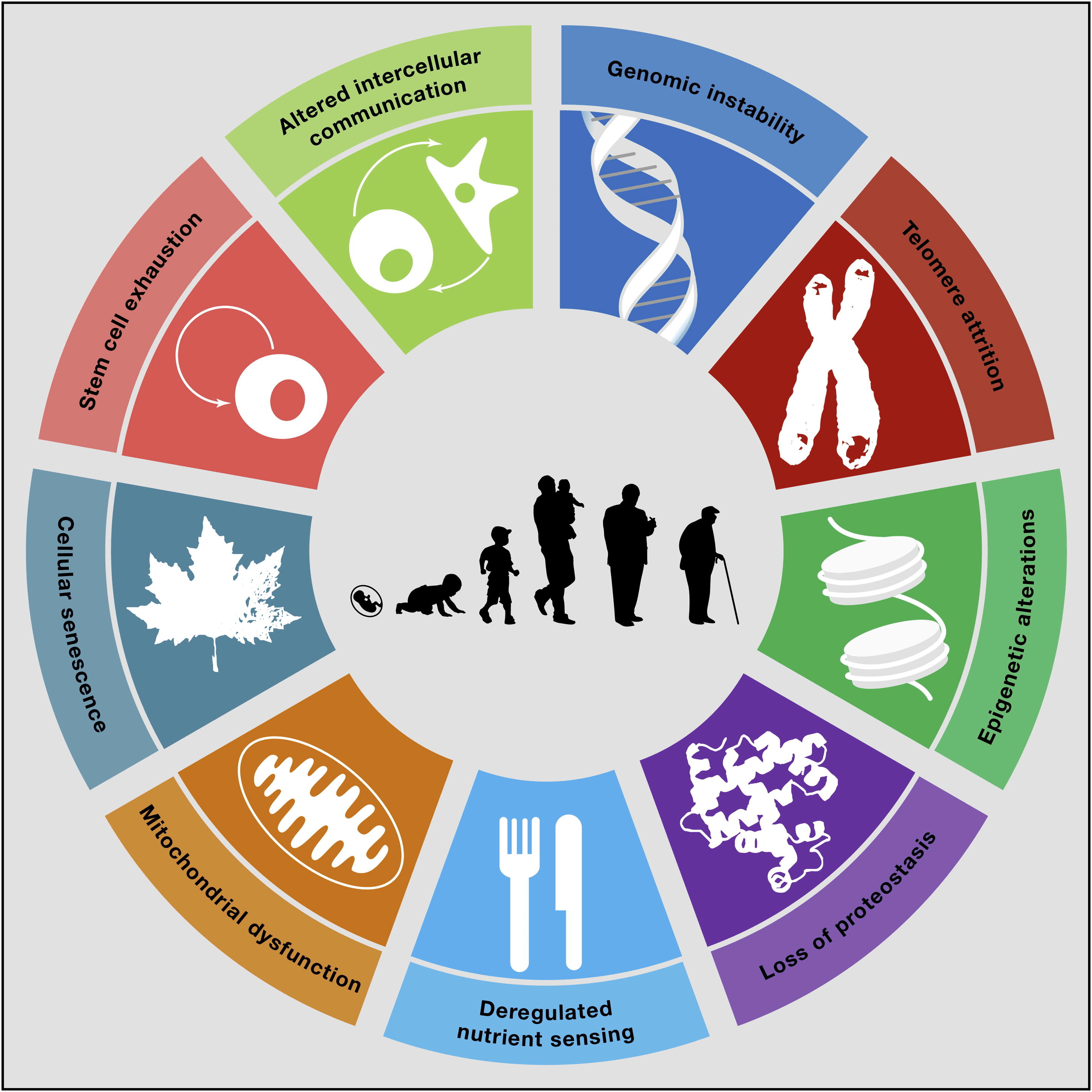
Рисунок 2. Девять признаков старения:
- нестабильность генома;
- истощение теломер;
- эпигенетические изменения;
- потеря протеостаза;
- нарушение всасывания питательных веществ;
- дисфункция митохондрий;
- клеточное старение;
- истощение стволовых клеток;
- изменение межклеточной коммуникации.
Преодоление перечисленных на рисунке 2 препятствий — один из этапов на пути к нивелированию эффектов старения. Другой подход — подсчет рисков. Это предиктивный способ определить вероятное развитие старческого заболевания; способ опередить болезнь, не дать ей взять верх. Для этого можно сдать генетический анализ и проверить наличие мутаций, ассоциированных с заболеваниями, а можно проверить биомаркеры. Быть может, они дадут ответы на многие вопросы и помогут встретить старость с высоко поднятой головой?
Какие биомаркеры могут определять качество старения?
Биомаркеры — это биологические показатели, которые служат индикаторами состояния некоего процесса или органа. Выходит, что биомаркеры старения (если они существуют) позволили бы предсказать функциональную активность и состояние процессов или органов в будущем.
На самом деле универсального биомаркера старения пока не существует, а некоторые сомневаются, что он вообще будет найден [17]. Но давайте взглянем на те биомаркеры, которые используются в геронтологии или разработках, связанных со старением:
- «Рутинные» лабораторные биомаркеры, которые можно стандартно получить в большинстве коммерческих или медицинских лабораторий. Они связаны с: липидами (факторы риска сердечно-сосудистых заболеваний) — общий холестерин, триглицериды; иммунной системой — интерлейкины, хемокины; функциями органов — креатинин, мочевина, альбумин; метаболическими патологиями — гликированный гемоглобин, глюкоза, инсулин.
Именно эти биомаркеры, полученные при помощи простого анализа крови, чаще всего берутся за входные данные для программного обеспечения, предсказывающего биологический возраст — например, Aging.AI [5] (подробная речь об этом пойдет дальше).
- Биомаркеры исследовательских лабораторий выходят за рамки того, что можно сделать быстро, просто и дешево в клинической лаборатории в соседнем доме. Сюда чаще всего относятся данные геномного анализа — например, длина теломер или степень повреждения ДНК [18]; а также активные формы кислорода, состав микробиоты кожи и кишечника [19–21].
- Эпигенетические маркеры (в основном, метилирование ДНК) представляют его в форме «эпигенетических часов первого поколения», или часов Хорвата [22], [23]. Такие часы отлично определяют биологический возраст, но о старении мало чего могут сказать. Поэтому ученые пошли дальше и разработали эпигенетические часы второго поколения, которые способны предсказывать изменения здоровья по мере старения [24]. Это такие методики как DNAm PhenoAge и DNAm GrimAge [25], [26]. За подробностями просим обратиться к врезке «Такие разные молекулярные часы».
- Биомаркеры физических и когнитивных функций — постепенная утрата поддерживающих функций тканей — тоже хорошо описывает старение [1]. К ним относятся такие биомаркеры как артериальное давление, индекс массы тела, тест на равновесие в положении стоя и другие. Отдельным информативным маркером могут служить данные с фитнес-трекеров, которые способны предоставить ряд данных для оценки биологического возраста [27].
- Биомаркеры клеточного старения (рис. 3) — когда клетки прекращают делиться в связи с укорочением теломер, окислительным и онкогенным стрессом. В ряду этой группы биомаркеров — прогерин и количество лизосом, которое с возрастом увеличивается [17].
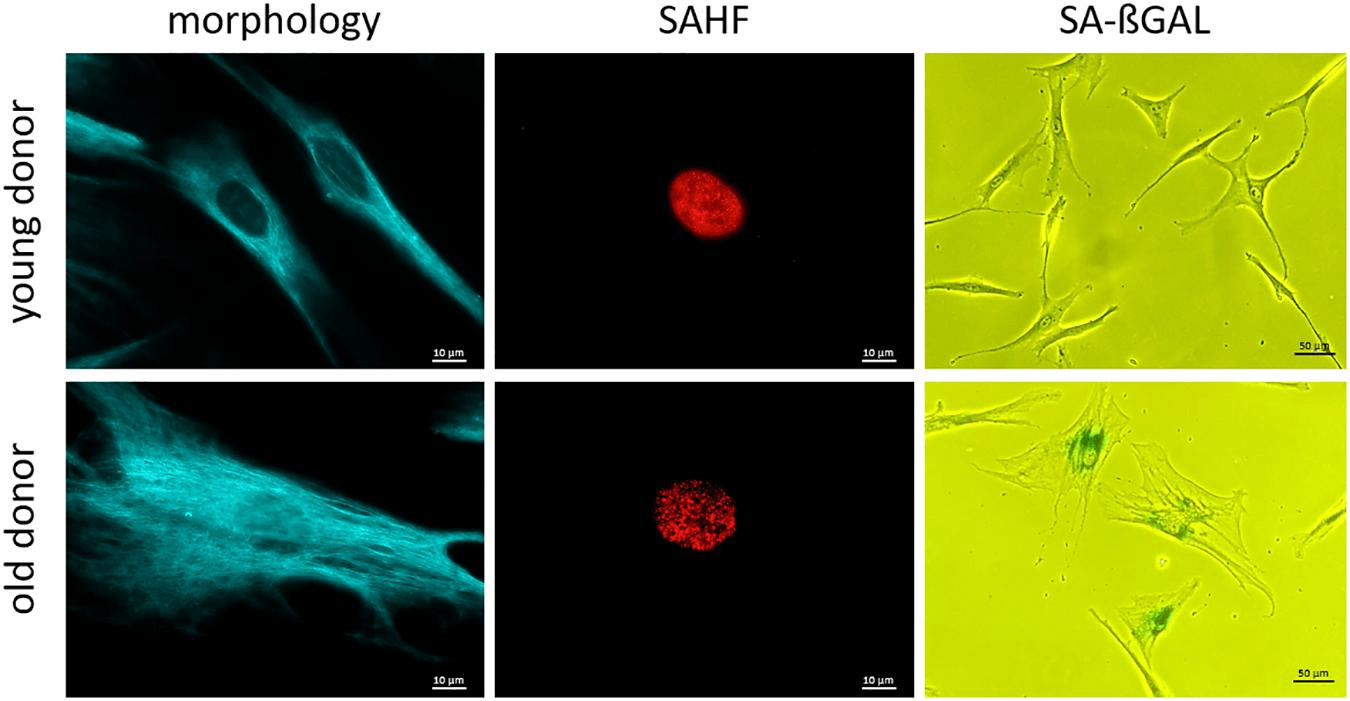
Рисунок 3. Микроскопические снимки биомаркеров клеточного старения. Видны явные отличия в морфологии клеток разного возраста — клетки пожилого донора крупнее и уплощены. Также в старых фибробластах образуются SAHF (ассоциированные со старением участки гистонов), обогащенные маркерами гетерохроматина — на снимке клетка пожилого донора похожа на решето. Еще один показатель — активность SA-ßGal (связанной со старением бета-галактозидазы). Она участвует в расщеплении лактозы и регулирует поступление энергии клеткам.
- Транскриптомные биомаркеры — показатели генной экспрессии — тоже характеризуют процесс старения. Для использования в области предсказания биологического возраста и старения созданы транскриптомные часы. Есть часы Хуана — их алгоритмы обучались на основе образцов определенной ткани; часы Флетчера — их «гоняли» на данных с образцов фибробластов кожи [28], [29]. Большинство этих часов используют в качестве входных данных мРНК, а некоторые используют микроРНК (часы Хуана) — см. врезку.
Такие разные молекулярные часы
Последовательность ДНК позволила не только разобраться в том, как регулируется работа всех систем в клетке, но и в том, как она модифицируется со временем. Гены постоянно меняются, что дало возможность эволюционным биологам навести в систематике «молекулярный» порядок. Выяснилось, что, фиксируя изменения в генах, присущие разным видам, мы можем отслеживать их расхождение и даже отмечать время этого события. Однако, разбор хронологии событий коснулся не только масштабных происшествий на уровне таксонов, но затронул и временные перемены внутри живых организмов в относительно короткий промежуток времени — в течении их жизни [30].
Эпигенетические часы основаны на определении количества и расположения метильных групп на ДНК. С возрастом и по мере воздействия факторов окружающей среды уровень метилирования меняется и позволяет судить о биологическом возрасте организма. Первый эпигенетические часы предложил Стив Хорват, применив методику машинного обучения для оценки возраста тканей по уровню метилирования [31]. Существует ряд модификаций часов Хорвата, которые отличаются источником данных. Так, часы Хуана являются результатом обработки данных микроРНК, а информацию для часов Фишера «предоставили» дермальные фибробласты [28], [29].
Другой тип часов — транскриптомные. В их основе лежат данные о реализуемых в организме генах. Транскриптом представляет собой специфичный набор данных и многое говорит о качестве жизни и старении организма, позволяя определять биологический возраст.
Как мы видим, геронтологам и биохакерам есть где развернуться [32]. Каждый из типов биомаркеров — отдельная область, требующая исследований, испытаний, а также разработки программного обеспечения для обработки (рис. 4).

Рисунок 4. Обучение глубоких нейронных сетей на мультимодальных лонгитьюдных данных для прогнозирования возраста и состояния здоровья человека. Работа алгоритмов позволяет также обнаруживать взаимодействия между входными параметрами, выявлять лекарственные мишени, находить причинно-следственные связи и новые источники данных.
В мире уже появились пионеры борьбы со старением: давайте познакомимся с двумя яркими представителями этой, пока довольно редкой, области — Gero и Insilico Medicine.
Что предлагает Gero?
Gero — стартап российских ученых, базирующийся в Сингапуре. Петр Федичев и другие сотрудники компании задумали ни много ни мало — «взломать» старение силой искусственного интеллекта и больших данных [33]. Изначально, для обучения моделей команда использовала данные полноэкзомного секвенирования из Британского биобанка. Значительное финансирование, которое сотрудники Gero уже привлекли в работу стартапа, демонстрирует весомую разницу между деятельностью подобной новаторской компании по сравнению с классическими НИИ, которые во многом ограничены при выборе и смелости своих начинаний.
В статье Hacking Aging: A Strategy to Use Big Data From Medical Studies to Extend Human Life («Взлом старения: стратегия использования больших данных медицинских исследований для продления жизни человека») Петр Федичев — основатель Gero — представляет, как симбиоз аналитических подходов из области машинного обучения и больших данных можно применить к закону смертности Гомперца — Мейкхама [34] (рис. 5). Разработка программного обеспечения на основе подобных алгоритмов может определять биомаркеры старения.
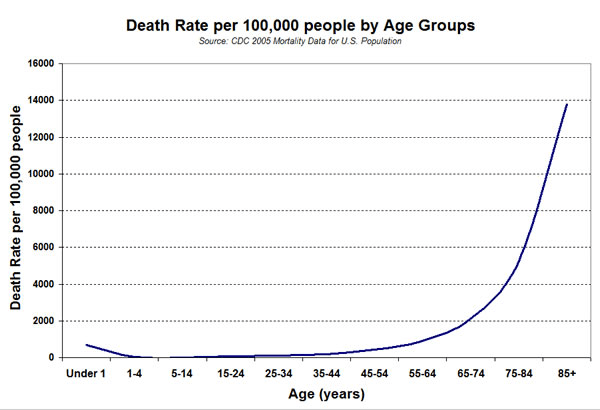
Рисунок 5. Смертность на 100 000 населения по возрастным группам. Анализ смертности по возрастам в четырех английских городах помог Бенджамину Гомперцу вывести так называемый закон смертности Гомперца — Мейкхама. Из него следует, что вероятность смерти зависит от систематических возрастных изменений и случайных событий. Также, согласно этому закону, начиная примерно с 40 лет, риск смерти экспоненциально возрастает, удваиваясь каждые восемь лет.
Ученые из Gero использовали общедоступные большие данные из Британского биобанка для обучения алгоритмов ИИ. Основные используемые ими статистические подходы, которые позволили извлечь максимум достоверной информации, — метод главных компонент (PCA) и обучение без учителя.
Между некоторыми физиологически значимыми переменными и возрастом человека есть линейная связь, которую позволяют оценивать биологические часы. Если описывать видимую зависимость еще точнее, то в основе типичных моделей биологического возраста человека находится линейная регрессия — по мере увеличения хронологического возраста наблюдается регресс физиологически значимых переменных. Такая закономерность одинаково верна как для параметров крови, так и для микробиоты [36], [37]. Эти параметры тоже могут быть использованы в качестве входных данных для исследований в области геронтологии. Но что, если мы сразу возьмем огромный пул данных, которые можно применить для анализа ряда биомаркеров старения?
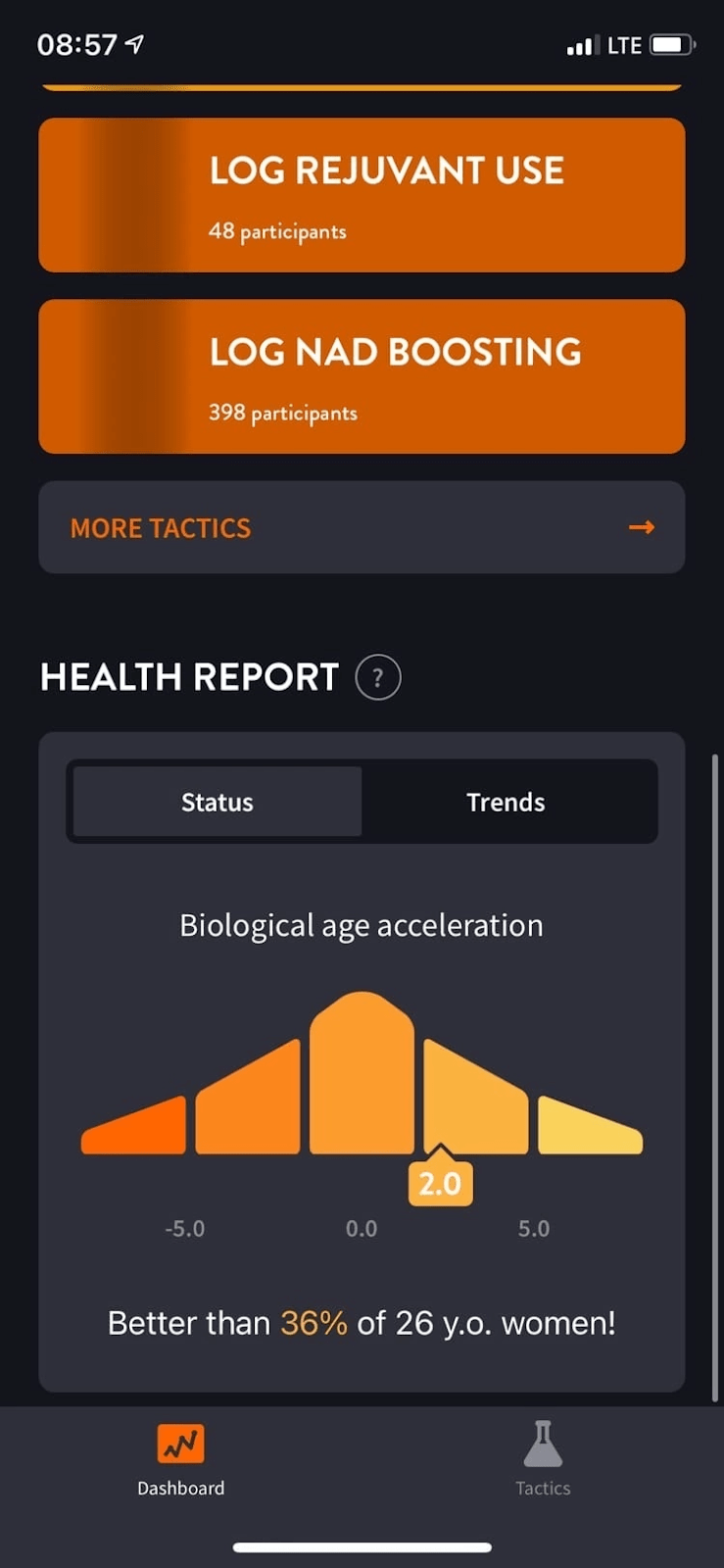
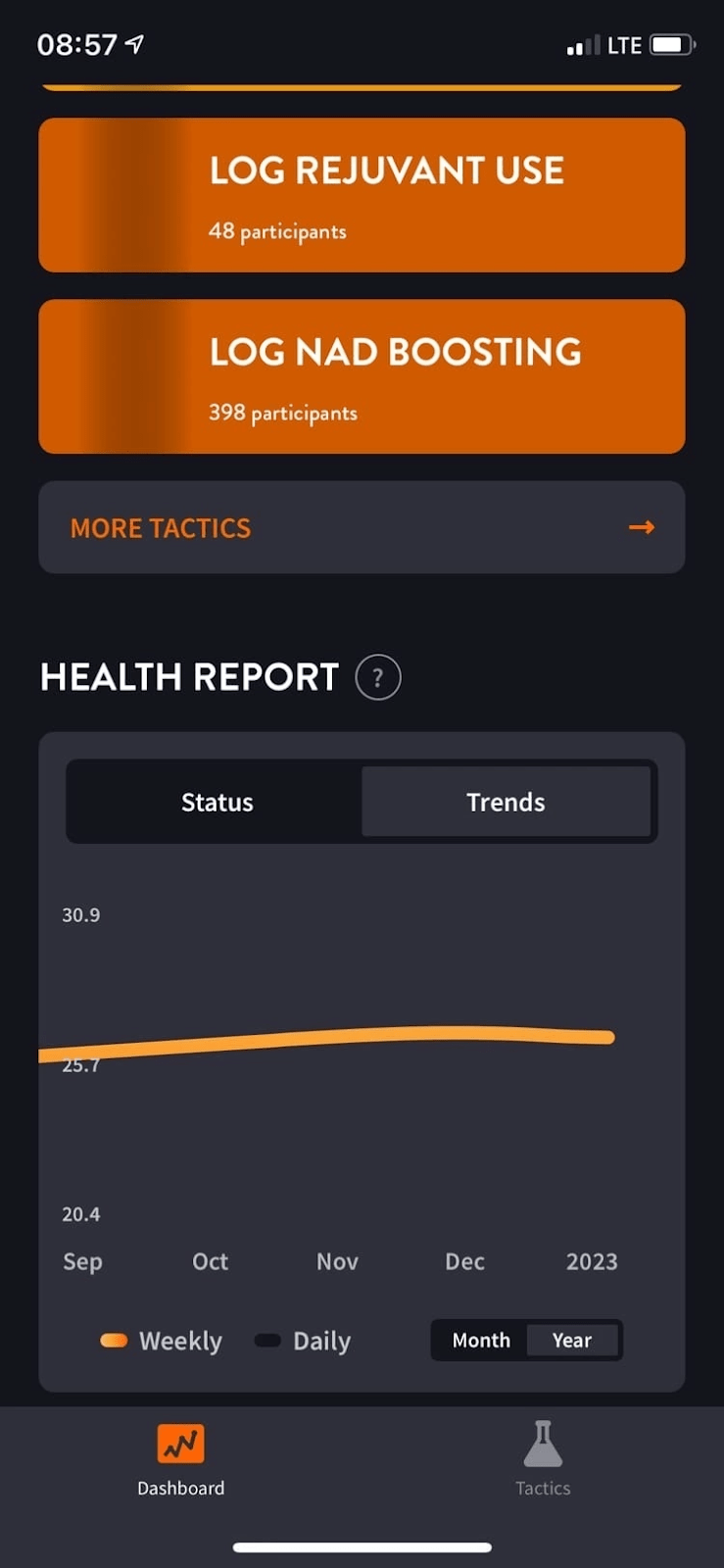
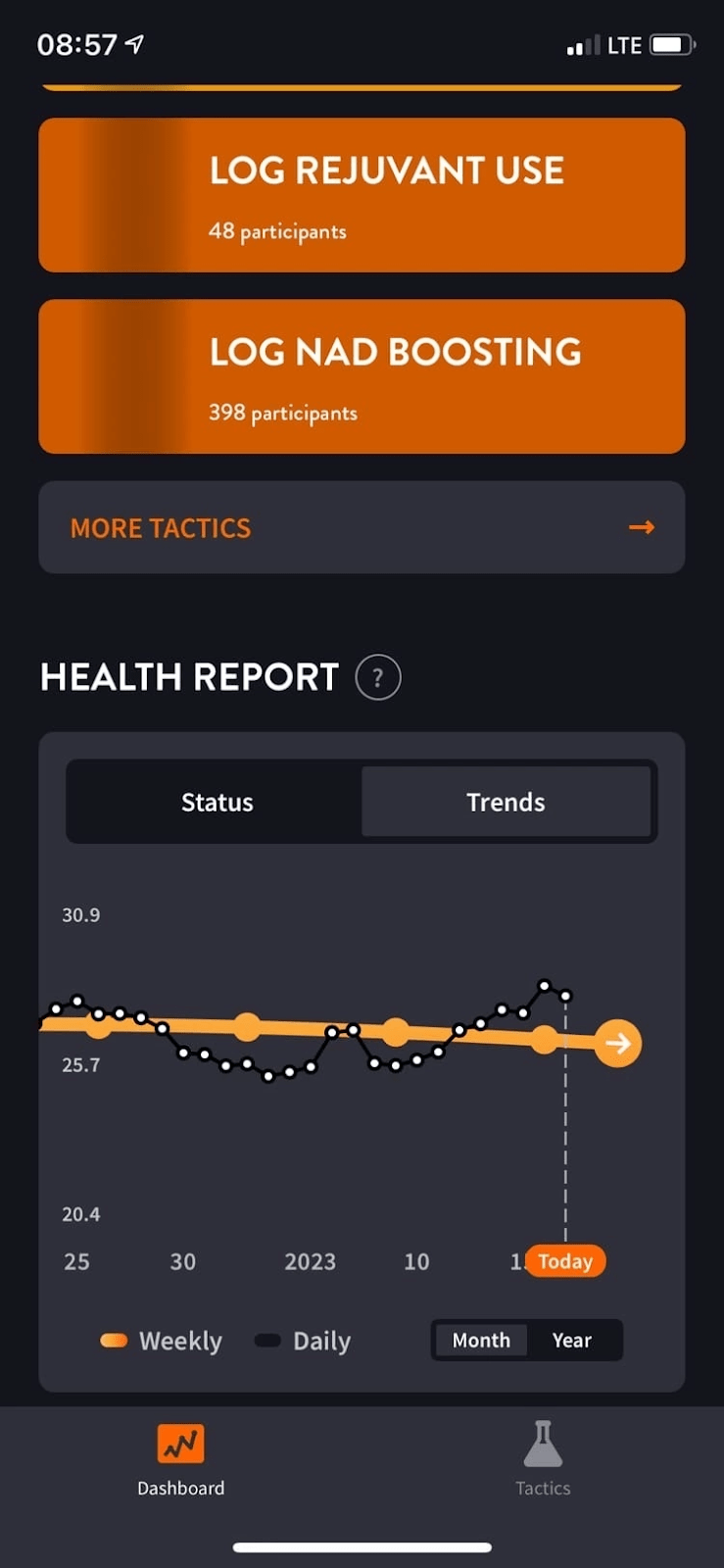
Результатом анализа больших данных для оценки биологического возраста стало мобильное приложение GeroSense. Пока что оно платное, но в планах компании сделать его доступным для всех. Сотрудники Gero создали его в качестве «цифровой» альтернативы клиническим испытаниям [38]. Приложение оценит биологический возраст и покажет, насколько хорош для здоровья ваш образ жизни. Чем больше разница биологического возраста с хронологическим, тем выше риск возникновения хронического заболевания и сокращения продолжительности жизни [39].
Алгоритм оценивает биологический возраст, устойчивость к стрессу, риск развития хронических заболеваний. А на вход принимает данные с Apple Watch, а если конкретнее, то с приложения Apple Health, которое фиксирует активность пользователя (шагомер), количество часов сна, пульс. Мониторинг состояния здоровья без других «классических» анализов выглядит действительно новаторски.
Отслеживание корреляции и обучение искусственного интеллекта проходит при помощи все тех же данных из Британского биобанка, а также NHANES (национальной программы по отслеживанию здоровья в США) [39]. Только вот, чтобы определять биологический возраст при помощи алгоритма и данных с фитнес-трекера, нет необходимости отправляться в лечебное учреждение и сдавать кровь. На выходе пользователи могут ознакомиться с индивидуальными расчетами рисков в виде графиков (рис. 6).
Что предлагает Insilico Medicine?
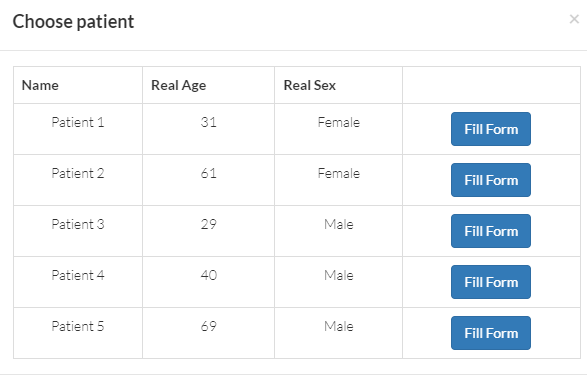
Тем временем, компания Insilico Medicine, известная своими исследованиями по применению больших данных в медицине [40], продолжает находить им новые приложения. Из поля зрения сотрудников не укрылась и геронтология вкупе с предсказанием биологического возраста. Так на свет появился Aging.AI — инструмент, созданный Insilico Medicine, — при помощи которого можно сразу узнать свой биологический возраст. Для этого необходимо заполнить форму на сайте: обозначить свой пол, хронологический возраст, рост и вес. Пока что Aging.AI больше похожа на разминку перед реальным забегом. Например, все мы знаем, что избыточный вес логично повысит биологический возраст. Но ведь это только начало пути: будут поступать новые данные, появляться новые компьютерные алгоритмы. Вполне вероятно, что спустя годы исследователи из области ИИ в медицине смогут нас удивить.Любопытным требованием стала отметка «курите / не курите». О связи курения и старения на просторах научных журналов встречается относительно много статей [41]; этот фактор оказался весомым и для расчетов. Также создатели алгоритма просят определиться с этнической принадлежностью. Это связано с тем, что наборы данных, взятые для обучения модели, чаще всего представляют определенную этническую выборку — например, среди граждан Китая или европейских стран.
Далее в форме на сайте следует таблица, где необходимо ввести биохимические показатели крови (рис. 7). И мы вновь приходим к анализу молекулярных данных при помощи алгоритмов искусственного интеллекта, только входные данные в этот раз — показатели крови. Снова молекулярные часы, только теперь они гематологические [42]. Кстати, а как они работают?
Представители Insilico Medicine обучили алгоритм на наборах данных биохимии крови для нескольких популяций [36], [42]. Подобный тип данных удобен по ряду причин — например, их довольно просто и дешево получить. Главной трудностью стала зависимость данных от этнической принадлежности популяции, поэтому их разбили на группы, как и следует далее использовать для оценки новых. Например, качество и количество пищи в разных географических зонах и у разных народов различны, а они оказывают влияние на показатели крови [43]. Ну и так уж вышло, что этнос связан с ожидаемой продолжительностью жизни и показателями смертности [44].
В основе машинного обучения для Aging.AI лежат глубокие нейронные сети, которые позволяют обрабатывать скрытые взаимосвязи внутри многомерных данных [45]. Для обучения взяли данные трех популяций — корейской (65 760 образцов), канадской (20 699 образцов) и восточноевропейской (55 920 образцов). На вход подали двадцать показателей крови (самых распространенных при направлении на анализ), количество определенных клеток крови (например, тромбоцитов и эритроцитов) и пол для каждой из трех групп (рис. 8). Входными данными послужили следующие показатели — альбумин, глюкоза, гемоглобин, холестерин, натрий, мочевина, холестерин ЛПНП, триглицериды, гематокрит, холестерин ЛПВП, общий белок, кальций, креатинин, калий и общий билирубин, а также четыре маркера количества клеток, включая эритроциты и тромбоциты. Данные людей моложе 20 лет исключили [42].

Рисунок 8. Дизайн нейросети. Образцы крови трех популяций (канадской, корейской и восточноевропейской) использовали для обучения трех специфических для популяции предикторов. Полученный набор данных, состоящий из выборок из всех трех популяций, использовался для обучения и тестирования глубоких нейронных сетей для прогнозирования возраста пациентов.
Прогностические способности модели проверили при помощи данных NHANES. Полученные данные показали, что часы гематологического старения на основе Deep Learning, даже при обучении на ограниченном количестве признаков, демонстрируют достаточно высокую точность прогнозирования хронологического возраста (рис. 9).

Рисунок 9. В перспективе искусственный интеллект позволит подбирать индивидуальные траектории для коррекции образа жизни (но пока это не точно). Так или иначе они будут направлены на продление молодости.
Заключение: перспективы исследований
Анализ больших данных при помощи алгоритмов искусственного интеллекта позволил вывести новые параметры, определяющие здоровье человека. Одним из них стал биологический возраст — показатель физиологического состояния организма, который также можно рассматривать как характеристику старения (изношенности). Способность искусственного интеллекта определять биологический возраст может оказать существенную поддержку медицинским сотрудникам и войти в ряд классических. Возможно, на основе полученных данных врачи будут давать советы по предупреждению развития некоторых заболеваний, свойственных старению. Вкупе с генетическим анализом, которым определяет «слабые» места нашего генома, медики смогут предиктивно работать в отношении большинства заболеваний в целом. Всё же предупреждать болезнь легче, чем ее лечить, как и правильно питаться проще (и дешевле), чем пить горсть таблеток каждый день. Некоторый убыток может грозить фармацевтической отрасли, но, впрочем, она скорее всего не замедлит адаптироваться и станет производить «полезные» таблетки для снижения биологического возраста.
На примере GeroSense мы увидели, что постоянный мониторинг биологического возраста — это уже реальность. А в будущем возможно создание программы на основе искусственного интеллекта, которая будет в режиме реального времени давать рекомендации по уменьшению биологического возраста, улучшению показателей устойчивости и продлению продолжительности жизни [34]. Не за горами и применение такого рода данных для персонализированной медицины или даже создания индивидуальных лекарственных средств, чем уже активно занимаются исследователи из отрасли фармакогеномики [46].
Однако оценкой биологического возраста ограничивать искусственный интеллект точно не стоит. Пока что применение этого показателя ограничено, и прорыва в медицине благодаря ему ждать не следует. Бесценная помощь в обработке больших данных и ускоренная работа разных алгоритмических подходов позволяют внедрять искусственный интеллект в разные области, так или иначе направленные на помощь человеку (рис. 10).

Рисунок 10. Подходы, которые могут увеличить продолжительность жизни человека. Девять основных признаков старения (вспомним их по рис. 2) и подходящие к ним терапевтические подходы — экспериментально подтвержденные пока только на мышах:
Литература
- Carlos López-Otín, Maria A. Blasco, Linda Partridge, Manuel Serrano, Guido Kroemer. (2013). The Hallmarks of Aging. Cell. 153, 1194-1217;
- Day of Eight Billion. (2022). United Nations;
- James F. Fries. (1980). Aging, Natural Death, and the Compression of Morbidity. N Engl J Med. 303, 130-135;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Alex Zhavoronkov, Ricky Li, Candice Ma, Polina Mamoshina. (2019). Deep biomarkers of aging and longevity: from research to applications. Aging. 11, 10771-10780;
- Jean-Marie Robine, Michel Allard, François R Herrmann, Bernard Jeune. (2019). The Real Facts Supporting Jeanne Calment as the Oldest Ever Human. The Journals of Gerontology: Series A. 74, S13-S20;
- Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Sameer Quazi. (2022). Telomerase gene therapy: a remission toward cancer. Med Oncol. 39;
- Просто о сложном: CRISPR/Cas;
- Старение и долголетие: эпигеном раскрывает тайны;
- Эпигенетические часы: сколько лет вашему метилому?;
- Rodolfo G. Goya, Marianne Lehmann, Priscila Chiavellini, Martina Canatelli-Mallat, Claudia B. Hereñú, Oscar A. Brown. (2018). Rejuvenation by cell reprogramming: a new horizon in gerontology. Stem Cell Res Ther. 9;
- Anna V. Kudryavtseva, George S. Krasnov, Alexey A. Dmitriev, Boris Y. Alekseev, Olga L. Kardymon, et. al.. (2016). Mitochondrial dysfunction and oxidative stress in aging and cancer. Oncotarget. 7, 44879-44905;
- Молодость в энергии;
- Война и мир: как устроить белковую жизнь?;
- Alexander Hartmann, Christiane Hartmann, Riccardo Secci, Andreas Hermann, Georg Fuellen, Michael Walter. (2021). Ranking Biomarkers of Aging by Citation Profiling and Effort Scoring. Front. Genet.. 12;
- Slavica Dodig, Ivana Čepelak, Ivan Pavić. (2019). Hallmarks of senescence and aging. Biochem. med. (Online). 29, 483-497;
- Население кожи: как микробиом влияет на ее общее состояние и при чем тут генетика?;
- Микробиом кишечника: мир внутри нас;
- Sholpan Askarova, Bauyrzhan Umbayev, Abdul-Razak Masoud, Aiym Kaiyrlykyzy, Yuliya Safarova, et. al.. (2020). The Links Between the Gut Microbiome, Aging, Modern Lifestyle and Alzheimer's Disease. Front. Cell. Infect. Microbiol.. 10;
- Levine M. E. Epigenetic biomarkers of aging. In: Biomarkers of Human Aging / ed. by Moskalev A. Cham: Springer International Publishing, 2019. P. 155–171;
- Эпигенетические часы: сколько лет вашему метилому?;
- Liam Drew. (2022). Turning back time with epigenetic clocks. Nature. 601, S20-S22;
- Morgan E. Levine, Ake T. Lu, Austin Quach, Brian H. Chen, Themistocles L. Assimes, et. al.. (2018). An epigenetic biomarker of aging for lifespan and healthspan. Aging. 10, 573-591;
- Ake T. Lu, Austin Quach, James G. Wilson, Alex P. Reiner, Abraham Aviv, et. al.. (2019). DNA methylation GrimAge strongly predicts lifespan and healthspan. Aging. 11, 303-327;
- Timothy V. Pyrkov, Evgeny Getmantsev, Boris Zhurov, Konstantin Avchaciov, Mikhail Pyatnitskiy, et. al.. (2018). Quantitative characterization of biological age and frailty based on locomotor activity records. Aging. 10, 2973-2990;
- Tianxiao Huan, George Chen, Chunyu Liu, Anindya Bhattacharya, Jian Rong, et. al.. (2018). Age-associated microRNA expression in human peripheral blood is associated with all-cause mortality and age-related traits. Aging Cell. 17, e12687;
- Jason G. Fleischer, Roberta Schulte, Hsiao H. Tsai, Swati Tyagi, Arkaitz Ibarra, et. al.. (2018). Predicting age from the transcriptome of human dermal fibroblasts. Genome Biol. 19;
- Сверим часы;
- Эпигенетические часы: сколько лет вашему метилому?;
- Биохакеры: молекулярная биология в стиле «сделай сам»;
- Петр Федичев: «Взломать старение: Почему теперь мы сможем жить дольше». Рецензия;
- Peter O. Fedichev. (2018). Hacking Aging: A Strategy to Use Big Data From Medical Studies to Extend Human Life. Front. Genet.. 9;
- Benjamin Gompertz Finds that Mortality Increases Exponentially with Age. (2019). Science of Aging;
- Evgeny Putin, Polina Mamoshina, Alexander Aliper, Mikhail Korzinkin, Alexey Moskalev, et. al.. (2016). Deep biomarkers of human aging: Application of deep neural networks to biomarker development. Aging. 8, 1021-1033;
- Toshitaka Odamaki, Kumiko Kato, Hirosuke Sugahara, Nanami Hashikura, Sachiko Takahashi, et. al.. (2016). Age-related changes in gut microbiota composition from newborn to centenarian: a cross-sectional study. BMC Microbiol. 16;
- Lomas N. (2021). Longevity startup Gero AI has a mobile API for quantifying health changes. TechCrunch;
- Timothy V. Pyrkov, Ilya S. Sokolov, Peter O. Fedichev. (2021). Deep longitudinal phenotyping of wearable sensor data reveals independent markers of longevity, stress, and resilience. Aging. 13, 7900-7913;
- Залог успеха — большие данные в умелых руках;
- Курить – Y-хромосоме вредить;
- Polina Mamoshina, Kirill Kochetov, Evgeny Putin, Franco Cortese, Alexander Aliper, et. al.. (2018). Population Specific Biomarkers of Human Aging: A Big Data Study Using South Korean, Canadian, and Eastern European Patient Populations. The Journals of Gerontology: Series A. 73, 1482-1490;
- Alan A. Cohen, Vincent Morissette-Thomas, Luigi Ferrucci, Linda P. Fried. (2016). Deep biomarkers of aging are population-dependent. Aging. 8, 2253-2255;
- Richard G. Rogers, Bethany G. Everett, Jarron M. Saint Onge, Patrick M. Krueger. (2010). Social, behavioral, and biological factors, and sex differences in mortality. Demography. 47, 555-578;
- Polina Mamoshina, Armando Vieira, Evgeny Putin, Alex Zhavoronkov. (2016). Applications of Deep Learning in Biomedicine. Mol. Pharmaceutics. 13, 1445-1454;
- Фармакогеномика: изучение генов на службе персонализированной медицины;
- Пилюли для эпигенома;
- Нутригеронтология: питание vs. старение.