
Двуликие геномы! Что такое амбисенсные вирусные РНК?
12 января 2021
Двуликие геномы! Что такое амбисенсные вирусные РНК?
- 3332
- 0
- 2
Двусмысленные вирусные геномы содержат участки как положительной, так и отрицательной «полярности»
здесь и далее рисунки Андрея Занкевича
-
Автор
-
Редактор
Статья на конкурс «Био/Мол/Текст»: Некоторые РНК-вирусы человека, животных и растений демонстрируют чудеса организации структуры генома, который, хотя и представлен одноцепочечной молекулой РНК, кодирует две трансляционные рамки, направленные в разные стороны. Что это за вирусы, и как им это удаётся? Давайте попробуем разобраться.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Напомним, что РНК (рибонуклеиновая кислота) — это такая молекула, представляющая собой одну цепочку нуклеотидов. В составе каждого нуклеотида присутствует остаток моносахарида рибозы. На сегодняшний день известно множество разных типов РНК, которые выполняют совершенно разные функции: от кодирования клеточных белков (мРНК) до противовирусной защиты (некоторые микроРНК) [1–5]. РНК, входящие в состав многих вирусов, могут иметь ряд оригинальных функций, таких как регуляция времени экспрессии различных вирусных генов путем изменения пространственной организации цепи РНК или привлечение клеточных белковых комплексов.
Биологи привыкли думать об РНК главным образом как о «молекуле-посреднике» между ДНК и белком. Именно молекулы матричной РНК (мРНК) распознаются рибосомами — молекулярными машинками, расшифровывающими последовательность РНК в процессе синтеза белка. мРНК имеют в своем составе кодирующие последовательности и, как правило, некодирующие области на 5′- и 3′-концах. Для мРНК эукариот характерно наличие особой кэп-структуры (которая узнается рибосомой) на 5′-конце и полиаденозиновой последовательности на 3′-конце («ключик» для выхода из ядра, вдобавок повышающий стабильность такой мРНК). мРНК называют РНК положительной полярности, или (+)РНК, то есть РНК, с которой не нужно проводить никаких дополнительных операций — у нее есть всё, что нужно для «посадки» рибосомы и последующей трансляции! У некоторых вирусов встречаются молекулы РНК отрицательной полярности, или (–)РНК, несущие комплементарные кодирующим последовательностям участки. В таком случае для образования вирусной мРНК необходима эта самая (–)РНК, а также вирусный фермент, осуществляющий матричный синтез комплементарной РНК-цепи.
Но бывает ли такое, что в пределах одной молекулы РНК одна ее часть, кодирующая некоторый белковый продукт, имеет положительную полярность, в то время как другая часть цепи представлена участком отрицательной полярности, кодирующим другой белок? Могла ли такая молекула возникнуть в процессе эволюции живых форм?
Ответ — да! И для того, чтобы разобраться, как функционируют такие молекулы, нам предстоит погрузиться в таинственный мир вирусов...
Давным-давно, в далекой-далекой галактике...
Сегодня очень популярна гипотеза «РНК-мира» [6], указывающая на РНК как на главного кандидата в прародители жизни на нашей планете. Поскольку РНК может как кодировать информацию, так и проявлять иногда каталитическую (рибозимную) активность (то есть специфически ускорять протекание определенных химических реакций), молекулы РНК, включающие обе эти функции, вполне могли бы являться первыми объектами живой природы, так как при наличии субстрата они способны реплицировать сами себя.
Как известно, все формы жизни обладают определенной наследственностью, которая определяет степень генетической идентичности живых объектов. В качестве молекул, ответственных за поддержание такой наследственной идентичности, выступают нуклеиновые кислоты (ДНК и РНК). Клеточные формы жизни для хранения и передачи информации используют только один тип нуклеиновых кислот — дезоксирибонуклеиновую кислоту (ДНК), в то время как вирусы в качестве основной молекулы наследственности могут использовать либо ДНК, либо РНК.
В случае ДНК-содержащих вирусов реализуется, как правило, Центральная догма молекулярной биологии в классическом виде: попав в клетку, ДНК удваивается в процессе репликации вирусного генома, на матрице ДНК в ходе транскрипции синтезируются мРНК, которые затем прочитываются рибосомой, синтезирующей по ним вирусные белки, то есть осуществляется трансляция. Далее вирусные белки ассоциируются с ДНК-геномом вируса в вирусную частицу (вирион), которая способна заражать новые клетки.
Очевидно, что РНК-содержащие вирусы используют иные стратегии размножения и, следовательно, реализации своего генома. Непривычные для большинства биологов молекулярные механизмы, которые используются такими вирусами, вероятно, унаследованы от далеких предков из того самого РНК-мира.
Немного истории
Первым найденным РНК-вирусом стал бактериофаг f2, инфицирующий бактерию кишечную палочку (Escherichia coli) [7]. Выделенная геномная РНК фага f2 имела свойства мРНК, то есть она распознавалась рибосомой и могла транслироваться. На родственном РНК-бактериофаге Qβ была изучена РНК-зависимая РНК-полимераза (RdRp), которая, как оказалось, может синтезировать цепь РНК на матрице другой цепи РНК, то есть осуществлять репликацию вирусного РНК-генома! В ходе работы с РНК-бактериофагами f2 и его родственником Qβ были получены общие представления о биологии таких РНК-вирусов [8].
РНК, способную распознаваться рибосомой с осуществлением синтеза белка, назвали «(+)РНК». Эта РНК, попав в клетку-хозяина, может сразу использоваться в качестве мРНК для синтеза вирусных белков. У многих вирусов такая (+)РНК инфекционна сама по себе, т. к. кодирует все нужные для полноценной вирусной инфекции белки, включая RdRp, осуществляющую репликацию генетического материала вируса.
После РНК-бактериофагов были найдены (+)РНК-вирусы животных, такие, как вирус полиомиелита [9], [10], представитель группы пикорнавирусов. Подобные вирусы не содержат репликативных белков в составе вирусной частицы (вириона).
Вирус везикулярного стоматита (VSV), как и вирус полиомиелита, был также одним из первых исследованных РНК-вирусов животных, однако в составе вириона нашли фермент RdRp, синтезирующий комплементарную (антигеномную) цепь РНК [11]. Антигеномная цепь является интермедиатом репликации и не участвует в трансляции. Матрицами для синтеза белка в данном случае выступают более короткие вирусные мРНК (субгеномные РНК), транскрибируемые с геномной цепи. Хотя антигеномная РНК не транслируется, ее последовательность совпадает с последовательностями мРНК, поэтому говорят, что она имеет ту же полярность — положительную. Итак, в рассматриваемом случае антигеномная и субгеномные цепи являются (+)РНК, а геномная РНК играет роль матрицы для синтеза (+)РНК и оттого называется «РНК противоположной полярности», то есть «(–)РНК». У (–)РНК-вирусов как раз такая РНК в качестве геномной упаковывается в вирион вместе с вирусной RdRp, которая ответственна за матричный синтез антигеномной и субгеномных (+)РНК после проникновения в клетку. Cреди (–)РНК вирусов выделяют вирусы с несегментированным геномом (вирион содержит одну молекулу (–)РНК, вместе с RdRp необходимую для инфекции; порядок Mononegavirales) и сегментированным геномом (для инфекции необходимо несколько разных молекул геномной РНК, каждая из которых связана со своей молекулой RdRp; порядок Articulavirales). Хорошо известный вирус гриппа А является представителем второй группы. Каждая (–)РНК (геномный сегмент), упакованная в вирусную частицу, «обёрнута» молекулами белка нуклеокапсида NP, в комплексе с которым образуется РНП (рибонуклеопротеин). Также в этот комплекс входит мультисубъединичная RdRp.
Встречаются вирусы, геном которых представлен двухцепочечной РНК. Как и в случае (–)РНК-вирусов, у дцРНК-вирусов во время репликации в клетке первым делом происходит синтез (+)цепи. Вирусные частицы этой группы также включают в свой состав RdRp.
Наша статья посвящена очень занятной группе вирусов, имеющих «двусмысленный РНК-геном». Сегментированная природа генома роднит их с представителями порядка Articulavirales, однако, в отличие от последних, один или два РНК-сегмента являются «(±)РНК». Такие РНК называют амбисенсными: это значит, что в пределах одной молекулы РНК есть последовательности, по смыслу соответствующие мРНК ((+)участки), а также участки отрицательной полярности ((–)участки), то есть комплементарные мРНК. Согласно таксономии, вирусы с двусмысленным РНК-геномом определяют в семейства Bunyaviridae и Arenaviridae.
Исторически одним из первых выделенных вирусов с двусмысленной РНК был флебовирус — вирус лихорадки долины Рифт (RVFV) [12]. Открытие амбисенсной природы РНК некоторых вирусов [13], [14] пришлось на период, когда были достаточно хорошо исследованы (+)- и (–)РНК-содержащие вирусы, что и позволило предположить возможность «двусмысленной» молекулы РНК в составе таких вирусов.
Вирусы с двусмысленным РНК-геномом из семейства Bunyaviridae
Вирусные частицы (вирионы) Bunyaviridae диаметром от 80 до 130 нанометров могут иметь изменчивую (плеоморфную) форму. Липопротеидная оболочка, образованная фосфолипидной мембраной и вирусными гликопротеинами Gn и Gc, содержит внутри три нуклеокапсида (рибонуклеопротеина, состоящих из молекулы РНК (сегмента), «одетой» в молекулы белка нуклеокапсида N, и ассоциированной с ней одной молекулы репликазы L (RdRp)). Три сегмента РНК-генома, несущих на концах комплементарные участки (благодаря которым РНК «циклизуются» в вирионе), получили названия в соответствии с длинами их нуклеотидной последовательности: L (large, ~7000 нуклеотидных остатков), M (medium, ~3000 н.о.), S (small, ~1000 н.о.) (рис. 1.). В семействе встречаются (–)РНК-вирусы (роды Orthobunyavirus, Hantavirus и Nairovirus), имеющие концептуальную схожесть молекулярной стратегии репликации с таковой, например, вируса гриппа. Однако вирусы семейства Bunyaviridae не имеют матриксного белка — широко распространенного типа полипротеинов, встречающегося у большинства липид-содержащих РНК-вирусов животных и человека.
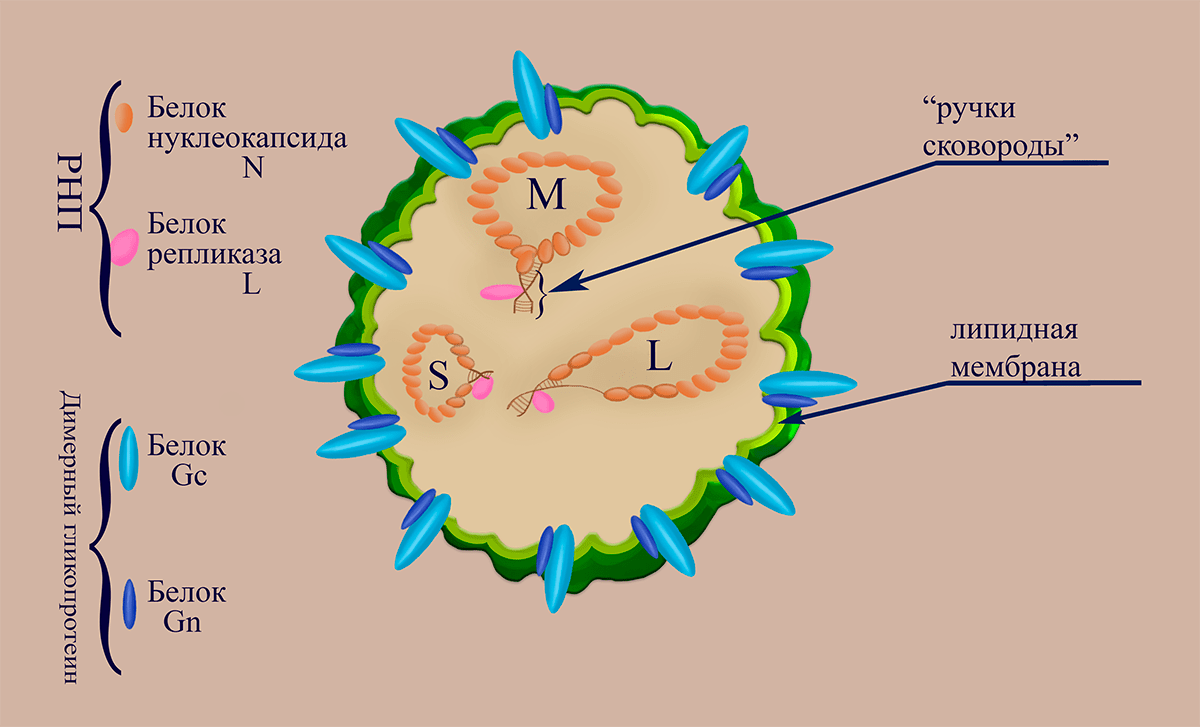
Рисунок 1. Схематичное изображение структуры вириона флебовирусов
В семействе Bunyaviridae роды Phlebovirus, Tospovirus и Tenuivirus являются вирусами с двусмысленным РНК-геномом и, в отличие от остальных представителей семейства, имеют чуть более длинный S-сегмент генома (РНК S) (±)полярности. Род Tospovirus имеет вдобавок (+)участок на РНК M, который делает и эту РНК амбисенсной.
Флебовирусы
Вирусы рода Phlebovirus выделяют практически по всему миру и относят к нетаксономической группе арбовирусов, распространяющихся в членистоногих переносчиках и в позвоночных, на которых питаются переносчики. Члены этого рода переносятся кровососущими членистоногими. Инфекции не обходят стороной человека: вирусы сицилийской и неаполитанской москитных лихорадок широко распространены по территории Средиземноморья [15]. Среди симптомов таких инфекций — продолжительная сильная лихорадка, тошнота, рвота, диарея и головные боли. Вирус Тосканы, также переносимый москитами, обладает способностью проникать в нервную ткань и, вдобавок к вышеперечисленным симптомам, вызывает асептический менингит и менингоэнцефалит. Флебовирусы, переносимые клещами, например, вирус Бханджа, вирус тяжелой лихорадки с синдромом тромбоцитопении, или вирус Хартленд, вызывают серьезные вспышки инфекций среди людей [16].
Эти вирусы получили свое имя от латинского названия москитов (Phlebotominae), которые являются их основными переносчиками. Вирионы флебовирусов имеют диаметр 100-125 нанометров. Внутри вириона находятся три вирусных рибонуклеопротеина (вРНП), содержащих геномные сегменты, однако для вируса лихорадки долины Рифт (RVFV) было показано [17], что вирионы также могут содержать ещё три дополнительных вРНП, образованных цепочками антигеномных РНК, комплементарных геномным вирусным РНК. Рецептор-распознающий аппарат вирусов представлен гетеродимерами гликопротеинов Gn и Gc, которые организованным способом распределены по мембране вириона.
Структура генома флебовирусов
Геном флебовирусов как и других представителей семейства Bunyaviridae, включает три молекулы РНК: PHК L, РНК M, РНК S, имеющие на 5′- и 3′- концах уникальные для каждого геномного сегмента комплементарные последовательности. РНК L (–)полярности кодирует белок репликазы L. (–)РНК M кодирует предшественник гликопротеинов G1 и G2. (±)РНК S кодирует белок нуклеокапсида N на (–)полярном участке (ближе к 3′) и неструктурный белок NSs на (+)полярном участке (ближе к 5′) (рис. 2).
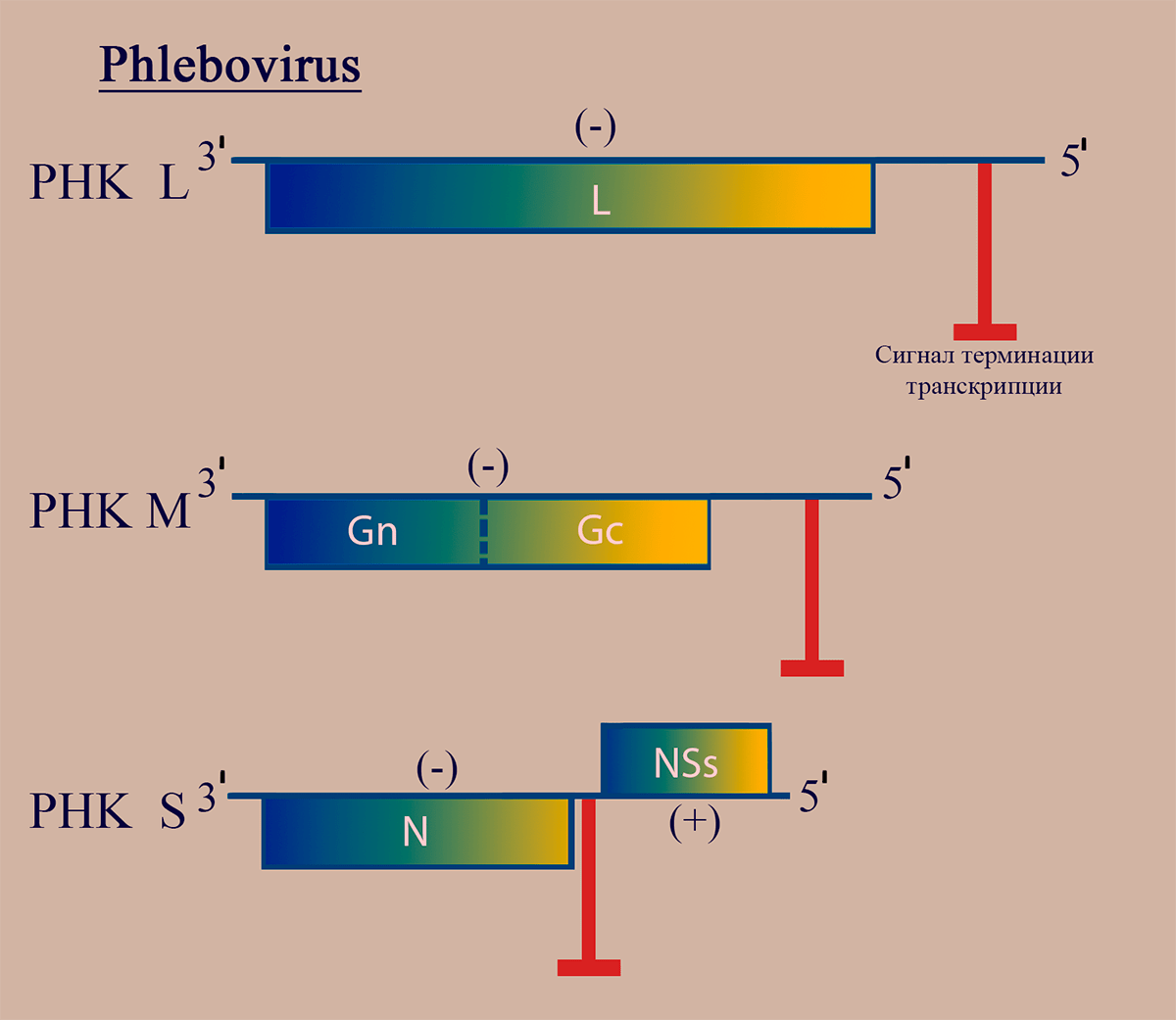
Рисунок 2. Схема структуры генома флебовирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
NSs выполняет ряд функций, среди которых подавление индукции интерферона, усиление репликации и транскрипции вирусной РНК и определение круга хозяев [18]. NSs через цепочку белковых факторов способен приводить к инактивации противовирусной протеинкиназы R организма-хозяина [19].
При одевании вирусных РНК белок N распознаёт последовательность на ее 5′-конце. В вирионе каждая молекула РНП закольцована за счет комплементарных взаимодействий 5′- и 3′-концевых последовательностей (образование т.н. «ручек сковороды»). Таким образом, сегменты генома организуются в шпилечные структуры с короткими (около 12 пар нуклеотидных остатков) стебельками и большими (весь остальной геном) петлями, которые покрыты белком N.
Главный промотор транскрипции и репликации располагается в области спаренных 5′- и 3′-концевых участков («ручки»). Транскрипция и репликация генома флебовирусов осуществляются репликазой L (RdRp).
Механизмы транскрипции и репликации РНК флебовирусов
Транскрипция кодирующей белок N последовательности на РНК S, как и для генов других геномных сегментов, происходит с участием геномной (–)РНК по принципу «стащить кэп», а мРНК, кодирующая белок NSs (закодирован в (+)последовательности РНК S), транскрибируется по этому же принципу, но с антигеномной цепи. То есть (+)участок геномной цепи не способен сразу распознаваться рибосомой — для трансляции этого участка необходимо сначала синтезировать полноразмерную антигеномную РНК, с нее — содержащую клеточный кэп субгеномную РНК, и только на субгеномную РНК «сядет» рибосома.
Остановка транскрипции (–)участка РНК S определяется межгенным сигналом терминации. Похожие сигналы терминации находятся в 5′-концевой области РНК M и РНК L. В результате синтезируются кэпированные, но неполиаденилированные (и, следовательно, не такие стабильные, как клеточные мРНК) субгеномные РНК [18]. Также было показано [17], что в инфицированных клетках наблюдается ранняя экспрессия белка NSs, к тому же при детальном анализе состава вирионов обнаружили, что в вирусную частицу может упаковываться как три геномных цепи, так и еще три антигеномных цепи. Считается, что антигеномная РНК S присутствует в вирионе для осуществления ранней транскрипции мРНК, кодирующей NSs, поскольку этот неструктурный белок способен регулировать клеточные процессы, и чем раньше он начнёт работать в зараженной клетке, тем интенсивнее будет протекать вирусная инфекция.
Когда белка N накапливается некоторое «пороговое» количество, происходит переключение режима работы белка L с транскрипционного на репликационный, в результате чего синтезируются не субгеномные РНК, а антигеномные. Инициация репликации не требует затравок клеточной природы, полимеризация комплементарной цепи начинается с одного рибонуклеотида, который и является затравкой [18]. Репликация прекращается, когда репликаза доходит до конца геномной цепи. Геномные РНК синтезируются по аналогичной схеме с антигеномных цепей. Все вышеописанные процессы протекают в цитоплазме — для эффективных транскрипции, репликации, созревания гликопротеинов и, в конце концов, формирования вирусных частиц необходимо образование «вирусных фабрик», представляющих собой трубчатые структуры, образованные мембранами комплекса Гольджи. Такие «фабрики» позволяют повысить локальную концентрацию компонентов репликации вируса [20].
Жизненный цикл флебовирусов
Жизненный цикл состоит из следующих стадий (рис. 3):
- адсорбция (прикрепление) на поверхности клетки-мишени;
- проникновение путем эндоцитоза (т.е. захват вириона клеткой);
- «раздевание» вириона;
- транскрипция: вирусный белок L отрезает от клеточных кэпированных мРНК 5′-концевые фрагменты, которые затем использует в качестве затравок для синтеза вирусных мРНК. На матрице геномных (–)РНК синтезируются субгеномные (+)цепи в цитоплазме, а в случае с РНК S для экспрессии генов, закодированных на (–)участке и (+)участке геномной цепи, необходим синтез мРНК путем транскрипции (–)участков геномной и антигеномной РНК соответственно;
- синтез вирусных белков: клеточные рибосомы осуществляют трансляцию с участием субгеномных РНК; продуктом трансляции с М-сегмента является GnGc — дипротеин, предшественник вирусных гликопротеинов; далее следует разрезание белка GnGc с образованием Gn и Gc, их попарное объединение на мембране эндоплазматической сети (ЭПС);
- мембран-ассоциированная репликация при участии все той же репликазы L начинается с синтеза антигеномных цепей, которые «одеваются» белком нуклеокапсида N и используются в дальнейшем как матрицы для синтеза вирионных РНК-сегментов;
- происходит перенос гетеродимера белков Gn и Gc на мембрану аппарата Гольджи, где этот гетеродимер гликозилируется (к нему пришиваются сахарные остатки) с образованием зрелого двухсубъединичного гликопротеина;
- оборачивание собранных вирусных геномных РНП мембраной комплекса Гольджи, усеянной вирусным гликопротеином; включение вирионов в экзосомные цитоплазматические пузырьки;
- слияние цитоплазматических пузырьков, содержащих вирионы, с плазматической мембраной клетки, что приводит к высвобождению вирусных частиц из инфицированной клетки.

Рисунок 3. Схема, демонстрирующая основные этапы цикла флебовируса
Тосповирусы и тенуивирусы
Тосповирусы имеют сходную с флебовирусами структуру вириона. Они являются патогенами растений, использующими в качестве переносчика и второго хозяина трипсов, отряд мелких насекомых-фитофагов [21] и способными к межклеточному транспорту через плазмодесмы в растениях благодаря наличию транспортного белка NSm. Этот белок не входит в состав вириона и синтезируется в течение короткого периода на ранних стадиях инфекции. Он способен связываться с белком нуклеокапсида N, вирусной РНК и клеточными белками, оказываясь ответственным не только за межклеточный транспорт вРНП, без упаковки в вирион, но и за образование вышеупомянутых «вирусных фабрик» в клетке, что в совокупности сказывается на степени вирулентности тосповирусов [22].
Название рода Tospovirus происходит от сокращения названия вируса пятнистого увядания томатов (tomato spotted wilt virus, ТоSWV), впервые выделенного в 1930 году из зараженных растений томата. Этот вирус имеет очень широкий спектр хозяев и важное хозяйственное значение, борьба с ним ведется, в основном, за счет контроля численности трипсов.
Структура генома тосповирусов и тенуивирусов
Представители родов Тospovirus и Tenuivirus (тенуивирусы близки к тосповирусам, но не имеют липидной оболочки) являются единственными известными РНКвирусами растений с двусмысленным геномом [23]. Геном тосповирусов представлен тремя РНК-сегментами: большим, средним и малым (L, M, S). РНК L кодирует репликазу L. РНК S, подобно таковой у флебовирусов, кодирует белок нуклеокапсида N в (–)области и неструктурный белок NSs в (+)области. Эти области не пересекаются, они разделены межгенным некодирующим участком, содержащим сигналы терминации транскрипции. М-сегмент генома имеет принципиально отличную от РНК М флебовирусов структуру, являясь амбисенсной РНК. РНК М тосповирусов имеет область (–)полярности, в которой находится последовательность, кодирующая мРНК GnGc — предшественника поверхностных гликопротеинов, а также участок (+)полярности в 5′-области, кодирующий белок межклеточного транспорта NSm. Эти последовательности также разделены межгенным участком (рис. 4). Механизмы транскрипции и репликации РНК этих вирусов сходны с таковыми у флебовирусов [18].
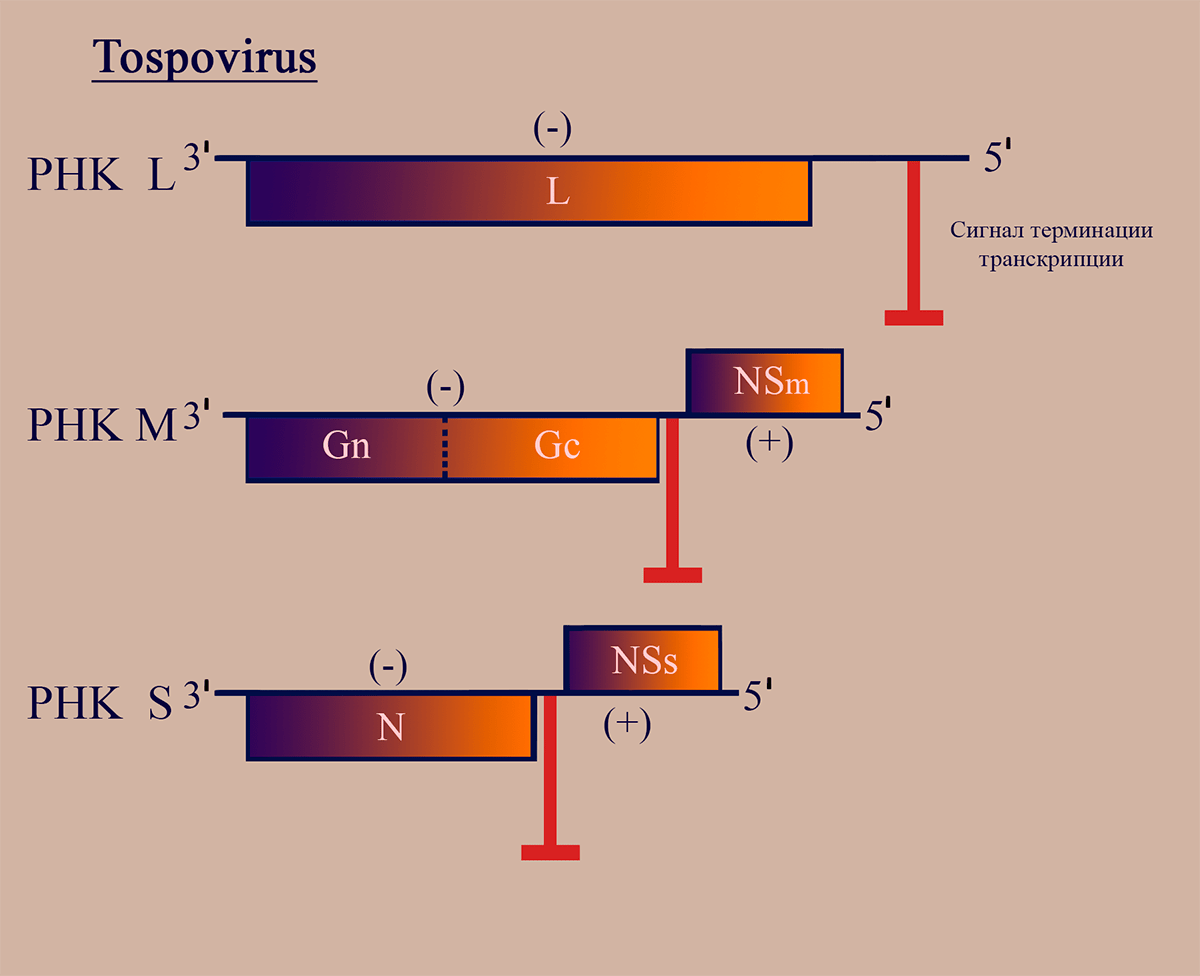
Рисунок 4. Схема структуры генома тосповирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
Отдельного внимания заслуживает неструктурный белок, закодированный в S-сегменте генома тосповирусов — NSs. Основной его функцией является супрессия противовирусного сайленсинга РНК, системы малых интерферирующих РНК [5], [24], распознающих вирусные РНК, что приводит к деградации последних [25]. Логично предположить, что синтез такого белка должен происходить как можно раньше, поэтому, возможно, по аналогии с белком NSs флебовирусов, ранняя транскрипция такой последовательности происходит в результате наличия в вирионе, помимо геномной цепи РНК S, еще и соответствующей ей антигеномной.
Вирусы с двусмысленным РНК-геномом из семейства Arenaviridae
Помимо семейства Bunyaviridae, амбисенсные РНК имеют представители семейства Arenaviridae. Аренавирусы являются таксономической группой вирусов позвоночных с сегментированным двусмысленным РНК-геномом. Вирусы, инфицирующие млекопитающих, определены в род Mammarenavirus, а заражающие рептилий — в роды Reptarenavirus и Hartmanivirus [26].
Вирионы аренавирусов, как и рассмотренных выше буньявирусов, плеоморфны, а их диаметр может варьировать от 40 до 200 нанометров в зависимости от вида, однако и частицы одного вида могут заметно различаться по размерам [27]. Границы вириона представлены липопротеидной оболочкой — производной клеточной мембраны, модифицированной равномерно распределёнными гликопротеиновыми комплексами (гетеродимерный гликопротеин GP1/GP2). Гликопротеины синтезируются в виде предшественника, который разрезается примерно пополам клеточной протеиназой на рецептор-распознающую субъединицу GP1 и трансмембранную субъединицу GP2. Последняя ответственна за слияние мембран при проникновении в цитоплазму [28]. В вирионе гликопротеины ассоциированны с лежащими на внутренней стороне мембраны молекулами матриксного белка Z, выстилающего внутреннюю поверхность мембраны, и белка нуклеокапсида N. Белок N способен связываться с РНК, распознавать кэп и ингибировать интерфероновый ответ. Структурный белок Z в клетке выполняет ряд функций (в том числе ингибирование трансляции клеточных мРНК и подавление апоптоза), являясь фактором созревания вирусных частиц (отвечает за инициацию сборки вирионов и за их отпочковывание).
Во время сборки вирусных частиц при формировании внешней оболочки иногда происходит захват субъединиц клеточных рибосом, по всей видимости, не играющих роли в вирусной инфекции (рис. 5).

Рисунок 5. Схематичное изображение структуры вириона аренавирусов
Значительная часть представителей семейства вызывает хронические и, как правило, бессимптомные инфекции у грызунов. При контакте человека с такими вирусами может развиваться острая и тяжелая инфекция, часто — геморрагическая лихорадка (например, в случае инфекции вирусом лихорадки Ласса, LasV). Вирус лимфоцитарного хориоменингита (LCMV), первый выделенный аренавирус, является нейроинвазивным. Попав в организм человека (например, через выделения грызунов), вирионы с током крови преодолевают гематоэнцефалический барьер центральной нервной системы и вызывают воспаления мозговых оболочек [29].
Структура генома аренавирусов
Геном аренавирусов имеет ряд особенностей и представлен двумя сегментами (РНК L ~7000 н.о.; РНК S ~3000 н.о.), циклизованными уже известными нам «ручками сковороды» и закрученными в спиральный рибонуклеопротеиновый комплекс (рис. 6). Обе молекулы РНК — двусмысленные!
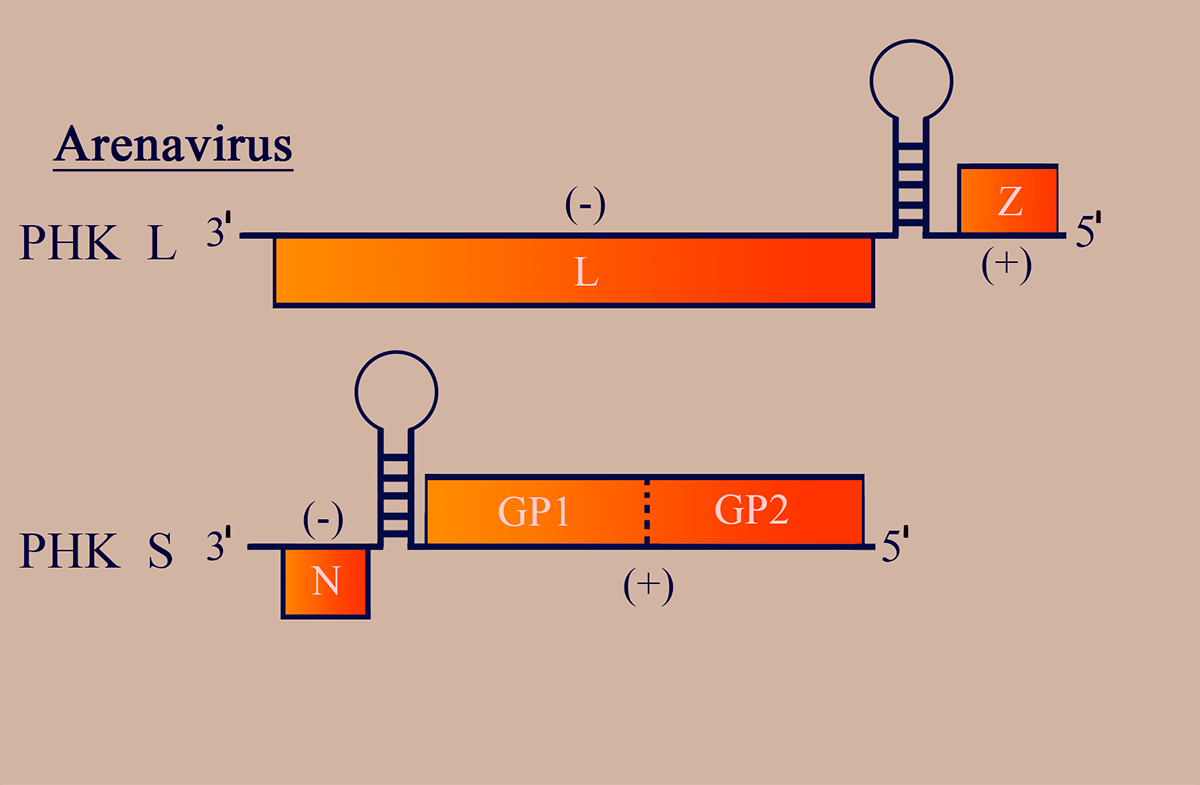
Рисунок 6. Схема структуры генома аренавирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирными линиями обозначены сайты протеолиза белковых продуктов.
РНК L на (–)участке несет последовательность, комплементарную гену репликазы L, и рамку матриксного и регуляторного белка Z на (+)участке в 5′-концевой части геномной РНК.
РНК S кодирует белок нуклеокапсида N в области (–)полярности и содержит рамку считывания GP1GP2 — предшественника поверхностных гликопротеинов GP1/GP2 (также в 5′-концевой части геномного сегмента).
(–)- и (+)участки разделены межгенными сайтами, образующими прочные вторичные структуры шпилечного характера. На 5′-конце геномных и антигеномных цепей присутствует сигнал инициации инкапсидации (то есть «одевания» РНК вирусными белками с образованием вРНП), распознаваемый белком N [18].
Транскрипция и репликация генома аренавирусов
Оба процесса проходят в цитоплазме инфицированной клетки. Транскрипция начинается при участии репликазы L по уже описанному выше для флебовирусов принципу «стащить кэп» (cap snatching). Терминация транскрипции обусловлена наличием соответствующего сигнала в стабильных шпильках межгенного пространства геномной или антигеномной РНК. Вирусные субгеномные РНК не полиаденилируются [18].
Переключение на репликацию связано с наличием белка N: когда его накапливается такое количество, что он начинает покрывать строящиеся цепи РНК, это, вероятно, влияет на конформацию репликазы и приводит к проскоку сигналов терминации транскрипции в виде межгенных шпилек. РНК S при репликации накапливается в больших количествах, так как нужно много копий белка нуклеокапсида, а также гликопротеинов (для экспрессии последних необходим предварительный синтез антигеномной РНК).
Заключение
Принимая во внимание всё вышеизложенное, можно сделать выводы относительно общих особенностей вирусов, содержащих амбисенсную РНК. Геном таких вирусов является сегментированным, и хотя бы один сегмент представлен амбисенсной РНК. Каждый геномный сегмент содержит комплементарные 3′- и 5′-концевые последовательности, образующие «ручки сковороды». В составе этого не очень протяженного дуплекса в геномной РНК присутствует главный промотор транскрипции и репликации, распознаваемый репликазой L. 5′- концевые последовательности геномных и антигеномных молекул РНК связываются белком нуклеокапсида N. Затравкой для синтеза вирусных мРНК, как и в случае типичных вирусов с сегментированным (–)РНК-геномом, является «откушенный» кэпированный фрагмент клеточной мРНК.
Что же касается самих амбисенсных РНК, они содержат последовательности отрицательной полярности в 3′-части и положительной полярности в 5′-части геномной цепи. Терминация транскрипции в таких двусмысленных РНК связана с наличием соответствующих сигналов в межгенном участке. При этом (+)участок амбисенсной РНК не может сразу выступать в качестве мРНК, необходим последовательный синтез антигеномной, а только потом субгеномной РНК положительной полярности. Все эти процессы занимают определенное время, поэтому вопрос «отсрочки» синтеза белков из (+)участка геномной РНК может решаться для вируса путем включения в зрелую вирусную частицу, помимо геномной (±)РНК, ещё и антигеномной (±)РНК.
Такая необычная организация двусмысленных геномных сегментов является интересным способом представления двух кодирующих последовательностей в одном геномном сегменте. На примере вирусов с двусмысленными РНК-геномами заметно, насколько изобретательной может быть эволюция вирусных РНК. Поскольку вирусы с двусмысленными РНК-геномами до сих пор удерживают определенную нишу, можно утверждать, что такой способ кодирования обладает некоторыми преимуществами по сравнению с более привычным для родственных вирусов способом, использующим только (–)РНК-сегменты.
Как возникли амбисенсные РНК и почему поддержались отбором, до сих пор остается одной из загадок современной вирусологии.
И как сказал один известный принц: «Есть многое на свете, друг Горацио, что и не снилось нашим мудрецам!»
Благодарности от автора
Я благодарю доктора биологических наук, профессора кафедры вирусологии биологического факультета МГУ им. М.В. Ломоносова Аграновского Алексея Анатольевича за интересные и содержательные лекции по молекулярным процессам РНК-вирусов и вдохновение на написание данной статьи. Также выражаю благодарность художнику Андрею Занкевичу, чьи наглядные и яркие иллюстрации украшают данную статью.
Литература
- Обо всех РНК на свете, больших и малых;
- Кодирующие некодирующие РНК;
- Длинные некодирующие РНК бактерий;
- Власть колец: всемогущие кольцевые РНК;
- piРНК — аналог CRISPR у эукариот;
- РНК: начало (мир РНК);
- T. Loeb, N. D. Zinder. (1961). A BACTERIOPHAGE CONTAINING RNA. Proceedings of the National Academy of Sciences. 47, 282-289;
- C. Weissmann. (1974). The making of a phage. FEBS Letters. 40, S3-S9;
- Baltimore D. The replication of picornaviruses. In: The biochemistry of viruses / ed. by Levy H.B. New York and London: Marcel Dekker Inc., 1969. P. 101–176;
- Полиомиелит: убийца из XX века;
- D. Baltimore, A. S. Huang, M. Stampfer. (1970). Ribonucleic Acid Synthesis of Vesicular Stomatitis Virus, II. An RNA Polymerase in the Virion. Proceedings of the National Academy of Sciences. 66, 572-576;
- R. Daubney, J. R. Hudson, P. C. Garnham. (1931). Enzootic hepatitis or rift valley fever. An undescribed virus disease of sheep cattle and man from east africa. J. Pathol.. 34, 545-579;
- Takeshi Ihara, Hiroomi Akashi, David H.L. Bishop. (1984). Novel coding strategy (ambisense genomic RNA) revealed by sequence analyses of punta toro phlebovirus S RNA. Virology. 136, 293-306;
- D D Auperin, V Romanowski, M Galinski, D H Bishop. (1984). Sequencing studies of pichinde arenavirus S RNA indicate a novel coding strategy, an ambisense viral S RNA.. Journal of Virology. 52, 897-904;
- Martina Moriconi, Gianluca Rugna, Mattia Calzolari, Romeo Bellini, Alessandro Albieri, et. al.. (2017). Phlebotomine sand fly–borne pathogens in the Mediterranean Basin: Human leishmaniasis and phlebovirus infections. PLoS Negl Trop Dis. 11, e0005660;
- Katherine Hornak, Jean-Marc Lanchy, J. Lodmell. (2016). RNA Encapsidation and Packaging in the Phleboviruses. Viruses. 8, 194;
- Tetsuro Ikegami, Sungyong Won, C. J. Peters, Shinji Makino. (2005). Rift Valley Fever Virus NSs mRNA Is Transcribed from an Incoming Anti-Viral-Sense S RNA Segment. JVI. 79, 12106-12111;
- Аграновский А.А. Репликация вирусных РНК: учебник. М.: «Товарищество научных изданий КМК», 2019. — 165 с.;
- Markus Kainulainen, Simone Lau, Charles E. Samuel, Veit Hornung, Friedemann Weber. (2016). NSs Virulence Factor of Rift Valley Fever Virus Engages the F-Box Proteins FBXW11 and β-TRCP1 To Degrade the Antiviral Protein Kinase PKR. J. Virol.. 90, 6140-6147;
- Reyes R. Novoa, Gloria Calderita, Rocío Arranz, Juan Fontana, Harald Granzow, Cristina Risco. (2005). Virus factories: associations of cell organelles for viral replication and morphogenesis. Biology of the Cell. 97, 147-172;
- I. Wijkamp, J. van Lent, R. Kormelink, R. Goldbach, D. Peters. (1993). Multiplication of tomato spotted wilt virus in its insect vector, Frankliniella occidentalis. Journal of General Virology. 74, 341-349;
- Weimin Li, Dennis J. Lewandowski, Mark E. Hilf, Scott Adkins. (2009). Identification of domains of the Tomato spotted wilt virus NSm protein involved in tubule formation, movement and symptomatology. Virology. 390, 110-121;
- Marie Nguyen, Anne-Lise Haenni. (2003). Expression strategies of ambisense viruses. Virus Research. 93, 141-150;
- Есть ли смысл в антисенсах?;
- Atsushi Takeda, Kazuhiko Sugiyama, Hideaki Nagano, Masashi Mori, Masanori Kaido, et. al.. (2002). Identification of a novel RNA silencing suppressor, NSs protein of Tomato spotted wilt virus. FEBS Letters. 532, 75-79;
- Piet Maes, Sergey V. Alkhovsky, Yīmíng Bào, Martin Beer, Monica Birkhead, et. al.. (2018). Taxonomy of the family Arenaviridae and the order Bunyavirales: update 2018. Arch Virol. 163, 2295-2310;
- Rémi N Charrel, Xavier de Lamballerie, Sébastien Emonet. (2008). Phylogeny of the genus Arenavirus. Current Opinion in Microbiology. 11, 362-368;
- Dominique J. Burri, Joel Ramos Palma, Stefan Kunz, Antonella Pasquato. (2012). Envelope Glycoprotein of Arenaviruses. Viruses. 4, 2162-2181;
- Oldstone M.B.A. Biology and pathogenesis of lymphocytic choriomeningitis virus infection. In: Arenaviruses II. The molecular pathogenesis of arenavirus infections / ed. by Oldstone M.B.A. Berlin, Heidelberg: Springer, 2002. P. 83–117.







