
Дети, которые боятся еды
26 сентября 2024
Дети, которые боятся еды
- 3108
- 0
- 2
Избегающее/ограничительное расстройство приема пищи (ARFID) — психиатрический диагноз, который определяется крайней придирчивостью в еде, отсутствием интереса или страхом перед едой или приемом пищи.
Рисунок в полном размере.
автор иллюстрации — Полина Голованова, подросток с ARFID (г. Ярославль)
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Наверняка в окружении каждого из вас есть дети, которые привередливы в еде. Они могут предпочитать одни продукты, а от других отказываться, но это никак не влияет на качество их жизни, а с возрастом и вовсе проходит. А слышали ли вы о детях, которые едят только 5–10 продуктов, а новые даже не пробуют, более того — всячески их избегают, испытывая при этом сильную тревогу и страх? И это не только в отношении овощей, которые не любят большинство детей, но даже в отношении сладостей. Такое ограничительное поведение называют по-разному — пищевая неофобия, пищевая избирательность, крайняя придирчивость в еде и т.д. Но в 2013 году в Диагностическом и статистическом руководстве 5-го издания (DSM-5) появился новый психиатрический диагноз, о котором у нас до сих пор мало говорят — избегающее/ограничительное расстройство приема пищи (ИОРПП, англ. — Avoidant/restrictive food intake disorder, ARFID). В отличие от более известных расстройств пищевого поведения, таких как анорексия или булимия, ограничение в еде, вызванное ARFID, не связано с образом тела. А обусловлено оно, как правило, нарушениями сенсорного восприятия, низким интересом к еде или же неприятным опытом, связанным с приемом пищи. В этой статье я расскажу о некоторых аспектах этого расстройства — о сенсорной чувствительности и о том, каким образом она способствует формированию поведения избегания и ограничения пищи у детей.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Цитаты детей с ARFID:
— «На вкус как пепел».
— «Это похоже на гальку во рту».
— «Это так страшно пахнет!»
— «Текстура банана — это всегда сюрприз».
— «Мне бы хотелось это попробовать, но я боюсь, что мне будет больно».
Что такое расстройство ARFID и каким оно бывает
ARFID — это сложное многофакторное расстройство, при котором у людей (и у детей, и у взрослых) наблюдается избегание определенных продуктов питания, что приводит к ограниченному разнообразию рациона [1]. После последнего пересмотра Международной классификации болезней (2019 г.) расстройство ARFID было включено в МКБ-11.
ARFID чаще развивается в раннем возрасте (до 2–3 лет) и по разным оценкам охватывает от 0,3% до 15,5% детей (в неклинических выборках) [2]. Этот диагноз заменил и расширил «расстройство питания в младенчестве или раннем детстве», который в DSM-IV диагностировался только у детей в возрасте до шести лет.
Последствия ARFID могут быть самыми серьезными для ребенка. Недостаточное и ограниченное питание может привести к потере веса и замедлению роста, а также к дефициту питательных веществ [3], [4]. ARFID чаще встречается среди детей с расстройством аутистического спектра (РАС) [5], синдромом дефицита внимания и гиперактивности (СДВГ), генетическими заболеваниями, заболеваниями желудочно-кишечного тракта (ЖКТ), тревожными расстройствами [4], [6].
На сегодняшний день выделяют три типа ARFID в зависимости от вызываемой его причины [4], [7–9] (рис. 1):
- Избегание пищи, основанное на ее сенсорных характеристиках. У детей с этим типом наблюдается сенсорная гиперчувствительность, при которой ребенку трудно не то что съесть тот или иной продукт, но даже прикоснуться к нему. У некоторых детей только один вид еды может вызвать приступ тошноты. Во многих случаях ограничение распространяется на способ подачи пищи и на детали, связанные с ее приготовлением. Например, разные продукты на тарелке не должны соприкасаться, фрукты должны быть почищены и порезаны, упаковка должна быть определенного цвета и даже определенной формы. Часто дети выбирают пищу, основываясь на текстуре и цвете.
- Отсутствие интереса к употреблению пищи. Ребенок может забывать о еде, проявлять признаки низкого или полного отсутствия аппетита, чувствовать раннее насыщение или быть крайне взволнованным и/или рассеянным во время приема пищи.
- Отвращение к еде, основанное на травматическом событии. Дети могут отказываться от пищи и избегать ее, опасаясь какой-то неблагоприятной реакции (страх удушья, тошноты, рвоты, боли и/или затруднения с глотанием). При этом процесс избегания/ограничения не осознается ребенком.
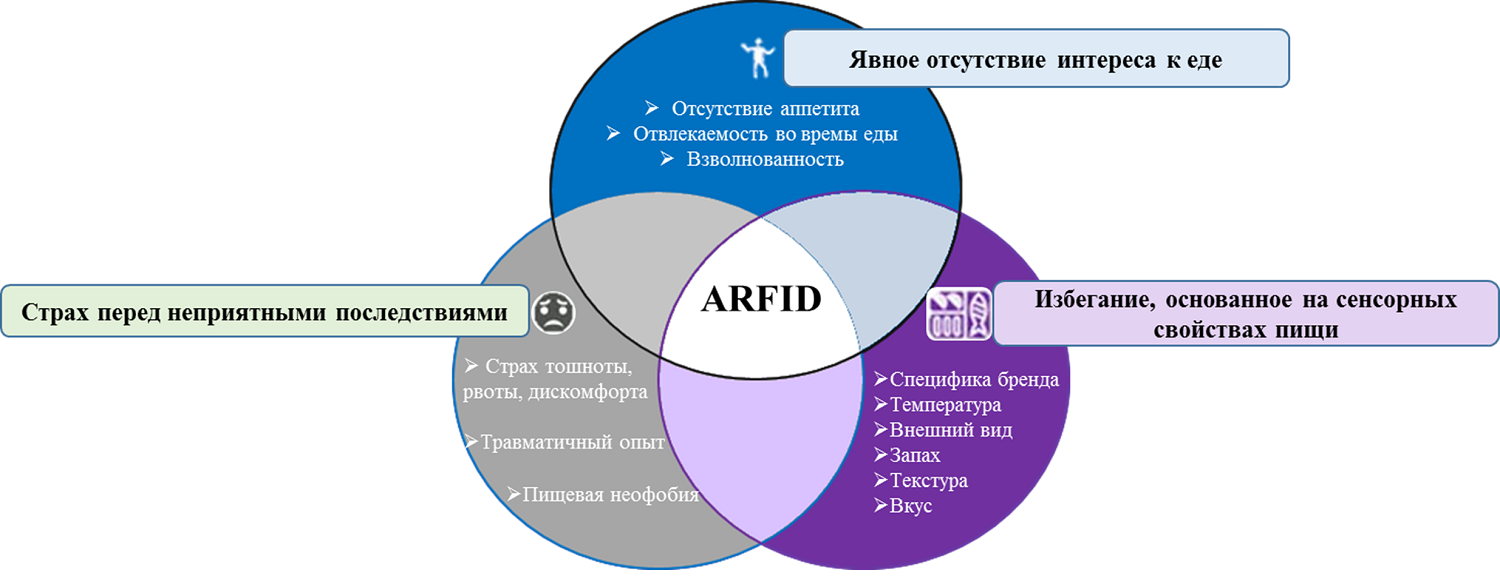
Рисунок 1. Три типа ARFID.
Все эти типы не исключают друг друга, и чаще всего наблюдается смешанная форма двух-трех типов ARFID. В одном из последних исследований комбинированный тип был выделен как отдельный тип ARFID [10].
Теперь, зная основные причины формирования ARFID, попробуем углубиться в некоторые из них. Но сначала разберемся, каким образом люди вообще принимают решение о том, есть или не есть ту или иную пищу, и какие факторы на это влияют.
Съедобное-несъедобное
Перенесемся на два миллиона лет назад, когда наши предки бродили по африканским саваннам в поисках пищи. По мере того, как они постепенно переселялись на новые земли, они сталкивались с новыми растениями, которые выглядели особенно вкусно после нескольких дней блужданий по жаре. Как в такой ситуации они могли знать, что будет безопасно есть, а что может привести к отравлению и даже к смерти? Сегодня у нас есть море информации, которая позволяет нам достоверно определить, что безопасно, а что опасно употреблять, но что тысячи поколений назад повлияло на диетические решения, принятые нашими предками?
Пищевое поведение — это, прежде всего, обучение. В детстве мы учимся почти исключительно через наблюдение и подражание. Если мы видим, что наши родители едят бананы каждое утро в течение первых нескольких лет нашей жизни, наш мозг каталогизирует эту информацию, отмечая, что бананы являются безопасными продуктами для употребления. Та же концепция «выученного поведения» относится и к нашим далеким предкам. При встрече с новыми растениями они, вероятно, использовали фундаментальный принцип проб и ошибок. За один раз потреблялось лишь небольшое количество растений, семян, ягод, фруктов, насекомых или животных. Если кто-то тяжело заболевал или умирал, в будущем этого конкретного продукта избегали. Если никаких побочных эффектов не возникало, продукт постепенно входил в рацион в возрастающих дозах до тех пор, пока он не был полностью определен как «безопасный» продукт.
Однако у человека есть еще высокоразвитая сенсорная система, которая также обеспечивает нашу безопасность, когда дело доходит до еды. Мы обладаем сложными чувствами — зрением, слухом, осязанием, чувством вкуса и запаха. Нас естественным образом привлекают продукты, богатые сахарами (углеводами), в то время как горькие и кислые на вкус — наоборот, отталкивают и часто вызывают отвращение. Ярко окрашенные насекомые часто сигнализируют о том, что они токсичны для хищников, в то время как ярко окрашенные растения часто означают, что они приносят сладкие плоды или нектар. Что-то колючее или жесткое внешнее может сигнализировать о более низком уровне съедобности, чем что-то мягкое и приятное на ощупь. Безусловно, эти правила не всегда точны (например, ананасы, кокосы или перец чили — все-таки съедобны), но они помогают нам принимать решения о том, будет съеден тот или иной продукт или нет.
Представьте, что вы заходите на кухню и видите пачку печенья и кусочек пиццы, которую вы никогда не ели. Решение о том, открыть ли пачку печенья или взять кусочек пиццы будет зависеть от того, заметите ли вы вообще там еду. Допустим, вы ее заметили, и ваш мозг воспринял ее как желаемый объект. Затем вы оцениваете текстурные и структурные характеристики, и на их основании выбираете, например, пиццу. Желание взять именно пиццу может объясняться также тем, что ее вкус связан с положительной гедонистической реакцией — то есть у вас, возможно, уже был благоприятный опыт употребления другой пиццы. Затем вы откусываете немного, и в это время почти одновременно активируются обонятельная и вкусовая системы, каждая из которых различает и реагирует на химические вещества, попадающие в рот [11]. После этого сенсорная информация о вкусе, запахе, консистенции и температуре пищи поступает в центральную нервную систему (ЦНС) [12] (рис. 2) [13].
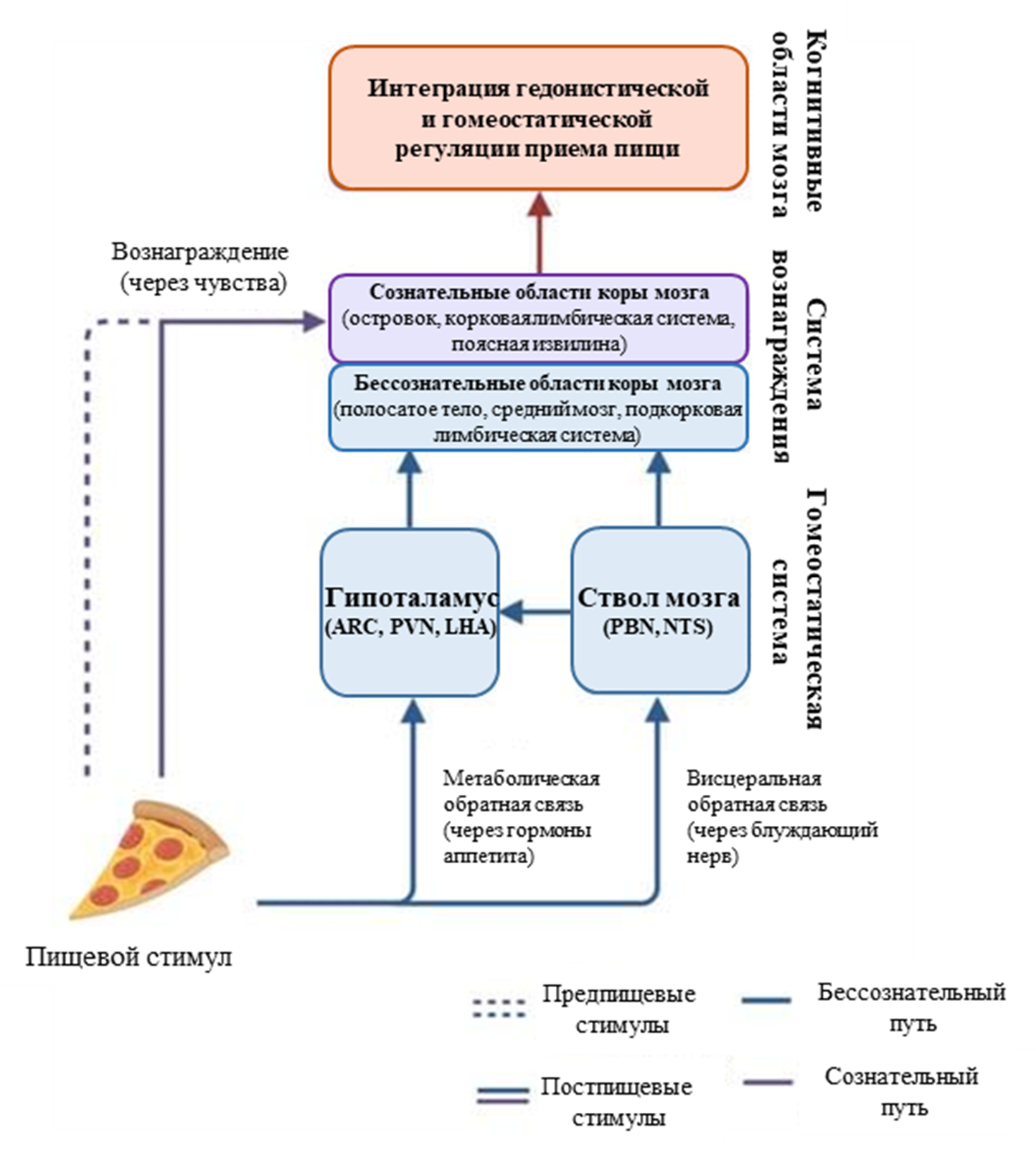
Рисунок 2. Регуляция потребления пищи.
ARC — дугообразное ядро; PVN — паравентрикулярное ядро; LHA — латеральная гипоталамическая область; PBN — парабрахиальное ядро; NTS — ядро одиночного пути
Когда съеденная пища попадает в просвет кишечника, происходит высвобождение гормонов, таких как пептид YY, глюкагоноподобный пептид 1 (ГПП-1), холецистокинин (ХЦК), инсулин и другие, после чего в ЦНС поступает информация о потреблении энергии. Эти процессы вместе с сигналами вознаграждения интегрируются в областях мозга, связанных с отвращением, познанием, удовольствием, мотивацией, памятью и принятием решений. После обработки всей полученной информации вы будете точно знать — была ли пицца на вкус такой, какой ожидалось? Дала ли она энергию? И в дальнейшем вы будете использовать эту информацию для принятия пищевых решений.
Но как все это происходит у маленьких детей, когда у них еще нет такого большого пищевого опыта, как у взрослых? Что для них является основополагающим при принятии пищевых решений? Вероятно, в первую очередь, это сенсорное восприятие.
Странная текстура и тревожное прикосновение
Первая информация, благодаря которой дети распознают продукты питания, принадлежит зрительной области, а отказ от еды изначально происходит на основе визуальных сигналов. Внешний вид и текстура являются основными причинами отторжения или принятия пищи у детей [14], [15]. Поздняя неофобная реакция (нежелание пробовать новые продукты), которую можно наблюдать примерно в возрасте 18–24 месяца, в значительной степени основана на визуальных факторах [16]. Если ребенку какие-то продукты кажутся «неправильными» (например, зеленые овощи или сломанное печенье), он откажется от них. Этот отказ вызван неспособностью сделать всеобъемлющие категорические обобщения, которые позволили бы ему принимать незнакомую пищу [17].
Дети с визуально-сенсорной гиперчувствительностью определяют, какие продукты безопасны для употребления в пищу, по мелким визуальным деталям. Воспринимаемая безопасность пищи может прогнозироваться ребенком даже по упаковке, в которой она поставляется. Любое небольшое изменение во внешнем виде пищи приведет к отторжению. Таким образом, зрительное восприятие — это самая первая линия защиты от потенциально опасных продуктов. Но если дети с ней справляются и их любопытство преобладает, они переходят ко второму этапу — возможности потрогать и ощутить текстуру тактильно.
Осязание — первое чувство, которое развивается в утробе матери. Кожные и тройничные соматосенсорные рецепторы созревают примерно на 4–7 неделе беременности [18]. Осязание обеспечивает не только связь с внешним миром (соматосенсорное ощущение), но и с внутренним — это так называемое висцеральное ощущение, которое охватывает систему сенсорных нейронов, передающих информацию от внутренних органов к мозгу. Обе системы необходимы для выживания, и обе могут стать проблемными. Например, люди с сенсорной гиперчувствительностью могут быть чрезмерно чувствительны к определенным типам прикосновений к своей коже, и также они могут испытывать боль или дискомфорт в желудочно-кишечном тракте во время пищеварения — это так называемая висцеральная гиперчувствительность [19], [20].
Тактильная гиперчувствительность характеризуется чрезмерной реакцией на тактильный сигнал, при которой этот сигнал может восприниматься как вредный, что приводит к целенаправленному избеганию. Гиперчувствительность может быть результатом изменений на одном или нескольких этапах сенсорной обработки, начиная от периферических рецепторов в коже, спинномозговых синапсов, перцептивной системы мозга и заканчивая когнитивными или эмоциональными процессами.
В 2016 году команда нейробиологов из Гарвардской медицинской школы показала, что дисфункция периферических сенсорных нейронов приводит к изменению соматосенсорной чувствительности и способствует развитию множества поведенческих фенотипов, связанных с РАС, включая социальные нарушения и тревожно-подобное поведение [21]. Исследователи разработали мышиные модели аутизма — с делецией генов Mecp2 (который кодирует белок MeCP2) и Gabrb3 (кодирующего субъединицу рецептора ГАМК-А β3 [22]) — и использовали их для изучения сенсорных нейронов, которые при нарушении вызывают гиперчувствительность к прикосновениям. Они обнаружили, что периферические сенсорные нейроны мутантных мышей имеют слишком мало рецепторов для химического мессенджера ГАМК-А, которая подавляет нейронную активность. В 2019 году эти же ученые опубликовали работу [23], в которой была показана эффективность агониста рецептора ГАМК-А — изогувацина — в снижении тактильной гиперчувствительности.
Таким образом, на основе зрительного и тактильного восприятия ребенок оценивает предлагаемую ему пищу с точки зрения безопасности и возможности быть съеденной без последствий. Если пища воспринимается как угроза, она будет отвергнута. А если решение ребенка все же будет положительным, его ждут новые, более яркие ощущения — вкус и запах.
Слишком горько, запредельно кисло
Вкус — сложное мультимодальное чувство, которое включает в себя вкусовые рецепторы, терморецепторы, механические ощущения зубов и жевательных мышц, а также обонятельные рецепторы [24], активируемые компонентами пищи [25]. Примерно за 150 миллисекунд вкусовой сигнал достигает соматосенсорной коры, гипоталамуса, миндалевидного тела и островковой доли, добавляя вкусу эмоциональную ценность. Вкус тесно связан с системой вознаграждения мозга, которая влияет на прием пищи, выбор продуктов питания и предпочтения [26]. Известно пять основных вкусов — сладкий, соленый, кислый, горький и умами, каждый из которых воспринимается посредством активации специфических вкусовых рецепторов [27].
Вкусовая система новорожденных чрезвычайно чувствительна и тонко настроена на определение различных вкусовых качеств пищи. Младенцы рождаются с врожденным предпочтением сладкого вкуса, а в возрасте от трех до четырех месяцев у них развивается естественное предпочтение соленого вкуса и вкуса умами [28], [29]. Горький и кислый вкусы неприятны для младенцев, и их принятие приобретается со временем, обычно в результате многократного воздействия определенных продуктов питания [30]. В 1979 году Штайнер [31] изучал выражения лиц маленьких детей, когда им давали растворы сладких, кислых и горьких соединений, и младенцы реагировали совершенно по-разному (рис. 3).
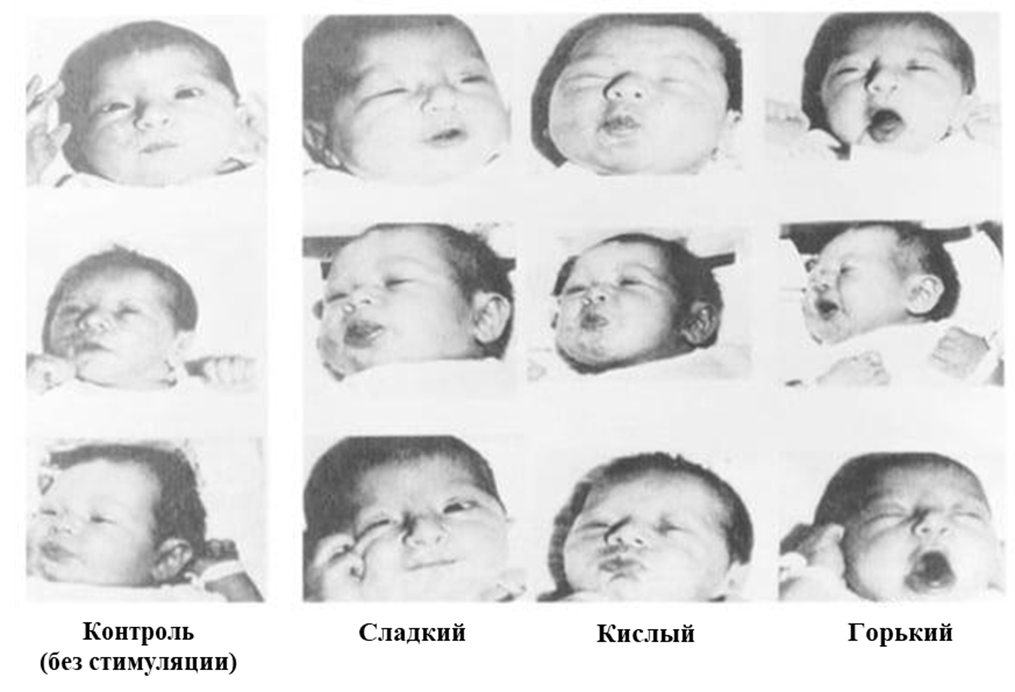
Рисунок 3. Вкусовые реакции новорожденных на сладкий, кислый и горький вкус.
Индивидуальные различия во вкусовом восприятии могут быть обусловлены физиологическими различиями во вкусовой системе, когнитивной обработкой вкусовых сигналов в мозге, влиянием окружающей среды или генетикой [32], [33]. Наиболее изучена изменчивость восприятия горького вкуса, и большая часть этих исследований сосредоточена на рецепторе горького вкуса TAS2R38 [34]. Показано, что его генотип предсказывает, насколько чувствительным будет человек к горьким веществам — фенилтиокарбамиду и 6-н-пропилтиоурацилу [35]. Три полиморфизма в гене TAS2R38 приводят к трем заменам аминокислот, определяющим два основных гаплотипа — PAV (пролин, аланин и валин) и AVI (аланин, валин и изолейцин). Носители PAV обладают либо высокой чувствительностью к горечи (супердегустаторы), либо средней чувствительностью (дегустаторы), в то время как носители AVI вообще не чувствуют горечи (недегустаторы) [29]. Полиморфизмы гена TAS2R38 входят в число факторов, которые могут влиять на принятие пищи в начале отлучения от груди и на пищевой статус и здоровье младенца в дальнейшей жизни [29], [35]. Например, дети-супердегустаторы чаще отказываются от растительной пищи, чем дети-недегустаторы [29], [36].
Кислый вкус, как и горький, относится к защитной/предупреждающей системе, хотя он гораздо меньше изучен. Недавно рецептор кислого вкуса был идентифицирован как OTOP1 — протонный канал, который позволяет протонам пересекать клеточные мембраны [37], [38]. С его помощью мы распознаем содержащиеся в пище кислоты (протоны), которые участвуют во многих физиологических процессах и в изобилии присутствуют в незрелых фруктах и испорченной пище, и поэтому служат для предупреждения нас об опасности.
Наша способность узнавать и различать, что отвратительно/неприятно, основана также и на обонятельной системе. Дети с ARFID часто отказываются от пищи из-за запаха, но пока не ясна природа обонятельной гиперчувствительности у таких детей. Исследования на животных показали, что чувствительность к запахам повышается в периоды, когда требуется повышенное обнаружение угрозы и может быть связана с предрасположенностью к тревожности и с историей негативных аффективных переживаний [39], [40].
В целом, исследования показывают, что симптомы сенсорной гиперчувствительности связаны с более высокими уровнями пищевой неофобии, а также с более низкими уровнями социального и адаптивного поведения [41]. Кроме того, более высокие уровни сенсорной чувствительности связаны с рядом сопутствующих трудностей, которые также распространены у детей с повышенной тревожностью, включая хронические симптомы желудочно-кишечного тракта, нарушение сна и повышенный родительский стресс. Показано, что 52% детей с по крайней мере одной модальностью сенсорной чувствительности в дошкольном возрасте соответствовали критериям тревожного расстройства в школьном возрасте. Тогда как из детей, у которых не было сенсорной сверхчувствительности, лишь у 15% были симптомы тревожности в школьном возрасте [42]. Существует мнение, что именно тревожность является виновником сенсорной гиперчувствительности, а не наоборот. Например, при тревоге повышается бдительность и обнаруживается предвзятость внимания, что заставляет детей уделять внимание мелким деталям в текстуре еды и мешать их способности регулировать негативную реакцию на нее. Однако пока до конца причинно-следственные связи между сенсорной чувствительностью и тревожностью не понятны. Ясно лишь, что и то, и другое — неотъемлемые составляющие поведения избегания и ограничения в отношении пищи.
Из всех перечисленных выше сенсорных модальностей именно вкус (в сочетании с запахом) является определяющим при формировании пищевого поведения у детей. Прикосновение может быть слишком грубым, внешний вид — слишком опасным и возбуждающим, однако эти стимулы оставляют лишь малый физиологический след. И только вкус пищи влияет на внутренние ощущения и позволяет формировать ассоциации относительно пищевой ценности потребляемых веществ (их приятности или отвращения).
Синдром соуса беарнез
Давайте представим, что вы ужинаете в знакомом ресторане и заказываете в меню новое блюдо — то, которое раньше никогда не пробовали, а позже, тем же вечером вам резко становится плохо, вы чувствуете тошноту, боль и дискомфорт. Несмотря на то, что причиной такого дискомфорта может быть какое-то заболевание, все же, скорее всего, вы будете винить в своем недомогании то самое новое блюдо. И если вы попытаетесь вспомнить его вкус, то сама мысль о нем будет вам неприятна. И велика вероятность, что вы можете решить никогда больше не есть эту еду. У вас сформируется негативная ассоциация, связанная с новым блюдом.
А теперь представим маленького ребенка. Если после знакомства с новым продуктом ребенок спустя какое-то время заболеет, почувствует боль и дискомфорт, будет испытывать тошноту, то он быстро сообразит, что именно новый продукт явился причиной недомогания и, скорее всего, свяжет это недомогание со вкусом этого продукта. А если у ребенка имеются функциональные желудочно-кишечные расстройства, то это будет происходить нередко. Феномен, когда человек ассоциирует негативные пищевые последствия со вкусом называется условным отвращением вкуса (англ. CTA), или эффектом Гарсиа. Это своего рода обучение страху, установленное на основе ассоциации качества вкуса пищи и постпищевого недомогания.
Джон Гарсия и его коллеги, прежде чем выявить основные закономерности формирования условного отвращения к вкусу, первоначально изучали воздействие ионизирующего излучения на поведение лабораторных крыс [43]. Они обнаружили, что облученные крысы в конечном итоге прекращали пить предоставленные им растворы сахарина для гидратации во время радиационных испытаний, вместо этого выбирая жажду. Гарсия постулировал, что крысы невольно ограничивали питье, как будто именно оно служило плохому самочувствию, в то время как истинным виновником выступала радиация. И даже после снятия воздействия радиации крысы сохраняли отвращение к воде.

Рисунок 4. Птицы, демонстрирующие обучение вкусовому отвращению после того, как они начали есть бабочку-монарха.
Обучение отвращению вкуса широко распространено среди млекопитающих. Такая способность обусловлена естественным отбором и помогает избегать ядовитых продуктов. Однако, безусловно, есть видовые различия. Например, летучие мыши-вампиры, которые питаются кровью и обычно не сталкиваются с токсичной пищей, практически не демонстрируют способности к отвращению вкуса к невкусной пище, хотя другие летучие мыши обладают такой способностью [44]. У людей употребление пищи и вскоре после этого возникновение боли, сильной тошноты и рвоты приводит к отвращению к этой пище, которое может сохраняться до конца жизни. Крысы обладают превосходной способностью формировать устойчивое отвращение к еде, что позволяет им избегать попыток человека отравить их [45]. Птицы, питающиеся насекомыми, быстро учатся избегать ядовитых насекомых, и эта информация сохраняется на протяжении всей жизни птицы (рис. 4) [46].
Эффект Гарсия также называют синдромом беарнезского соуса. Это название принадлежит американскому психологу Мартину Селигману, который однажды имел одну прискорбную встречу с соусом «Беарнез» (рис. 5).
Селигман писал: «Однажды вечером, в 1966 году, я приготовил филе миньон с соусом беарнез. Примерно через шесть часов меня начало рвать, и следующие несколько часов я провел в рвоте. После этого соус беарнез мне показался отвратительным» [47]. Селигмана интриговало то, что его опыт нарушал некоторые основные принципы классического обусловливания. Во-первых, он заболел через несколько часов после ужина. Таким образом, время между условным стимулом — в данном случае соусом беарнез — и безусловным стимулом — рвотой — было странно долгим для обусловливания. Тем не менее — оно произошло. А все потому, что время, необходимое для переваривания пищи, вызывает задержку в ассоциации между стимулами. Кроме того, Селигман задавался вопросом, почему тошнота была вызвана соусом, а не филе-миньоном , картофелем фри или любым другим стимулом, испытанным в ресторане в тот вечер? А все потому, что из всех этих компонентов ужина только с соусом беарнез он встретился впервые.

Рисунок 5. Мартин Селигман и его неудачный опыт с соусом беарнез.
Тошнота, рвота, боль, дискомфорт в качестве негативной реакции и вкус в качестве безусловного стимула закрепляются в большинстве случаев с одного-единственного сочетания, и такое сочетание крайне устойчиво. Интересно и то, что запах сам по себе не является таким воздействующим стимулом, а вот сочетание запаха и вкуса приводит к самым быстрым и к самым устойчивым негативным связям с тошнотой и рвотой.
В отношении формирования условного отвращения к вкусу у людей остается очень много вопросов. Такая особая способность ассоциировать стимулы, которые не связаны одновременно, особенно важна в отношении отвращений, приобретенных во время химиотерапевтического лечения, поскольку прием пищи связан с тошнотой, которая на самом деле вызвана химическими веществами, вводимыми на разных этапах. При этом незнакомая пища вызывает гораздо более выраженную вкусовую аверсию, чем привычная. Поэтому важный момент при формировании условного отвращения вкуса — это присутствие новизны.
Поведенческий невролог Илен Бернштейн в своих исследованиях показала, что дети, проходящие курс химиотерапии, часто приобретали отвращение к еде, которую они потребляли во время лечения [48]. Она давала детям новую пищу (мороженое с уникальным вкусом) непосредственно перед химиотерапией и обнаружила, что они уменьшали потребление мороженого, когда у них была возможность съесть его снова, по сравнению с детьми, которые не получали химиотерапии или получали химиотерапию без мороженого. Этот результат показал, что сочетания нового мороженого с химиотерапией было достаточно, чтобы обусловить отвращение, и дала объяснение тому, почему те дети, которые проходили химиотерапию, демонстрировали изменения в предпочтениях в еде, избегали незнакомых продуктов и были очень чувствительны ко вкусам.
Негативная вкусовая ассоциация имеет решающее значение для выживания: хотя новая пища может быть приятной и очень питательной, она также может быть токсичной и опасной для жизни. Неудивительно, что наш мозг развил способность не только обнаруживать вкус и запах новой пищи, но и преобразовывать эту хемосенсорную информацию в след памяти [49] (след памяти о новом вкусе) [50].
В более ранних исследованиях показано, что поведенческие и нейронные характеристики условного отвращения вкуса могут быть объяснены следующими пятью пунктами: (1) бдительность (новизна условного стимула), (2) связь между условным и безусловным стимулами, (3) избегание, (4) отвращение (гедонистический сдвиг с положительного на отрицательный) и (5) усиление ответов на условный стимул (рис. 6) [51].
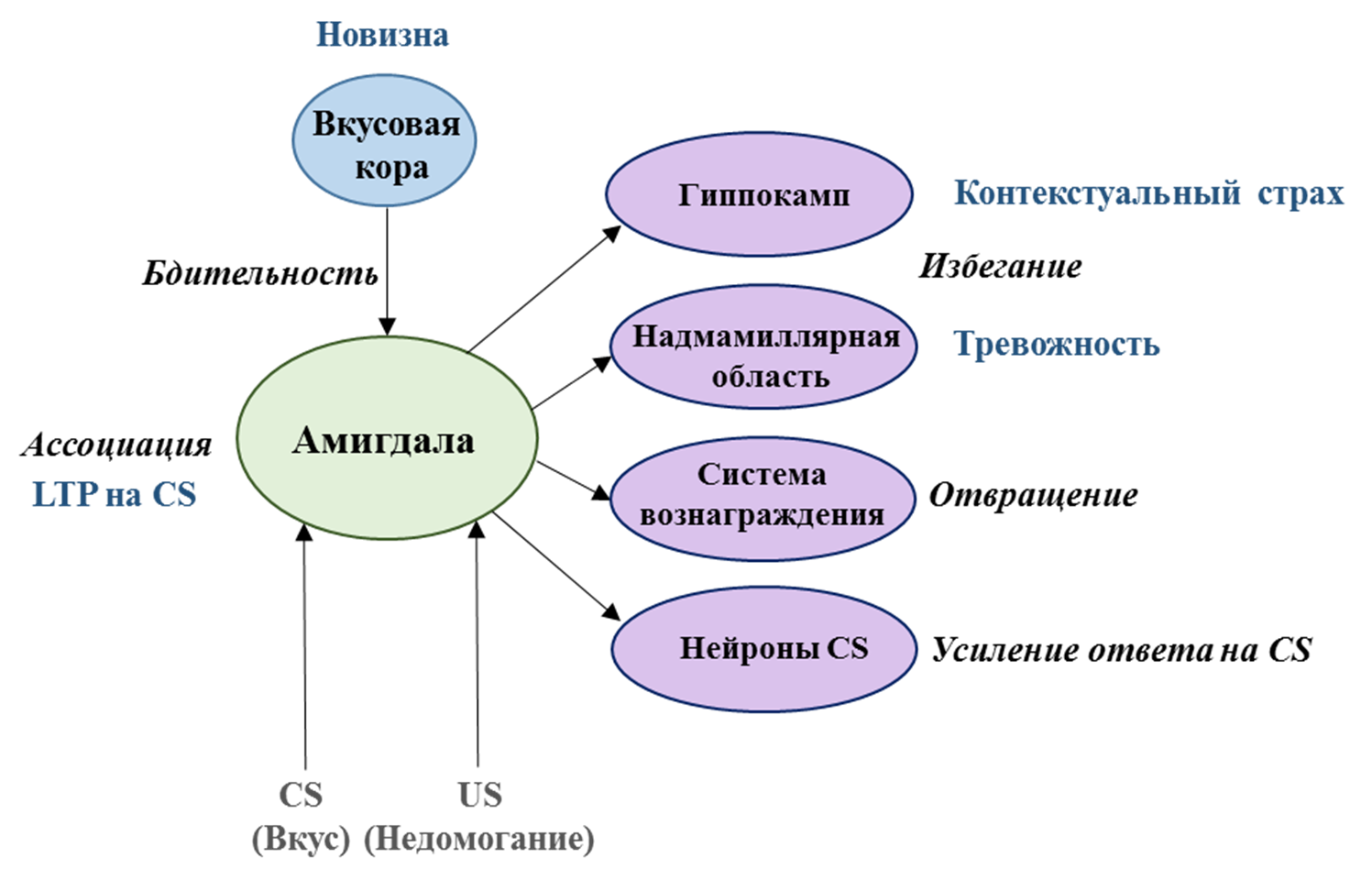
Рисунок 6. Поведенческие и нейронные характеристики условного отвращения к вкусу.
CS — условный стимул; US — безусловный стимул; LTP — долговременная потенциация.
В таком ассоциативном обучении участвуют базолатеральная миндалина [52] и часть островковой коры — вкусовая кора, которая играет центральную роль в различных функциях, связанных со вкусом, включая интеграцию информации об идентичности и гедонистической ценности вкуса, прогнозирование возникновения вкуса на основе предвосхищающих сигналов пищи, изучение безопасности или опасности, связанных со вкусами, формирование ассоциаций между вкусами и постпищеварительными эффектами и принятие решений на основе вкусовой информации [53]. Однако до недавнего времени не было понятно, как эти отделы мозга могут работать вместе во время обучения. Пластичность вкусовой коры указывала на возможность того, что нейронные цепи в ней могут быть чувствительны к опыту со вкусом. И изначально предполагалось, что при формировании аверсивной памяти происходит усиление нейронных реакций на повторное воздействие вкусового стимула. И это усиление основано на пластических изменениях синаптической эффективности, вызываемых долговременной потенциацией [49] в период приобретения. Это было показано с помощью электрической стимуляции [54].
Однако недавно нейробиологи из Университета Стони-Брук показали другие нейронные механизмы, лежащие в основе реакции отвращения к вкусу. Они использовали оптогенетику [55] — технику, которая объединяет световую и генетическую информацию для управления нейронами в мозге, и определили поведенческие реакции и нейронные пути, вовлеченные во вкус и угрозу. И обнаружили, что обучение условному отвращению к вкусу снижает прочность синаптической связи между базолатеральной миндалиной и вкусовой корой и приводит к общему снижению активации нейронов во вкусовой коре (рис. 7).
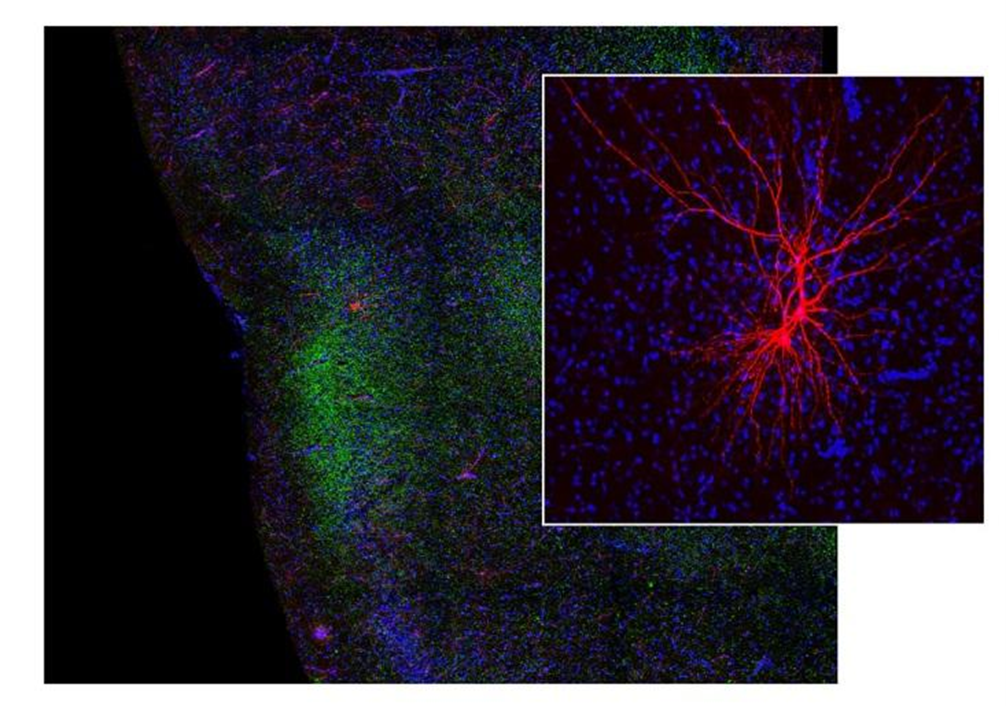
Рисунок 7. Участок вкусовой коры и вход из базолатеральной миндалины. Синим обозначены все нейроны вкусовой коры, зеленым — связь миндалины с вкусовой корой, а красным — зарегистрированные нейроны в экспериментах (увеличенные в правом поле).
Этот процесс отличается от широко распространенного представления об одновременной активации нейронов. То есть, как оказалось, обучение избегать определенных вкусов зависит от долгосрочного снижения активности в связях между вкусовыми и угрожающими сенсорами в мозге [56]. Авторы этого исследования теперь утверждают, что долговременная депрессия, а не потенциация является механизмом обучения отвращению к вкусу. И именно этот механизм приводит к снижению гедонистической ценности вкусового стимула.
Таким образом, формирование условного отвращения вкуса (вкусовой аверсии) — довольно сложный механизм, и еще многое предстоит понять. И этот механизм — один из тех, что лежит в основе ограничительного (избегающего) поведения в отношении незнакомой пищи, которое мы наблюдаем при ARFID. Безусловно, одни дети будут легче обучаться такому атипичному пищевому поведению (например, дети с соматосенсорной и висцеральной гиперчувствительностью), а другие — сложнее. Несмотря на крайне скудные научные и клинические данные в этой области, на сегодняшний день известно, что в группе риска — недоношенные дети [57]; дети, находящиеся в раннем возрасте в отделении интенсивной терапии, на зондовом питании [58]; дети с генетическими заболеваниями [59], перинатальными поражениями ЦНС [60], функциональными желудочно-кишечными расстройствами [61], с различными неврологическими расстройствами (РАС, СДВГ и др.) [4], [62].
Вместо заключения
Мне бы хотелось написать намного больше, чем вмещает в себя данный рассказ. Ведь это только малая часть аспектов, позволяющих объяснить состояние, в котором находятся дети с ARFID (да и взрослые тоже). Здесь практически не затронуты проблемы гормональной регуляции голода/сытости, не описаны исследования в области взаимодействия микробиом-кишечник-мозг и участие иммунной системы — это отдельные истории, не менее интересные. Практически неизученной областью является генетика ARFID. В настоящее время уже завершено (согласно clinicaltrials.gov) крупномасштабное генетическое исследование на основе полногеномного поиска ассоциаций (GWAS [63]), которое призвано продвинуть изучение генетики ARFID [57].
Главное, на что мне хотелось обратить внимание в этой статье, это то, что биологическая составляющая вносит важный вклад в развитие расстройства ARFID. Дети, которые боятся пробовать новые продукты, не выбирали свой путь, и этот путь не выбирали их родители. Эти дети избегают незнакомой пищи или времени приема пищи для того, чтобы избежать дискомфорта, боли (чаще — мнимой) или тревоги, тем самым продолжая подкреплять избегающее поведение и закрепляя страх, создавая порочный круг, из которого практически невозможно выбраться без помощи.
На сегодняшний день нет лечения ARFID, дающего абсолютной гарантии. Методами высокой эффективности считается поведенческая терапия — прикладной анализ поведения, когнитивно-поведенческая терапия, экспозиционная терапия. Не существует доказанного фармакологического лечения, хотя есть отдельные исследования, и некоторые психиатры используют антипсихотики и анксиолитики в качестве дополнения к основной психотерапии (например, оланзапин и миртазапин). Доказано, что самым эффективным при ARFID является междисциплинарное и раннее вмешательство, но из-за крайне низкой осведомленности врачей, психологов и помогающих специалистов дети в большинстве случаев остаются без какой-либо помощи. Фразы «проголодается — поест» или «перерастет» — самые частые от врача, к которому приходит родитель ребенка с проблемой питания. Мне, прежде всего как маме ребенка с ARFID, хотелось бы обратить внимание научного и медицинского сообщества на эту проблему.
Литература
- Kathryn S. Brigham, Laurie D. Manzo, Kamryn T. Eddy, Jennifer J. Thomas. (2018). Evaluation and Treatment of Avoidant/Restrictive Food Intake Disorder (ARFID) in Adolescents. Curr Pediatr Rep. 6, 107-113;
- Javier Sanchez‐Cerezo, Lidushi Nagularaj, Julia Gledhill, Dasha Nicholls. (2023). What do we know about the epidemiology of avoidant/restrictive food intake disorder in children and adolescents? A systematic review of the literature. Euro Eating Disorders Rev. 31, 226-246;
- Sarah Benezech, Chrystele Hartmann, Diane Morfin, Yves Bertrand, Carine Domenech. (2020). Is it leukemia, doctor? No, it’s scurvy induced by an ARFID!. Eur J Clin Nutr. 74, 1247-1249;
- Natasha K. O. Fonseca, Vitória D. Curtarelli, Juliana Bertoletti, Karla Azevedo, Tiago M. Cardinal, et. al.. (2024). Avoidant restrictive food intake disorder: recent advances in neurobiology and treatment. J Eat Disord. 12;
- Диагностика РАС и генетика;
- Mark L. Norris, Nicole Obeid, Alexandre Santos, Darcie D. Valois, Leanna Isserlin, et. al.. (2021). Treatment Needs and Rates of Mental Health Comorbidity in Adolescent Patients With ARFID. Front. Psychiatry. 12;
- Agnieszka Białek-Dratwa, Dorota Szymańska, Mateusz Grajek, Karolina Krupa-Kotara, Elżbieta Szczepańska, Oskar Kowalski. (2022). ARFID—Strategies for Dietary Management in Children. Nutrients. 14, 1739;
- Jennifer J. Thomas, Elizabeth A. Lawson, Nadia Micali, Madhusmita Misra, Thilo Deckersbach, Kamryn T. Eddy. (2017). Avoidant/Restrictive Food Intake Disorder: a Three-Dimensional Model of Neurobiology with Implications for Etiology and Treatment. Curr Psychiatry Rep. 19;
- Tanith Archibald, Rachel Bryant‐Waugh. (2023). Current evidence for avoidant restrictive food intake disorder: Implications for clinical practice and future directions. JCPP Advances. 3;
- Javier Sanchez-Cerezo, Josephine Neale, Nikita Julius, Tim Croudace, Richard M. Lynn, et. al.. (2024). Subtypes of avoidant/restrictive food intake disorder in children and adolescents: a latent class analysis. eClinicalMedicine. 68, 102440;
- B.G. Galef. (1996). Food selection: Problems in understanding how we choose foods to eat. Neuroscience & Biobehavioral Reviews. 20, 67-73;
- Ликбез по ЦНС;
- Alejandro Campos, John D. Port, Andres Acosta. (2022). Integrative Hedonic and Homeostatic Food Intake Regulation by the Central Nervous System: Insights from Neuroimaging. Brain Sciences. 12, 431;
- Devina Wadhera, Elizabeth D. Capaldi-Phillips. (2014). A review of visual cues associated with food on food acceptance and consumption. Eating Behaviors. 15, 132-143;
- Maddalena Cappellotto, Annemarie Olsen. (2021). Food Texture Acceptance, Sensory Sensitivity, and Food Neophobia in Children and Their Parents. Foods. 10, 2327;
- Agnieszka Białek-Dratwa, Oskar Kowalski. (2023). Infant Complementary Feeding Methods and Subsequent Occurrence of Food Neophobia—A Cross-Sectional Study of Polish Children Aged 2–7 Years. Nutrients. 15, 4590;
- Damien Foinant, Jérémie Lafraire, Jean-Pierre Thibaut. (2022). Tears for pears: Influence of children’s neophobia on categorization performance and strategy in the food domain. Front. Nutr.. 9;
- A.J. Bremner, C. Spence. (2017). The Development of Tactile Perception. Advances in Child Development and Behavior. 227-268;
- Micah O. Mazurek, Amy Keefer, Amy Shui, Roma A. Vasa. (2014). One-year course and predictors of abdominal pain in children with autism spectrum disorders: The role of anxiety and sensory over-responsivity. Research in Autism Spectrum Disorders. 8, 1508-1515;
- Nikhil Thapar, Marc A. Benninga, Michael D. Crowell, Carlo Di Lorenzo, Isabelle Mack, et. al.. (2020). Paediatric functional abdominal pain disorders. Nat Rev Dis Primers. 6;
- Lauren L. Orefice, Amanda L. Zimmerman, Anda M. Chirila, Steven J. Sleboda, Joshua P. Head, David D. Ginty. (2016). Peripheral Mechanosensory Neuron Dysfunction Underlies Tactile and Behavioral Deficits in Mouse Models of ASDs. Cell. 166, 299-313;
- Спокоен как GABA;
- Lauren L. Orefice, Jacqueline R. Mosko, Danielle T. Morency, Michael F. Wells, Aniqa Tasnim, et. al.. (2019). Targeting Peripheral Somatosensory Neurons to Improve Tactile-Related Phenotypes in ASD Models. Cell. 178, 867-886.e24;
- Обоняние: от носа к мозгу, спотыкаясь и падая;
- Justus V. Verhagen, Lina Engelen. (2006). The neurocognitive bases of human multimodal food perception: Sensory integration. Neuroscience & Biobehavioral Reviews. 30, 613-650;
- Lender A, Miedl SF, Wilhelm FH, Miller J, Blechert J. (2020). Love at first taste: Activation in reward-related brain regions during single-trial naturalistic appetitive conditioning in humans. Physiology & Behavior. 224, 113014;
- Andrew Costanzo. (2024). Temporal patterns in taste sensitivity. Nutrition Reviews. 82, 831-847;
- Gary K. Beauchamp, Julie A. Mennella. (2011). Flavor Perception in Human Infants: Development and Functional Significance. Digestion. 83, 1-6;
- Alison K. Ventura, John Worobey. (2013). Early Influences on the Development of Food Preferences. Current Biology. 23, R401-R408;
- Anna Wiernicka, Karolina Piwczynska, Paulina Mika-Stepkowska, Dorota Kazimierska, Piotr Socha, Anna Rybak. (2022). Impact of the Gut-Brain Hormonal Axis and Enteric Peptides in the Development of Food Neophobia in Children with Genetically Determined Hypersensitivity to the Bitter Taste. Gastrointestinal Disorders. 4, 237-248;
- Jacob E. Steiner. (1979). Human Facial Expressions in Response to Taste and Smell Stimulation. Advances in Child Development and Behavior. 257-295;
- Noriatsu Shigemura, Shinya Shirosaki, Keisuke Sanematsu, Ryusuke Yoshida, Yuzo Ninomiya. (2009). Genetic and Molecular Basis of Individual Differences in Human Umami Taste Perception. PLoS ONE. 4, e6717;
- Melania Melis, Lisa Grzeschuchna, Giorgia Sollai, Thomas Hummel, Iole Tomassini Barbarossa. (2019). Taste disorders are partly genetically determined: Role of the TAS2R38 gene, a pilot study. The Laryngoscope. 129;
- 25 оттенков горечи;
- Gabriele Cont, Giulia Paviotti, Marcella Montico, Paola Paganin, Martina Guerra, et. al.. (2019). TAS2R38 bitter taste genotype is associated with complementary feeding behavior in infants. Genes Nutr. 14;
- Kendra I Bell, Beverly J Tepper. (2006). Short-term vegetable intake by young children classified by 6- n-propylthoiuracil bitter-taste phenotypey. The American Journal of Clinical Nutrition. 84, 245-251;
- Ziyu Liang, Courtney E. Wilson, Bochuan Teng, Sue C. Kinnamon, Emily R. Liman. (2023). The proton channel OTOP1 is a sensor for the taste of ammonium chloride. Nat Commun. 14;
- Hannah E. R. Frank, Katie Amato, Michelle Trautwein, Paula Maia, Emily R. Liman, et. al.. (2022). The evolution of sour taste. Proc. R. Soc. B.. 289;
- David C. Houghton, Samuel L. Howard, Thomas W. Uhde, Caitlin Paquet, Rodney J. Schlosser, Bernadette M. Cortese. (2019). Odor sensitivity impairment: a behavioral marker of psychological distress?. CNS Spectr.. 24, 404-412;
- Marley D. Kass, Michelle C. Rosenthal, Joseph Pottackal, John P. McGann. (2013). Fear Learning Enhances Neural Responses to Threat-Predictive Sensory Stimuli. Science. 342, 1389-1392;
- Claire V. Farrow, Helen Coulthard. (2012). Relationships between sensory sensitivity, anxiety and selective eating in children. Appetite. 58, 842-846;
- Kimberly L. H. Carpenter, Grace T. Baranek, William E. Copeland, Scott Compton, Nancy Zucker, et. al.. (2019). Sensory Over-Responsivity: An Early Risk Factor for Anxiety and Behavioral Challenges in Young Children. J Abnorm Child Psychol. 47, 1075-1088;
- Garcia, J., Kimeldorf, D. J., Koelling, R. A. (1955). Conditioned aversion to saccharin resulting from exposure to gamma radiation. Science, 5, 121–122;
- Wei Hong, Huabin Zhao. (2014). Vampire bats exhibit evolutionary reduction of bitter taste receptor genes common to other bats. Proc. R. Soc. B.. 281, 20141079;
- Lindsey A. Schier, Kellie M. Hyde, Alan C. Spector. (2019). Conditioned taste aversion versus avoidance: A re-examination of the separate processes hypothesis. PLoS ONE. 14, e0217458;
- Michael D. Breed, Janice Moore. (2012). Learning. Animal Behavior. 125-150;
- Marcus C. Stensmyr, Sophie J.C. Caron. (2020). Neuroscience: The Secret of Sauce Béarnaise Syndrome Is in the Circuit. Current Biology. 30, R1413-R1415;
- Ilene L. Bernstein. (1978). Learned Taste Aversions in Children Receiving Chemotherapy. Science. 200, 1302-1303;
- Химические модуляторы памяти;
- M Miranda. (2003). Role of cholinergic system on the construction of memories: Taste memory encoding. Neurobiology of Learning and Memory. 80, 211-222;
- Takashi Yamamoto, Kayoko Ueji. (2011). Brain Mechanisms of Flavor Learning. Front. Syst. Neurosci.. 5;
- Роль миндалевидного тела в социальном поведении;
- Haneen Kayyal, Adonis Yiannakas, Sailendrakumar Kolatt Chandran, Mohammad Khamaisy, Vijendra Sharma, Kobi Rosenblum. (2019). Activity of Insula to Basolateral Amygdala Projecting Neurons is Necessary and Sufficient for Taste Valence Representation. J. Neurosci.. 39, 9369-9382;
- Yamamoto T., Yasoshima Y. Electrophysiological Representation of Taste Memory. In: Bermúdez-Rattoni F, editor. Neural Plasticity and Memory: From Genes to Brain Imaging. Boca Raton (FL): CRC Press/Taylor & Francis, 2007. Chapter 6;
- https://biomolecula.ru/themes/optogenetika;
- Melissa S Haley, Stephen Bruno, Alfredo Fontanini, Arianna Maffei. (2020). LTD at amygdalocortical synapses as a novel mechanism for hedonic learning. eLife. 9;
- Ranjith Kamity, Prasanna K. Kapavarapu, Amit Chandel. (2021). Feeding Problems and Long-Term Outcomes in Preterm Infants—A Systematic Approach to Evaluation and Management. Children. 8, 1158;
- David Forbes, Zubin Grover. (2015). Tube feeding: Stopping more difficult than starting. J Paediatrics Child Health. 51, 245-247;
- Linda Cooper‐Brown, Sara Copeland, Scott Dailey, Debora Downey, Mario Cesar Petersen, et. al.. (2008). Feeding and swallowing dysfunction in genetic syndromes. Dev Disabil Res Revs. 14, 147-157;
- Miriam Martinez-Biarge, Jesus Diez-Sebastian, Courtney J. Wusthoff, Stacey Lawrence, Annie Aloysius, et. al.. (2012). Feeding and communication impairments in infants with central grey matter lesions following perinatal hypoxic–ischaemic injury. European Journal of Paediatric Neurology. 16, 688-696;
- Imani Weeks, Sophie R. Abber, Jennifer J. Thomas, Samantha Calabrese, Braden Kuo, et. al.. (2023). The Intersection of Disorders of Gut-Brain Interaction With Avoidant/Restrictive Food Intake Disorder. Journal of Clinical Gastroenterology. 57, 651-662;
- Marios Vasilakis, Konstantinos Polychronis, Eleni Panagouli, Efthalia Tzila, Alexia Papageorgiou, et. al.. (2022). Food Difficulties in Infancy and ASD: A Literature Review. Children. 10, 84;
- GWAS и психогенетика: консорциумы в поисках ассоциаций.







