25 оттенков горечи
15 августа 2023
25 оттенков горечи
- 1761
- 0
- 7
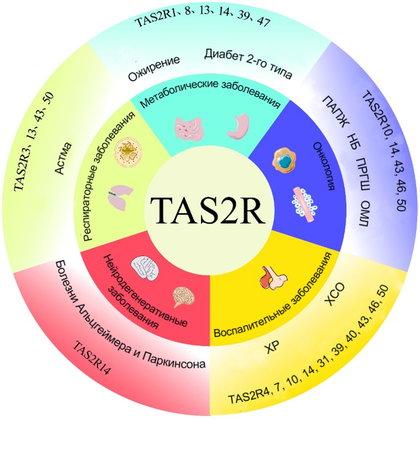
Разнообразие семейства рецепторов TAS2R и их многофункциональная роль.
Рисунок в полном размере.
фото из препринта Advances in the study of the role of extraoral bitter taste receptors [1]
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: За миллионы лет эволюции млекопитающие выработали множество способов защититься от болезней. Один из них — предотвратить попадание в организм вредных веществ, а именно — реакция на горечь. Ведь что горько — то неприятно и невкусно, а что невкусно — то не едят. Горький вкус — наиболее сложный из всех известных основных вкусов (обнаружено 25 различных рецепторов, отвечающих за его восприятие), и именно он защищает от принятия токсичных веществ, вызывая врожденную реакцию отвращения у людей. Это основная роль рецепторов горького вкуса (TAS2Rs), относящихся к семейству GPCR. Удивительно, но встречаются они не только во рту, но и по всему организму: в желудке, мозге, сердце, иммунных клетках, мочеполовой и дыхательной системах. Какие же роли они там играют?
Конкурс «Био/Мол/Текст»-2023/2024
 Эта статья участвовала в конкурсе «Био/Мол/Текст»-2023/2024 в номинации «Свободная тема» и будет опубликована в журнале «Наука и жизнь».
Эта статья участвовала в конкурсе «Био/Мол/Текст»-2023/2024 в номинации «Свободная тема» и будет опубликована в журнале «Наука и жизнь».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Код опасности
Если вы отправитесь в растительный мир, то обнаружите, что почти всё в нем имеет горький вкус. В ходе эволюции растения приспособились к травоядным, снабдив себя множеством физических, репродуктивных и химических средств защиты — шипы, шелуха, синхронное плодоношение и симбиозы с животными-защитниками. Однако наиболее мощной линией защиты растений от травоядных стало использование ими токсинов. Почти все растения производят вторичные метаболиты, некоторые из которых ядовиты и для человека [2], [3]. Например, маниок вырабатывает цианид, который прерывает способность клеток производить аденозинтрифосфат (АТФ); в соевых бобах содержатся сапонины — их избыток в организме приводит к раздражению слизистой желудка и кишечника, вызывая рвоту и диарею. Полный набор защитных соединений, используемых растениями, исчисляется сотнями тысяч, причем большинство из них не получает должного внимания, поскольку они либо не смертельны, либо встречаются довольно редко. Однако почти все ядовитые вещества горькие, поэтому избежать их эффективнее всего позволяет восприятие горечи [4].
Эволюция горького вкуса связана с особенностями строения различных химических веществ. Историю изучения горького вкуса позволяют проследить фенилтиокарбамид (PTC) и пропилтиоурацил (PROP).
В 1931 году химик Артур Фокс насыпал в бутылку порошкообразное химическое вещество под названием фенилтиокарбамид. Когда часть порошка случайно попала в воздух, коллега, стоявший рядом, пожаловался, что пыль горчит. Фокс же вообще ничего не почувствовал. Затем они попробовали это вещество, и результаты были такими же. Тогда Фокс попросил своих друзей и семью попробовать порошок и описать его вкус. Некоторые вообще ничего не почувствовали, а другим оно показалось сильно горьким. Но были и те, кто чувствовал лишь незначительную горечь. В 1932 г. Фокс опубликовал окончательное описание полиморфизма чувствительности PTC в журнале Proceedings of the National Academy of Sciences (рис. 1) [5].

Рисунок 1. Факсимиле заголовка и первого абзаца статьи Артура Фокса о чувствительности к фенилтиокарбамиду в Proceedings of the National Academy of Sciences.
Дальнейшее развитие событий связывают с именами Рональда Фишера, Эдмунда Форда и Джулиана Хаксли, которых объединяла идея естественного отбора как движущей силы эволюции. В 1939 году они проверили, смогут ли шимпанзе попробовать воду с добавлением PTC, который некоторые люди находят тошнотворно горьким, а другие, наоборот, не ощущают горечи. История произошла в Эдинбургском зоопарке. Когда шимпанзе сделал глоток воды, он посмотрел в глаза Фишеру и плюнул в него.
Команда Фишера предположила, что различия в чувствительности к горькому вкусу были вызваны генетической мутацией, общей для людей и шимпанзе, и что естественный отбор сохранил это разнообразие у обоих видов [6], [7].
И только семь десятилетий спустя был идентифицирован ген TAS2R38 (T2R38), ответственный за чувствительность к PTC. Также было подтверждено, что его различные варианты в значительной степени объясняют, почему не все могут почувствовать горький вкус фенилтиокарбамида.
Некоторые люди имеют чрезвычайно высокую чувствительность к горькому вкусу из-за высокой экспрессии генов TAS2R. Этих людей называют «супердегустаторами». Их чаще всего можно встретить в некоторых частях Азии, Африки и Южной Америки. И связано это, вероятно, с тем, что в этих районах изначально была более высокая концентрация токсичных растений по сравнению с другими континентами. Чтобы компенсировать увеличение количества потенциальных токсинов, живущие в этих районах люди могли получить больше пользы от рецепторов горького вкуса.
TAS2R экспрессируются у всех позвоночных. Однако их количество у разных видов различается. Например, у кошек идентифицировано 12 различных рецепторов горького вкуса, у кур — три, а у мышей — 35 [8]. У человека имеется всего 25 функциональных генов TAS2R [9]. Более того, различные рецепторы горечи появлялись и исчезали в ходе эволюции: в геноме человека имеются нефункционирующие остатки генов (псевдогенов), некогда кодировавших рецепторы семейства TAS2R. Вероятно, эти рецепторы были важны в прошлом, но со временем стали ненужными.
Каким же образом человек при относительно небольшом количестве рецепторов может ощущать горечь огромного множества химически разнообразных горьких веществ?
Как мы воспринимаем горечь
Когда дело доходит до еды, всё начинается с языка. Он действует как «привратник», помогая нам различать полезные и вредные вещества. В тканях языка, мягкого нёба и глотки встроены вкусовые луковицы — скопления специализированных вкусовых клеток вытянутой формы, которые обладают многими свойствами нейронов (способностью к генерации потенциалов действия и образованию синапсов). Сама вкусовая луковица не достигает поверхности слизистой оболочки языка, в полость рта выходит только пóра, через которую вкусовая луковица и получает информацию об окружающей среде (рис. 2). Снаружи вкусовых клеток имеются микроворсинки, на которых расположены рецепторы [10]. Ощущение горечи опосредовано вкусовыми G-белок-сопряженными рецепторами (GPCR) — крупными мембранными белками из семейства с крайне разнообразными функциями [11–13].

Рисунок 2. Анатомия языка. Клетки вкусовых рецепторов сгруппированы в пучки под поверхностью сосочков, где они через поры контактируют с окружающей средой.
GPCR способны связывать огромное разнообразие сигнальных молекул, но при этом имеют весьма консервативную структуру [14]. Их белковая цепь встроена в клеточную мембрану, пронизывая ее семь раз и образуя пучок из семи α-спиралей. Как следует из названия, GPCR взаимодействуют с G-белками в составе трех субъединиц: α, β и γ. G-белок, специфичный для вкусовых клеток, назван гастдуцином (от лат. gustus — вкус).
Когда сигнальная молекула активирует рецептор, это выражается в изменении его конформации и активации G-белка. В результате его субъединицы разделяются на две части: α-субъединицу и β/γ-димер. Обе части продолжают крепиться к мембране, но не связаны более с GPCR, а потому могут свободно перемещаться и взаимодействовать с другими мембранными белками.
При стимуляции TAS2R горькими веществами (лигандами) запускается каскад реакций, ключевая из которых — активация фосфолипазы C β2 (PLC β2) субъединицами β и γ G-белка (фосфоинозитидный путь с участием инозитол-1,4,5-трисфосфата, IP3, и диацилглицерола, DAG) (рис. 3) [9]. Однако в передаче «горького» сигнала немаловажную роль играет и α-субъединица (Gα-гастдуцин), которая активирует фосфодиэстеразу, снижает уровень циклического аденозинмонофосфата и тем самым регулирует эффективность фосфоинозитидного пути.

Рисунок 3. Каскад передачи сигнала TAS2R во вкусовых клетках. Горькие вещества связываются с TAS2R, что приводит к активации G-белка, а затем — фосфолипазы С β2. Это, в свою очередь, приводит к увеличению концентрации внутриклеточного кальция (при участии IP3-рецептора). Он открывает Ca2+-зависимый ионный канал TRPM5, что приводит к деполяризации мембраны (снижению потенциала покоя между внутренней и наружной сторонами мембраны [15]) и генерации серии потенциалов действия. В свою очередь, это стимулирует потенциал-зависимые ионные каналы CALHM1 и приводит к высвобождению АТФ из клетки, после чего с помощью пуринергических рецепторов [16] сигнал о воздействии горьких веществ уходит в мозг. Кстати, кальций — катион, играющий невероятно важную роль во внутриклеточной передаче сигнала: читайте об этом в статье «Загадочный кальциевый язык» [17].
На сегодняшний день установлено более тысячи веществ, которые воспринимаются человеком как горькие [18]. Некоторые рецепторы TAS2R могут активироваться широким спектром лигандов, в то время как другие избирательны, имея только 1–2 известных лиганда. Например, рецептор TAS2R46 широко реактивен: он активируется более чем 20 горькими веществами. А TAS2R14 имеет по меньшей мере 150 зарегистрированных агонистов, включая множество структурно различных лигандов.
Точно так же некоторые горькие соединения могут активировать одновременно несколько рецепторов, а некоторые — только один [19]. Так, колхицин активирует TAS2R4, TAS2R39 и TAS2R46. Хинин входит в число веществ, которые активируют наибольшее количество TAS2R (девять), включая TAS2R4, TAS2R7, TAS2R14, TAS2R10 и TAS2R46.
Показана перекрестная реактивность пахучих и горьких веществ. Некоторые пахучие вещества способны активировать рецепторы горького вкуса [20]. Так, туйон, или монотерпин (бесцветное вещество с характерным запахом, напоминающим ментол), способен активировать рецепторы TAS2R4 и TAS2R14, а камфора, которая входит в состав многих эфирных масел и имеет мятно-камфорный запах, активирует рецепторы TAS2R4, TAS2R10 и TAS2R14 [21].
Подробнее понять молекулярные механизмы, лежащие в основе восприятия горечи, позволило бы изучение структуры рецепторов TAS2R; однако до недавнего времени ни одна такая структура не получена экспериментальными методами, и приходилось полагаться на компьютерные модели [22] в сочетании с функциональными экспериментами на точечных мутантах рецепторов. Но вот в 2022 году в научном журнале Science была опубликована решенная структура рецептора TAS2R46. Это удалось сделать с помощью криоэлектронной микроскопии при активации рецептора стрихнином [23]. Структуру можно загрузить в банке данных белков под следующими именами: 7xp6 — активное состояние; 7xp5 — безлигандное состояние; 7xp4 — апо-состояние.
В одной и той же клетке для разных горьких веществ одновременно работает множество TAS2R-рецепторов. Эти горькие соединения действуют на одни и те же элементы внутриклеточного сигнального каскада. Возможно, именно поэтому всё горькое ощущается нами одинаково — чего, кстати, нельзя сказать о сладком. Но стоит учесть, что в повседневной жизни мы практически не сталкиваемся с чистыми горькими вкусами.
Супердегустаторы, дегустаторы и недегустаторы
Гены, кодирующие рецепторы TAS2R, сгруппированы на коротких плечах хромосом 5 (5p15) и 12 (12p13) и на длинном плече хромосомы 7 (7q31—7q35). Показано, что все 25 генов TAS2R экспрессируются во вкусовых клетках, и примерно от 4 до 11 генов TAS2R коэкспрессируются в одной клетке [8]. Максимальное число таких комбинаций совместной экспрессии — 4,5x106! Учитывая, что это значение значительно превышает количество вкусовых луковиц и вкусовых рецепторных клеток, никакие две вкусовые луковицы и две рецепторные клетки не могут быть одинаковыми в отношении их репертуара TAS2R [24].
Гены рецепторов горького вкуса полиморфны, включают множество несинонимичных вариантов: это распространенный источник фенотипической изменчивости, и в случае TAS2R это приводит к различному восприятию горечи у разных людей [25].
Среди всех генов семейства TAS2R наиболее изучен TAS2R38, рецептор которого опосредует горький вкус соединений тиомочевины, таких как PTC и PROP. Восприятие этих вкусов весьма индивидуально, что позволяет им выступать пероральным маркером пищевых предпочтений и диетического поведения. Ген TAS2R38 содержит три несинонимичных однонуклеотидных полиморфизма (SNP), которые приводят к двум распространенным вариантам белка TAS2R38: функциональной форме, содержащей пролин, аланин и валин (далее ассоциированный генотип называется PAV, а его носитель — «супердегустатором»); и нефункциональному варианту, содержащему аланин, валин и изолейцин (с генотипом, названным AVI, а его носитель — «недегустатор») [25–27]. Носителей гетерозигот (PAV/AVI) называют «дегустаторами»: у них промежуточная чувствительность к горькому вкусу.

Рисунок 4. Бумага, пропитанная PTC, используется для проверки, является ли человек «супердегустатором», «дегустатором» или «недегустатором».
Люди, обладающие двумя копиями PAV, сообщают, что PTC/PROP более горькие, чем гетерозиготы TAS2R38, а люди, обладающие двумя копиями AVI, вообще не чувствуют горечи PTC/PROP.
Примерно 25–30% людей — недегустаторы. Помимо того, что они менее восприимчивы к горьким вкусам, недегустаторы менее чувствительны и к сладким вкусам, терпкости алкоголя, остроте перца чили и текстуре жиров. Среди них больше курильщиков, чем среди супердегустаторов. Поэтому чувствительность к PTC/PROP часто рассматривается как общий маркер остроты вкусовых ощущений. Если вы захотите узнать, супердегустатор ли вы, то можете сделать это с помощью бумаги, пропитанной PTC (рис. 4).
Чрезмерная чувствительность к горьким веществам может быть серьезным препятствием к употреблению многих продуктов и лекарств. Но при этом быть супердегустатором — не так уж и плохо, как оказалось. Такая суперспособность таит в себе источник здоровья и долголетия.
Полиморфизмы и здоровье
Вышеописанные полиморфизмы связаны не только с пищевыми предпочтениями, но и с такими показателями здоровья, как индекс массы тела, метаболические изменения, нарушения вкуса, восприимчивость к респираторным заболеваниям, частота хронического риносинусита, онкологии и нейродегенеративных заболеваний [28]. Такая связь обусловлена присутствием рецепторов горького вкуса не только во рту, но и по всему организму, что уже сейчас подтверждается многочисленными исследованиями. В таблице из статьи An update on extra-oral bitter taste receptors можно посмотреть экспрессию и распределение TAS2R в различных тканях человека [29].
Первые намеки на роль TASR2 в других частях тела появились в 2009 году, когда исследователи из Университета Айовы обнаружили их на клетках эпителия в легких. Липкий слой слизи поверх этих клеток задерживает микробы и раздражители, когда мы их вдыхаем, а крошечные реснички синхронно бьются 8–15 раз в секунду, подталкивая раздражители к горлу, после чего мы их проглатываем или выплевываем. Команда из Айовы обнаружила, что реснички в клетках легких бьются еще быстрее, когда их рецепторы TAS2R (а именно TAS2R4, TAS2R43, TAS2R38 и TAS2R46) стимулируются горькими соединениями, помогая дыхательным путям быстрее очиститься от потенциально опасных веществ [30].
Примерно в это же время исследователи из Университета Колорадо изучали рецепторы горького вкуса, обнаруженные в носу крысы. Они показали, что эти клетки, называемые одиночными хемосенсорными клетками, становятся более активными, когда обнаруживают бактериальные молекулы, называемые ацил-гомосеринлактонами (АГЛ) [31].
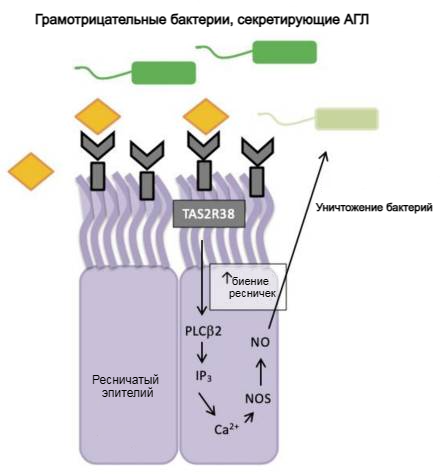
Рисунок 5. Регуляция рецептора горького вкуса TAS2R38 во врожденном иммунитете синоназального эпителия человека. АГЛ бактерий связывается с рецептором TAS2R38 и запускает каскад передачи вкусового сигнала, активируя PLC-β2 и высвобождая внутриклеточный кальций, который, в свою очередь, активирует синтазу оксида азота (NOS) и приводит к продукции оксида азота (NO). Оксид азота и его производные повреждают мембраны, ферменты и ДНК бактерий, а также увеличивают частоту биения ресничек.
Чуть позже, в 2011 году, ученые взялись за поиски вкусовых рецепторов в эпителии носа человека [32]. Они решили изучить, как различные полиморфизмы TAS2R38 влияют на поведение клеток носовых пазух, и подвергли эти клетки воздействию PTC. Результаты были весьма интересными — клетки супердегустаторов производили гораздо большее количество оксида азота, чем клетки недегустаторов. Это открытие дало новый импульс в изучении связи вкуса и иммунитета. Оксид азота в отношении бактерий выполняет две важные функции в дыхательных путях: во-первых, он может стимулировать эти клетки, увеличивая биение ресничек, а во-вторых, он также может непосредственно убивать бактерии. Это заставило ученых задуматься о том, что разные полиморфизмы TAS2R38 могут по-разному влиять на восприимчивость людей к инфекциям верхних дыхательных путей. Кроме того, было показано, что назальные клетки супердегустаторов обнаруживают бактериальные АГЛ через TAS2R38 и продуцируют оксид азота (рис. 5), в то время как клетки недегустаторов этого не делают [32]. В 2017 году такой же механизм обнаружения АГЛ с участием оксида азота был подтвержден и для рецепторов TAS2R4 и TAS2R16, присутствующих в синоназальной ткани [33].
Изучили и связь между фенотипами TAS2R38 и тяжестью COVID-19. Показано, что недегустаторы значительно чаще дают положительный результат теста на SARS-CoV-2, госпитализируются после заражения и проявляют симптомы в течение более длительного времени, что свидетельствует об усиленной врожденной иммунной защите от SARS-CoV-2 у супердегустаторов [35], [36].
Все эти эксперименты показали, что рецепторы горького вкуса играют важную роль в иммунном ответе дыхательных путей. Более того, их функция несколько отличается от функции толл-подобных рецепторов (TLR) [37], которые также активируют иммунный ответ врожденного типа. Однако имеется по крайней мере одно важное отличие: ответ с помощью TLR происходит намного медленнее, занимая несколько часов или даже дней — в то время как TAS2R38 и его «горькие» родственники, напротив, дают ответ в течение нескольких секунд или минут. Поэтому «горькие» защитники могут быть наиболее важными в начале инфекции, реагируя по принципу «здесь и сейчас».
Рецепторы горького вкуса обнаружены и в других клетках и органах — в лимфоцитах, моноцитах, гранулоцитах, тучных клетках, в желудочно-кишечном тракте, сердечной ткани, почках, мочевом пузыре, в плаценте и мозге, где они играют самые разные роли [38], [39].
Последние данные показывают, что соединения с горьким вкусом проявляют противораковое и химиосенсибилизирующее действие [40], [41]. Обнаружено, что TAS2R по-разному экспрессируются в раковых клетках: одни изоформы могут быть активированы, а другие, наоборот, подавляются. Например, экспрессия TAS2R4 в клетках рака молочной железы относительно подавлена, тогда как экспрессия TASR14 — активна. В таблице из уже другой статьи (The Role of Bitter Taste Receptors in Cancer: A Systematic Review) представлены результаты многочисленных исследований, в которых изучалась роль рецепторов горького вкуса при различных видах рака и уровни их экспрессии [41]. Предполагается, что активация TAS2R в различных раковых клетках оказывает такие противораковые эффекты, как снижение деления и миграции клеток, а также повышенную скорость апоптоза (увеличение запрограммированной клеточной гибели клеток) [41]. Однако многие механизмы по сей день остаются неизвестными.
До сих пор нет убедительных доказательств того, что риск развития рака зависит от потребления с пищей компонентов горького вкуса. В 1995 году диетологами-эпидемиологами из Университета Лидса было организовано когортное исследование британских женщин для изучения связи между питанием и раком. Предполагалось, что женщины с более высокой чувствительностью к горькому вкусу потребляют меньше овощей и потому чаще болеют раком. Несмотря на то, что эта гипотеза не подтвердилась, было обнаружено, что среди пожилых женщин чувствительность к горькому вкусу была связана с повышенным риском рака. У супердегустаторов риск заболеть раком был примерно на 58 процентов, а у дегустаторов — на 40 процентов выше по сравнению с женщинами-недегустаторами. При этом было отмечено, что супердегустаторы и дегустаторы ели не меньше овощей, чем недегустаторы.
Исходя из имеющихся на сегодняшний день данных, есть много оснований полагать, что рецепторы горького вкуса вовлечены в клеточные процессы рака, и это делает их ценными мишенями для разработки новых терапевтических средств.
Роль внеротовых рецепторов горького вкуса также активно изучается и при других заболеваниях — их обзор можно посмотреть в еще одной таблице (из статьи Extraoral bitter taste receptors in health and disease) [38].
TAS2R и пищевое поведение
Чувствительность к горькому вкусу оказывает огромное влияние на пищевое поведение и пищевые предпочтения. Исследования показывают, что супердегустаторы употребляют меньше овощей, а некоторые и вовсе их избегают [34]. Несложно догадаться, что сильнее всего это затрагивает детей. Показано, что дети с гаплотипом PAV (супердегустаторы) чаще отказываются от овощей и другой пищи, в которой содержатся горькие вещества, чем их сверстники-недегустаторы (рис. 6) [42]. Употребление супердегустаторами горьких веществ (содержащихся не только в еде, но и во многих лекарствах) может приводить к поведенческим реакциям отторжения и отвращения, таким как выплевывание, рвота, кашель и чихание [13], [43]. Для младенцев и маленьких детей это чревато развитием пищевой неофобии (избеганию новых продуктов) и крайней избирательности в еде.

Рисунок 6. Ребенок, который отказывается есть овощи.
Показано, что младенцы-недегустаторы чаще съедают полностью свой первый прикорм, чем дети-супердегустаторы, причем это не зависит от того, какую еду им предлагают [44]. Кроме того, чувствительные к горькому вкусу дети более худые [45].
В то время как младенцы автоматически отвергают горькие раздражители, взрослым людям проще себя контролировать, когда они ощущают горечь. Яркий пример — кофе и алкоголь. Несмотря на горький вкус, люди любят эффект, который получают от этих напитков. Но при этом многие маскируют горечь, например, разбавляя алкоголь сладкой газировкой и добавляя в кофе сахар и сливки.
Особую роль в пищевом поведении играют рецепторы TAS2R, присутствующие в кишечнике (а именно — на энтероэндокринных клетках). В отличие от вкусовых рецепторов, обнаруженных в полости рта (несмотря на схожесть механизма передачи внутриклеточного сигнала), они не передают ощущение вкуса в мозг (рис. 7). Их активация приводит к высвобождению гормонов, которые участвуют в регуляции аппетита, чувства сытости и высвобождении инсулина. Среди таких гормонов — холецистокинин, грелин, глюкагоноподобный пептид-1 и пептид YY [46].
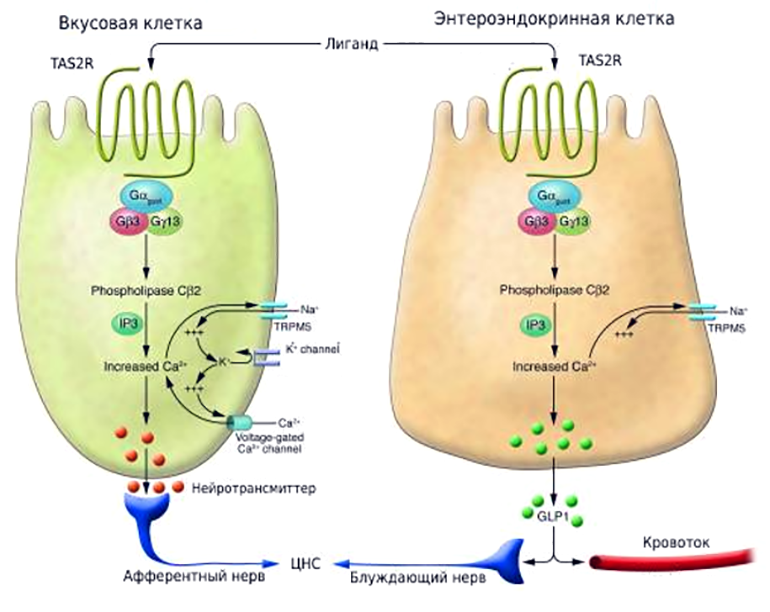
Рисунок 7. Сходство и различие в механизмах восприятия горьких веществ, рецепторами языка и энтероэндокринных клеток кишечника. И вкусовые клетки языка, и энтероэндокринные клетки (ЭЭК) имеют рецепторы TAS2R, которые обнаруживают горькие лиганды. Активированный TAS2R на ЭЭК передает сигнал внутрь клетки по пути, схожему с тем, который показан для клеток языка, и приводит к высвобождению гормонов (на рисунке — глюкагоноподобный пептид-1, GLP-1). После чего эти гормоны, с одной стороны, стремятся в кровоток и стимулируют высвобождение инсулина из клеток поджелудочной железы, а с другой — передают сигнал в центральную нервную систему (ЦНС), регулируя аппетит.
Всё это делает «кишечные» горькие рецепторы привлекательными мишенями для метаболических заболеваний. Например, воздействуя на них определенными горькими веществами, фактически можно сформировать чувство сытости и регулировать уровень инсулина, что важно при лечении ожирения и диабета [47].
Заключение
О рецепторах горького вкуса можно написать еще много. Здесь представлена лишь часть известного о них на сегодняшний день. А сколько еще неизведанного, учитывая их разнообразие и распространение по всему организму!
Теперь вы знаете, что восприятие горечи обусловлено генетически. Кто-то с утра выпьет крепкий кофе без сахара и при этом будет наслаждаться вкусом, а кто-то не сможет сделать даже глоток. Полиморфизмы генов TAS2R могут быть важным фактором в прогнозировании развития тех или иных заболеваний, определяя способ и интенсивность лечения. Это предоставляет широкие возможности для развития фармакогеномики [48].
Горечь многолика, а функции горьких рецепторов выходят за рамки обычного вкусового восприятия. Они регулируют самые разные защитные реакции — иммунологические, поведенческие, метаболические — и выступают потенциальными терапевтическими мишенями. Возможно, в будущем с помощью горьких веществ (агонистов рецепторов TAS2R) можно будет успешно лечить астму, хронический риносинусит, ожирение, диабет и даже рак. И смысл фразы «Хорошее лекарство горчит» станет еще более очевидным.
Литература
- Xiaohui Yu, Yanli Zhen, Ting Fang, Jian Zhang, Yuyi Xu, et. al. Advances in the study of the role of extraoral bitter taste receptors — Authorea, Inc.;
- О чем пахнут растения?;
- André Kessler, Aino Kalske. (2018). Plant Secondary Metabolite Diversity and Species Interactions. Annu. Rev. Ecol. Evol. Syst.. 49, 115-138;
- Danielle Renee Reed, Antti Knaapila. (2010). Genetics of Taste and Smell. Progress in Molecular Biology and Translational Science. 213-240;
- Arthur L. Fox. (1932). The Relationship between Chemical Constitution and Taste. Proc. Natl. Acad. Sci. U.S.A.. 18, 115-120;
- Stephen Wooding. (2006). Phenylthiocarbamide: A 75-Year Adventure in Genetics and Natural Selection. Genetics. 172, 2015-2023;
- Ewen Callaway. (2012). Evolutionary biology: The lost appetites. Nature. 486, S16-S17;
- Kamila Tuzim, Agnieszka Korolczuk. (2021). An update on extra-oral bitter taste receptors. J Transl Med. 19;
- Maria Talmon, Federica Pollastro, Luigia Grazia Fresu. (2022). The Complex Journey of the Calcium Regulation Downstream of TAS2R Activation. Cells. 11, 3638;
- «Элементы»: «Клеточные механизмы восприятия вкуса»;
- Stephen D. Roper, Nirupa Chaudhari. (2017). Taste buds: cells, signals and synapses. Nat Rev Neurosci. 18, 485-497;
- Stephen P Wooding, Vicente A Ramirez, Maik Behrens. (2021). Bitter taste receptors. Evolution, Medicine, and Public Health. 9, 431-447;
- Аллостерические регуляторы GPCR: ключи от всех замков;
- Структуры рецепторов GPCR «в копилку»;
- Формирование мембранного потенциала покоя;
- Вторая жизнь АТФ: от главной батарейки до нейромедиатора;
- Загадочный кальциевый язык;
- Ayana Dagan-Wiener, Antonella Di Pizio, Ido Nissim, Malkeet S Bahia, Nitzan Dubovski, et. al.. (2019). BitterDB: taste ligands and receptors database in 2019. Nucleic Acids Research. 47, D1179-D1185;
- Antonella Di Pizio, Masha Y. Niv. (2015). Promiscuity and selectivity of bitter molecules and their receptors. Bioorganic & Medicinal Chemistry. 23, 4082-4091;
- Запах горького ветра;
- Eitan Margulis, Tatjana Lang, Anne Tromelin, Evgenii Ziaikin, Maik Behrens, Masha Y. Niv. (2023). Bitter Odorants and Odorous Bitters: Toxicity and Human TAS2R Targets. J. Agric. Food Chem.. 71, 9051-9061;
- Торжество компьютерных методов: предсказание строения белков;
- Weixiu Xu, Lijie Wu, Shenhui Liu, Xiao Liu, Xiaoling Cao, et. al.. (2022). Structural basis for strychnine activation of human bitter taste receptor TAS2R46. Science. 377, 1298-1304;
- Maik Behrens, Susann Foerster, Frauke Staehler, Jan-Dirk Raguse, Wolfgang Meyerhof. (2007). Gustatory Expression Pattern of the Human TAS2R Bitter Receptor Gene Family Reveals a Heterogenous Population of Bitter Responsive Taste Receptor Cells. J. Neurosci.. 27, 12630-12640;
- Stephen P. Wooding, Vicente A. Ramirez. (2022). Global population genetics and diversity in the TAS2R bitter taste receptor family. Front. Genet.. 13;
- Beverly J. Tepper. (2008). Nutritional Implications of Genetic Taste Variation: The Role of PROP Sensitivity and Other Taste Phenotypes. Annu. Rev. Nutr.. 28, 367-388;
- Bernd Bufe, Paul A.S. Breslin, Christina Kuhn, Danielle R. Reed, Christopher D. Tharp, et. al.. (2005). The Molecular Basis of Individual Differences in Phenylthiocarbamide and Propylthiouracil Bitterness Perception. Current Biology. 15, 322-327;
- Melania Melis, Alessandra Errigo, Roberto Crnjar, Giovanni Mario Pes, Iole Tomassini Barbarossa. (2019). TAS2R38 bitter taste receptor and attainment of exceptional longevity. Sci Rep. 9;
- Kamila Tuzim, Agnieszka Korolczuk. (2021). Correction to: An update on extra-oral bitter taste receptors. J Transl Med. 19;
- Alok S. Shah, Yehuda Ben-Shahar, Thomas O. Moninger, Joel N. Kline, Michael J. Welsh. (2009). Motile Cilia of Human Airway Epithelia Are Chemosensory. Science. 325, 1131-1134;
- Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение;
- Robert J. Lee, Guoxiang Xiong, Jennifer M. Kofonow, Bei Chen, Anna Lysenko, et. al.. (2012). T2R38 taste receptor polymorphisms underlie susceptibility to upper respiratory infection. J. Clin. Invest.. 122, 4145-4159;
- Carol H. Yan, Samuel Hahn, Derek McMahon, David Bonislawski, David W. Kennedy, et. al.. (2017). Nitric Oxide Production is Stimulated by Bitter Taste Receptors Ubiquitously Expressed in the Sinonasal Cavity. Am J Rhinol�Allergy. 31, 85-92;
- Joanna Jeruzal-Świątecka, Wojciech Fendler, Wioletta Pietruszewska. (2020). Clinical Role of Extraoral Bitter Taste Receptors. IJMS. 21, 5156;
- Henry P. Barham, Mohamed A. Taha, Stephanie T. Broyles, Megan M. Stevenson, Brittany A. Zito, Christian A. Hall. (2021). Association Between Bitter Taste Receptor Phenotype and Clinical Outcomes Among Patients With COVID-19. JAMA Netw Open. 4, e2111410;
- Bethineedi L., Baghsheikhi H., Soltani A., Mafi Z., Samieefar N., Seraj S., Tabari M. (2023). Human T2R38 Bitter Taste Receptor Expression and COVID-19: From Immunity to Prognosis. Avicenna J Med Biotechnol. 15, 118–123;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Ping Lu, Cheng-Hai Zhang, Lawrence M. Lifshitz, Ronghua ZhuGe. (2017). Extraoral bitter taste receptors in health and disease. Journal of General Physiology. 149, 181-197;
- Conor J. Bloxham, Simon R. Foster, Walter G. Thomas. (2020). A Bitter Taste in Your Heart. Front. Physiol.. 11;
- Ana R. Costa, Ana C. Duarte, Ana R. Costa-Brito, Isabel Gonçalves, Cecília R.A. Santos. (2023). Bitter taste signaling in cancer. Life Sciences. 315, 121363;
- Sofie Zehentner, Agnes T. Reiner, Christoph Grimm, Veronika Somoza. (2021). The Role of Bitter Taste Receptors in Cancer: A Systematic Review. Cancers. 13, 5891;
- Jean Golding, Colin Steer, Pauline Emmett, Linda M. Bartoshuk, Jeremy Horwood, George Davey Smith. (2009). Associations between the Ability to Detect a Bitter Taste, Dietary Behavior, and Growth. Annals of the New York Academy of Sciences. 1170, 553-557;
- Maria Pia Riccio, Chiara Franco, Rossella Negri, Roberta Ida Ferrentino, Roberta Maresca, et. al.. (2018). Is food refusal in autistic children related to TAS2R38 genotype?. Autism Research. 11, 531-538;
- Gabriele Cont, Giulia Paviotti, Marcella Montico, Paola Paganin, Martina Guerra, et. al.. (2019). TAS2R38 bitter taste genotype is associated with complementary feeding behavior in infants. Genes Nutr. 14;
- Carlye Burd, Araliya Senerat, Earle Chambers, Kathleen L. Keller. (2013). PROP taster status interacts with the built environment to influence children's food acceptance and body weight status. Obesity. 21, 786-794;
- David E. Cummings, Joost Overduin. (2007). Gastrointestinal regulation of food intake. J. Clin. Invest.. 117, 13-23;
- Hung Pham, Hongxiang Hui, Susan Morvaridi, Jiena Cai, Sanqi Zhang, et. al.. (2016). A bitter pill for type 2 diabetes? The activation of bitter taste receptor TAS2R38 can stimulate GLP-1 release from enteroendocrine L-cells. Biochemical and Biophysical Research Communications. 475, 295-300;
- Фармакогеномика: изучение генов на службе персонализированной медицины.