
Неизвестные пептиды: «теневая» система биорегуляции
11 ноября 2010
Неизвестные пептиды: «теневая» система биорегуляции
- 12116
- 22
- 12
Молекула основного «дыхательного» белка крови гемоглобина, отвечающего за перенос кислорода по организму, состоит из четырёх субъединиц: двух альфа и двух бета. В составе каждой субъединицы присутствует молекула гема (показана каркасом и полупрозрачной поверхностью), «охватывающая» центральный атом железа, способный связывать молекулу кислорода. Пептидные пулы в организме человека на 30–90% состоят из фрагментов гемоглобина, зачастую обладающих биологической активностью, никак не связанной с функциями «дыхательного» белка.
-
Автор
-
Редакторы
Уже давно не вызывает сомнений значимость белков для практически любого аспекта существования жизни. Однако их «младшие братья» — пептиды — привлекают незаслуженно мало внимания, обычно считаясь биологически не такими уж важными. Нет, никто не забывает про исключительную роль пептидов в эндокринной системе и антибактериальной защите. Однако ещё двадцать лет назад нельзя было и заподозрить, что пептидный «фон», присутствующий во всех тканях и традиционно воспринимаемый как «обломки» функциональных белков, также выполняет свою функцию. «Теневые» пептиды формируют глобальную систему биорегуляции и гомеостаза, — возможно, более древнюю, чем эндокринная и нервная системы.
Белки, как постулировано ещё классиками диалектического материализма, являются основным «рабочим телом» жизни. Недаром даже в школьном учебнике биологии отдельным списком перечисляются функции белков: каталитическая, структурная, защитная, регуляторная, сигнальная, транспортная, запасающая, рецепторная и двигательная. Первые белки описали ещё в XVIII веке — это были альбумин («яичный» белок), фибрин (один из белков крови) и глютен (запасающий белок пшеницы). Центральная роль белков во всей биологии была осознана к концу первой четверти XX века, и с тех пор ни у кого уже не вызывает сомнения, что абсолютно все жизненные процессы протекают с участием этих универсальных «молекул жизни».
Есть у белков и «младшие братья» — пептиды. Отличие между этими двумя классами молекул довольно условное — идентичные по химической природе, они различаются лишь размером (длиной полипептидной цепи): если молекула состоит более чем из 50 аминокислотных остатков — это белок, а если менее — то пептид. Перечисленные выше «классические» функции относятся главным образом к белкам, на долю пептидов же традиционно отводилась роль в эндокринной регуляции: большинство хорошо известных биологических пептидов (а их не так уж много) являются нейрогормонами и нейрорегуляторами. Основные пептиды с известной функцией в человеческом организме — пептиды тахикининового ряда, вазоактивные интестинальные пептиды, панкреатические пептиды, эндогенные опиоиды, кальцитонин и некоторые другие нейрогормоны.
Кроме этого, важную биологическую роль играют антимикробные пептиды [1], секретируемые как животными, так и растениями (встречаются, например, в семенах или в слизи лягушек), а также антибиотики пептидной природы, о которых ещё будет немного сказано далее.
И вот не так давно (не более тридцати лет назад) обнаружилось, что кроме этих пептидов, обладающих вполне определёнными функциями, ткани живых организмов содержат довольно мощный пептидный «фон», состоящий в основном из фрагментов более крупных функциональных белков. Долгое время считалось, что это не имеет принципиального значения, и что такие пептиды — всего лишь «обломки» рабочих молекул, которые организм ещё не успел «подчистить». Однако в последнее время становится понятно, что этот «фон» играет важную роль в поддержании гомеостаза (тканевого биохимического равновесия) и регуляции множества жизненно важных процессов самого общего характера — таких как рост, дифференциация и восстановление клеток. Не исключено даже, что система биорегуляции на основе пептидов — эволюционный «предшественник» более современных эндокринной и нервной систем.
Однако давайте разбираться по порядку, и, чтобы не утратить исторической перспективы, начнём с короткой экскурсии в историю изучения пептидных веществ в нашей стране.
Историческая справка: пептидная школа в СССР
В 1959 году в Академии наук СССР был создан Институт химии природных соединений, во главе которого встал академик Михаил Михайлович Шемякин (1908–1970). Сотрудники института с самого начала были ориентированы на изучение природных биорегуляторов, таких как витамины и антибиотики. Большую работу по синтезу пептидных антибиотиков вёл молодой инициативный учёный — будущий директор института и вице-президент АН СССР Юрий Анатольевич Овчинников (1934–1988).
«Визитной карточкой» Института на долгие годы стал валиномицин — депсипептидный циклический антибиотик из бактерий Streptomyces fulvissimus, — синтез которого осуществила команда под руководством Овчинникова [2], доказав заодно ошибочность существовавших ранее представлений о структуре этого вещества (рис. 1). Валиномицин оказался ионофором, то есть веществом, селективно увеличивающим проницаемость биологической липидной мембраны для определённого типа ионов. Конформационное исследование валиномицина и его комплексов с ионами калия (а именно их он и переносит через мембрану) позволило сформулировать механизм работы антибиотика [3]. Ион металла, как в браслет, помещается в центр полости, присутствующей в циклической молекуле, и без энергетических затрат переносится через клеточную мембрану, — что и приводит к «обнулению» калиевого трансмембранного потенциала и, в конечном счёте, к гибели микроорганизма.

Рисунок 1. На лабораторном коллоквиуме в Институте химии природных соединений (1965 г.). Структуру циклического антибиотика валиномицина на доске рисует В.Т. Иванов. Депсипептиды, к которым относится и валиномицин, содержат наряду с «классическими» пептидными связями также одну или несколько сложноэфирных групп.
Блестящий пример валиномицина и других ионофоров, плюс шедшие параллельно в США исследования краун-эфиров, также способных к формированию прочных комплексов с ионами металлов, породили по всему миру каскад работ, приведших к становлению контейнерной химии, основанной на концепции «хозяин-гость» [4]. За работы в этой области Дональд Крам, Жан-Мари Лен и Чарльз Педерсен в 1987 году были удостоены Нобелевской премии по химии. Кстати, пространственная структура трансмембранного калиевого канала, полученная уже в XXI веке, показала, что механизм переноса и селективности к иону K+ у этого белка принципиально такой же, как и в случае валиномицина, — только в канале координационную сферу иона образуют аминокислотные остатки из субъединиц канала-тетрамера [5], а в антибиотике это остов самой циклической молекулы-депсипептида.
За огромную работу по исследованию валиномицина и других ионофоров, результаты которой суммированы в монографии «Мембрано-активные комплексоны», Ю. А. Овчинников и В. Т. Иванов — нынешний директор Института биоорганической химии РАН (ИБХ — так сегодня называется институт, созданный Шемякиным) — были в 1987 году удостоены Ленинской премии. А в память о том романтическом периоде в биоорганической химии около входа в ИБХ красуется статуя, изображающая комплекс валиномицина с ионом калия.
«Болгарская простокваша», или как пептиды стимулируют врождённый иммунитет
Пептидные антибиотики — вещь, бесспорно, интересная, однако они по большей части вырабатываются микроорганизмами и действуют на микроорганизмы же, а значит, исследования должны были двигаться дальше — в сторону изучения пептидов животных и человека. Чтобы сделать переход к рассказу о человеческих пептидах более плавным, сначала коротко расскажем о мурамилпептидах — компонентах клеточной стенки бактерий, способных стимулировать врождённый иммунитет у человека.
В 1970-е годы в ИБХ обратился болгарский врач Иван Богданов с просьбой помочь проанализировать препарат, полученный им из продуктов ферментации кисломолочной бактерии Lactobacillus bulgaricus. Дело в том, что он хотел найти действующее начало «чудотворных» болгарских кисломолочных продуктов (в первую очередь, простокваши), якобы играющих роль в знаменитом болгарском долголетии. Роль диеты в долголетии целых народов так и остаётся не до конца доказанной, но вот препарат Богданова вызвал живой интерес, поскольку обладал существенной противоопухолевой активностью. По своему составу этот экстракт представлял собой сложную смесь веществ бактериального происхождения.
В результате исследований обнаружилось, что действующим началом препарата Богданова является элементарное звено клеточной стенки бактерий — глюкозаминил-мурамил-дипептид (ГМДП), — оказывающее на организм человека иммуностимулирующее и противоопухолевое действие. Фактически, этот элемент бактерии представляет для иммунной системы как бы «образ врага», мгновенно запускающий каскад поиска и удаления патогена из организма. Кстати, быстрый ответ — неотъемлемое свойство врождённого иммунитета, в отличие от адаптивной реакции, требующей до нескольких недель, чтобы «развернуться» полностью. На основе ГМДП был создан лекарственный препарат ликопид [6], применяющийся сейчас для широкого спектра показаний, связанных в основном с иммунодефицитами и инфекционными заражениями — сепсисом, перитонитом, синуситами, эндометритами, туберкулёзом, а также при различных видах лучевой и химеотерапии.
Новые «-омики»: пептидомика — новое направление постгеномных исследований
На этом изыскания «из жизни пептидов» не закончились — на самом деле, история с «простоквашей» и многие другие работы по веществам пептидной природы сообщили толчок для рождения новой отрасли, занимающейся систематическим изучением пептидов, содержащихся в живых клетках и тканевых жидкостях.
В начале 1980-х годов стало понятно, что роль пептидов в биологии сильно недооценена — их функции много шире, чем у всем известных нейрогормонов. Прежде всего, обнаружилось, что пептидов в цитоплазме, межклеточной жидкости и тканевых экстрактах много больше, чем считалось до того — как по массе, так и по числу разновидностей. Более того, состав пептидного «пула» (или «фона») в разных тканях и органах существенно отличается, и эти отличия сохраняются у разных особей. Число «свеженайденных» в тканях человека и животных пептидов в десятки раз превышало количество пептидов «классических» с хорошо изученными функциями. В течение какого-то времени «теневые» пептиды считались просто биохимическим «мусором», оставшимся от деградации более крупных функциональных белков и ещё не «прибранным» организмом, и лишь с начала 1990-х завеса тайны начала приподниматься.
Изучением роли пептидных «пулов» стала заниматься новая дисциплина — пептидомика, — становление которой происходило не в последнюю очередь и в ИБХ. Всем известно, что реализация генетической программы, заложенной в ДНК организмов, начинается с генóма — совокупности хромосом и генов [7]. Изучением организации и работы генома занимается специальная область на стыке молекулярной биологии и биотехнологий — генóмика. Ядро клетки, подобно командному центру, отправляет в цитоплазму послания — матричные РНК (мРНК), являющиеся «слепками» генов. Этот процесс называется транскрипцией, а совокупность всех мРНК, присутствующих в данный момент в цитоплазме и отражающих активность генома, по аналогии назвали транскриптóмом, особенности которого изучает транскриптомика. Сумма всех белковых молекул, которые синтезировали рибосомы, «прочитав» кодирующие белки мРНК, называется протеóмом, и изучает эту «белковую сферу» протеомика [8].
Эти три «-омики» являются классическими, но если вспомнить о том, что белки имеют ограниченный «срок годности», после чего расщепляются протеазами на фрагменты — то есть на пептиды! — то появляется ещё одна «-омика»: пептидомика [9]. По аналогии, её роль — изучить состав и функции белковых «пулов», существующих в разных тканях и органах, а также объяснить механизмы их образования и разрушения. Пептидóм находится на самом конце информационной цепочки: Генóм → Транскриптóм → Протеóм → Пептидóм. Пептидомика — самая молодая дисциплина из перечисленных: её возраст не превышает 30 лет, а название было предложено только в районе 2000 года. К настоящему моменту экспериментальная пептидомика позволила сформулировать три самых главных закономерности, описывающие поведение совокупности «теневых пептидов» в живых организмах.
Прежде всего, биологические ткани, жидкости и органы содержат большое число пептидов, образующих «пептидные пулы», и роль их далеко не балластная. Эти пулы образуются как из специализированных белков-предшественников, так из белков с иными, своими собственными функциями (ферментов, структурных и транспортных белков и др.).
Во-вторых, состав пептидных пулов устойчиво воспроизводится при нормальных условиях и не обнаруживает индивидуальных отличий. Это значит, что у разных особей пептидóмы мозга, сердца, лёгких, селезёнки и других органов будет примерно совпадать, но между собой эти пулы будут достоверно различаться. У разных видов (по крайней мере, среди млекопитающих) состав аналогичных пулов также весьма схож.
И, наконец, в-третьих, при развитии паталогических процессов, а также в результате стрессов (в том числе, длительного лишения сна) или применения фармакологических препаратов состав пептидных пулов меняется, и иногда довольно сильно. Это может использоваться для диагностики различных патологических состояний, — в частности, такие данные есть для болезней Ходжкина и Альцгеймера.
Точный состав пептидных пулов определить сложно, — прежде всего, потому, что число «участников» существенным образом будет зависеть от концентрации, которую считать значимой. При работе на уровне единиц и десятых долей наномоля (10−9 М) это несколько сотен пептидов, однако при увеличении чувствительности методик до пикомолей (10−12 М) число зашкаливает за десятки тысяч. Считать ли такие «минорные» компоненты за самостоятельных «игроков», или же принять, что они не имеют собственной биологической роли и представляют лишь биохимический «шум» — вопрос открытый.
Пептидные пулы — общая черта живых организмов?
Большинство пионерских работ по пептидомике проведены на тканях животных, и во всех случаях были выявлены пептидные пулы определённого и характерного состава — у человека, быка, крысы, мыши, свиньи, суслика, гидры, дрозофилы, саранчи. Но является ли феномен наличия пептидных пулов общим, например, для растений и прокариот? В случае простейших или бактерий выяснить ситуацию ещё предстоит, но вот для растений, видимо, уже можно дать положительный ответ. В частности, для модельного растения — мха Рhyscomitrella patens, геном которого недавно был расшифрован, — было показано, что на каждой стадии развития (у нитчатой формы, протонемы и на стадии зрелой стадии, гаметофоров) в растении присутствует большое число эндогенных пептидов — фрагментов клеточных белков, набор которых индивидуален для каждой формы растения. (Схема экспериментального анализа пептидов из мха показана на рисунке 2.)
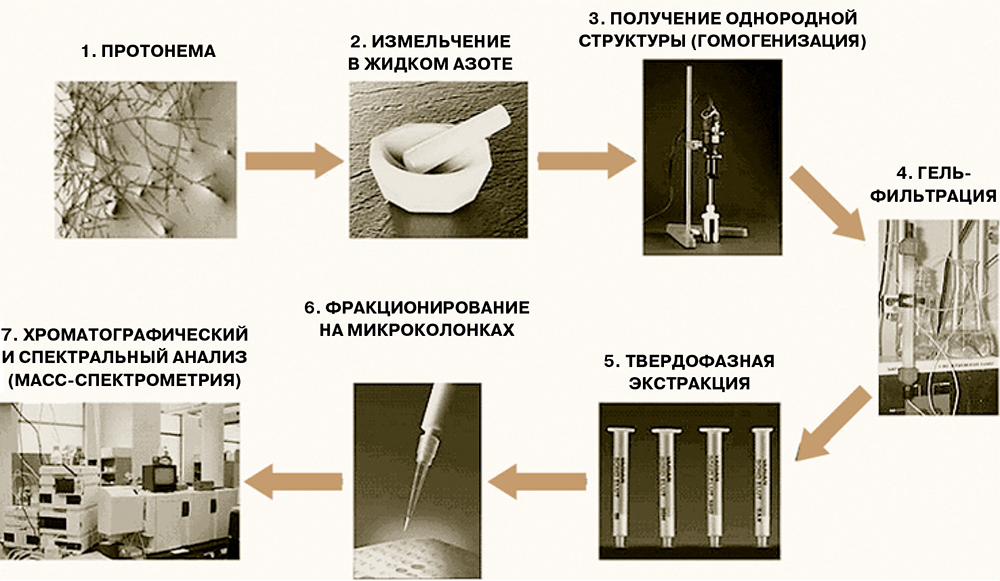
Рисунок 2. Схема анализа пептидов мха
Даже если у прокариот не обнаружится ничего похожего, уже можно сделать вывод, что большое число многоклеточных организмов культивирует внутри себя пептидные «пулы». Но для чего они служат и как образуются?
Пептиды: «теневая» система биорегуляции
Механизм образования пептидных пулов проще всего выяснить на культурах клеток, потому что, в отличие от целых тканей и органов, в этом случае появляется уверенность, что пептиды генерируются именно этим типом клеток, а не каким-то другим (или вообще не являются артефактом выделения из тканей). Наиболее подробно в этом смысле изучены эритроциты человека [10] — клетки тем более интересные, что они лишены ядра, а, следовательно, большинство биохимических процессов в них сильно заторможено.
Установлено, что внутри эритроцитов происходит «нарезание» гемоглобиновых α- и β-цепей на серию крупных фрагментов (всего выделено 37 пептидных фрагментов α-глобина и 15 — β-глобина) и, кроме того, эритроциты выделяют в окружающую среду множество более коротких пептидов (рисунок 3). Пептидные пулы образуются и другими культурами клеток (трансформированными миеломоноцитами, клетками эритролейкемии человека и др.), т. е. продукция пептидов культурами клеток — широко распространённый феномен. В большинстве тканей 30–90% всех идентифицированных пептидов являются фрагментами гемоглобина, однако идентифицированы и другие белки, порождающие «каскады» эндогенных пептидов, — альбумин, миелин, иммуноглобулины и др. Для части «теневых» пептидов предшественников пока не найдено.
Даже беглый взгляд на перечень пептидных фрагментов гемоглобина (рис. 3) приводит к выводу, что разнообразие эндогенных пептидов значительно превосходит традиционный набор пептидных гормонов, нейромодуляторов и антибиотиков. Несмотря на множество разрозненных данных об активности отдельных компонентов пептидных пулов, ключевой вопрос о биологической роли пептидных пулов в целом оставался не решённым. Представляет ли основная масса пептидов в пулах просто нейтральные промежуточные продукты разрушения белковых субстратов на пути к аминокислотам, вновь используемым для ресинтеза белков, или эти пептиды играют самостоятельную биологическую роль?
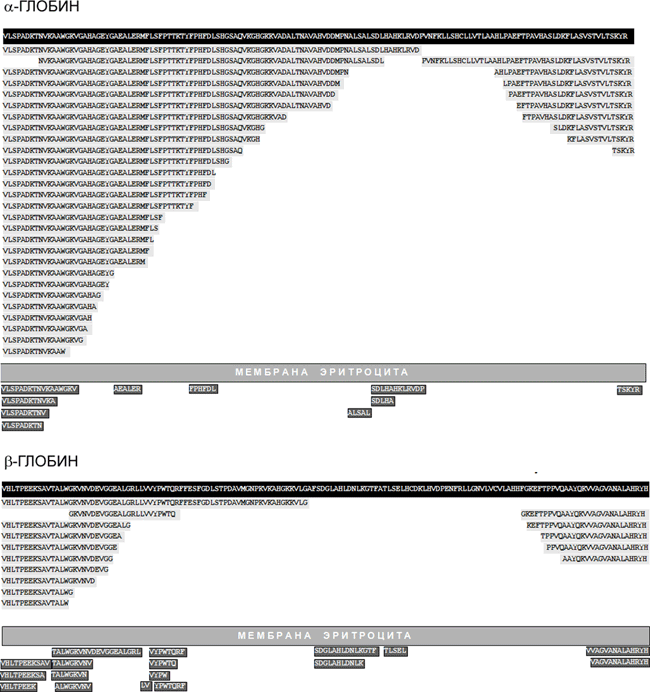
Рисунок 3. Образование пептидов в культуре эритроцитов человека. На чёрном фоне показаны аминокислотные последовательности α- и β-глобина, а на сером — последовательности пептидов, идентифицированных как фрагменты этих белков.
Для ответа на этот вопрос было изучено действие более 300 пептидов — компонентов пептидных пулов тканей млекопитающих — на набор культур опухолевых и нормальных клеток. В результате оказалось, что более 75% этих пептидов оказывают выраженное пролиферативное или антипролиферативное действие хотя бы на одну культуру (то есть, ускоряют или замедляют деление клеток) [11]. Были обнаружены и другие виды биологической активности, более или менее пересекающиеся с активностями гормонов, парагормонов и нейротрансмиттеров. В результате ряда таких работ было сделано несколько выводов:
- компоненты пептидóма участвуют в регуляции нервной, иммунной, эндокринной и других систем организма, причём их действие можно рассматривать как комплексное, — то есть, осуществляемое сразу всем ансамблем пептидов;
- пептидный пул в целом регулирует долговременные процессы («долго» для биохимии — это часы, дни и недели), отвечает за поддержание гомеостаза и регулирует пролиферацию, гибель и дифференцировку составляющих ткань клеток.
По-видимому, один из главных механизмов действия коротких биологических пептидов — работа через рецепторы хорошо известных пептидных нейрогормонов. Сродство «теневых» пептидов к рецепторам очень низкое — в десятки или даже тысячи раз ниже, чем у их «основных» лигандов, но нужно принимать во внимание и тот факт, что концентрация «теневых» пептидов примерно в такое же число раз выше. В результате оказываемый ими эффект может иметь ту же величину, а, учитывая широкий «биологический спектр» пептидного пула, можно сделать вывод об их важности в регуляторных процессах.
В качестве примера действия через «не свои» рецепторы можно привести геморфины — фрагменты гемоглобина, которые действуют на опиоидные рецепторы, аналогично «эндогенным опиатам» — энкефалину и эндорфину. Доказывается это стандартным для биохимии способом: добавление налоксона — антагониста опиоидных рецепторов, используемого в качестве антидота при передозировке морфина, героина или других наркотических анальгетиков, — блокирует действие геморфинов, что и подтверждает их взаимодействие с опиоидными рецепторами.
В то же время, мишени действия большинства «теневых» пептидов неизвестны. По предварительным данным, некоторые из них могут влиять на работу рецепторных каскадов и даже участвовать в «управляемой гибели» клетки — апоптозе.
Кстати, фрагменты более крупных белков, обладающие своей собственной функцией, никак не связанной с функцией «родителя», получили название криптеинов («спрятанные» белки). Криптеины сейчас довольно активно изучаются и выявляются в последовательностях «не секретных» белков в надежде обнаружить у них особые биологические (например, лекарственные) свойства.
Полифункциональный и полиспецифичный «биохимический буфер», который образует пептидный пул, «смягчая» метаболические колебания, позволяет говорить о новой, ранее неизвестной системе регуляции на основе пептидов (см. таблицу 1). Этот механизм дополняет всем известные нервную и эндокринную системы, поддерживая в организме своеобразный гомеостаз и устанавливая равновесие между ростом, дифференцировкой, восстановлением и гибелью клеток. Изменение пептидного «фона» почти наверняка обратит внимание на протекающий патологический процесс, а восстанавливающее и стимулирующее действие многих пептидных веществ, видимо, можно объяснить как раз восстановлением нарушенного равновесия.
Учитывая сказанное, можно даже высказать предположение, что пептидная биорегуляторная система является эволюционным предшественником более совершенных и современных нервной и эндокринной систем. Эффекты, оказываемые пептидным «фоном», могут проявляться уже на уровне отдельной клетки, в то время как невозможно себе представить работу нервной или эндокринной системы в одноклеточном организме.
| Свойство | |||
|---|---|---|---|
| Нервная | Эндокринная / паракринная | Тканеспецифичные пептидные пулы | |
| «Рабочее тело» | Нейротрансмиттеры | Гормоны | Пептиды — фрагменты функциональных белков |
| Предшественник | Специфический белковый предшественник | Специфический белковый предшественник | Функциональные белки |
| «Порождающий» процесс | Сайт-специфическое расщепление | Сайт-специфическое расщепление | Действие набора клеточных протеаз |
| Концентрация (нМ/г ткани) | 0,001–1.0 | 0,001–1.0 | 0,1–100 |
| Тип регуляции | Синаптическая секреция | Внеклеточная секреция | Изменение концентрации в ткани |
| Механизм действия | Связывание с рецепторами синаптической мембраны | Связывание с рецепторами клеточной мембраны | Связывание с рецепторами «родственных» гормонов |
| Константа связывания с рецептором (Kd, нМ) | 1–1000 | 0,1–10 | 100–10000 |
| Период активности | Секунды–минуты | Минуты–часы | Часы–дни |
| Биологическая роль | Передача нервного импульса | Регуляция физиологических процессов в ткани или всём организме | Поддержание тканевого гомеостаза |
Будущие приложения пептидомики
Лекарственные препараты, по существу являющиеся вариациями на тему пептидных пулов различных тканей животных, уже достаточно широко представлены на рынке (таблица 2), хотя они и не входят в число «блокбастеров», приносящих концернам максимальные барыши. Основная область их применения — состояния, связанные с дегенерацией или трансформацией клеток и тканей, а также необходимостью регенерации (заживления ран). Однако такие препараты не являются чистыми химическими веществами, а, следовательно, не удовлетворяют требованиям современной доказательной молекулярной медицины. (Дело в том, что современные фармакологические стандарты — такие как Good Clinical Practice — подразумевают проведение клинических испытаний, в которых совершенно чётко было бы доказано действие того или иного лекарственного компонента.)
| Препарат | Источник | Показание |
|---|---|---|
| Солкосерил (Швейцария) | Депротеинизированный гемодериват из телячьей крови | Заживление ран, трансплантация, ишемия |
| Актовегин (Дания) | Пептиды плазмы крови | Заживление ран, трансплантация, ишемия |
| Вирулизин (Канада) | Экстракт желчного пузыря крупного рогатого скота | Иммунодефициты, онкология |
| Тимулин (Россия) | Экстракт тимуса крупного рогатого скота | Иммунодефициты |
| Церебролизин (Австрия), Кортексин (Россия) | Экстракт головного мозга крупного рогатого скота/свиньи | Инсульт, болезнь Альцгеймера |
| Раверон (Швейцария) Простатилен (Россия) | Экстракт предстательной железы крупного рогатого скота | Простатит, аденома предстательной железы |
Одно из перспективных направлений здесь — использование упоминавшейся уже антипролиферативной активности пептидов. Так, в опытах на карциноме молочной железы мышей один из фрагментов гемоглобина (так называемый VV-геморфин-5) удваивал выживаемость животных при совместном применении со стандартным цитостатиком эпирубицином по сравнению с применением одного только эпирубицина [12] (рис. 4). Этот эксперимент даёт основания полагать, что на основе природных пептидных пулов возможно создание вспомогательных и поддерживающих препаратов для онкологической терапии.
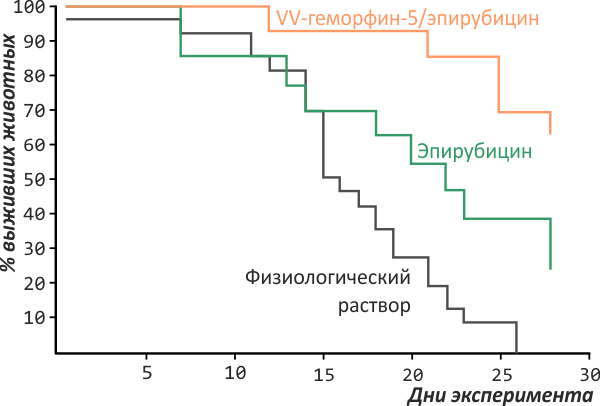
Рисунок 4. Средняя продолжительность жизни мышей с карциномой молочной железы при интраперитонеальном введении эпирубицина и комбинированной терапии эпирубицином с VV-геморфином-5. Выживаемость во втором случае была выше в два раза.
Однако разработка и тестирование новых лекарств — чрезвычайно долгий и затратный процесс, осложняемый конкурентной борьбой фармацевтических гигантов [13]. Более близкая перспектива использования пептидных пулов — это диагностика заболеваний и прочих патологических состояний. Выше уже не раз было сказано, что пептидный состав образца сильно зависит от состояния, в котором находился организм — донор ткани. Уже есть примеры использования пептидомного подхода для выявления маркеров тех или иных заболеваний, в том числе — онкологических.
В Институте биоорганической химии разработана методика масс-спектрометрического анализа пептидного профиля образцов крови и выявлены статистически достоверные различия, по которым можно диагностировать рак яичников, колоректальный рак или сифилис (рис. 5). Масс-спектр, отражающий состав пептидного пула образца тканей, в случае больного человека будет иметь характерные отличия, по которым исследователи — а в перспективе и врачи — смогут ставить точный диагноз.
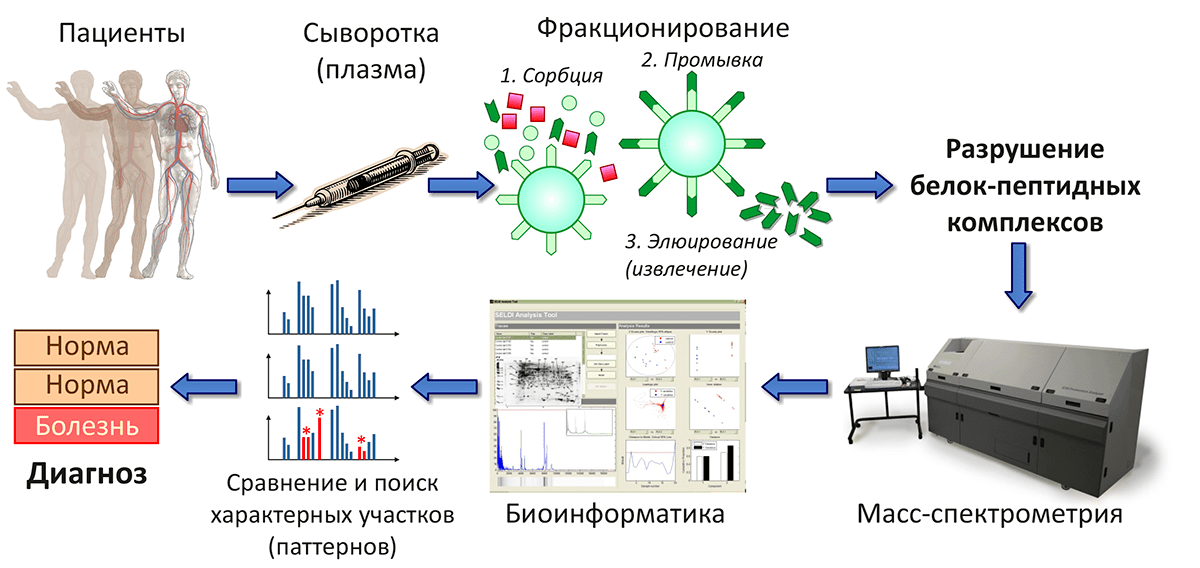
Рисунок 5. Медицинская диагностика на основе пептидного профилирования образцов крови. Сочетание масс-спектрометрических и биоинформатических методов позволяет выявить различия между пептидным составом крови больных и здоровых пациентов.
Эти примеры не оставляют сомнения, что «теневые» пептиды из тканевых пулов хранят массу практически полезной информации — от диагностики до лечения социально-значимых заболеваний.
Статья написана с использованием материалов и иллюстраций, любезно предоставленных В.Т. Ивановым. Упрощённая версия этой статьи была первоначально опубликована в журнале «Наука и жизнь» [14]; в 2011 году она заняла первое место в конкурсе научно-популярных статей «Наука — это понятно!», проводимом Советом молодых ученых РАН.
Литература
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- M.M. Shemyakin, N.A. Aldanova, E.I. Vinogradova, M.Yu. Feigina. (1963). The structure and total synthesis of valinomycin. Tetrahedron Letters. 4, 1921-1925;
- V.T. Ivanov, I.A. Laine, N.D. Abdulaev, L.B. Senyavina, E.M. Popov, et. al.. (1969). The physicochemical basis of the functioning of biological membranes: The conformation of valinomycin and its K+ complex in solution. Biochemical and Biophysical Research Communications. 34, 803-811;
- Чирков Ю. (2010). Молекулярные контейнеры. «Наука и жизнь». 7;
- Sameer Varma, Dubravko Sabo, Susan B. Rempe. (2008). K+/Na+ Selectivity in K Channels and Valinomycin: Over-coordination Versus Cavity-size constraints. Journal of Molecular Biology. 376, 13-22;
- Иванов В.Т., Андронова Т.М., Несмеянов В.А., Пинегин Б.В., Леджер Р., Бомфорд Р., Хаитов Р.М. (1997). Механизм действия и клиническая эффективность иммуномодулятора глюкозаминилмурамилдипептида (Ликопида). «Клиническая медицина». 3, 11–15;
- Геном человека: как это было и как это будет;
- Миллиард на протеомику;
- Andrei A Karelin, Elena Yu Blishchenko, Vadim T Ivanov. (1998). A novel system of peptidergic regulation. FEBS Letters. 428, 7-12;
- Vadim T. Ivanov, Andrei A. Karelin, Oleg N. Yatskin. (2005). Generation of peptides by human erythrocytes: Facts and artifacts. Biopolymers. 80, 332-346;
- Vadim T Ivanov, Oleg N Yatskin. (2005). Peptidomics: a logical sequel to proteomics. Expert Review of Proteomics. 2, 463-473;
- Elena Yu. Blishchenko, Olga V. Sazonova, Olga A. Kalinina, Ekaterina V. Moiseeva, Arpad A. Vass, et. al.. (2005). Antitumor effect of valorphin in vitro and in vivo: Combined action with cytostatic drugs. Cancer Biology & Therapy. 4, 125-131;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Чугунов А.О. (2010). Неизвестные пептиды. «Наука и жизнь». 10, 26–31.






