
Еще раз про ГМО
02 ноября 2016
Еще раз про ГМО
- 5736
- 0
- 9
Художественное представление того, как генные инженеры редактируют геном.
сайт prepareforchange.net
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Пожалуй, трудно придумать еще одну биологическую проблему, которую бы так активно обсуждали в СМИ, вагоне метро и очереди за батоном. ГМО. Эти три буквы, увы, пугают и вызывают недоверие. Хочется еще раз расставить все точки над «ё» и разобраться в том, зачем нужны ГМО, каковы плюсы современных генно-инженерных технологий и с какими трудностями и мерами предосторожности они связаны.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Юрий Викторович Лошкарев.
Что такое ГМО?
Итак, сайт «Википедия» дает следующее определение ГМО: «ГМО (генетически модифицированный организм) — организм, генотип которого был искусственно изменен при помощи методов генной инженерии. Это определение может применяться для растений, животных и микроорганизмов. Генетические изменения, как правило, производятся в научных или хозяйственных целях. Генетическая модификация отличается целенаправленным изменением генотипа организма в отличие от случайного, характерного для естественного и искусственного мутационного процесса».
Стόит сказать пару слов о том, с чего началась история ГМО. 1973 год можно считать годом рождения генной инженерии. Тогда в лаборатории Стэнли Нормана Коэна научились «комбинировать и трансплантировать» гены: в клетки E. coli начали вводить рекомбинантные кольцевые ДНК (плазмиды) [1]. Эти эксперименты показали, что определенные гены, включенные в плазмиду, можно запросто доставить в другой организм, где они будут работать. Но использовать эту технологию в медицине и сельском хозяйстве стали далеко не сразу: первый рекомбинантный препарат появился в 1982 году, а первая сельскохозяйственная культура — в 1992. Почему же к этой технологии отнеслись с такой осторожностью?
Научный журналист Ася Казанцева пишет в своей книге «В интернете кто-то не прав»: «Слышали ли вы когда-нибудь, чтобы производители мобильных телефонов или газированных напитков проводили научные конференции, посвященные тому, что мобильные телефоны или газированные напитки могут быть опасны? А создатели ГМО с этого начали». Дело в том, что в 1975 году в Калифорнии прошла Асиломарская конференция, на которой ученые совместно с представителями общественности обсуждали возможные риски, связанные с рекомбинантными ДНК и их хозяевами. В итоге был принят свод правил, регламентирующих работу с генетическими конструкциями разного происхождения. В частности, генным инженерам предписывалось по максимуму использовать биологические барьеры, предотвращающие распространение рекомбинантных ДНК за пределами популяций их лабораторных хозяев, а заодно и соблюдать меры предосторожности, утвержденные для работы с патогенами. Эти предписания и вообще вынос дискуссии за пределы научной среды в определенной мере создали преграды на пути развития генной инженерии [2].
Рецепты от матушки-природы
На самом деле, мы не первые, кто придумал ГМО. Существуют и природные генные инженеры — например, Agrobacterium tumefaciens (ныне — Rhizobium radiobacter). Дело в том, что у этой бактерии есть своя кольцевая ДНК, Ti-плазмида (от tumor-inducing — онкогенная), особый участок которой — Т-ДНК (от transfer DNA — переносимая ДНК) — может встраиваться в геном растений, вызывая бурное деление клеток корня и формирование опухолей — корончатых галлов, выделяющих ценные для бактерии-паразита питательные вещества, опины. Помимо Т-ДНК, Ti-плазмида содержит гены, кодирующие белки, которые образуют канал между бактерией и растением для протаскивания в растительную клетку Т-ДНК. Сама же бактерия и ее огромная (>200 т.п.н.) Тi-плазмида внутрь клетки не проникают. Так растительная клетка, ничего не подозревая, включает в свой геном фрагмент чужеродной ДНК, а затем клетка делится и передает Т-ДНК по наследству своим потомкам.
Как известно, лень — двигатель прогресса. Зачем выдумывать велосипед, когда есть готовая природная генная конструкция. Биотехнологи берут плазмиду A. tumefaciens, вырезают из нее онкогены и вставляют нужные им (целевые) последовательности. Обманутая бактерия добросовестно встраивает модифицированную T-ДНК в растительную клетку и ждет, что та начнет делиться и производить опины. Но вместо этого растение производит то, что нужно человеку. Например, с помощью такого «коварного» подхода удалось получить устойчивую к засухе кукурузу MON87460. В эту кукурузу был введен ген cspB, отвечающий за производство белка, который стимулирует транскрипцию генов, необходимых для преодоления стрессов (засухи в частности), а главное — играет роль РНК-шаперона, облегчающего синтез белков путем «распутывания» мешающих вторичных структур РНК. Потребителю же должно быть приятно то, что по вкусу трансгенные кукурузные початки никак не отличаются от обычных [2]. История жестокого обмана бактерии отражена на рисунке 1.
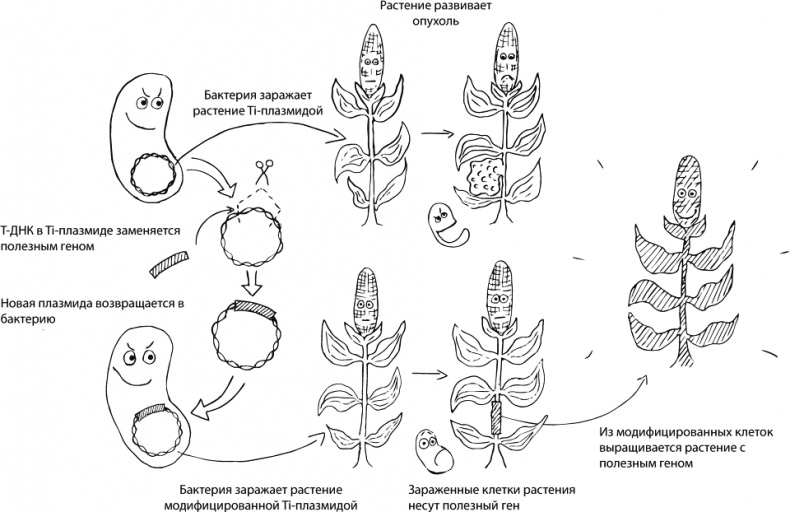
Рисунок 1. Как ученые обманывают Agrobacterium tumefaciens. Описание дано в тексте статьи.
Главный недостаток так называемой агробактериальной трансформации — невозможность контролировать, в какое именно место растительной ДНК встроится новая конструкция. Но сейчас появилась новая технология, позволяющая контролировать этот процесс, — CRISPR/Cas9, — и на ней обязательно нужно остановиться.
CRISPR/Cas9. По образу и подобию хромосомному
Это одна из самых модных технологий, позволяющих редактировать геном «в режиме онлайн». Интересно то, что эту систему мы тоже позаимствовали у бактерий. Скажем несколько слов об истории ее открытия.
В 1987 году японские ученые обнаружили в геномах бактерий участки с регулярной структурой — короткие одинаковые последовательности чередовались с уникальными фрагментами, которые у разных бактерий даже одного вида не имели ничего общего. Такие участки назвали CRISPR (clustered regularly interspaced short palindromic repeats) [3]. Оказалось, что система CRISPR, как это ни удивительно, играет у бактерий роль приобретенного иммунитета. Если в бактерию проникает вирус (фаг), она вырезает фрагмент вирусной ДНК и встраивает его в собственный геном, а именно — в CRISPR-локус. Так формируются спейсер, а заодно — и очередной повтор, отделяющий новый спейсер от предыдущего. По спейсеру бактерия затем строит РНК-зонд (по-научному — РНК-гид), соединяющийся с Cas-белком и плавающий в клетке в поисках комплементарных нуклеиновых кислот (протоспейсеров). В том случае, если таковые найдены, то есть снова вторгся тот же фаг, начинает работать белок-ножницы Cas — эндонуклеаза, которая разрезает распознанные последовательности, а следовательно, блокирует размножение вируса [2]. Иными словами — если бактерия повторно встретится с вирусом, фрагмент которого встроен в ее геном, она будет устойчива к этой инфекции.
Наиболее просто из систем CRISPR/Cas устроены системы II типа, где эффекторным (уничтожающим мишень) белком служит Cas9 (рис. 2). Такой механизм характерен, например, для бактерии Streptococcus pyogenes. В бактериальном иммунном контроле обычно помимо Cas-эффекторов задействованы «патрульные» белки Cas1 и Cas2, которые в комплексе распознают нарушителя клеточных границ и интегрируют его фрагмент в самое начало (ближе к промотору) CRISPR-локуса — «на память». В системах II типа Cas9, видимо, участвует и в процессе приобретения спейсеров, помогая Cas1/Cas2 выбрать наиболее подходящие фрагменты [4].
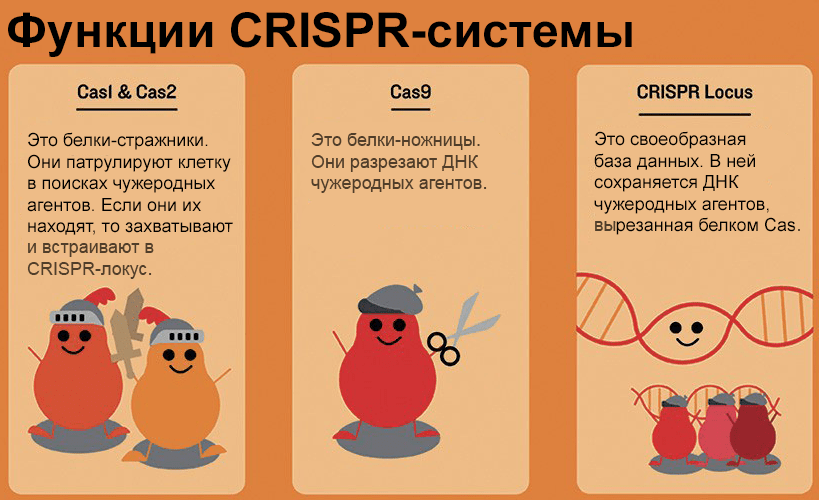
Рисунок 2. Упрощенное представление функций компонентов системы CRISPR. Описание дано в тексте статьи.
сайт dailycal.org, рисунок адаптирован
Из вышесказанного становится ясно, почему иммунитет CRISPR адаптивный: он совершенствуется и учится противостоять новым типам инфекции. Это подчеркивается еще и снижением эффективности спейсеров по мере их удаления от промотора CRISPR-локуса: если многие поколения бактерий давно не сталкивались с тем или иным агентом, снижается «напряженность иммунитета» к нему. CRISPR — это интересный пример эволюции по Ламарку: события жизни организма непосредственно влияют на его ДНК, изменяя ее так, что организм становится более приспособленным [3].
Рассмотрим на конкретном примере, как бактерии борются с вирусами. Вот, например, бактерия Streptococcus thermophilus используется для получения молочнокислых продуктов, но, к сожалению, она страдает от различных вирусных инфекций. Не случайно именно на этом модельном организме провели ключевые эксперименты по уточнению функции CRISPR-систем. Если живую культуру S. thermophilus заражали бактериофагами, то большинство бактерий погибало, но очень небольшая часть выживала. Чем же выжившие отличались от изначальной культуры? Оказалось, что их геном стал длиннее на 0,01% за счет того, что в CRISPR-последовательность добавились 1–4 новых фрагмента (спейсера). При повторном заражении этой культуры теми же вирусами все клоны выживали. Как будто, переболев вирусной инфекцией, бактерия стала немного опытнее и записала себе в «медицинскую карту» что-то важное об этом вирусе, и такая инфекция ей теперь не страшна. Если же ученые специально вырезали из вирусного генома небольшие фрагменты и вставляли их в виде новых спейсеров, то клетка оказывалась невосприимчивой к исходному вирусу, даже если никогда раньше с ним не встречалась.
Эта серия простых и изящных экспериментов на S. thermophilus полностью подтвердила гипотезу об иммунной функции CRISPR-систем. Благодаря полярной манере включения новых спейсеров, CRISPR-кассеты можно буквально читать как историю взаимоотношений прокариот и их паразитов в определенном эволюционном промежутке. CRISPR — это не только иммунитет, но еще и память о недавних победах прокариотической клетки [5].
Какую же практическую пользу из этой системы смог извлечь человек? Как вообще она работает в клетках эукариот? Если просто запустить CRISPR/Cas9 в клетку, эта система разрежет обе цепи ДНК в месте, которое укажет специально сконструированный РНК-гид, но разрез залатают обычные клеточные репарационные машины — путем негомологичного соединения концов (non-homologous end joining, NHEJ) либо гомологичной рекомбинации — если есть матрица с флангами, комплементарными участкам ДНК с двух сторон от разрыва, произойдет «заштопывание по шаблону». Это означает, что в зависимости от целей человека можно устроить в нужном месте делецию — «выключить» проблемную область генома — или «подставить» матрицу с нужными свойствами, чтобы просто заместить, например, мутантный, патологический вариант гена нормальным.
MCR, «за» и «против»

Рисунок 3. История мораториев в биологии. В 1975 году был введен мораторий на исследования рекомбинантных ДНК, в 1997 — на клонирование человека, в 2012 — на эксперименты по изменению свойств (вирулентности) вируса «птичьего» гриппа.
И это еще не всё. Можно сделать так, чтобы клетка «починенную» хромосому воспринимала как образец для ремонта второй хромосомы. В 2015 году ученые из Калифорнийского университета для апробации метода в качестве «заплатки» использовали саму кассету CRISPR/Cas9, которая затем экспрессировалась X-хромосомой мух и модифицировала гомологичную хромосому. В итоге потомству передавались уже измененные хромосомы, и инсерция CRISPR/Cas9 из поколения в поколение «саморазмножалась», замещая нормальные аллели. Этот метод получил название «мутагенная цепная реакция» (mutagene chain reaction, MCR) [6].
В том же году Лианг и соавторы провели работу на триплоидных (заведомо нежизнеспособных) эмбрионах с бета-талассемией. Из 86 CRISPR-отредактированных эмбрионов только 71 продолжил развиваться, и только у четырех из них ген был отредактирован правильно [7]. Эта статья вызвала настоящий взрыв споров на тему того, насколько вообще этично проводить такие исследования.
В Nature Эдвард Ланфир, один из исследователей ZF-нуклеаз (белков-ножниц, содержащих ДНК-связывающий домен «цинковые пальцы»), и его коллеги призвали к мораторию на любые эксперименты, касающиеся редактирования генов эмбрионов человека или половых клеток: «Стоит ли испытывать судьбу, даже если будет заметен терапевтический эффект от модификации зародышевых клеток? Мы готовы вступить в открытую дискуссию на тему дальнейших исследований в этой области». К слову, в биологии уже написана целая история мораториев на различные исследования (рис. 3). Но вернемся к CRISPR. Некоторое время спустя группа ученых выступила с предложением избегать попыток модификации клеток зародышевой линии человека, но поддержала идею работы с клетками человека в том случае, если они не участвуют в развитии и поддержании беременности (например, соматических клеток) [8].
Теперь стόит затронуть перспективы использования этой технологии. MCR может позволить, например, создать комаров, неспособных переносить малярию и лихорадку Денге. Появится возможность быстро выводить линии мышей со множественными мутациями для лабораторных исследований и не тратить время на тщательный скрининг [6]. Помимо этого, есть работы по тестированию CRISPR/Cas9 на мышах с целью лечения миодистрофии Дюшенна [9]. Тем не менее существуют опасения, что мы просто не знаем о возможных побочных эффектах таких изменений половых и эмбриональных клеток, в связи с чем и был предложен мораторий.
Почему ГМО полезны?
Ограничимся некоторыми яркими прикладными примерами, имеющими отношение к экологии, питанию и материалам.
«Эко-свинка»
На первый взгляд может показаться, что между свиньями, фосфором и экологическими катастрофами нет ничего общего. Но это не так. Существует серьезная сельскохозяйственная проблема: свиньи не могут усваивать большую часть фосфора в комбикормах, так как он представлен в форме фитатов, солей фитиновой кислоты. Неусвоенный фосфор в составе свиного навоза в конце концов попадает в водоемы, в которых начинается бурное размножение водорослей — они-то с радостью едят фитаты. Из-за токсичных продуктов обмена водорослей погибают рыбы и другие водные организмы. В общем, катастрофа. Но генные инженеры предложили проект «Эко-свинка». К сожалению, он пока так и остался проектом, не вышедшим на рынок. Но идея очень красивая. Речь идет о генетически модифицированных свиньях, способных усваивать фитаты. Идея заключалась в том, чтобы встроить в геном свиней ген, который кодирует фермент, необходимый для расщепления фитатов (а взять его можно у той же E. coli) [10]. Будем надеяться, что когда-нибудь ученые облегчат свиньям жизнь :-)
Стальная коза, трансгенный хлопок, суперсладость и кошерный сыр
А теперь рассмотрим примеры полезных ГМО, никак не связанные между собой: просто они красивые, и захотелось о них рассказать. В 2002 году в Science появилась статья о том, что генетически модифицированные клетки млекопитающих могут производить паутину. Канадская фирма Neхia вывела коз, в геном которых был встроен ген белка паутины. Оказалось, что молоко таких коз можно использовать для получения биостали, которая даже прочнее кевлара — материала, из которого делают современные бронежилеты [10].
Но генная инженерия помогает создавать не только новые материалы, но и успешно выращивать старые. Еще 1997 году в Китае приступили к выращиванию генно-модифицированного хлопчатника, снабженного гéном бактерии Bacillus thuringiensis. Белок Cry1Ac, кодируемый этим геном, токсичен только для гусениц некоторых бабочек и, по-видимому, безвреден для всех остальных животных, включая человека. Это привело к снижению численности популяции хлопковой совки — опасного вредителя многих сельскохозяйственных культур. В результате в выигрыше оказались не только производители хлопка, но и крестьяне, выращивающие сою, кукурузу, арахис и различные овощи [11].
Что касается сладкого, то существует такое растение, как Thaumatococcus daniellii, и у него есть ген, кодирующий белок тауматин, который в тысячи раз слаще сахара! Сейчас ведутся работы по созданию микроорганизмов и растений, производящих этот белок. Помимо сладости, тауматин увеличивает устойчивость растений к ряду инфекций [10].
Ну и напоследок — про кошерный сыр. Известно, что для приготовления обычного сыра ранее использовался фермент, выделяемый из сычуга — одного из отделов пищеварительного тракта жвачных животных. Но теперь биотехнологи встроили гены сычужных ферментов в геном бактерий, предоставив возможность получать кошерный сыр. Кажется, это редкий пример сотрудничества науки и религии [10].
Меры предосторожности
С одной стороны, приведенные выше примеры полезности ГМО — «песчинка как в морских волнах, как мала искра в вечном льде». Но с другой стороны, у любой технологии есть свои проблемы, связанные с вопросами этики и безопасности. Выше уже шла речь о моратории на использование CRISPR/Cas9 в отношении человеческих эмбрионов. В экспериментах на обезьянах показано, что из десяти отредактированных с помощью этой системы эмбрионов рождается, увы, не больше половины [8]. Что касается использования ГМО, то здесь больше всего опасаются реакций на продукт, которые не всегда возможно предусмотреть. Например, в 1992 году селекционная компания Pioneer разработала ГМ-сою, добавив в нее ген бразильского ореха и тем самым устранив в сое природный дефицит аминокислоты метионина. Такие бобы были предназначены в первую очередь для тех людей, для кого соя — основной продукт питания. Но вскоре оказалось, что у небольшого процента людей бразильский орех вызывает аллергию. Соответственно, и такая ГМ-соя тоже может вызывать аллергию [12].
Вышеперечисленные факты не умаляют достоинства генных технологий, а говорят о том, что любой метод требует грамотного и аккуратного использования. Поэтому хотелось бы закончить статью словами молекулярного генетика Джорджа Чёрча из Гарвардской медицинской школы в Бостоне, считающего, что de facto мораторий стόит налагать на все технологии, пока не доказана их безопасность: «Задача заключается в доказательстве того, что пользы в технологии больше, чем риска» [8].
Литература
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Казанцева А. В интернете кто-то неправ! М.: CORPUS, 2016. — 376 с.;
- Найдены системы CRISPR, использующие обратную транскрипцию;
- Heler R., Samai P., Modell J.W., Weiner C., Goldberg G.W., Bikard D., Marraffini L.A. (2015). Cas9 specifies functional viral targets during CRISPR-Cas adaptation. Nature. 519 (7542), 199–202;
- CRISPR-системы: иммунизация прокариот;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Liang P., Xu Y., Zhang X., Ding C., Huang R., Zhang Z. et al. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6, 363–372;
- Vogel G. (2015). Embryo engineering alarm. Science. 347, 1301–1301;
- Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик;
- Панчин А. Сумма биотехнологии. М.: CORPUS, 2016. — 432 с.;
- Элементы: «Трансгенный хлопок помог китайским крестьянам победить опасного вредителя»;
- Мэтт Р. Геном. Автобиография вида в 23 главах. М.: ЭКСМО, 2015. — 432 с.







