
Неоконченная история галектина-3
30 сентября 2016
Неоконченная история галектина-3
- 1639
- 3
- 0
Возможности галектина-3 безграничны?
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: После окончания университета мне больше всего хотелось заниматься разработкой новых лекарств. Несмотря на то, что это сложно. И долго. И дорого. Мне очень повезло: я попала в инновационную компанию «Антерикс» (г. Пущино), и мне поручили работать над поиском антител против галектина-3. Так я познакомилась с этой неординарной биомолекулой, которая, с одной стороны, чрезвычайно важна для жизни каждого из нас, а с другой — способна натворить больших бед.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2016.

Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Что такое галектин-3?
Существование многоклеточных организмов возможно благодаря способности клеток делиться и дифференцироваться — получать «профессию». То есть становиться нервной, мышечной, железистой или любой другой. Непросто содержать в порядке сложную систему из множества клеток. Для этого нужна уйма сигнальных веществ и метаболических путей. Но иногда отлаженный механизм регуляции в клеточном мегаполисе сбивается. Так возникает болезнь.
Например, из-под надзора иммунной системы ускользнула раковая клетка. Она поторопилась поделиться, образовала опухоль и задумалась: а не пора ли попутешествовать? И вот от нее отделились и уплыли по кровотоку несколько клеток. Теперь главная их задача — зацепиться за стенку сосуда, чтобы дать начало метастазу. Часто им в этом помогает белок галектин-3.
Его название говорит о том, что перед нами белок-лектин, который среди всего прочего предпочитает сахар галактозу. Все лектины умеют связывать углеводы, а это открывает им широкие возможности для функционирования. Дело в том, что углеводы в живых организмах выступают не только «топливом» для получения энергии, но и входят в состав воспринимающей части многих рецепторов. Напомню, что рецептор — это молекула-«антенна» на поверхности или внутри клетки. Связавшись с лигандом (сигнальной молекулой), она изменяет свою конфигурацию, тем самым сообщая клетке, что что-то произошло [1].
О том, как с помощью лектинов можно бороться с раком, подробно рассказывается в статье «Лектины — новые инструменты в диагностике и терапии злокачественных опухолей» [2]. — Ред.
Поверхности клеток и кровеносных сосудов выстланы разными углеводными остатками, как густым ковром. Лектины участвуют в клеточном распознавании, могут вызывать агглютинацию (слипание) клеток, влияют на работу иммунной системы [3]. Еще бы! Ведь она распознает не столько сами бактерии, сколько их углеводные оболочки [4].
Галектин-3 — небольшой белок. Его молекулярная масса всего 27 кДа, и он состоит из одной полипептидной цепи [5]. А еще он буквально вездесущ. За двадцать лет, в течение которых он известен ученым, его обнаружили во многих клетках, причем как в ядре, так и в цитоплазме, в сыворотке крови и внеклеточном пространстве множества органов [6].
В норме галектин-3 принимает участие в процессах клеточного самоубийства (апоптоза), активации клеток и прилипания их друг к другу (адгезии). Разберемся, как ему это удается. Следует начать с того, что все галектины имеют углеводсвязывающий домен. У разных членов семейства он различается незначительно. Галектины могут состоять из одного такого домена или двух, связанных между собой небольшим линкером [7]. Но галектин-3 отличается от всех прочих тем, что при одном углеводсвязывающем домене он способен мультимеризоваться — объединяться в структуру из пяти углеводсвязывающих доменов [8]. Мультимеризация происходит, если галектин-3 связывается с лигандом. А значит, он может действовать как «клей», объединяющий вместе несколько клеток (рис. 1).
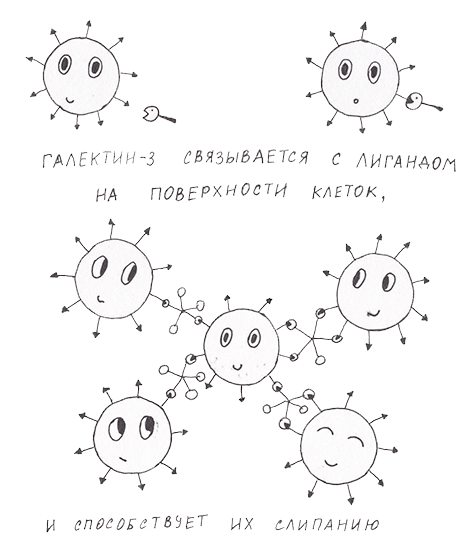
Рисунок 1. Галкетин-3 связывается с лигандом на поверхности клетки, пентамеризуется и вызывает адгезию
рисунок автора статьи
Легче всего найти галектин-3 там, где высока вероятность встречи с инфекцией: в слизистых оболочках и выстилке внутренних органов. Но самое главное — его могут производить клетки, вовлеченные в иммунный ответ. Например, нейтрофилы, которые составляют основную часть всех лейкоцитов крови [9], базофилы и тучные клетки, которые могут запускать аллергическую реакцию [10], дендритные клетки, показывающие антиген другим участникам иммунного ответа, макрофаги, способные съесть и переварить опасные частицы, и многие другие. Все они на редкость непоседливы и хорошо вооружены. Многие из них способны мигрировать за пределы кровеносных сосудов и при встрече с инфекцией выпускать провоспалительные медиаторы и активные формы кислорода [11], которые растворяют все вокруг. И опять здесь не обходится без галектина-3. Он может активировать продукцию супероксид-аниона у моноцитов [12] и повысить фагоцитарную активность нейтрофилов [13].
Как же одна маленькая молекула объединяет в себе столько функций? Оказалось, что галектин-3 не столько запускает все эти процессы, сколько повышает восприимчивость клеток к привычным для нее сигналам. Дело в том, что клетка постоянно поглощает части собственной мембраны, захватывая при этом множество рецепторов. Этот процесс называется конститутивным эндоцитозом. Предполагается, что галектин-3, связываясь с гликозилированными молекулами на поверхности клетки, образует «решетку», которая, судя по всему, препятствует конститутивному эндоцитозу (рис. 2). Это объясняет, каким образом присутствие внеклеточного галектина-3 заставляет клетки активироваться [14]. Другими словами, на поверхности клеток остается много рецепторов, и они продолжают воспринимать сигналы от своих лигандов.
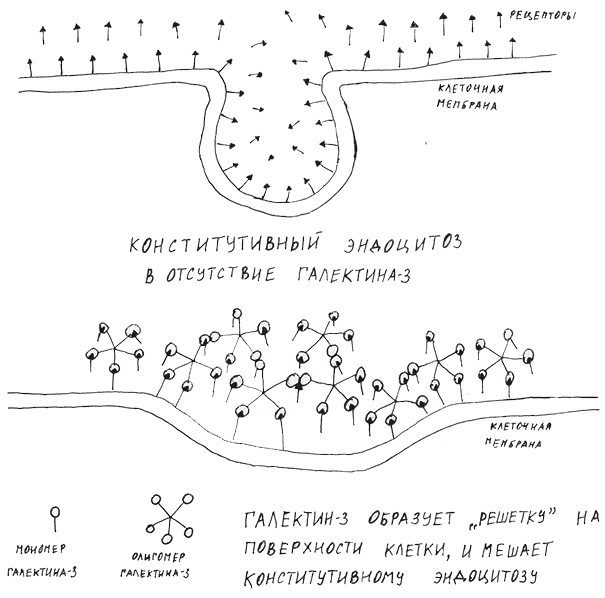
Рисунок 2. Галектин-3 препятствует удалению рецепторов с помощью конститутивного эндоцитоза
рисунок автора статьи
Одной из главных функций апоптоза — клеточного «самоубийства» — является уничтожение мутантных, инфицированных или дефектных клеток. Это довольно сложный процесс. Он включает в себя три фазы: сигнальную, эффекторную и деградационную [15]. Впрочем, с точки зрения участия галектина-3 нас интересует только сигнальная фаза. Она начинается с того, что с рецепторами смерти на поверхности клетки связывается специфический лиганд. Это значит, что клетка получила приказ «умри». С этого момента активируется целый каскад реакций, которые приводят к тому, что в клетке повреждаются митохондрии. Напомню, что митохондрии — это клеточные органеллы, которые производят энергию в виде молекул АТФ. Они чрезвычайно важны для жизнедеятельности, поэтому нарушение их работы влечет за собой клеточную гибель.
Нарушают целостность митохондрий специальные белки — Bax и Bak. Они встраиваются в митохондриальную мембрану, олигомеризуются и нарушают ее целостность [16]. Но пока этого не случилось, у клетки еще есть надежда на спасение. Дело в том, что у Bax и Bak есть антагонисты из их собственного семейства: Bcl-2, Bcl-xL и другие. Это — антиапоптотические белки, то есть те, которые не желают клетке смерти. Они имеют характерную особенность — последовательность из четырех аминокислот: аспарагин-триптофан-глицин-аргинин. Галектин-3 имеет точно такую же последовательность. Более того, у них 28% идентичных и 48% сходных аминокислотных остатков в последовательности [17]. И это не случайно. Есть данные, что галектин-3 предотвращает апоптоз не хуже, чем белки семейства Bcl-2. Точный механизм его действия, к сожалению, еще не выяснен, но уже понятно, что в этот процесс вовлечены многие регуляторные пути. В ответ на апоптотические стимулы галектин-3 поступает в пространство между внутренней и внешней мембранами митохондрий и мешает апоптотическим белкам выполнять свои функции [18].
В чем «виноват» галектин-3?
Итак, галектин-3 «склеивает» клетки между собой, вызывает их активацию и мешает им совершить самоубийство. Поэтому он частый помощник злокачественных опухолей. Так, рак щитовидной железы, простаты, груди и многие другие используют галектин-3 для обеспечения себе усиленного кровоснабжения и облегчения метастазирования. Поэтому опухоль, которая активно «пользуется» галектином-3 как инструментом для выживания и роста, требует более пристального внимания врача [19].
Уже упоминалось, что галектин-3 способен активировать макрофагов. Вообще различают два пути активации макрофагов: классический и альтернативный. Классически активированный макрофаг выделяет активные формы кислорода и провоспалительные цитокины, словом, делает все, чтобы спровоцировать воспаление и нанести как можно больший урон инфекции и зараженной ткани. А альтернативно активированный более дружелюбен: он выделяет противовоспалительные вещества и синтезирует коллаген для заживления ран [20]. Под воздействием галектина-3 макрофаги активируются альтернативно. Казалось бы, вреда от таких гораздо меньше, чем от классически активированных, но при хроническом воспалении этот процесс приводит к фиброзу, то есть к разрастанию соединительной ткани и появлению рубцов.
Фиброз легкого — очень опасное заболевание. Ему подвержены люди с инфекционно-аллергическими заболеваниями или те, кто из-за специфики работы вынужден дышать пылью. Люди с фиброзом легкого испытывают постоянную гипоксию, которая со временем провоцирует сердечную недостаточность, слабость и неспособность вести полноценную жизнь. А самое грустное, что эффективного лечения фиброза легкого на данный момент не существует. Все, что врач может предложить пациенту — кислородная маска, трансплантация легкого или очень дорогое лекарство: «Эсбриет» компании Roche. Механизм действия «Эсбриета» до конца не ясен, и препарат обладает достаточно неприятными побочными эффектами: у каждого десятого пациента наблюдаются тошнота, усталость, диарея и кожные реакции. Чуть менее распространены воспаление мочевого пузыря, боль в груди, одышка и анорексия.
Между тем на животных моделях было показано, что галектин-3 — отличная мишень для лечения фиброза. Крыс с искусственно вызванным фиброзом печени кормили специфическими ингибиторами галектина-3, что позволило не только остановить патологический процесс, но и обратить его вспять [21].
За счет процессов фиброза в сердце галектин-3 участвует в развитии сердечнососудистых заболеваний. В группе пациентов с одновременно повышенными уровнями галектина-3 и натрийуретического пептида (а это основной маркер сердечного неблагополучия) смертность еще в 1,5–2 раза выше [22].
Что делать?
Биомолекула такой значимости, как галектин-3, ставит перед врачом две задачи. Во-первых, нужно определить уровень галектина-3 у пациента, и, если он повышен, снизить концентрацию до нормальной. На данный момент существует несколько специфических ингибиторов галектина-3 — углеводов и пептидов [21], [23]. С точки зрения применения в клинике все они имеют ряд недостатков, так как могут выводиться, не успев подействовать, или привлечь чересчур пристальное внимание иммунной системы. Поэтому наша научная группа задалась целью создать рекомбинантные человеческие антитела к галектину-3. Дело в том, что антитело — почти идеальное лекарство. Молекула человеческого антитела обладает минимальной иммуногенностью и высокой специфичностью. Конечно, на данный момент уже существуют антитела против галектина-3, но, поскольку они мышиные и кроличьи, годятся они только для исследований.
Половина пути позади
Для того чтобы найти антитела, нужно сперва получить рекомбинантный галектин-3, а желательно даже два: макаки и человека. Ведь если будущие антитела покажут терапевтическую активность, прежде чем лечить ими людей, нужно будет испытать их на обезьянах. Тут-то и начались мои приключения. Главная часть галектина-3 — это углеводсвязывающий домен, а значит, достаточно получить рекомбинантным способом только его. Бактерии, в которые мы поместили плазмиду с закодированным галектином-3, честно вырабатывали белок с нужной молекулярной массой, но коммерческие мышиные антитела упорно отказывались связываться с ним. Скорее всего, это было вызвано тем, что неполный белок был неправильно свернут.
Ничего не оставалось, кроме как начать все с самого начала и настроить синтез всего белка целиком. Покопавшись в литературе, я обнаружила, что галектин-3 можно выделить с помощью аффинной хроматографии на лактозил-сефарозе [24]. Найти в литературе внятную методику оказалось не так-то просто. Многое пришлось додумывать, полагаясь на логику и интуицию. Когда у меня в руках оказались две пробирки с очищенными галектинами-3, я испытала настоящий триумф!
Спустя еще несколько месяцев мы получили два антитела. Этого вполне достаточно для создания диагностической системы, с помощью которой можно будет измерить концентрацию галектина-3 в сыворотке крови. Единственное условие: наши антитела должны «хватать» галектин-3 за разные части (эпитопы). Это необходимо для корректной работы системы. Но оказалось, что два антитела, хоть они и различаются по аминокислотной последовательности, связывают галектин-3 за один и тот же эпитоп. Поэтому до создания диагностического набора пройдена только половина пути. Для завершения этого этапа необходимо разработать еще одно антитело, которое будет «ловить» галектин-3 за «другую руку».
Предстоит проделать большую работу, чтобы антитела к галектину-3 пришли в лаборатории клинической диагностики. А чтобы создать лекарство, потребуется еще больше усилий. Мы и впредь будем стараться сделать так, чтобы неоконченная история галектина-3 увенчалась счастливым концом.
Литература
- Рецепторы в активной форме;
- Лектины — новые инструменты в диагностике и терапии злокачественных опухолей;
- Komath S.S., Kavitha M., Swamy M.J. (2006). Beyond carbohydrate binding: new directions in plant lectin research. Org. Biomol. Chem. 4, 973–988;
- Brade H. Endotoxin in health and disease. NY-Basel: Marcel Dekker, 1999. — 962 p.;
- Shekhar M.P., Nangia-Makker P., Tait L., Miller F., Raz A. (2004). Alterations in galectin-3 expression and distribution correlate with breast cancer progression: functional analysis of galectin-3 in breast epithelial-endothelial interactions. Am. J. Pathol. 165, 1931–1941;
- Van den Brûle F.A., Fernandez P.L., Buicu C., Liu F.T., Jackers P., Lambotte R., Castronovo V. (1997). Differential expression of galectin-1 and galectin-3 during first trimester human embryogenesis. Dev. Dyn. 209, 399–405;
- Barondes S.H., Castronovo V., Cooper D.N., Cummings R.D., Drickamer K., Feizi T. et al. (1994). Galectins: a family of animal beta-galactoside-binding lectins. Cell. 76, 597–598;
- Halimi H., Rigato A., Byrne D., Ferracci G., Sebban-Kreuzer C., ElAntak L., Guerlesquin F. (2014). Glycan dependence of galectin-3 self-association properties. PLoS One. 9, e111836;
- Truong M.J., Gruart V., Kusnierz J.P., Papin J.P., Loiseau S., Capron A., Capron M. (1993). Human neutrophils express immunoglobulin E (IgE)-binding proteins (Mac-2/epsilon BP) of the S-type lectin family: role in IgE-dependent activation. J. Exp. Med. 177, 243–248;
- Frigeri L.G., Zuberi R.I., Liu F.T. (1993). Epsilon BP, a beta-galactoside-binding animal lectin, recognizes IgE receptor (Fc epsilon RI) and activates mast cells. Biochemistry. 32, 7644–7649;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Liu F.T., Hsu D.K., Zuberi R.I., Kuwabara I., Chi E.Y., Henderson W.R. Jr. (1995). Expression and function of galectin-3, a beta-galactoside-binding lectin, in human monocytes and macrophages. Am. J. Pathol. 147, 1016–1028;
- Fernández G.C., Ilarregui J.M., Rubel C.J., Toscano M.A., Gómez S.A., Beigier Bompadre M. et al. (2005). Galectin-3 and soluble fibrinogen act in concert to modulate neutrophil activation and survival: involvement of alternative MAPK pathways. Glycobiology. 15, 519–527;
- Partridge E.A., Le Roy C., Di Guglielmo G.M., Pawling J., Cheung P., Granovsky M. et al. (2004). Regulation of cytokine receptors by Golgi N-glycan processing and endocytosis. Science. 306, 120–124;
- Ivanova D., Zhelev Z., Aoki I., Bakalova R., Higashi T. (2016). Overproduction of reactive oxygen species — obligatory or not for induction of apoptosis by anticancer drugs. Cancer Res. 28, 383-396;
- Minutoli L., Rinaldi M., Marini H., Irrera N., Crea G., Lorenzini C. et al. (2016). Apoptotic pathways linked to endocrine system as potential therapeutic targets for benign prostatic hyperplasia. Int. J. Mol. Sci. 17. pii: E1311;
- Akahani S., Nangia-Makker P., Inohara H., Kim H.R., Raz A. (1997). Galectin-3: a novel antiapoptotic molecule with a functional BH1 (NWGR) domain of Bcl-2 family. Cancer Res. 57, 5272–5276;
- Yu F., Finley R.L. Jr, Raz A., Kim H.R. (2002). Galectin-3 translocates to the perinuclear membranes and inhibits cytochrome c release from the mitochondria. A role for synexin in galectin-3 translocation. J. Biol. Chem. 277, 15819–15827;
- van den Brûle F., Califice S., Castronovo V. (2004). Expression of galectins in cancer: a critical review. Glycoconj. J. 19, 537–542;
- Yona S. and Gordon S. (2007). Glucocorticoids turn the monocyte switch. Immunol. Cell Biol. 85, 81–82;
- Traber P.G., Chou H., Zomer E., Hong F., Klyosov A., Fiel M.I., Friedman S.L. (2013). Regression of fibrosis and reversal of cirrhosis in rats by galectin inhibitors in thioacetamide-induced liver disease. PLoS One. 8, e75361;
- Chen J.J., Hao W.R., Chang K.C., Liu J.C. (2016). The infiltrating macrophage-secreted galectin-3 plays an essential role in cardiac fibrosis and diastolic function in murine pressure-overload model. J. Hypertens. 34 Suppl. 1, e549;
- Abu-Elsaad N.M. and Elkashef W.F. (2016). Modified citrus pectin stops progression of liver fibrosis by inhibiting galectin-3 and inducing apoptosis of stellate cells. Can. J. Physiol. Pharmacol. 94, 554–562;
- Павлова Е.В. и Михайлов Р.В. (2015). Разработка антител к галектину-3 для терапевтических и диагностических целей. Российский иммунологический журнал. 2, 797–798.







