
Лектины — новые инструменты в диагностике и терапии злокачественных опухолей
27 октября 2014
Лектины — новые инструменты в диагностике и терапии злокачественных опухолей
- 5186
- 4
- 1
Опухолевая клетка — «коварный предатель» человеческого организма. Любая нормально функционирующая клетка способна стать раковой, приобретая способность к неограниченному делению и распространению (метастазированию).
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: История борьбы человечества с различными заболеваниями имеет совершенно драматический характер. Она включает в себя примеры и ужасающих поражений, таких как свирепствовавшая на территории Европы XIV века чума, и потрясающих побед, таких как открытие вакцины против оспы или использование пенициллина во время Второй Мировой войны. На современном этапе развития этой истории человек вступил в схватку с ещё одним коварным врагом — онкологическими заболеваниями. Человечество разработало впечатляющий набор средств по борьбе с этим противником, но вооружение постоянно теряет эффективность. Среди всего разнообразия современного антиопухолевого арсенала отдельного внимания заслуживают углеводсвязывающие белки — лектины.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
О лектинах, клеточных поверхностях и их взаимоотношениях
Лектины — общее название гликопротеинов, а также белков не иммунного происхождения, способных избирательно и обратимо связываться с углеводами [1], [2]. Подобные углевод-белковые взаимодействия составляют основу многих физиологических процессов, протекающих в организме. С их помощью происходит адгезия отдельных клеток и микроорганизмов к тканям, они участвуют в неспецифическом иммунном ответе на различные патогены, а также обеспечивают межклеточные контакты посредством хеморецепторного «узнавания» клетками друг друга [3]. Существуют и другие виды активности лектинов, однако три вышеперечисленных — наиболее интересны, если говорить об их отношении к появлению и развитию злокачественных опухолей. И в первую очередь это связано с изменениями поверхности клеток при их малигнизации (приобретении свойств злокачественной опухоли).
Как известно, клеточная поверхность представляет собой довольно сложную «мозаику» [4], состоящую из двойного слоя фосфолипидов, различных белков, гликопротеинов и гликолипидов (рис. 1). Последние два класса соединений содержат в своём составе гетероолигосахариды, которые состоят из разных моносахаридных звеньев, таких как галактоза, глюкоза, фукоза, манноза, сиаловая кислота и нескольких других. Многочисленными исследованиями, проводимыми с 50-х годов XX века, установлено, что изменения этих структур неизменно сопровождают процессы злокачественного роста опухолей. В частности, существует несколько характерных путей перегликозилирования поверхности клетки при их трансформации:
- происходит возрастание числа разветвлённых олигосахаридных цепей;
- запускается экспрессия эмбриональных углеводных антигенов;
- увеличивается степень фукозилирования и содержание сиаловой кислоты в терминальном (т.е. концевом) положении [5].

Рисунок 1. Строение клеточной мембраны. Углеводные цепи гликопротеинов и гликолипидов в совокупности образуют на поверхности клетки гликокаликс — особый примембранный слой, обеспечивающий рецепторную функцию и избирательный транспорт веществ в клетку.
И все эти изменения можно отследить при помощи лектинов. В этом и заключается первая слабость опухолевой клетки: она даёт «обнаружить» себя углеводсвязывающим белкам.
Почему же так происходит? Отчасти, дело состоит в том, что малигнизированная клетка так же, как и нормальная, активно использует лектины для обеспечения своих «потребностей» к передвижению, а главное — к делению. Наиболее ярким примером такого «пособничества» является развитие опухоли при участии галектина-3 — углеводсвязывающего белка из семейства галектинов [6]. Этот лектин способствует опухолевой трансформации клеток, стимулирует их пролиферацию (деление), опосредствует адгезию трансформированных клеток к нормальным тканям и метастазирование опухоли. Более того, галектин-3 может влиять на иммунный ответ организма, тем самым уводя опухолевые клетки из-под иммунного надзора. В случаях некоторых онкологических заболеваний, например, при злокачественных образованиях щитовидной железы, наличие галектина-3 является практически подтверждением развития болезни [7].
Приказ — обнаружить врага!
Praemonitus praemunitus! или, в переводе с латыни, «Предупреждён — значит вооружён!» — слова, как нельзя лучше описывающие использование лектинов в ранней диагностике злокачественных новообразований, поскольку «следы», которые оставляют малигнизированные клетки, становятся заметными для углеводсвязывающих белков ещё на ранних стадиях развития опухоли. Что же это за «улики»?
Во-первых, как уже было сказано, сиалирование углеводных цепей различных гликопротеинов — общий признак злокачественной прогрессии [5]. Именно этот фактор был взят за основу мексикано-португальской группой учёных, которые попытались создать биосенсорную систему на основе лектина SNA из чёрной бузины Sambucus nigra [8]. Им удалось разработать метод, основанный на связывании STn-антигена (сиалированного гликопротеина, экспрессируемого при различных онкопатологиях) с SNA. Потрясающие особенности данного метода — высокая точность определения уровня антигена, практически полное отсутствие влияния других гликопротеинов в сыворотке, а также большая универсальность применения, поскольку STn-антиген обнаруживается при многих видах заболеваний.
Во-вторых, для разного рода онкопатологий удобно исследовать изменения разных гликопротеинов, поскольку особенности их перегликозилирования не определяются обычными способами и сложным образом зависят от конкретного заболевания [9]. Одними из таких маркеров являются онкофетальные антигены (ОФА) — опухолеассоциированные антигены, которые в норме появляются лишь при эмбриональном развитии плода. Экспрессируясь на клетках взрослого организма, эти антигены расцениваются как «чужие» и вызывают иммунный ответ. Наиболее хорошо изученными являются альфа-фетопротеин (АФП), раково-эмбриональный антиген (РЭА) и трофобласт-специфический-бета-1 гликопротеин (ТБГ). На основе этих и нескольких других специфичных антигенов создаются разнообразные лектин-ферментные методы анализа для диагностики онкопатологий; в том числе, подобные работы ведутся и в России.
Например, группа учёных Тихоокеанского института биоорганической химии разработала метод лектин-иммуноферментного анализа для выявления различий гликозилирования РЭА при доброкачественных и злокачественных патологиях шейки матки. Лектин MBL-AJ, выделенный из дальневосточного трепанга Apostichopus japonicus, показал большую чувствительность и высокую точность прогноза диагноза (87,8% — положительный прогноз, 95,2% — отрицательный) [1]. Ещё одной отличительной стороной метода является его невысокая стоимость относительно существующих коммерческих тест-систем. При условии одинаково высокой чувствительности и специфичности этот критерий может стать решающим в выборе метода, который получит широкое использование в дифференциальной диагностике раковых заболеваний.
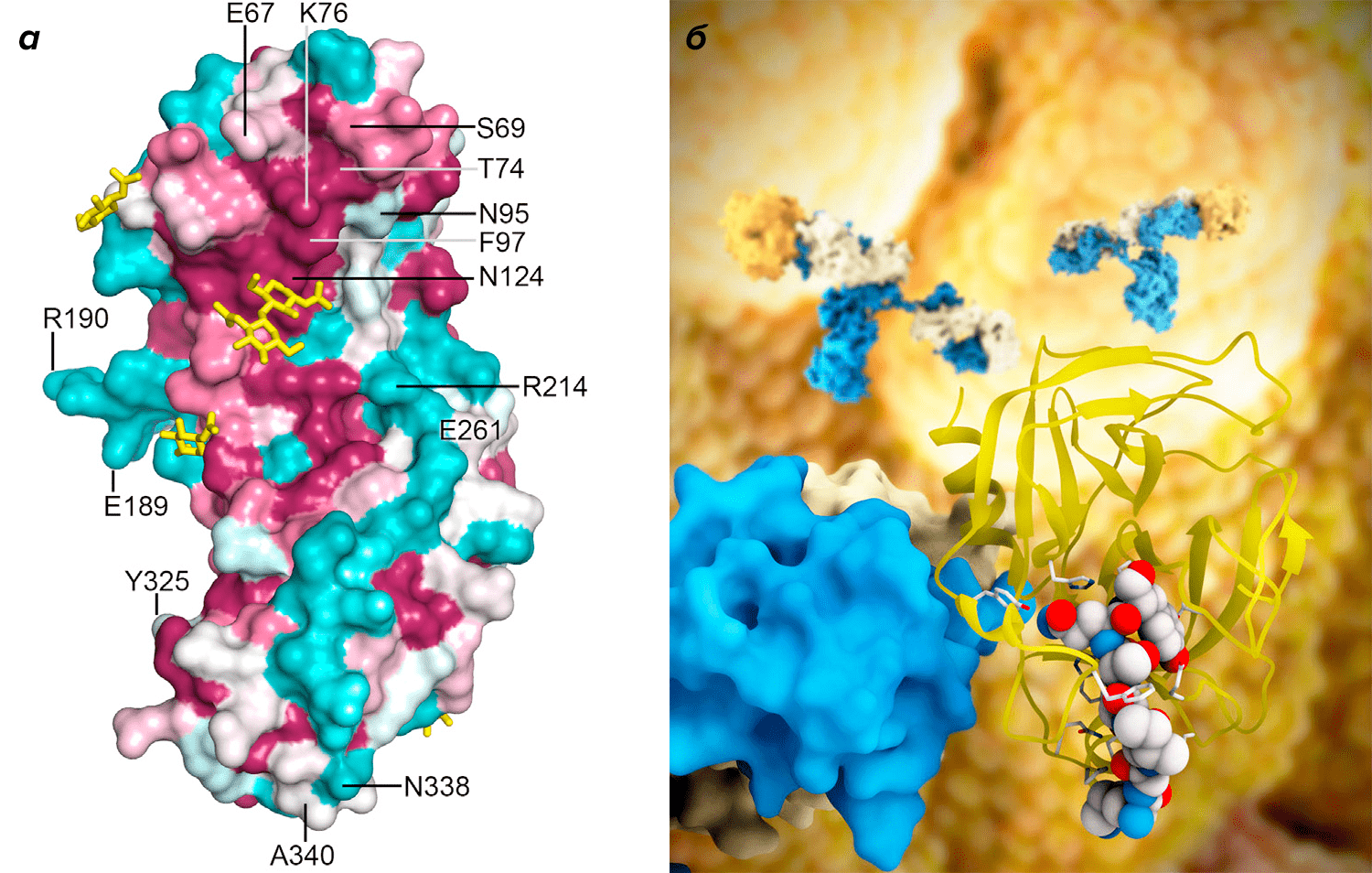
Рисунок 2. Структура некоторых опухолевых антигенов. а — Поверхность 54T онкофетального трофобласт-специфичного гликопротеина, активно экспрессируемого при карциномах почек, молочной железы, толстой кишки и яичников. б — Простат-специфический антиген (PSA) — важный маркер для диагностики и терапии рака простаты.
Киллер с доставкой на дом
Интересно, что одной «разведывательной» функцией лектины не ограничиваются. Их свойства позволяют использовать их также и в терапии злокачественных новообразований. Уникальная идея — использовать углеводсвязывающие взаимодействия как путь доставки антиопухолевых препаратов — это колоссальное увеличение шансов, что агент, стимулирующий гибель клеток, будет «атаковать» именно опухолевые клетки, а не здоровые. На настоящий момент существует огромное количество антиопухолевых препаратов — это всевозможные ингибиторы синтеза ДНК и различных жизненно важных ферментов, регуляторы транскрипции ДНК и другие противоопухолевые агенты. Но проблема точной и специфичной доставки этих лекарств к опухоли остаётся актуальнейшей задачей современных исследований.
Наверняка, каждому, кто хоть раз смотрел в кино триллер или детектив, знаком следующий популярный образ — заказчик, оставляющий фотографию «жертвы» наёмному убийце. Если проводить аналогию между антиопухолевым препаратом и образом киноэкранного киллера, то специфичный лектин как раз и будет тем самым «заказчиком», но с одним отличием — он не просто отдаёт киллеру «фотографию» опухолевой клетки, но и доставляет его непосредственно к «жертве». Именно такой механизм лёг в основу исследований американских учёных, которые попытались кардинально улучшить процесс нейтрализации опухолевых клеток в кровеносной системе при метастазировании опухоли. В настоящее время, в тех случаях, когда у пациентов обнаруживаются метастазы, смертность, к сожалению, может превышать 90%. Однако, их быстрая и эффективная нейтрализация, может существенно увеличить продолжительность жизни пациента. Исходя из специфичности некоторых лектинов — Е-селектинов — к лигандам на поверхности опухолевых клеток кровеносной системы, учёные предположили, что сочетание особой формы доставки антиопухолевых лекарств в виде липосом и специальных углеводных векторов (Е-селектинов) может существенно повысить точность адресной доставки препарата к злокачественным клеткам (рис. 3) [12]. И действительно, подобный метод показал лучшие результаты, по сравнению с методами без участия лектинов.

Рисунок 3. Схема доставки липосом, нагруженных лекарством, к опухолевым клеткам кровеносной системы. а — Включение в липосому антиопухолевого препарата доксорубицина (DOX) и «пришивание» к её поверхности углеводных векторов — E-селектинов. б — Взаимодействие модернизированных липосом (ES) с рецепторами (Selectin ligands) на поверхности опухолевых клетках. Клетки движутся вместе с током крови, присоединяя к себе ES-липосомы, которые располагаются на поверхности галлуазитовых нанотрубок (HNT) для увеличения площади связывания Е-селектина.
Несколько иная схема была разработана учёными из Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова в Москве при сотрудничестве с коллегами из Российского онкологического центра им. Н.Н. Блохина. Они предложили использовать селектины уже не в качестве «системы наведения», а в роли самой «мишени». Дело в том, что при процессах малигнизации клеток, на поверхности кровеносных сосудов опухоли экспрессируют селектины, которые являются отличным «ориентиром» для липосом, содержащих лиганды этих лектинов. Таким образом, липосомы, связываясь с клетками кровеносных сосудов опухоли, вызывают их разрушение, что, в свою очередь, приводит к ухудшению тока кислорода и питательных веществ к опухоли и, в конечном итоге, к её гибели. Подобная форма доставки противоопухолевых препаратов показала увеличение жизни мышей с опухолями молочных желёз в два раза по сравнению с липосомами, не несущими углеводных лигандов, и в 4 раза — по сравнению с исходным препаратом [11]. Вероятно, что в обозримом будущем подобные альтернативные формы противоопухолевых лекарств заменят стандартные методы химиотерапии.
Лицензия на убийство
В последние десятилетия активно развивающаяся гликобиология произвела ряд потрясающих открытий. Например, выяснилось, что большую роль в жизнеобеспечении клетки играет углевод-белковый путь передачи химического сигнала. Остатки сахаров, связываясь со специальными белковыми рецепторами на поверхности клетки, способны запускать в ней целые каскады химических превращений. Одним из таких явлений является запуск программы контролируемой клеточной смерти — апоптоза. В норме у всех клеток организма существует определенный срок жизни, по истечении которого данная программа запускается одним или несколькими апоптотическими факторами, что приводит к гибели клетки. У раковых клеток этот процесс нарушается — отсюда и проявляется их способность к неограниченному делению и распространению в организме. Чтобы избавиться от опухолевых клеток, необходимо вернуть в норму процесс апоптоза. И среди множества веществ, проявляющих апоптотическую активность, лектины находят своё законное место.
Пожалуй, наиболее известным и хорошо изученным лектином является конканавалин А (Con A), выделенный из мечевидной канавалии Canavalia ensiformis. За почти столетие его исследований (впервые он был получен ещё в 1919 году) была полностью установлена его структура, углеводная специфичность и многие другие характеристики. Однако совсем не так давно появились работы, показывающие наличие антиопухолевой активности у этого лектина. Коллектив учёных из Китая резюмировал данные, полученные в многочисленных экспериментах, и пришёл к выводу, что Con A способен запускать апоптоз в опухолевых клетках при некоторых онкопатологиях, причём делать это он может разными путями [15].
Первый путь включает в себя индукцию апоптоза путём изменения трансмембранного потенциала митохондрий в клетке. Из-за подобной перемены потенциала в клетке начинает запускаться сложный каскад химических реакций, приводящий к образованию таких ферментов, как каспазы. Каспазы — это ферменты, выносящие клетке «смертный приговор» и приводящие его в исполнение. Они расщепляют белковые компоненты цитоскелета клетки, и клетка буквально распадается на множество маленьких фрагментов (апоптотических телец).
Второй путь стимуляции клеточной смерти — увеличение в ней активных форм кислорода (АФК), вызываемое Con A. АФК включают в себя ионы, свободные радикалы и разнообразные перикисные соединения, которые являются продуктами различных процессов метаболизма кислорода. В норме они присутствуют в клетке лишь в небольшом количестве, поскольку специальная антиоксидантная система защиты клетки препятствует накоплению этих, вообще говоря, токсичных веществ. Однако при воздействии на клетку Con A число АФК может резко увеличиться, что приводит к сильному окислительному стрессу. При достаточно больших повреждениях в клетке начинают образовываться различные медиаторные белки, которые опосредствуют деградацию ДНК и активацию каспаз, т.е. приводят к апоптозу.
Подобные эффекты были выявлены в экспериментах с клетками человеческой меланомы A375 и человеческой гепатоцеллюлярной карциномой печени HepG2. Помимо индукции апоптоза у лектина была выявлена способность к стимуляции в клетках аутофагии [14] — процесса, в котором отдельные фрагменты клетки или большая её часть подвергается деградации в специальных органеллах — лизосомах. Это явление приводило к смерти клеток только гепатоцеллюлярной карциномы. Также Con A способствовал уменьшению опухоли путём ингибирования её ангиогенеза — процесса образования новых кровеносных сосудов, питающих клетки (рис. 4).
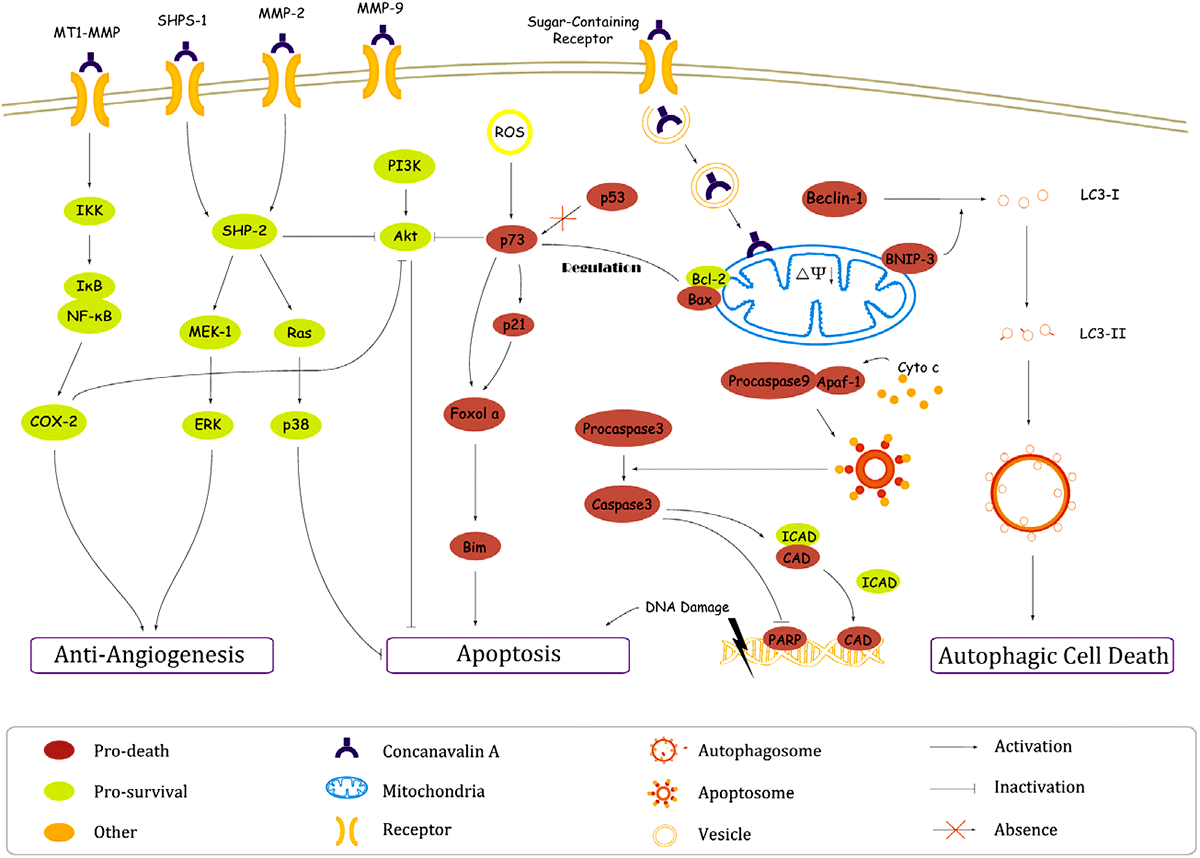
Рисунок 4. Механизм взаимодействия Con A с опухолевой клеткой. Лектин оказывает на клетку разные типы влияния, в зависимости от рецептора, с которым он связывается. Есть рецепторы, которые в результате снижают образование кровеносных сосудов в районе опухоли (антиангиогенез), но они также ингибируют и апоптоз. При взаимодействии Con A с углеводспецифичным рецептором запускается аутофагия или апоптоз, причём, последний протекает по одному из возможных путей: 1) трансмембранное изменение электрического потенциала митохондрии или 2) образование активных форм кислорода.
Использование лектинов — «От слова к делу» или наоборот?
Лектины пришли в онкологию сравнительно недавно, и прежде чем их использование в диагностике и терапии станет повсеместным, они должны пройти испытание временем и клиническими исследованиями на предмет безопасности и эффективности использования.
Уже сейчас на основе углеводсвязывающих белков созданы коммерческие тест-системы некоторых окнопатологий, например AFP-L3-% тест на гепатоцеллюлярную карциному компании Wako Diagnostics. GP Biosciences Ltd. выпускает микрочипы, включающие панель из 41 лектина для диагностики биомаркеров. Лектины используются для отчистки крови и удаления незрелых форм клеток лимфы при остром лейкозе [1]. Всё новые и новые методы гистохимических, иммуноферментных и других видов анализа на основе лектинов используются в медицинской практике. Большой потенциал к применению лектинов в диагностике и терапии раковых опухолей постепенно начинает реализоваться, однако они по-прежнему остаются классом соединений, требующим к себе более пристального внимания. Возможно, уже в ближайшее десятилетие нам предстоит стать свидетелями крупных побед над раковыми опухолями. Надеемся, что не последнюю роль в этих победах сыграют лектины.
Литература
- Чикаловец И.В., Молчанова В.И., Булнаков А.А., Черников О.В., Петрова И.Ю., Лукьянов П.А. (2010). Использование лектинов морских гидробионтов для диагностики ряда социально значимых заболеваний человека. «Вестник ДВО РАН». 5, 1–6;
- Игнатов В.В. (1997). Углеводсвязывающие белки — лектины. «Соросовский образовательный журнал». 2, 14–15;
- Черников О.В. Физико-химические свойства и биологическая активность лектинов морских гидробионтов: дис. ... канд. биол. наук. — Владивосток, 2008;
- Липидный фундамент жизни;
- Галич И.П. и Евтушенко Н.В. (2003). Изменение гликозилирования при окногенезе и развитии других патологических процессов. «Онкология». 5, 4–8;
- Васильева О.А., Якушина В.Д., Рязанцева Н.В., Новицкий В.В. (2011). Возможности использования галектина-3 в лабораторной диагностике. «Клинико-лабораторный консилиум». 2, 12–15;
- Антонова С.С. и Юшков П.В. (2004). Галектин-3 как представитель семейства лектинов: в норме и при патологии. «Молекулярная медицина». 1, 60–64;
- M. Luísa S. Silva, Evelin Gutiérrez, José A. Rodríguez, Catarina Gomes, Leonor David. (2014). Construction and validation of a Sambucus nigra biosensor for cancer-associated STn antigen. Biosensors and Bioelectronics. 57, 254-261;
- Скиба М.А. Разработка лектин-ферментных методов анализа для диагностики онкопатологий: дипломная работа. — Владивосток, 2007;
- Yuguang Zhao, Tomas Malinauskas, Karl Harlos, E. Yvonne Jones. (2014). Structural Insights into the Inhibition of Wnt Signaling by Cancer Antigen 5T4/Wnt-Activated Inhibitory Factor 1. Structure. 22, 612-620;
- E.L. Vodovozova, E.V. Moiseeva, G.K. Grechko, G.P. Gayenko, N.E. Nifant'ev, et. al.. (2000). Antitumour activity of cytotoxic liposomes equipped with selectin ligand SiaLeX, in a mouse mammary adenocarcinoma model. European Journal of Cancer. 36, 942-949;
- Волшебные пузырьки — липосомы цифелина;
- Jiahe Li, Michael R. King. (2012). Adhesion receptors as therapeutic targets for circulating tumor cells. Front. Oncol.. 2;
- Аутофагия, протофагия и остальные;
- Wen-wen Li, Jia-ying Yu, Huai-long Xu, Jin-ku Bao. (2011). Concanavalin A: A potential anti-neoplastic agent targeting apoptosis, autophagy and anti-angiogenesis for cancer therapeutics. Biochemical and Biophysical Research Communications. 414, 282-286.








