Флуоресцентные репортеры и их молекулярные репортажи
25 октября 2014
Флуоресцентные репортеры и их молекулярные репортажи
- 9828
- 1
- 13
Словно микроскопические репортеры, флуоресцентные соединения сообщают нам особыми световыми сигналами о свойствах молекулярного мира, в котором они находятся. Вот так, как эти три репортера, «направленные» в клетки фибробластов мышиных эмбрионов. Ну, или примерно так... В коллаже использована флуоресцентная микрофотография Dr. Dylan Burnette (National Institutes of Health, Bethesda, Maryland, United States). Методика: флуоресцентная микроскопия со структурированным облучением (structured illumination microscopy).
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Флуоресценция: свечение, индуцированное светом. Мы почти не встречаем или не замечаем это явление в обычной жизни. Интенсивность флуоресценции слишком мала по сравнению с вызывающим ее светом. Так, например, мы даже не догадываемся, глядя на зеленый лист растения, что хлорофилл в нем флуоресцирует красным светом. Однако ученым удалось разработать приборы и методы, позволяющие не только выявлять, но и измерять различные параметры флуоресценции. Причем оказалось, что, благодаря этим измерениям, можно получать уникальную информацию о молекулярной организации и функционировании биологических систем. Так был создан и постоянно расширяется богатый арсенал оптических методов исследований, в которых особую роль играют специальные вещества — флуоресцентные репортеры.
Конкурс «био/мол/текст»-2014
 Эта работа заняла первое место в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2014.
Эта работа заняла первое место в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2014.
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Как известно, однажды свет был успешно отделен от тьмы. С тем, что такое тьма, еще предстоит разобраться. Пока наметились лишь некоторые перспективы в этом направлении в связи с изучением темной материи и темной энергии. А вот свет человечество давно и успешно изучает и использует, в том числе в качестве исследовательского «инструмента». Одно из направлений использования света в экспериментальных исследованиях связано с явлением флуоресценции. За последние тридцать лет использование различных методов, основанных на регистрации флуоресценции, в биологических и медицинских исследованиях стремительно возросло. Обусловлено это появлением как новых технических возможностей — в первую очередь компьютеров и лазеров, — так и широкого спектра доступных флуоресцирующих молекул и молекулярных комплексов. Словно микроскопические репортеры эти соединения сообщают нам особыми световыми сигналами о свойствах молекулярного мира, в котором они находятся. Флуоресцентная методология обеспечила решение многих принципиальных задач биологии и медицины. Благодаря высокой чувствительности и сравнительной безопасности она вытеснила многие традиционные методы, связанные с применением радиоактивных веществ. Методы флуоресцентного анализа используются как в фундаментальных исследованиях для получения новых знаний о живом, так и в прикладных работах в биотехнологии, медицинской диагностике, криминалистике и многих других областях. Что же представляют собой флуоресцентные репортеры? Какую информацию можно получить с их помощью из глубин микромира? Как эту информацию регистрируют и анализируют? Но прежде всего — что такое флуоресценция?
Флуоресценция: свечение, индуцированное светом
Некоторые вещества после поглощения света в определенном диапазоне длин волн начинают излучать свет в другом, более длинноволновом, диапазоне. Впервые это явление было описано как видимое изменение цвета растворов некоторых органических соединений и минералов при наблюдении не на просвет (в проходящем свете), а под углом к проходящему свету. Так, например, Дэвид Брюстер (Sir David Brewster) в 1833 году заметил, что при освещении белым светом зеленого спиртового раствора хлорофилла от него «отражается» красный свет. Позднее, в 1845 году, Джон Хершель (Sir John Herschel) описал подобные наблюдения — появление голубой окраски у бесцветного раствора сульфата хинина при облучении солнечным светом. В 1852 году Джордж Стокс (George Gabriel Stokes) обнаружил видимое на глаз свечение минерала флуорита при его облучении невидимым ультрафиолетовым излучением. Учитывая источник происхождения наблюдавшегося свечения, он назвал это явление флуоресценцией, как он отметил, по аналогии с термином опалесценция, описывающим явление дихроизма в опале. Важно отметить, что эти термины не только отражают «историю» своего происхождения, но, что более важно, обозначают разные физические явления. Флуоресценция — это излучение, возникающее в молекулах вещества под влияние света. Опалесценция — это рассеяние света, которое иногда сопровождается интерференцией.
По своей сущности флуоресценция является одной из разновидностей люминесценции. Этим термином описывают все явления излучения веществом, вызванного «возбуждением» молекул различными факторами. Так, например, в некоторых химических реакциях возникает хемилюминесценция. Хемилюминесценцию в биологических объектах называют биолюминесценцией . Есть вещества, которые испускают свет при возбуждении электрическим током (электролюминесценция), быстрыми электронами (катодолюминесценция), γ-излучением (радиолюминесценция) и другие. В этом контексте флуоресценция относится к категории фотолюминесценции.
Недавно на «биомолекуле» вышла замечательная статья, описывающая открытие нового типа биолюминесценции: «Биолюминесценция: возрождение» [1]. — Ред.
Способные флуоресцировать атомы, молекулы и молекулярные комплексы называют флуорофорами или флуорохромами. Обычно этими терминами пользуются как синонимами. Однако в ряде источников под флуорохромами понимают все виды флуоресцирующих молекул, а под флуорофорами — только флуоресцирующий компонент (группировку) крупной молекулы. В классической монографии Дж. Р. Лаковица [2] используется только один термин — флуорофор, для всех типов флуоресцирующих веществ. С целью единообразия мы будем пользоваться этим термином. Отметим также, что в исследовательской практике ковалентно присоединенный к макромолекуле флуоресцирующий компонент принято называть флуоресцентной меткой, а свободный флуорофор — зондом. Применяемые в микроскопии флуорофоры традиционно именуют флуоресцентными красителями. Наконец, некоторые авторы стали использовать термин биосенсоры в отношение флуорофоров, используемых в биологических исследованиях.
Физическую природу флуоресценции удобно проиллюстрировать, пользуясь диаграммой, которую предложил польский физик Александр Яблонский в 1933 году, и которая носит его имя. На рисунке 1 представлена упрощенная форма этой диаграммы.
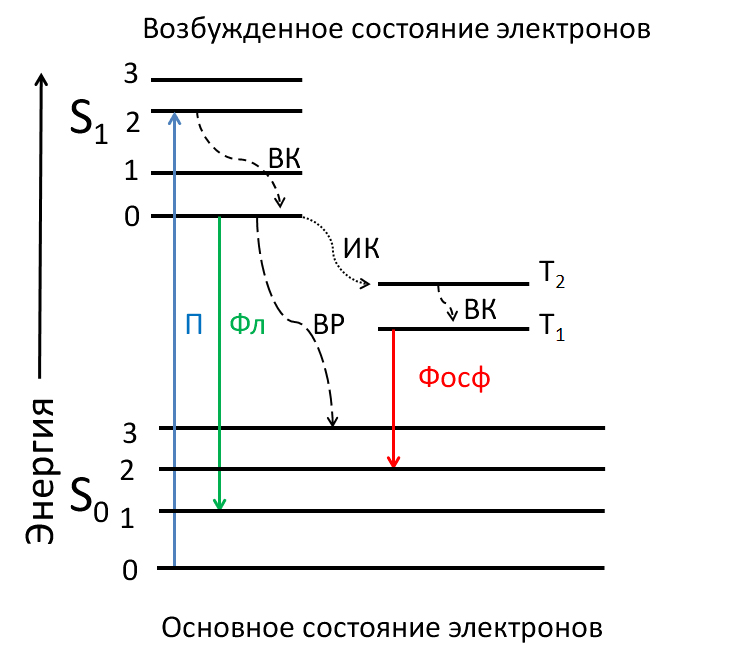
Рисунок 1. Диаграмма Яблонского, иллюстрирующая электронные процессы в молекулах-флуорофорах при поглощении квантов света. Горизонтальные линии — энергетические уровни электронов: S0 — основное, невозбужденное состояние; S1 — синглетное возбужденное состояние; 0–3 — квантованные подуровни; Т1, Т2 — квантованные уровни триплетного возбужденного состояния. Стрелками показаны переходы электронов в разные энергетические состояния: П — поглощение света, Фл, Фосф — испускание флуоресценции и фосфоресценции, соответственно, ВК — внутренняя конверсия, ИК — интеркомбинационная конверсия, ВР — вибрационная релаксация.
При поглощении фотонов определенной энергии в молекуле флуорофора происходит переход электронов из «основного» (S0) на один из подуровней «возбужденного» (S1, S2, ..., Sn) состояния с более высокой энергией. Спин электрона при переходе не меняется, и поэтому эти уровни называют синглетными. «Возбужденное» состояние нестабильно, и электроны быстро возвращается на исходный энергетический уровень. Происходить это может несколькими путями. Три из них — безызлучательные квантовые переходы: внутренняя конверсия, интеркомбинационная конверсия и вибрационная релаксация. Два других сопровождаются излучением света — это флуоресценция и фосфоресценция. При внутренней конверсии энергия электрона уменьшается до минимального синглетного уровня. В ходе вибрационной релаксации, которая вызвана преимущественно взаимодействием с окружающими молекулами, поглощенная энергия может «рассеяться» в виде тепла до «основного» уровня. Интеркомбинационная конверсия приводит к уменьшению энергии электронов с изменением спина. Такое энергетическое состояние электрона называется триплетным. Флуоресценция возникает при переходе с нижнего синглетного уровня в «основное» состояние, а фосфоресценция — при переходе в «основное» состояние с триплетного уровня.
Отметим три важных обстоятельства.
- Во-первых, вероятности вышеотмеченных переходов различаются. Представление об этом дает сравнение времени, за которое осуществляется каждый из этих переходов, иными словами, время пребывания электронов в каждом из этих состояний (таблица 1). Чем меньше время, тем более вероятен данный переход. Очевидно, что флуоресценция и тем более фосфоресценция — маловероятные процессы. Это проявляется в сравнительно слабом свечении большинства флуорофоров даже при интенсивном облучении.
- Во-вторых, поскольку флуоресценция возможна при переходе электронов в «основное» состояние только с самого низкого синглетного уровня, то энергия излучения меньше поглощенной энергии. Поэтому спектр флуоресценции флуорофора всегда находится в более длинноволновой области по сравнению со спектром поглощения.
- И, наконец, в-третьих, состояние электронов, участвующих в вышеуказанных процессах, зависит как от физических факторов окружающей среды, так и от общей электронной конфигурации молекулы. Именно это обстоятельство и делает флуорохром молекулярным репортером, который «на языке» флуоресценции сообщает о физико-химических условиях своего окружения.
| Переход | Временной интервал, с | Участие светового излучения |
|---|---|---|
| Поглощение | 10−15 | + |
| Внутренняя конверсия | 10−14—10−11 | — |
| Вибрационная релаксация | 10−14—10−11 | — |
| Флуоресценция | 10−9—10−7 | + |
| Интеркомбинационная конверсия | 10−8—10−3 | — |
| Фосфоресценция | 10−4—10−1 | + |
«Язык» флуоресцентных репортеров
Флуоресценция характеризуется рядом параметров, которые меняются в зависимости от физического окружения или химической модификации флуорофора. Эти параметры и являются тем «языком», на котором передается информация от флуоресцентного репортера. Если продолжить аналогию, то сами параметры подобно словам приобретают конкретный смысл только при определенной их комбинации и в контексте. «Контекстом» для параметров флуоресценции являются условия их регистрации. Флуоресценция всех флуорофоров имеет пять ключевых характеристик: спектры поглощения и флуоресценции, а также квантовый выход, время жизни и анизотропия флуоресценции.
Каждый флуорофор имеет индивидуальные спектры поглощения и флуоресценции. Для иллюстрации на рисунке 2 представлены спектры Lyso TrackerTM Blue (Molecular Probes®) и флуоресцеина. Основными параметрами спектров являются интенсивность флуоресценции, положение максимумов и так называемая полуширина (ширина спектра на уровне половины максимума). Часто именно эти параметры «информируют» об определенных свойствах окружения, в котором находится репортер. Так, в спектре флуоресценции многих флуорохромов возникают характерные изменения при разных рН среды. На рисунке 3 в качестве примера показана рН-зависимость спектра флуоресценции Lyso SensorTM Yellow/Blue (Molecular Probes®). Если такие изменения специфические, т.е. могут быть вызваны только сдвигами рН, то данный флуорофор может быть рН-репортером. Lyso SensorTM Yellow/Blue является одним из таких репортеров.

Рисунок 2. Спектры поглощения (пунктир) и флуоресценции (сплошные линии) флуоресцеина и Lyso TrackerTM Blue (Molecular Probes®)
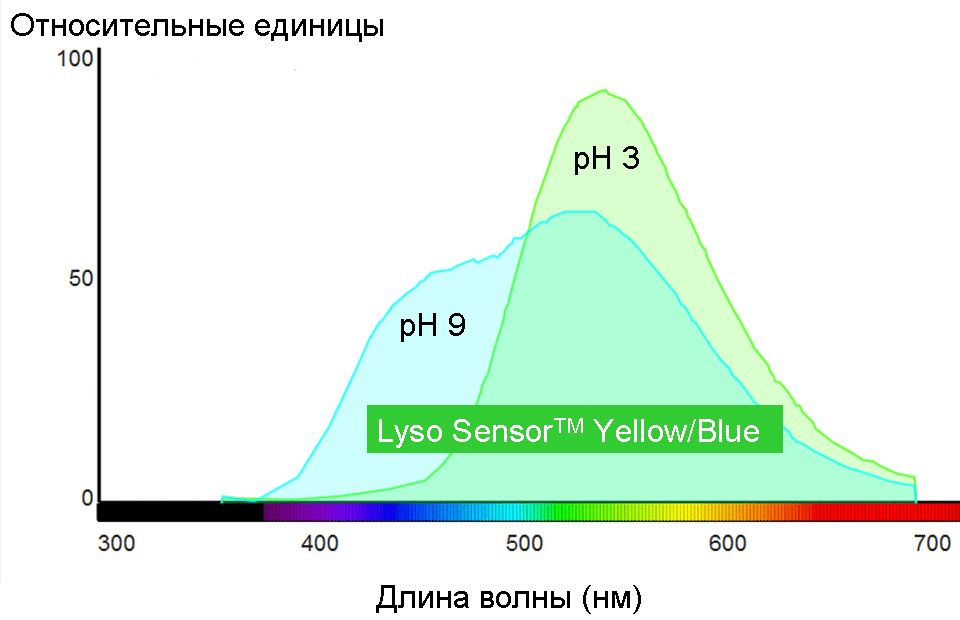
Рисунок 3. Спектры флуоресценции Lyso SensorTM Yellow/Blue (Molecular Probes®) при рН 3 и 9
Квантовый выход флуоресценции — это характеристика эффективности, с которой поглощенная энергия трансформируется в излучение по сравнению с процессами безызлучательной релаксации. Количественно квантовый выход определяется как отношение числа высвеченных фотонов к числу поглощенных. Чем больше квантовый выход, тем больше интенсивность свечения флуорофора. Часто этот показатель является решающим при выборе флуорофора на роль флуоресцентного репортера. Например, флуоресцеин имеет квантовый выход около 0,9, что и обеспечивает его широкое использование как в роли самостоятельного зонда, так и в качестве флуоресцентной метки нефлуоресцирующих молекул. Важно также и то, что этот показатель очень чувствителен к различным физико-химическим взаимодействиям репортера.
Время жизни флуоресценции — это усредненное время, в течение которого молекулы флоурофоров находятся в возбужденном состоянии перед испусканием фотонов флуоресценции. Измеряется этот показатель по затуханию флуоресценции после кратковременного возбуждения. Время жизни флуоресценции, с одной стороны, очень «чувствительно» к физико-химической «обстановке», в которой находится флуоресцентный репортер. С другой стороны, этот показатель является специфической характеристикой флуорофора, что позволяет получать «репортажи» от него в присутствии других флуоресцирующих молекул с похожими спектральными характеристиками.
Анизотропия флуоресценции — это количественная характеристика зависимости поляризации флуоресценции от поляризации возбуждающего света. По анизотропии можно судить о вращательной подвижности репортера и тем самым о вязкости среды в его микроокружении.
Пять вышеуказанных параметров флуоресценции являются непосредственно измеряемыми характеристиками излучения, которое «передают» репортеры. Однако информационные возможности флуоресцентных репортеров этим не ограничиваются. С флуоресценцией связан ряд явлений, которые используются в качестве методических «ухищрений» для получения той или иной информации от флуоресцентных репортеров.
Так, например, существует явление безызлучательной (резонансной) передачи энергии (БПЭ) от одного флуорофора на другой. При этом интенсивность флуоресценции у донора энергии уменьшается, а у акцептора возрастает. Происходить это может между флуорофорами с определенными спектральными свойствами и, что особенно важно, если они находятся на достаточно близком расстоянии. БПЭ лежит в основе многих методических подходов, позволяющих выявлять взаимодействие молекул. Определение эффективности безызлучательной передачи энергии позволяет даже оценивать расстояние между молекулами. В связи с этим БПЭ иногда называют «молекулярной линейкой» (см.: «Рулетка для спектроскописта» [3]).
Ряд методических возможностей базируется на тушении флуоресценции. Тушение может быть вызвано физическим взаимодействием флуорофора с молекулами-тушителями — такими, как кислород, галогены, амины, а также некоторые «электрон-дефицитные» органическими молекулы. В этом случае флуоресцентный репортер может «сообщать» о присутствии в его окружении определенных «тушителей».
Тушение флуорофора может происходить также за счет фотообесцвечивания под влиянием излучения большой интенсивности. В большинстве случаев с точки зрения регистрации флуоресценции это негативное явление. Однако «в умелых руках» это явление используется как специальный методический прием. Широкое распространение в изучении вязкости и/или диффузионных свойств цитоплазмы клеток получила методика восстановления флуоресценции флуорофора после фотообесцвечивания. Сущность ее заключается в том, что в небольшом участке клетки, содержащей флуорофор, производится его обесцвечивание кратковременной мощной вспышкой лазера. Затем регистрируется восстановление флуоресценции в том же участке, что обусловлено диффундирующими из других областей клетки не обесцвеченными молекулами флуорофора. По динамике этого процесса и характеризуют диффузионные свойства цитоплазмы.
Флуоресцентные репортеры, какие они?
Способностью флуоресцировать обладают многие вещества с определенными конфигурациями электронов. Такие конфигурации складываются в некоторых атомах, молекулах и надмолекулярных комплексах. Однако требуются специальные исследования для выявления потенциальной «способности» флуорофора выступать в роли молекулярного репортера для биологических и медицинских исследований. «Способности» эти оцениваются по специфичности информации, которую они передают, их стабильности, в первую очередь фотостабильности, в ряде случаев учитывается токсичность для отдельных клеток или организма. Особенностью флуоресцентных «корреспондентов» является их высокая индивидуальная «специализация». «Специализация» каждого репортера характеризуется по взаимодействию с определенными компонентами биологической системы, а также по специфичности флуоресцентных сигналов. Условно можно выделить две группы репортеров, созданных на основе органических и неорганических флуорофоров.
Органические молекулы-флуорофоры представляют наиболее многочисленную и разнообразную группу флуоресцентных репортеров. Как велико это разнообразие, можно оценить, заглянув в каталог фирмы Molecular Probes, специализирующейся на разработке и производстве флуорофоров c 1975 года. Это уже одиннадцатое издание (обновление) каталога (на момент написания статьи), что свидетельствует о высоких темпах развития данной области.
Большое разнообразие органических флуоресцентных репортеров обусловлено широким спектром задач и условий их применения. При выборе или при разработке репортеров принимаются во внимание информация, которую нужно получить, спектральные свойства флуорофора, а также специальные условия, связанные с особенностями исследуемой системы. Проиллюстрируем это на примере флуоресцеина и его производных (рис. 4). Как уже отмечалось, этот флуорофор имеет высокий квантовый выход и, соответственно, яркую флуоресценцию. Он может выступать в роли репортера рН. Однако, например, для измерения рН внутри клеток он не подходит, т.к. не проникает через цитоплазматическую мембрану. Его «доставка» в клетки может быть осуществлена с использованием гидрофобного производного — флуоресцеиндиацетата, который утратил способность флуоресцировать, но может проникать через гидрофобный барьер цитоплазматической мембраны. В клетках эстеразы отщепляют ацетильные группировки, и флуоресцеин оказывается в клетках. Аналогичным образом доставляется в клетки дихлорфлуоресцеин, т.е. через эстерифицированное производное. Этот репортер служит для регистрации наличия в клетках активных форм кислорода. Введение изотиоцианата в молекулу флуоресцеина дает возможность присоединять флуорохром к аминогруппам не флуоресцирующих молекул. С использованием флуоресцеинизотиоцианата создаются высокоспецифичные флуоресцирующие белковые репортеры — различные антитела, стрептавидин (реагент на биотин), а также нуклеотиды и олигонуклеотиды. Наконец, 5-карбоксиметокси-2-нитробензиловый эфир флуоресцеина (не показан на рис. 4) представляет собой не флуоресцирующее производное, которое может превращается в обычный флуоресцеин при облучении светом с длиной волны 355 нм. Это пример фотоактивируемых флуорофоров, флуоресцентные свойства которых как бы «спрятаны» (англ. caged) до облучения.
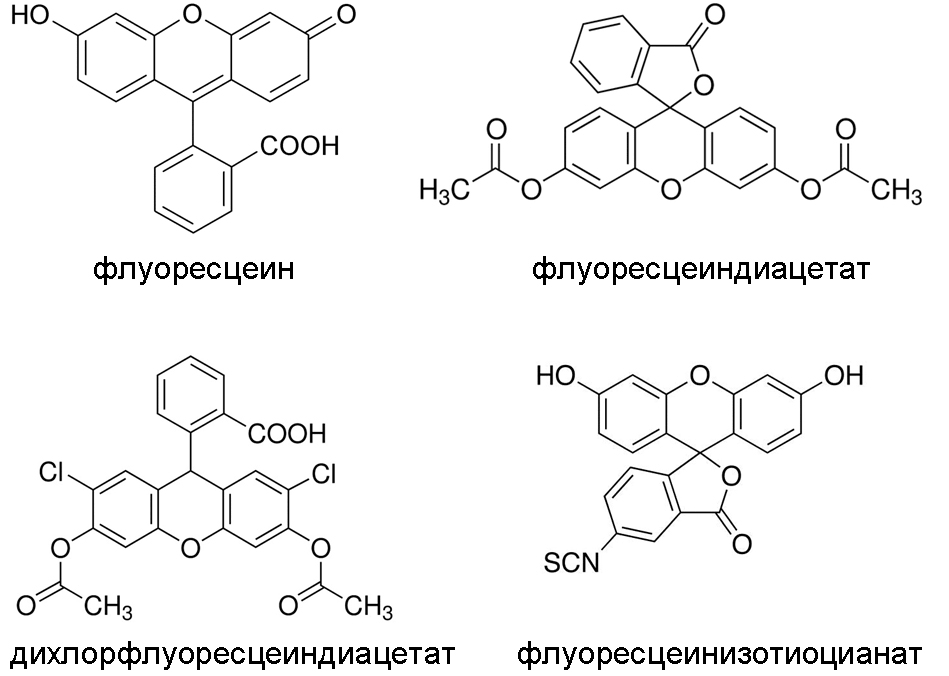
Рисунок 4. Структурные формулы флуоресцеина и некоторых его производных
В семидесятых годах ХХ века сотрудник Принстонского университета (США) Осаму Симомура (Osamu Shimomura) при изучении биолюминесценции медузы Aequorea victoria выделил два белка, участвующих в этом процессе. Он установил, что при взаимодействии ионов кальция с одним из выделенных белков возникает хемилюминесценция голубого цвета. При этом второй белок может поглощать голубой свет и флуоресцировать зеленым светом, что придает зеленоватый оттенок свечения медузы. Первый белок был назван экворином, второй зеленым флуоресцентным белком (ЗФБ). С этого момента начинается история одной из самых успешных разработок молекулярной биологии, а ее основные герои — Осаму Симомура, Мартин Чалфи (Martin Chalfie) и Роджер Тсьен (Roger Tsien) в 2008 году были удостоены Нобелевской премии в области химии за открытие и подробное изучение ЗФБ [4]. Чем же так замечателен этот белок?
После открытия ЗФБ начались интенсивные исследования его структуры, был синтезирован и клонирован соответствующий ему ген. Кроме того у некоторых морских беспозвоночных (Hydrozoa и Anthozoa) были обнаружены аналогичные флуоресцирующие белки, структура которых также была охарактеризована. Все это позволило с помощью методов молекулярной биологии целенаправленно конструировать гены, кодирующие модифицированные формы ЗФБ с широким диапазоном спектральных характеристик, а также такие фоторегулируемые варианты, свечение которых можно «включать и выключать» путем облучения ультрафиолетовым излучением. В настоящее время можно говорить о том, что на основе ЗФБ создана и продолжает увеличиваться целая «армия» разнообразных флуоресцентных белков (ФБ) [5]. Возможность применения ФБ показана в исследованиях многих видов клеток от бактерий до млекопитающих.
Несколько «скромнее» по сравнению с ЗФБ пока выглядит «судьба» экворина. Его структура также была установлена, и синтезирована ДНК, кодирующая этот белок. Изучение зависимости хемилюминесценции экворина от ионов кальция позволило разработать методики измерения концентрации катиона в некоторых клетках. Для измерения содержания ионов кальция внутри клеток существуют и флуоресцентные репортеры, в том числе производные ФБ. Однако достоинством хемилюминесцентного метода с использованием экворина является отсутствие необходимости возбуждающего флуоресценцию облучения, которое не всегда является безвредным для биологической системы, да и для флуорофоров, свечение которых при длительном облучении ослабляется (эффект фотообесцвечивания). Экворин относят к сравнительно большой группе так называемых люциферинов — веществ, ответственных за био(хеми)люминесценцию [1] у некоторых морских и наземных организмов. Изучение люциферинов представляет интерес не только с целью их практического применения. Ведь до сих пор не известно, зачем биологических объектам вообще нужна биолюминесценция.
В последние годы заметно возрос интерес к созданию флуоресцентных репортеров на основе неорганических флуорофоров путем формирования так называемых биоконъюгатов, т.е. их комплексов с некоторыми органическими соединениями и/или с биологическими молекулами. Многие атомы, например, переходные металлы, лантаниды (точнее их ионы, например, Tb3+ и Eu3), кластеры из нескольких атомов золота и серебра после образования таких комплексов приобретают способность к сенсибилизированной флуоресценции. Сущность явления заключается в том, что энергия света, поглощенного органическим соединением, передается на атом неорганического элемента, который и излучает флуоресценцию. Важным свойством этого процесса является то, что молекулы-доноры энергии передают ее от электронов, находящихся в триплетном состоянии. Поэтому излучение неорганических флуорофоров в таком комплексе является «замедленным» по сравнению с «обычной» флуоресценцией, поскольку время жизни электронов в триплетном состоянии заметно больше, чем в синглетном (см. табл. 1). Кроме того, спектры флуоресценции неорганических биоконъюгатов имеют небольшую ширину и сильно сдвинуты относительно спектров поглощения. Сенсибилизированная флуоресценция репортеров-биоконъюгатов делает их «полезными» с точки зрения техники регистрации излучения. Так, в частности, они используются в условиях, когда в исследуемой системе имеется «обычная» флуоресценция других компонентов в том же диапазоне длин волн.
Особое место в этой группе занимают репортеры-биоконъюгаты, в которых в качестве флуорофора используются полупроводниковые кристаллы размером 2–10 нм (нанокристаллы), получившие название квантовых точек (англ. quantum dots). Квантовые точки, как правило, состоят из пары элементов III/V (например, CdS, CdSe, ZnS) или II/VI групп (например, GaN, InP, InAs). Вследствие малых размеров полупроводниковых кристаллов (в них всего 10–50 атомов!) для их электронов создаются условия квантованных энергетических переходов, подобных тем, что существуют в отдельных атомах. (Квантовые точки иногда даже называют «искусственными атомами»). Причем энергия этих переходов, а тем самым и длина волны флуоресценции, зависят от размера кристалла. Чем меньше кристалл, тем больше энергия излучения, т.е. меньше длина волны флуоресценции (рис. 5). Это свойство открывает возможность создания квантовых точек, имеющих практически любую спектральную конфигурацию. К этому следует добавить, что они, по сравнению с органическими флуорофорами, обладают еще и более высоким квантовым выходом и фотостабильностью. На рисунке 6 показаны примерные размеры различных флуорофоров-репортеров.
Кого заинтриговало это название, прочтите подробную статью «Квантовые точки — наноразмерные сенсоры для медицины и биологии» [6]. — Ред.

Рисунок 5. Флуоресценция коллоидных растворов квантовых точек разного размера

Рисунок 6. Относительные размеры флуоресцентных репортеров. Для сравнения показан также белок иммуноглобулин G (Ig G).
Биоконъюгаты на основе квантовых точек состоят из ядра (например, CdSe), покрытого слоем полупроводникового материала (например, ZnS), выполняющего «защитную» функцию, и лиганда — какого-нибудь органического вещества, обеспечивающего растворимость и/или присоединение биологических молекул.
Биоорганическая оболочка биоконъюгата обеспечивает его стабильность как коллоидной частицы и формирует «задание» репортера, его целевое назначение: где и с чем провзаимодействовать, какую «собрать и передать» информацию. При этом, конечно, размеры репортера на основе квантовой точки могут существенно увеличиться (на рис. 6 показаны приблизительные размеры квантовых точек без «снаряжения» биоконъюгата). В биоорганическую оболочку могут быть включены низкомолекулярные соединения — такие как биотин — и высокомолекулярные: одноцепочечные фрагменты ДНК (олигонуклеотиды) и белки, в том числе ферменты и антитела (Ig G).
Инструменты для «чтения» флуоресцентных репортажей
В списке инструментов для получения и анализа «сообщений» флуоресцентных репортеров исторически первым является наш глаз. С его помощью можно проводить визуальные наблюдения флуоресцентного свечения на макроскопических объектах непосредственно, а на микроскопических — с помощью флуоресцентного (люминесцентного) микроскопа. Примером макроскопических объектов могут служить колонии микроорганизмов, в которых экспрессированы ФБ, хроматограммы и электрофореграммы с применением флуоресцентных красителей. А в «обычный» флуоресцентный микроскоп (о «необычных» микроскопах чуть дальше) чаще всего заглядывают для выявления иммунологических реакций с использованием меченных флуорофорами антител, а также в некоторых исследованиях на уровне единичных клеток. Однако возможности зрительного анализа существенно ограничены в основном качественной оценкой «сигналов» флуоресцентных репортеров: «есть свечение — нет свечения» в определенной области образца. Гораздо больше информации можно получить, если «читать и расшифровывать» флуоресцентные «репортажи» по количественным характеристикам свечения (см. раздел «Язык» флуоресцентных репортеров).
Для количественной характеристики флуоресценции необходимы измерения с использованием специальных приборов и определенной методологии. Условно можно выделить две методологии измерений параметров флуоресценции. Первая служит для измерения различных характеристик флуоресценции в сравнительно большой (макроскопической) области объекта, что обеспечивает получение интегральных (усредненных) характеристик флуоресценции по объекту: раствору, суспензии коллоидных частиц, клеток, субклеточных частиц и т.п. Вторая методология ориентируется на измерения на уровне единичных микроскопических объектов — в первую очередь клеток и субклеточных частиц.
Измерения интегральной флуоресценции проводят с помощью спектрофлуориметров (флуоресцентных спектрофотометров) и планшетных флуориметров (англ. plate readers). Спектрофлуориметры — это, как правило, аналитические приборы, на которых можно получить все основные характеристики флуоресценции. Планшетные флуориметры — это устройства, рассчитанные на массовые анализы большого количества образцов (стандартные планшеты рассчитаны на 96, 384 или 1536 образцов). Измерения в них осуществляются по нескольким фиксированным характеристикам — например, по интенсивности флуоресценции в определенной спектральной области. Недавно появились планшетные флуориметры с возможностью измерения параметров затухания флуоресценции и тем самым оценки времени жизни флуорофоров в возбужденном состоянии. Большинство методик с использованием планшетных флуориметров основано на иммунологических реакциях или на анализе развития культур клеток в монослоях.
Методология измерений флуоресценции единичных микроскопических объектов также имеет два варианта. Первый основан на получении цифровых изображений флуоресцирующих микрообъектов (англ. fluorescence imaging) с последующим их компьютерным анализом (англ. computer image analysis). Второй — на «поштучном» измерении флуоресценции микрообъектов в потоке при прохождении через узкий капилляр специального прибора — проточного цитометра [7] (англ. flow cytometer).
Цифровые изображения флуоресцирующих микрообъектов получают с использованием флуоресцентной микроскопии, которая недавно пережила настоящую техническую революцию. Так, в частности, наряду со стандартными флуоресцентными микроскопами, существенно усовершенствованными цифровыми фотокамерами и компьютерами, разработаны принципиально новые устройства. Это прежде всего так называемые конфокальные микроскопы (рис. 7). В конфокальном микроскопе возбуждение и регистрация флуоресценции осуществляются через микроскопическое отверстие, отсекающее «лишнее» свечение, которое возникает вне фокуса объектива. Путем сканирования этим «оптическим зрачком» в горизонтальной и/или вертикальной плоскости, регистрации сигналов фотоумножителем и обработки компьютером получается пространственное изображение флуоресцирующего объекта. Такая конструкция прежде всего позволяет получать более четкие по сравнению со стандартными микроскопами двумерные и трехмерные изображения. Кроме того, на современные конфокальных микроскопах можно проводить измерения параметров затухания флуоресценции.
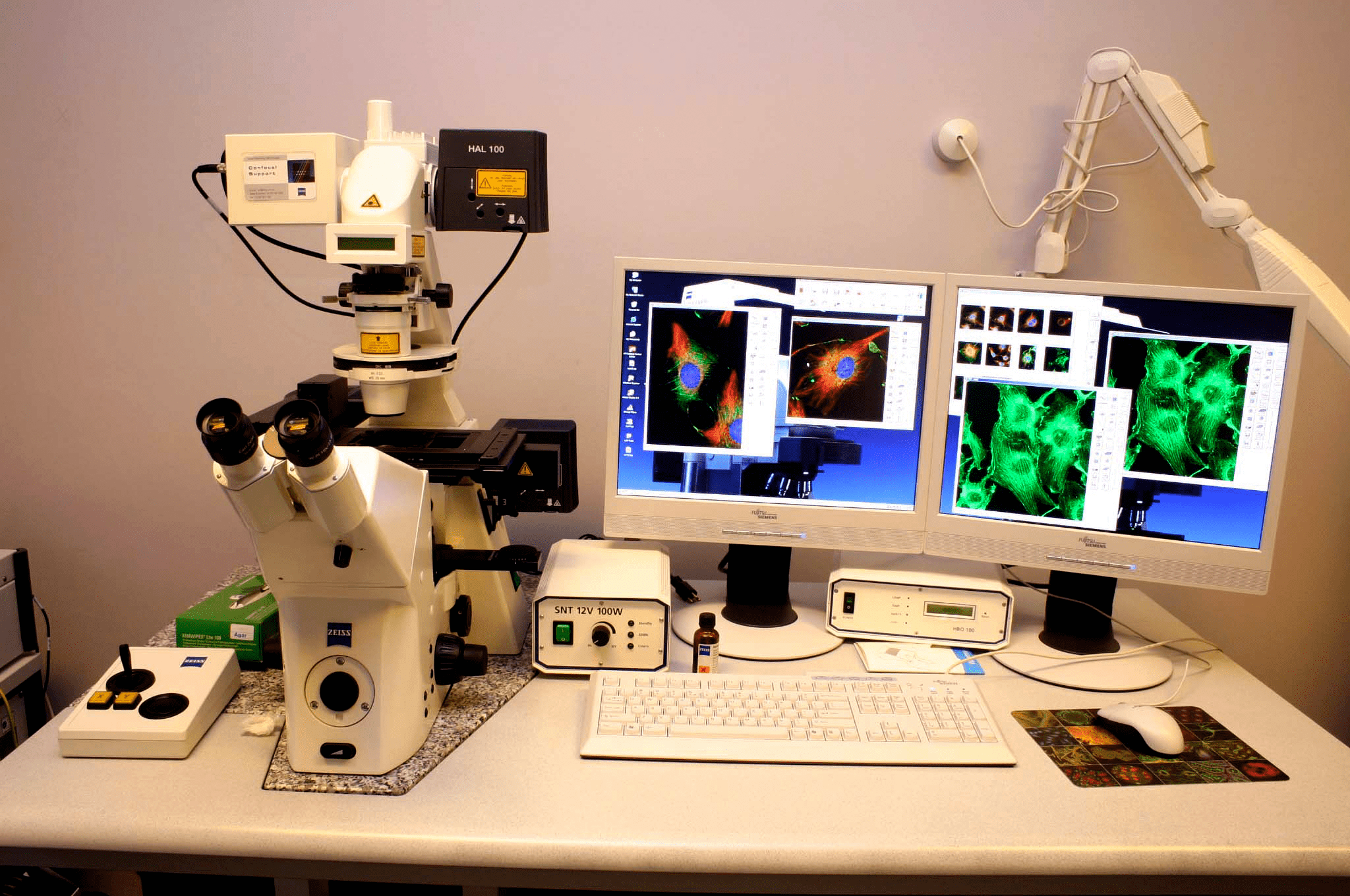
Рисунок 7. Конфокальный микроскоп
Еще один тип «революционных» микроскопов функционирует... вопреки основным физическим принципам флуоресценции. Возбуждение атомов в них осуществляется светом с длиной волны больше длины волны флуоресценции... (см. раздел Флуоресценция: свечение, индуцированное светом). На самом деле основные законы физики при работе этих микроскопов не нарушаются. Просто при достаточной интенсивности светового потока с длиной волны больше длины волны возможной флуоресценции в один и тот же атом одновременно могут «попасть» два фотона, поглощенная электронами энергия удваивается, и ее оказывается достаточно для возбуждения флуоресценции. Поэтому такие микроскопы называются двухфотонными. Одновременное «попадание» двух фотонов в один атом — явление сравнительно маловероятное, и может происходить только там, где световой поток максимально сконцентрирован, т.е. в фокусе объектива. Это и обеспечивает высокое разрешение флуоресцентных изображений. К достоинствам, отличающим двухфотонные от других микроскопов, относится также их способность регистрировать флуоресценцию в образцах на глубине до 1,5 мм (есть сообщения о проникновении и на большую глубину), а также возможность существенно уменьшить неблагоприятное действие возбуждающего излучения как на исследуемые объекты, так и на флуоресцентные репортеры.
Специальные аналитические приемы (так называемая флуоресцентная корреляционная спектроскопия) позволяют использовать конфокальную и двухфотонную микроскопию для исследования движения единичных (!) флуоресцирующих молекул.
Однако «на вершине» современной оптической микроскопии по разрешающей способности стоят так называемые «наноскопы», то есть микроскопы, позволяющие различать на изображении флуоресцирующие объекты, расстояние между которыми составляет несколько нанометров. Существует два типа таких устройств. Первый основан на сканировании образца двумя узкими пучками лазерного излучения. Оптические свойства их подобраны так, что один возбуждает флуоресценцию в «нужной» области, а другой подавляет ее в рядом лежащей «ненужной» области. Размер же «нужной» области может быть порядка нескольких нанометров. Этот метод получил название STED-микроскопия.
Принцип работы второго типа наноскопов опирается на возможность оптического «включения и выключения» флуоресценции отдельных флуорофоров. Получают изображение одного и того же образца несколько раз, включая то одни, то другие молекулы. Затем компьютер «накладывает» изображения друг на друга, и на суммарном изображении можно увидеть свечение каждой из близлежащих молекул. В «обычном», пусть даже и конфокальном, микроскопе они слились бы одно светящееся пятно. Такой подход назвали PALM-микроскопией.
Флуоресцентные «репортажи», зарегистрированные в виде цифровых изображений, «расшифровывают», то есть извлекают количественную информацию с помощью специальных компьютерных программ анализа изображений. Так можно измерять интенсивность флуоресценции и ее пространственное распределение, оценивать спектральные характеристики излучения (псевдоспектральный анализ), определять количество флуоресцирующих частиц (например, клеток), характеризовать временные и поляризационные параметры флуоресценции.
Следует отметить также и эстетическую информативность флуоресцентной микроскопии. Флуоресцентные репортеры на микрофотографиях открывают нам чарующий мир причудливого сочетания цвета и форм (рис. 8). Фирмы-производители микроскопов Nikon и Olympus даже проводят ежегодные конкурсы фоторабот о микромире в свете флуоресценции. С галереями работ-победителей в этих конкурсах можно познакомиться на сайтах Olympus BioScapes и Nikon Small World.
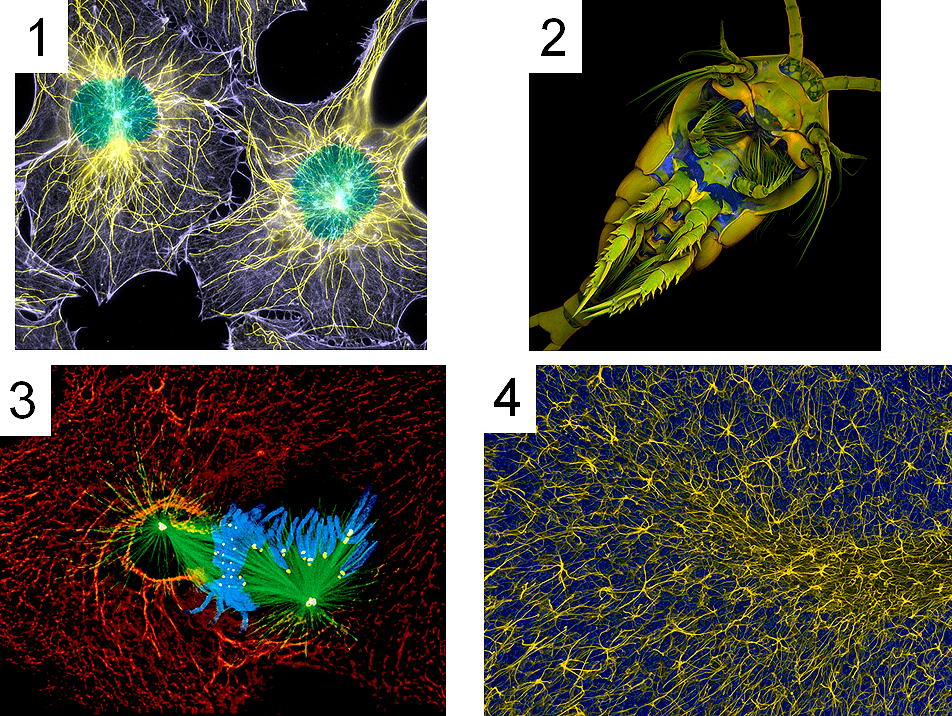
Рисунок 8. Флуоресцентные микрофотографии с галереи ежегодного конкурса Nikon Small World. 1. Фибробласты мыши. 2. Веслоногий рачок Temora longicornis. 3. Митоз в клетках легких тритона. 4. Клетки глии мозжечка мыши in vivo (двухфотонная флуоресцентная микроскопия).
В отличие от флуоресцентных микроскопов, проточные цитометры не дают возможности полюбоваться флуоресцирующими объектами. Как правило, это суспензии клеток, в которых находятся флуорофоры. Сильная сторона проточных цитометров — скорость регистрации сигналов от единичных объектов. Обычный коммерчески доступный цитометр позволяет измерять флуоресцентные сигналы от клеток со скоростью 1000 клеток в секунду, а специализированные высокопроизводительные — до 25000 клеток в секунду! Стандартный вариант работы предусматривает измерение у каждого объекта от двух до десяти параметров: светорассеяния и флуоресценции одного или нескольких флуорофоров. Измерения на большом массиве объектов позволяют получать статистически достоверные результаты при исследовании гетерогенности клеточных, в частности, микробных популяций.
Наряду с обычными проточными цитометрами существуют приборы, которые способны физически разделять (сортировать) клетки по определенным параметрам светорассеяния или флуоресценции. Это открывает возможность дальнейшего изучения определенных субпопуляций с использованием других методов.
О чем «сообщают» флуоресцентные репортеры
Как уже отмечалось (см. раздел Флуоресцентные репортеры), все флуоресцентные репортеры имеют «специализацию», т.е. способны избирательно характеризовать определенные свойства биологической системы. Остановимся вкратце на некоторых категориях «специалистов».
С помощью ряда флуоресцентных репортеров можно следить за ферментативным катализом. Как правило, это органические флуорофоры. Так, например, создают субстраты с ковалентно присоединенными флуорофорами, которые начинают флуоресцировать только после высвобождения в ходе реакции. Это и служит «сообщением» о ходе ферментативного катализа. Другой прием — использование «профлуорофора», который становится флуоресцентным в результате взаимодействия с продуктом реакции. С помощью флуоресцентных репортеров ферментативных реакций исследуют динамику процессов, а также их локализацию в клетках, тканях, органах и т.п.
Репортеры, сформированные на основе антител, «информируют» о протекании иммунологических реакций. Они представляют собой физические комплексы или ковалентные соединения флуорофоров с антителами (иммуноглобулинами). В качестве флуоресцирующего компонента показана возможность использования всех известных органических и неорганических флуорофоров, включая квантовые точки. Кроме того, к антителам можно присоединять ферменты, катализирующие реакции с образованием флуоресцирующего продукта. С помощью иммунологических флуоресцентных репортеров выявляют наличие в образцах определенных белков-антигенов, а также их локализацию. Так, например, показанные на рисунке 8 (фото 1) микрофибриллы в фибробластах мышей выявлены с помощью флуоресцентных антител.
Много видов информации можно получать с использованием ФБ. Разработаны методы создания генов гибридных белков, содержащих ФБ в качестве флуоресцирующей метки какого-нибудь естественного белка или даже нуклеиновой кислоты. Введение в клетки генов таких «гибридов» позволяет по флуоресценции определять «адреса» локализации молекулярных компонентов живых клеток, следить за динамикой их синтеза и перемещений. Существует рН-зависимость флуоресценции ФБ-содержащих гибридных белков, что используется для измерения внутриклеточного рН. Преимуществом таких рН-репортеров по сравнению с другими рН-чувствительными органическими флуорофорами является возможность измерений рН внутри различных внутриклеточных отделов (органелл), куда «адресован» основной компонент «гибрида».
Особый интерес вызывает применение различных ФБ в сочетании с методиками измерения флуоресценции, основанными на БПЭ. Для изучения взаимодействия или совместной локализации в клетках каких-нибудь двух белков к ним присоединяют два ФБ, подобранных так, чтобы при их сближении был возможен эффект БПЭ. Похожим образом можно изучать конформационные (структурные) изменения в белках. С этой целью соответствующие ФБ присоединяют к разным участкам белковой молекулы. Появление эффекта БПЭ свидетельствует о сближении ФБ и тем самым о конформационных перестройках в исследуемом белке. На этом же принципе работает «конструкция» из трех белков, которая используется как индикатор содержания ионов Са2+ в живых клетках. В нее входят два ФБ и Са2+-связывающий белок кальмодулин между ними. При связывании Са2+ конформация кальмодулина изменяется, ФБ сближаются и дают сигнал БПЭ. Здесь уместно заметить, что для регистрации ионов Са2+ внутри клеток существуют и «простые» органические флуоресцентные репортеры. Белковые же репортеры могут быть более точно «адресованы» в определенные внутриклеточные компоненты либо с помощью микроинъекций, либо путем включения в структуру белка с определенной внутриклеточной локализацией.
Чувствительность флуоресценции к физическим свойствам микроокружения, в котором находится молекулы флуорофоров, позволяет использовать некоторых из них в качестве репортеров различных параметров внутриклеточной среды. Измерение внутриклеточной вязкости основано на зависимости поляризации флуоресценции от вращательной диффузии репортеров. Благодаря специально отобранным репортерам удалось измерить вязкость цитоплазмы внутри некоторых органелл, а также в гидрофобном слое биомембран. Взаимодействие некоторых флуорофоров с биологическими мембранами зависит от разности электрических потенциалов на них. С помощью таких репортеров получают сведения о величине мембранного потенциала. Для измерения внутриклеточной температуры разработано несколько вариантов флуоресцентных репортеров на основе лантанидов, квантовых точек, термочувствительных полимеров и органических флуорофоров. Наиболее впечатляющие результаты получены от специально сконструированных органических флуорофоров, которые способны «сообщать» температуру в различных частях клеток, «зашифрованную» в динамических параметрах затухания флуоресценции.
Что нового о микромире мы узнали благодаря флуоресцентным репортерам?
Флуоресцентные репортеры долго и успешно «служат» экспериментальной биологии и медицине. Только перечисление различных вариантов их применения могло бы составить объем не одной статьи. Однако есть такие области, где они сыграли ключевую роль в изучении принципиальных свойств и явлений биологических систем. Отметим некоторые из них для иллюстрации.
С использованием флуоресцентных репортеров была экспериментально доказана модель жидкокристаллической структуры всех биологических мембран . Согласно этой модели, при структурной целостности и обеспечении барьера проницаемости для гидрофильных веществ биологическая мембрана достаточно «жидкая», чтобы в ней могли перемещаться «по назначению» ее отдельные компоненты. Такое представление о биологических мембранах позволяет понять основные молекулярные механизмы их функционирования, а также свойства живых клеток в целом.
В том числе благодаря флуоресцентным техникам было установлено, что мембрана является не просто пассивным «морем» фосфолипидов, в котором плавают «острова» мембранных белков, а полноправным участником множества важнейших биофизических процессов: «Липидный фундамент жизни» [8]. — Ред.
Механизмы трансформации энергии в клетках также стали понятны в значительной мере благодаря информации от флуоресцентных репортеров. Особую роль здесь сыграли флуорофоры, позволяющие регистрировать внутриклеточный и внутримитохондиральный рН , а также разность электрический потенциалов на мембранах. С их помощью прежде всего был выявлен механизм сопряжения энергодонорных реакций окисления с энергозатратным синтезом аденозинтрифосфата (АТФ) — универсального донора энергии для большинства метаболических процессов. Кроме того, была изучена природа накопления различных веществ в цитополазме и в клеточных органеллах за счет мембранного электрического потенциала и градиента рН.
об устройстве флуоресцентного pH-сенсора см. статью «Нано-pH-метр» [9]. — Ред.
Жизнедеятельность клеток обеспечивается совокупностью скоординированных в пространстве и времени биохимических реакций. Эта координация осуществляется за счет специфического взаимодействия компонентов так называемых сигнальных систем. Основные компоненты этих систем были изолированы и охарактеризованы с помощью методов традиционной биохимии и молекулярной биологии. Однако только с появлением подходов, основанных на применении флуоресцентных репортеров, стало возможным получать сведения о пространственно-временной организации сигнальных путей непосредственно в клетках. Так, в частности, можно в реальном времени следить за пространственной динамикой взаимодействия белков-компонентов сигнальных систем. Это позволяет изучать распространение, усиление и интеграцию сигналов в клетках. Более того, стало возможным на уровне единичных клеток оценивать динамику экспрессии генов, что позволяет подойти к развитию концепций клеточной индивидуальности в противовес традиционным статистическим подходам. Следует отметить также и то, что с помощью флуоресцентных репортеров удалось обнаружить неизвестные ранее сигнальные компоненты. Например, была выявлена принципиальная роль ионов Са2+ как сигнального посредника во многих регуляторных реакциях.
Во второй половине прошлого века в микробиологии возникла проблема, которую окрестили «великой аномалией учета микроорганизмов с помощью чашек Петри». «Виновниками» оказались флуоресцентные репортеры, два красителя нуклеиновых кислот — акридиновый оранжевый и 4,6-диамидино-2-фенилиндол. В многочисленных исследованиях природных образцов постоянно обнаруживалось несоответствие между данными о содержании микроорганизмов, полученными путем учета по колониям размножающихся клеток на чашках Петри, и данными прямого подсчета микроорганизмов, прокрашенных флуоресцентными красителями нуклеиновых кислот, с помощью микроскопии. Флуоресцентные репортеры всегда выявляли значительно больше микроорганизмов, чем анализ с чашками Петри. Для объяснения этих данных были выдвинуты две гипотезы. Согласно первой, часть клеток может находиться в некотором состоянии «покоя» и не размножается на чашках Петри. Согласно второй, условия культивирования (состав среды, температура и др.) не соответствуют «потребностям» некоторой части популяции для размножения. Проверка этих гипотез показала, что обе эти возможности могут реализовываться. Более того, был дан толчок к формированию двух новых больших направления исследований.
Первое связано с изучением так называемого «жизнеспособного, но некультивируемого состояния микроорганизмов». Особая значимость этого направления обусловлена наличием такого состояния у многих патогенных для человека микроорганизмов. В этом состоянии они как бы «невидимы» для стандартных методов диагностики. Кроме того, в этом состоянии у них увеличивается устойчивость к лекарственным препаратам.
Второе направление — это выявление и изучение микроорганизмов непосредственно в природных образцах (лат. in situ, буквально — на месте) путем прямого анализа их нуклеиновых кислот без предварительного получения чистых культур, как это делалось раньше. Это направление даже получило собственное название — метагеномика. Благодаря методам метагеномики, среди которых, кстати, некоторые основаны на использовании флуоресцентных репортеров, появилась возможность по-новому оценить биологическое разнообразие микроорганизмов в отдельных экосистемах и на Земле в целом. Вот так «незатейливые» репортажи двух флуоресцентных репортеров способствовали появлению двух важнейших направлений исследований в современной микробиологии.
Наконец, благодаря использованию флуоресцентных репортеров созданы оптические микроскопы, которые преодолели «магический барьер» принципа Аббе, постулировавшего, что разрешение, которое может быть достигнуто с помощью оптической микроскопии не может быть меньше, чем 0,2 мкм. За разработку метода флуоресцентной микроскопии сверхвысокого разрешения («наноскопию») в 2014 году Нобелевская Премия по химии была присуждена Эрику Бетцигу (Eric Betzig), Штефану Хеллю (Stefan Hell) и Уильяму Мернеру (William Moerner). Прочесть об их открытиях подробнее можно в статье «По ту сторону дифракционного барьера: Нобелевская премия по химии 2014» [10].
Итак, флуоресцентные репортеры сегодня представляют собой большую армию разнообразных «специалистов», которые уже имеют славную историю в экспериментальной биологии и медицине. Их флуоресцентные репортажи позволили лучше «разглядеть» те уголки микромира, куда может проникнуть свет. Причем разглядеть не только визуально, но и с точки зрения понимания физико-химических и биологических закономерностей. И все же исследователи, работающие в области разработки и применения этих «молекулярных помощников» изучения микромира, считают, что это только начало!
Первоначально статья была опубликована в «Химии и жизни» [11].
Литература
- Биолюминесценция: возрождение;
- Lakowicz J.R. Principles of fluorescence spectroscopy (3rd Edition). Springer Science + Business Media, LLC, 2006;
- Рулетка для спектроскописта;
- Флуоресцирующая Нобелевская премия по химии;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Квантовые точки — наноразмерные сенсоры для медицины и биологии;
- Сычевский А. (2012). Технология акустической фокусировки частиц в проточной цитометрии. ИБХ;
- Липидный фундамент жизни;
- Нано-pH-метр;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Пучков Е.О. (2014). Флуоресцентные репортеры и их репортажи. «Химия и жизнь». 9, 8–13.