Биолюминесценция: возрождение
24 сентября 2014
Биолюминесценция: возрождение
- 6118
- 0
- 9
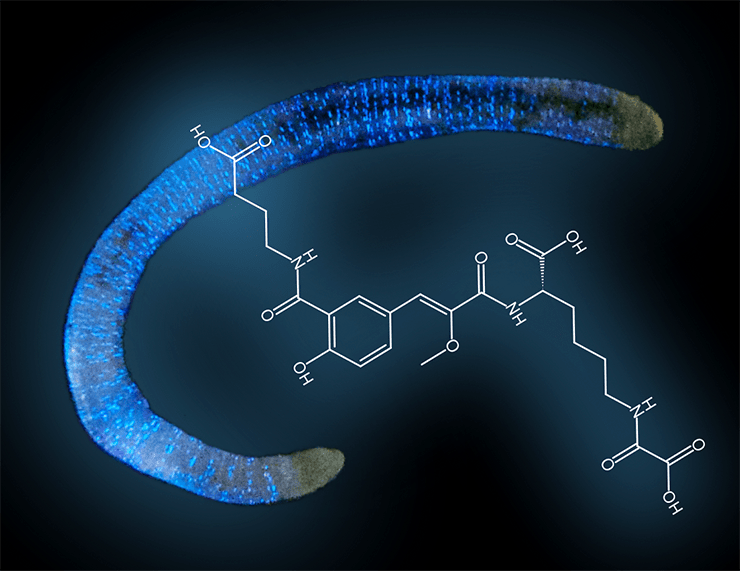
Сибирский биолюминесцентный червь Fridericia heliota и структура люциферина F. heliota
-
Авторы
-
Редакторы
Статья на конкурс «био/мол/текст»: Феномен биолюминесценции известен около двух с половиной тысячелетий, однако только в ХХ веке ученые вплотную взялись за изучение его химической природы. По современным оценкам, существует около 30 различных биолюминесцентных систем, но на данный момент известны структуры только семи природных люциферинов, последняя из которых была расшифрована 25 лет назад. В ходе недавнего исследования, проведенного совместно группой синтеза природных соединений и лабораторией биомолекулярной ЯМР-спектроскопии ИБХ РАН в Москве, а также красноярской лабораторией фотобиологии ИБФ СО РАН, была расшифрована структура и проведен полный синтез нового люциферина, обладающего уникальными химическими свойствами. Этот люциферин является ключевым компонентом новой АТФ-зависимой биолюминесцентной системы.
Конкурс «био/мол/текст»-2014
 Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2014.
Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2014.
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
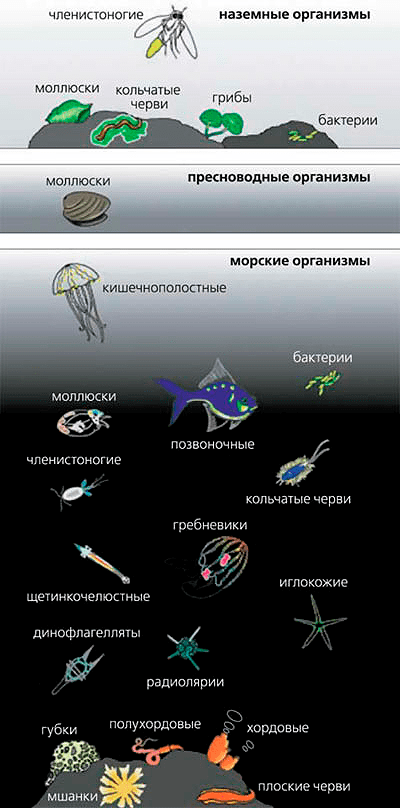
Рисунок 1. Многообразие биолюминесцентных организмов
Морской черт, подстерегающий на глубине добычу, привлекает «обед» светящимся концом специальной «удочки» перед ртом. Медуза, чтобы защититься от краба, окутывает себя спасительным ореолом. Рачок, несший нелегкую службу во Вторую мировую войну, позволял японским солдатам освещать карты незаметно для противника. Длинен ряд существ, использующих для своих (а иногда и чужих) разнообразных целей удивительный процесс — биолюминесценцию (от греч. βioς — жизнь — и лат. lumen — свет). Способностью излучать в видимом диапазоне обладают эволюционно разнородные группы организмов. В их числе некоторые бактерии, грибы, кораллы, медузы, водоросли, черви, моллюски, насекомые, рыбы (но не более высокоорганизованные животные). Около 700 родов содержат виды, испускающие свет самостоятельно или благодаря симбионтам (рис. 1). Биолюминесценция используется для привлечения добычи, освещения, коммуникации, маскировки, а также как средство обороны, нападения, отпугивания или отвлечения, в качестве «любовного» языка, предупреждения или угрозы. Продолжительность свечения варьирует от долей секунды до часов, цвет — от голубого до красного. У бактерий свет создается в цитоплазме, у одноклеточных эукариот — в специальных органоидах, у высокоразвитых организмов (насекомых, рыб) — в особых органах (от скоплений железистых клеток до сложных образований, содержащих люминесцирующие бактерии). Помимо внутриклеточного свечение бывает секреторного типа: кальмары для ослепления противника выбрасывают в воду «облако» из продуктов секреции двух желез.
Особенность биолюминесцентных систем в том, что они не закреплялись эволюционно, а формировались в каждом случае независимо. Известно около 30 различных механизмов, обеспечивающих свечение [1]. В отличие от многих структурных белков и ферментов (гистонов, цитохромов, мышечных белков), сходных у филогенетически далеких форм, компоненты биолюминесцентных систем у родственных животных могут быть различны. Считается, что биолюминесценция впервые возникла на стадии перехода от анаэробных форм жизни к аэробным, хотя общего мнения по этому вопросу нет [2].
Сущность явления
Природа биолюминесценции — химическая. Субстрат люциферин — маленькая органическая молекула — окисляется под действием специфического фермента люциферазы. Люциферины и люциферазы у различных биологических видов химически не идентичны. Все такие реакции требуют окислителя (чаще всего молекулярного кислорода, иногда перекиси водорода) и протекают с образованием промежуточных комплексов — органических перекисных соединений. При их распаде высвобождается энергия, которая не рассеивается в виде тепла, а возбуждает молекулы вещества, испускающего фотоны (отсюда название «холодное свечение»). От их энергии, а значит от типа конкретного люциферина, зависит частота света (т.е. цвет). В трех известных случаях участником люциферин-люциферазной реакции становится еще и аденозинтрифосфат (АТФ). Это свойственно многоножке Luminodesmus sequoia, грибной мушке Arachnocampa flava и всем видам светляков. Биолюминесценция, однако, может происходить и по-другому. Свечение медузы Aequorea обусловлено взаимодействием специфического белка экворина с ионами кальция, причём без участия кислорода.
От суеверных страхов к знанию
О загадочном свечении морских вод, рыб и некоторых грибов писал еще Аристотель (384–322 гг. до н.э.). Мореплаватели приписывали этому явлению мистические свойства, считая его источником огонь из преисподней. Однако если в начале нашей эры свечение моря пытались объяснить эффектом бомбардировки частиц воды солью (по аналогии с искрой из-под кремня, ударяющего о сталь), а свечение рыб — содержащимся в их чешуе фосфором, то сегодня эти предположения могут вызвать лишь снисходительную улыбку.
Научные основы биолюминесценции заложил Роберт Бойль (1627–1691), знаменитый и известный всем со школьной скамьи (закон Бойля—Мариотта) английский физик, один из учредителей Лондонского королевского общества. Он показал абсурдность предрассудков и суеверий, порожденных этим явлением, обнаружив его сходство с горением — простой химической реакцией, которая прекращается в отсутствие кислорода. Откачивая воздух из сосуда с куском светящегося (из-за грибов) дерева, он наблюдал, как излучение, постепенно ослабевая, исчезает совсем, но возобновляется, когда в сосуд опять попадает кислород. Изучение механизмов органического свечения продолжил Рафаэль Дюбуа (1849–1929). Из экстрактов люминесцирующих жуков Pyrophorus он выделил две фракции, ответственные за возникновение света в присутствии кислорода. Белковую составляющую, которая теряла активность при нагревании (как ферменты), он назвал люциферазой, а термоустойчивую низкомолекулярную — люциферином.
С тех пор было сделано множество открытий, связанных с природой биолюминесценции. Однако в 2006 г. нобелевский лауреат Осаму Шимомура [4], посвятивший более 50 лет своей жизни исследованию этого завораживающего явления, с сожалением отметил, что значительный прогресс, достигнутый в этой области, сменился упадком [1]. На сегодняшний день известны структуры только семи природных люциферинов. Если в третьей четверти XX в. были определены пять из них, то в последней четверти — только два. К тому же последняя структура нового люциферина из динофлагеллят (простейших организмов, составляющих значительную часть морского планктона и светящихся от движения водных масс) была охарактеризована уже четверть века назад [5].
Долгожданный прорыв
Недавно в таежных районах юга Красноярского края был открыт новый люминесцирующий вид кольчатых червей семейства энхитреид. Один из авторов этой статьи (В.Н. Петушков), специалист по люминесценции бактерий, еще студентом, работая ночью на биостанции Красноярского университета, заметил, что его следы на земле светятся. Источником голубоватого излучения оказались мелкие черви. Тогда эта находка не показалась важной, и о сибирских светящихся червях забыли на много лет. А в конце 1980-х годов В.Н. Петушков с коллегой Н.С. Родионовой вернулся на биостанцию, чтобы попытаться определить вид этих существ. Выяснилось, что миру они неизвестны. С помощью Н.Т. Залесской, специалиста по беспозвоночным из московского Института проблем эволюционной морфологиии и экологии животных им. А.Н. Северцова РАН, было сделано первое краткое описание нового вида олигохет, названного Fridericia heliota (рис. 2) [6].
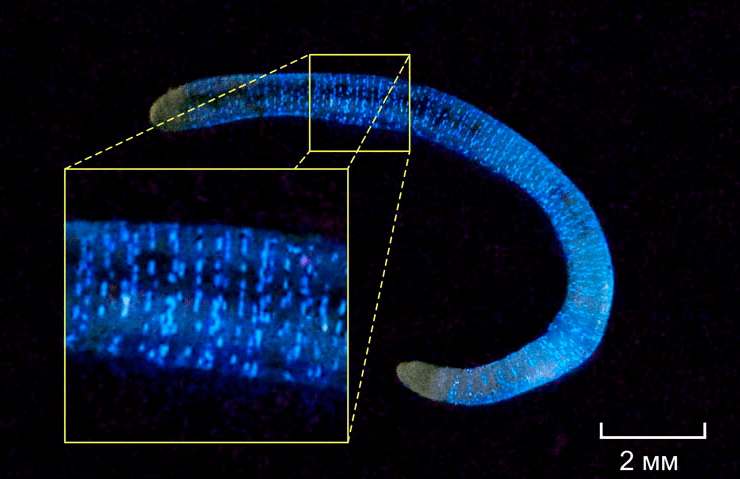
Рисунок 2. Свечение червя Fridericia heliota
фото А.А. Семенова
Небольшие (длина взрослой особи 15–20 мм, диаметр 0.5 мм, масса 2 мг) бело-желтые черви F. heliota живут в лесных сибирских почвах. Они испускают зеленовато-голубой свет (максимум спектра излучения приходится на 478 нм), который после механического, химического или электрического раздражения постепенно, в течение примерно 10 минут, затухает. Светящиеся точки расположены на теле червя, а целомическая жидкость (заполняющая вторичную полость тела) не излучает. Считалось, что люминесценция всех земляных червей имеет единый характер. 12 видов из шести родов олигохет (Diplocardia, Diplotrema, Fletcherodrilus, Octochaetus, Pontodrilus и Spenceriella) выделяют целомическую жидкость, в клетках которой содержится биолюминесцентная система, включающая перекись водорода [7]. Наиболее полно механизм свечения изучен у крупных (длина около 60 см, масса 7 г) червей Diplocardia longa, обитающих в песчаных почвах на юге штата Джорджии (США). Люциферин D.longa, алифатический альдегид N-изовалерил-З-амино-1-пропаналь, служит субстратом для люцифераз всех других светящихся олигохет. Более того, люцифераза D. longa активна в кросс-реакциях (когда два взаимодействующих вещества берут от двух разных видов животных) с люциферинами других червей [8]. Но сибирский червь F. heliota оказался уникальным — кросс-реакции с люциферинами и люциферазами любых других организмов дали отрицательный результат. Это подразумевало, что механизм биолюминесценции у F. heliota и других видов отличается. В 2003 г. совместно с итальянским специалистом по систематике червей Э. Рота было опубликовано подробное описание светящегося червя из сибирской тайги [9].
Трудный путь к свету
В 2003–2007 гг. группа Петушкова провела первые исследования свойств биолюминесцентной системы F. heliota и выявила ее необходимые компоненты — новые люциферин и люциферазу, кислород, АТФ и ионы магния. Люциферин и люциферазу очистили, получили ультрафиолетовый спектр (зависимость поглощения от длины волны в ультрафиолетовом диапазоне) люциферина, исследовали рН- и температурную зависимости скорости реакции in vitro, влияние на нее солей и детергентов [10–12]. Эта работа требовала непрерывного поступления биомассы червей, которых ежегодно с тоннами земли в летне-осенний период и днем, и ночью добывали в лесах. В 2011 г. Шимомура возглавил новую лабораторию биолюминесцентных биотехнологий в Сибирском федеральном университете, и работы по изучению механизма испускания света F. heliota продолжились.
Чтобы установить структуру природного вещества, сначала его надо выделить в чистом виде. С люциферином F. heliota возникли серьезные затруднения из-за ограниченности биомассы червей (ручной сбор давал около 30 г в год, а в лабораторных условиях эти черви не хотят размножаться) и низкого содержания люциферина (приблизительно 0.1 мкг на 1 г необработанной биомассы) [12]. Ценой огромных усилий группе Петушкова за несколько лет из 90 г биомассы червей удалось выделить всего 5 мкг люциферина. Помимо него, экстракт F. heliota содержал несколько соединений неустановленного состава, которые похожи на люциферин по своим спектральным и хроматографическим свойствам. Они флуоресцируют так же, как и настоящий люциферин, но им самим не являются. Петушков предположил, что эти соединения — неактивные аналоги люциферина (его предшественники или продукты деградации). Значит, они должны иметь схожую с люциферином структуру. Одним из основных компонентов экстракта червя (его содержание в 30 раз больше, чем люциферина) было соединение, названное CompX. Выделенного количества (около 150 мкг) вполне хватило, чтобы получить всю информацию о его структуре [13].
Основной метод определения состава и строения вещества в современной органической химии — спектроскопия ядерного магнитного резонанса (ЯМР) [14]. Его важный частный случай — протонный магнитный резонанс. Ядро атома водорода, 1Н, во внешнем магнитном поле может находиться в двух энергетических состояниях: его собственный магнитный момент (важно, что он ненулевой) может ориентироваться по направлению поля и против него. Переход с нижнего энергетического уровня на верхний сопровождается поглощением энергии (ΔE = hn, где E, h и n — энергия, постоянная Планка и частота излучения соответственно), которое регистрируется ЯМР-спектрометром. Ампулу с растворенным исследуемым веществом помещают в сильное магнитное поле и подвергают воздействию импульсов радиочастотного излучения. При определенных частотах протоны резонируют — частота импульса оказывается равной частоте переходов между энергетическими уровнями. При возникновении таких переходов образцом поглощается энергия внешнего поля. Частота ЯМР зависит от напряженности магнитного поля, а при заданном его значении — от магнитного момента исследуемого типа ядер. Однако частота резонанса для ядер одного химического элемента чрезвычайно чувствительна к их химическому окружению. Электронные оболочки атомов и молекул реагируют на внешнее магнитное поле, частично экранируя его, что приводит к изменению частоты резонанса — химическому сдвигу. Его величина зависит от окружения исследуемого ядра, взаимного расположения соседних атомов в пространстве, связи между ними. Часто в образце содержится несколько типов молекул, или в сложных органических молекулах резонирующие ядра находятся в разных атомных группах. Тогда даже для похожих атомов в близком окружении спектр ЯМР покажет разные сигналы, если атомы химически различны. Положение сигнала в спектре характеризует строение атомных групп, окружающих исследуемое ядро, а соотношение амплитуд пиков дает информацию об относительном количестве ядер с разным химическим окружением. Более того, из-за взаимодействия магнитных моментов разных ядер сигнал резонансного поглощения каждого из них может представлять собой сложный мультиплет (эффект спин-спинового взаимодействия), число и интенсивность компонент которого тоже однозначно связаны со строением молекулы исследуемого вещества. Так, спектр ЯМР позволяет расшифровать химическое строение и структуру сложнейших органических соединений.
Итак, по данным ЯМР- и масс-спектроскопии (метода исследования вещества, требующего его ионизации и основанного на определении соотношения массы и заряда образующихся ионов) М.А. Дубинный и К.Д. Надеждин из Института биоорганической химии предложили структуру соединения CompX. Оно оказалось необычным (такой молекулы в природе еще не находили) производным аминокислоты тирозина, получаемым в результате трех модификаций: дезаминирования до кетокислоты, метилирования енола и карбоксилирования ароматического кольца. Для установления конфигурации двойной связи А.С. Царькова и М.С. Баранов (из ИБХ) синтезировали и сравнили спектральные данные обоих изомеров (рис. 3). Z-изомер оказался идентичен природному образцу. Тогда как E-изомер обладал значимо отличными спектральными свойствами, в том числе отсутствием флуоресценции.
Z от нем. zusammen — вместе; когда старшие заместители у каждого из атомов углерода, образующих двойную связь, расположены по одну сторону от нее.
E от нем. entgegen — против; старшие заместители у атомов углерода из пары — по разные стороны от двойной связи.
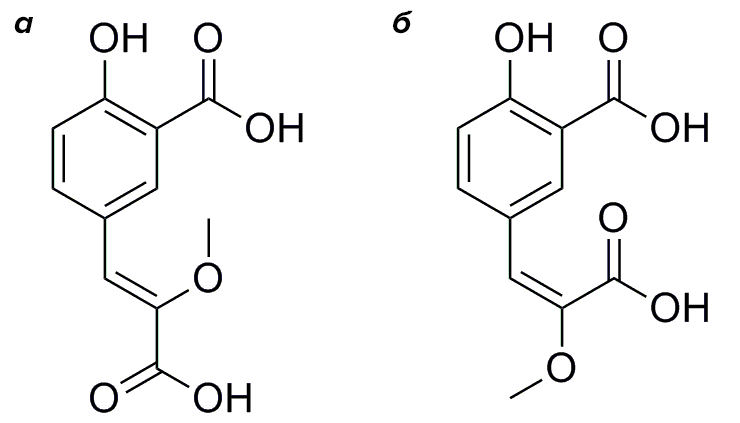
Рисунок 3. Структуры CompX (а) и его неприродного изомера (б)
Чрезвычайно малое количество люциферина, добытое из экстракта червей F. heliota, позволило получить лишь масс-спектры высокого разрешения и часть ЯМР-спектров. По ним были расшифрованы три фрагмента структуры люциферина: это оказались CompX, лизин и γ-аминомасляная кислота (ГАМК). Но как они соединяются между собой, было непонятно, так как для дальнейшего исследования не хватило люциферина. Наиболее вероятный способ, каким они могут образовать устойчивое соединение (не противоречащее имеющимся данным ЯМР), — с помощью пептидных связей между некоторыми из их четырех карбоксильных и трех аминогрупп. Дубинный снял [15] 1H ЯМР-спектры люциферина при нескольких значениях рН, чтобы различить свободные карбоксильные группы и те, которые образуют пептидные связи с аминогруппами остатков лизина и ГАМК. Дело в том, что свободные карбоксильные группы переходят из формы COOH в кислом растворе в COO− в нейтральной и щелочной среде, а эти изменения отражаются на соседних группах, за которыми наблюдают методом ЯМР. Зависимость от pH химических сдвигов протонов, прилегающих к титруемым карбоксильным группам, показала, что в лизине и ГАМК они свободны, а принадлежащие CompX вовлечены в пептидную связь. Данные масс-спектров позволили установить брутто-формулу люциферина: C23H29N3O11. Вычисленная по ней масса и суммарная масса фрагментов CompX, лизина и ГАМК за вычетом двух молекул воды, которые освобождаются при образовании двух пептидных связей, отличаются на массу C2O3. «Недостача» как раз соответствует остатку щавелевой кислоты (оксалата), невидимой в тех ЯМР-экспериментах, которые удалось провести с 5 мкг вещества. Люциферин F. heliota оказался необычным олигопептидом, состоящим из четырех остатков. Спектральным и масс-спектрометрическим данным не противоречили только четыре структурных изомера (рис. 4), которые отличались порядком пептидных связей, соединяющих четыре «строительных кирпичика» люциферина F. heliota — CompX, лизин, ГАМК и оксалат.
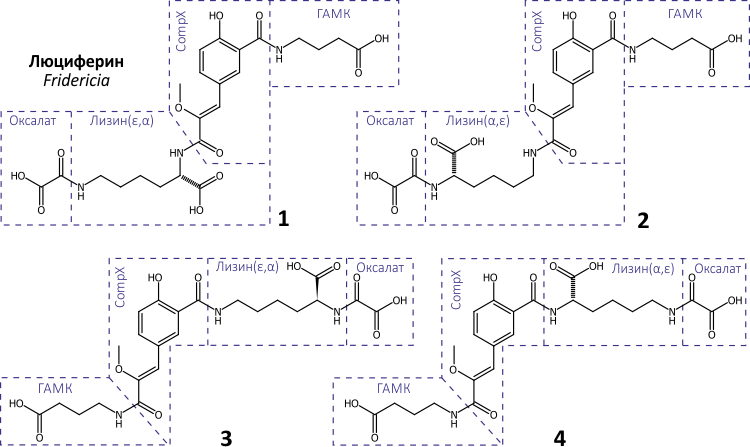
Рисунок 4. Структуры четырех пептидных изомеров люциферина F. heliota
Чтобы выяснить, какой из четырех пептидных изомеров отражает строение люциферина, пришлось провести их полный синтез, а затем сравнить ЯМР-спектры синтетических и природного соединений. Из четырех синтезированных только вещество 1 (рис. 4) по всем спектральным характеристикам оказалось идентичным природному люциферину (рис. 5). И только оно обладало способностью испускать свет при добавлении белкового экстракта F. heliota в присутствии АТФ и MgSO4 (рис. 6). Более того, спектр люминесценции и зависимость интенсивности свечения от концентрации вещества у синтетического и природного люциферинов были идентичны [16].
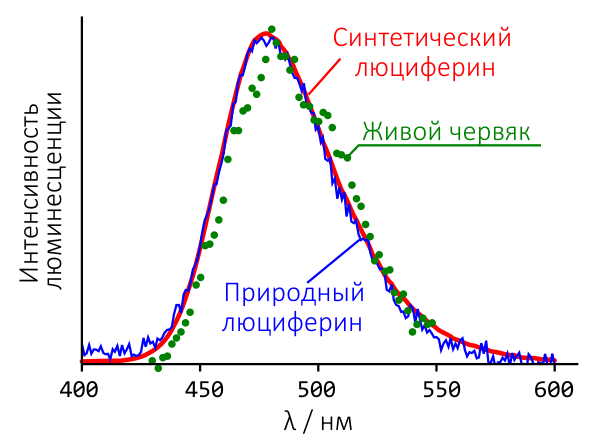
Рисунок 5. Спектры люминесценции червей F. heliota in vivo, природного и синтетического люциферинов

Рисунок 6. Люминесценция синтетического люциферина в присутствии экстракта червей F. heliota, АТФ, кислорода O2 и ионов магния Mg2+
Открытый люциферин стал восьмым известным науке. 25-летний перерыв в установлении новых механизмов биолюминесценции в живой природе завершился. Предположительно, в ходе соответствующей реакции происходит окисление одной из трех свободных карбоксильных групп люциферина, в то время как флуоресцентный остаток CompX отвечает за испускание квантов света. Аналогичный химический процесс лежит в основе работы «светящихся палочек». В цилиндрическом пластиковом контейнере, наполненном смесью флуорофора и дифенилового эфира щавелевой кислоты (дифенилоксалата), находится стеклянная капсула с перекисью водорода. При изгибе палочки внутренняя капсула разрушается, а дифенилоксалат и перекись водорода, смешиваясь, вступают в химическую реакцию, продукты которой — две молекулы фенола и одна эфира пероксикислоты (1,2-диоксетандион). Эфир спонтанно распадается на диоксид углерода с выделением энергии, которая возбуждает молекулы флуорофора. Последний высвобождает ее, испуская фотоны.
Открытие и расшифровка структуры компонента новой биолюминесцентной системы помимо чисто научного имеет и важное прикладное значение. Явление биолюминесценции очень широко применяется. Светящиеся метки используют для проведения анализов в медицине и фармацевтике, в лабораторных исследованиях — для визуализации различных физиологических процессов и активности генов, измерения концентрации АТФ. В экологии биолюминесценцию применяют для мониторинга окружающей среды. В тест-системах для поиска лекарств люциферин-люциферазные системы служат своего рода лампочкой, помогающей определить, есть ли в электрической цепи напряжение. Люциферин Fridericia heliota непременно займет свою нишу в прикладной биолюминесценции. Он прост в химическом синтезе, исключительно стабилен в течение месяцев (а не часов, как самый используемый сегодня люциферин — светлячковый) и нетоксичен (в отличие от люциферина бактерий).
Исходно статья была опубликована в «Природе» [17] и «Науке и Жизни» [18], а также представлена в виде пресс-релиза на сайте ИБХ [19].
Литература
- Shimomura O. Bioluminescence. WORLD SCIENTIFIC, 2006;
- Лабас Ю.А. и Гордеева А.В. (2003). Свет и цвет живых организмов. «Природа». 2, 25–31;
- Santiago Roura, Carolina Gálvez-Montón, Antoni Bayes-Genis. (2013). Bioluminescence imaging: a shining future for cardiac regeneration. J. Cell. Mol. Med.. 17, 693-703;
- Флуоресцирующая Нобелевская премия по химии;
- Hideshi Nakamura, Yoshito Kishi, Osamu Shimomura, David Morse, J. Woodland Hastings. (1989). Structure of dinoflagellate luciferin and its enzymic and nonenzymic air-oxidation products. J. Am. Chem. Soc.. 111, 7607-7611;
- Залесская Н.Т., Петушков В.Н., Родионова Н.С. (1990). Светящиеся почвенные энхитреиды (Oligochaeta, Enchytraeidae). «Докл. АН СССР». 310, 496–498;
- John E. Wampler, B.G.M. Jamieson. (1980). Earthworm bioluminescence: Comparative physiology and biochemistry. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry. 66, 43-50;
- Hiroko Ohtsuka, Noel G. Rudie, John E. Wampler. (1976). Structural identification and synthesis of luciferin from the bioluminescent earthworm, Diplocardia longa. Biochemistry. 15, 1001-1004;
- Emilia Rota, Nadezhda T. Zalesskaja, Natalja S. Rodionova, Valentin N. Petushkov. (2003). Redescription of Fridericia heliota (Annelida, Clitellata: Enchytraeidae), a luminous worm from the Siberian taiga, with a review of bioluminescence in the Oligochaeta. J. Zoology. 260, 291-299;
- V. N. Petushkov, N. S. Rodionova, V. S. Bondar'. (2003). . Doklady Biochemistry and Biophysics. 391, 204-207;
- N. S. Rodionova, V. S. Bondar', V. N. Petushkov. (2003). . Doklady Biochemistry and Biophysics. 392, 253-255;
- V.N. Petushkov, N.S. Rodionova. (2007). Purification and partial spectral characterization of a novel luciferin from the luminous enchytraeid Fridericia heliota. Journal of Photochemistry and Photobiology B: Biology. 87, 130-136;
- Valentin N. Petushkov, Aleksandra S. Tsarkova, Maxim A. Dubinnyi, Natalja S. Rodionova, Simone M. Marques, et. al.. (2014). CompX, a luciferin-related tyrosine derivative from the bioluminescent earthworm Fridericia heliota. Structure elucidation and total synthesis. Tetrahedron Letters. 55, 460-462;
- Федин Э.И. (1980). ЯМР-интроскопия — новый метод изучения структуры биологических объектов. «Природа». 4, 77–81;
- Дубинный М. (2012). Как разгадать химический кроссворд: рисуем формулу вещества по ЯМР- и масс-спектрам. Семинар Совета молодых ученых ИБХ РАН;
- Valentin N. Petushkov, Maxim A. Dubinnyi, Aleksandra S. Tsarkova, Natalja S. Rodionova, Mikhail S. Baranov, et. al.. (2014). A Novel Type of Luciferin from the Siberian Luminous EarthwormFridericia heliota: Structure Elucidation by Spectral Studies and Total Synthesis. Angew. Chem. Int. Ed.. 53, 5566-5568;
- Ямпольский И.В., Царькова А.С., Дубинный М.А., Петушков В.Н., Родионова Н.С. (2014). Биолюминесценция: возрождение. «Природа». 7, 10–16;
- Восьмая формула света. (2014). «Наука и жизнь». 6, 2–3;
- Ямпольский И.В. (2014). Восьмая формула света. ИБХ.