Взаимосвязь между курением и болезнью Паркинсона: можно ли извлечь выгоду из вредной привычки?
10 февраля 2025
Взаимосвязь между курением и болезнью Паркинсона: можно ли извлечь выгоду из вредной привычки?
- 424
- 0
- 2
Бактерии способны влиять на нервную систему человека с помощью внеклеточных везикул.
Рисунок в полном размере.
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В статье будут описаны данные о нейропротекторном (предотвращающем гибель нейронов) влиянии отдельных компонентов табачного дыма (никотин, СО, нафтохиноны) на моделях паркинсонического синдрома у животных (индуцированный МФТП паркинсонизм и др.). Цель работы — пролить свет на активно ведущиеся опыты по изучению такого парадоксального явления, как нейропротекция у курящих пациентов с болезнью Паркинсона. Надо отметить, что авторы ни в коем случае не призывают к курению, а, скорее, ведут размышления о возможной терапевтической роли отдельных компонентов в составе правильных фармацевтических композиций (в качестве примера будет упомянут HBI-002, представляющий собой жидкую композицию низких доз СО для приема внутрь, разрабатываемый компанией Hillhurst Biopharmaceuticals).
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что представляет из себя болезнь Паркинсона?
Болезнь Паркинсона (БП) — нейродегенеративное заболевание, в основе которого лежит гибель дофаминергических нейронов черной субстанции (substantia nigra, SN) — главного места синтеза дофамина. Возникающий в результате дефицит дофамина приводит к целому спектру двигательных расстройств, среди которых особенно можно отметить ригидность мышц, тремор покоя, брадикинезию и постуральную неустойчивость [1]. Кроме того, наблюдаются и немоторные нарушения, которые часто могут проявляться даже за годы до постановки диагноза заболевания [2]. К подобным симптомам можно отнести депрессию, снижение обоняния или его полную потерю, тревожность и др. Отмечались также случаи аномальных изменений поведения, например, пристрастие к азартным играм, увеличение потенции, агрессивность [3].
Стоит отметить, что патофизиология БП достаточно сложна в связи со множеством процессов, вовлеченных в нейродегенерацию. Однако можно все же выделить несколько ключевых патологических звеньев, которые так или иначе в конечном итоге и приводят к гибели нейронов. К подобным событиям относятся агрегация и накопление токсичного белка α-синуклеина (более подробно о данном белке рассказывается в одной из статей на «Биомолекуле» [4]), митохондриальная дисфункция, нарушение в работе убиквитин-протеасомной и аутофаго-лизосомальной систем и нейровоспаление [1] (рис. 1). Детально рассматривать вышеперечисленные патологические процессы не является задачей текущей статьи, однако стоит отметить, что все они часто связаны со многими другими патофизиологическими процессами, такими как нарушение везикулярного транспорта, потеря целостности микротрубочек, нарушения метаболизма железа и эксайтотоксичность нейронов [1]. Также зачастую многие из этих процессов приводят к окислительному стрессу, тем самым опосредуя нейродегеративные изменения. Более того, все эти механизмы потенциально способствуют запрограммированной клеточной смерти (апоптозу) или некрозу. Однако, поскольку клеточные процессы динамичны, а нейродегенерация происходит в течение длительного периода воздействия неблагоприятных факторов/стрессов и с участием различных компенсаторных механизмов, невозможно с уверенностью определить, работают ли эти механизмы независимо друг от друга или сходятся к одному пути гибели нейронов. Более вероятно, что различные патофизиологические процессы пересекаются друг с другом, что приводит к каскаду нарушений и, в конечном итоге, к необратимому повреждению клеток.
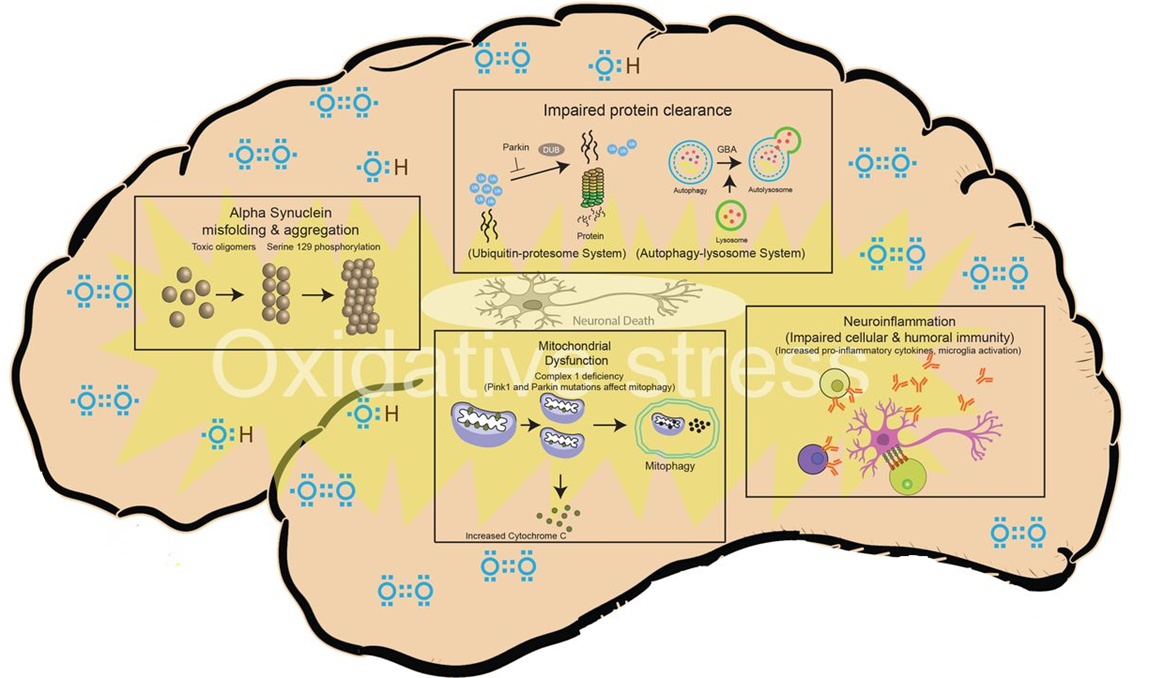
Рисунок 1. Основные патологические звенья болезни Паркинсона. Примечание: на рисунке изображены следующие патологические звенья, играющие ведущую роль патогенезе БП: неправильный фолдинг и агрегация токсичного белка альфа-синуклеина, нарушенный клиренс белков (нарушение в работе убиквитин-протеасомной системы), митохондриальная дисфункция, приводящие в итоге к митофагии и нейровоспаление.
А что по поводу сигарет?
Какую же пользу можно извлечь для потенциального лечения БП из такой вредной привычки, как курение? Конечно, из самого процесса курения — никакого, поскольку, как известно, курение повышает риски многих сосудистых и легочных заболеваний (ишемическая болезнь сердца, инфаркт миокарда, хронические обструктивные заболевания легких, пневмония и рак полости рта, пищевода и легких). Однако из отдельных компонентов, входящих в состав курительной смеси сигареты, можно извлечь определенную пользу. Исследования потенциального нейропротекторного действия (то есть защитное действие на нейроны, предотвращающее их гибель) ряда компонентов табачного дыма началось после весьма парадоксального открытия: того факта, что у курильщиков относительный риск развития БП значительно ниже, чем у некурящих.
Так, метаанализ клинических обсервационных исследований (отобраны публикации за период с 1959 по 2014 год в базах данных PubMed, ScienceDirect, Springer Link и Web of Science с расчетом относительных рисков — ОР — для конкретного исследования и 95% доверительного интервала — ДИ) показал, что суммарный ОР развития БП составил 0,59 (95% ДИ 0,56–0,62) для тех, кто когда-либо курил, по сравнению с теми, кто никогда не курил. Интересно отметить, что подобный защитный эффект был более выражен у мужчин, чем у женщин, а обратный эффект был немного выше в клинических исследованиях, чем в популяционных. Кроме того, наблюдалась значительная обратная зависимость «доза—эффект» от количества выкуренных пачек сигарет в год [5]. Так, авторы приходят к выводу о наличии обратной зависимости между курением и риском развития БП.
Другим примером, подтверждающим эту необычную зависимость, является исследование, проводимое на 30 000 врачей мужского пола в течение 65 лет [6]. Авторы сравнивали риски смерти от БП в зависимости от курения у врачей, участвовавших в когортном (для групп, объединенных общим признаком) исследовании в 1951 году, и у тех, кто дожил до повторного обследования, проводившегося периодически в течение пяти десятилетий (выживаемость участников исследования оценивалась до 2016 года). Смертность по определенным причинам наблюдалась в течение 65 лет и включала 283 случая смерти от БП. В ходе исследования было установлено, что смертность от БП была ниже у курящих в настоящее время, чем у никогда не куривших. Согласно этому исследованию, риск развития БП был на 40% ниже у курящих в настоящее время по сравнению с никогда не курившими [6] (рис. 2). Таким образом, выходит, что риск развития БП был обратно пропорционален количеству выкуриваемого табака.
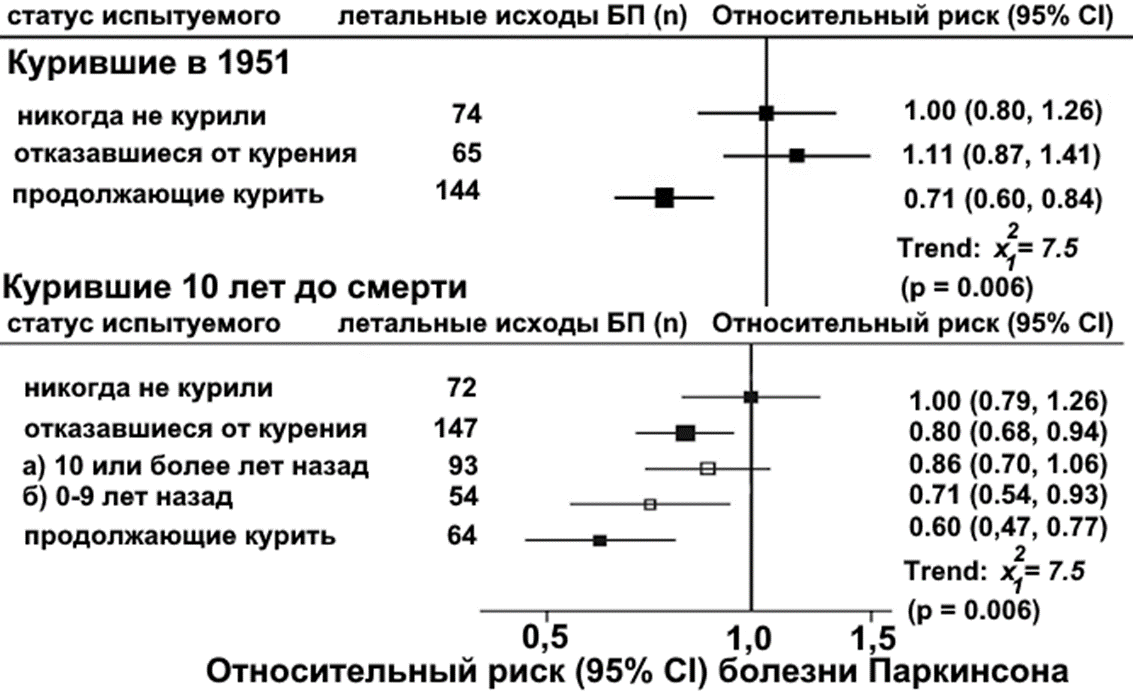
Рисунок 2. Относительный риск развития БП в зависимости от статуса курильщика по данным первоначального обследования в 1951 году и повторных обследований.
Примечание: данные о курении обновлялись при каждом повторном обследовании с 10-летним интервалом, чтобы свести к минимуму возможное искажение результатов из-за обратной причинно-следственной связи.
СI (confidence intervals) — доверительные интервалы для каждой группы. n — количество смертей от БП.
адаптировано из [6]
Разумеется, неблагоприятное воздействие курения на риск развития сосудистых, респираторных и других заболеваний значительно превышает любой защитный эффект табакокурения на риск развития БП. Однако целесообразно рассмотреть некоторые составляющие табачного дыма, для которых был установлен нейропротекторный эффект и которые могут являться кандидатами в разработке стратегий профилактики и терапии БП нового поколения.
Встречайте первого претендента
Первым из таких кандидатов является никотин. Более подробно про никотин, его рецепторы, а также о различных биологических эффектах этого алкалоида можно прочесть в материале «Биомолекулы» [7]. В лабораторных исследованиях было показано, что введение никотина оказывает нейропротекторное действие на моделях БП.
Например, в одном из подобных исследований никотин оказывал нейропротекторное действие в МФТП-индуцированной модели паркинсонического синдрома (ПС) на дофаминрегические нейроны черной субстанции [10]. МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридин) является нейротоксином, часто использующимся для моделирования ПС у лабораторных животных. МФТП — липофильное соединение, благодаря чему данный нейротоксин способен проникать через гематоэнцефалический барьер (ГЭБ) в головной мозг и быстро превращаться в токсичный метаболит — МПП+ (1-метил-4-фенилпиридиний) под действием моноаминоксидазы-Б (МАО-Б) [8]. Только став активным метаболитом, МПП+ избирательно захватывается дофаминергическими нейронами через транспортеры дофамина и ингибирует комплекс цепи переноса электронов, тем самым запуская нейродегенерацию [8]. Таким образом, МФТП способен приводить к митохондриальной дисфункции, блокировать синтез АТФ и инициировать образование свободных радикалов [9]. На животных моделях, индуцированных MФТП, и при БП у человека были выявлены сходные патогенетические условия.
В данном исследовании модельными животными служили мыши линии C57Bl/6. ПС моделировался острым введением МФТП в большой дозе, а именно 15 мг/кг внутрибрюшинно четыре раза в день на протяжении одного дня [10]. Нейротоксин вводили после восьми дней лечения мышей растворами никотина в дозах 2 или 0,2 мг/кг. Никотин также вводили внутрибрюшинно длительным курсом четыре недели. Помимо этого, мышей подвергали воздействию табачного дыма, при этом использовали специальный мышиный обкуриватель (Hamburg II), который сконструирован наподобие прибора [11] (рис. 3).

Рисунок 3. Аппарат для модулирования воздействия табачного дыма на мышей. Примечания: представлена машина для проведения доклинического моделирования процесса курения на мышах. Аппарат, изображенный на фото, вмещает в себя до восьми мышей (4+4). Животные подвергаются воздействию (путем прямого вдыхания) дыма, образующегося при выкуривании экспериментальных сигарет 3R4F (также совместимых с автоматическими электронными сигаретами). Табачный дым генерируется и подается непосредственно в две герметичные камеры для курения (размер — 24 л × 12 м × 12 м), в которых находятся мыши, с помощью одноканальной машины для выкуривания сигарет. Впускное отверстие для обкуривания соединено с трубкой для подачи корма и системой подачи кислорода (2 л/мин) при атмосферном давлении (1 бар). В перерывах между затяжками животные получают непрерывную подачу обычного воздуха, обогащенного кислородом.
адаптировано из [11]
Таким образом, исследование было проведено на 9 группах (см. табл. 1).
| Опытные группы с МФТП (мыши-паркинсоники) | Опытные группы с физиологическим раствором (растворителем для МФТП) (здоровые мыши, относительный контроль) |
|---|---|
| 1) Контрольная группа МФТП + плацебо (физиологический раствор) | 6) Физраствор + плацебо |
| 2) МФТП + никотин в дозе 2 мг/кг | 7) Физраствор + никотин в дозе 2 мг/кг |
| 3) МФТП + никотин в дозе 0,2 мг/кг | 8) физ. раствор + никотин в дозе 0,2 мг/кг |
| 4) МФТП + сильное воздействие табачного дыма | 9) Физраствор + сильное воздействие табачного дыма |
| 5) МФТП + слабое воздействие табачного дыма |
Сильного воздействия табачного дыма авторы достигали посредством раскуривания 24 экспериментальных сигарет без фильтра пять раз в день в течение 21 минуты с 2-х часовым интервалом в течение трех недель. Слабое воздействие, в свою очередь, осуществлялось посредством восьми экспериментальных сигарет без фильтра пять раз в день в течение семи минут с 2-х часовым интервалом в течение трех недель. С более подробным процессом подбора режимов курения можно ознакомиться в оригинальном тексте статьи [10].
Согласно результатам этого исследования, никотин в дозе 2 мг/кг снижал нейрональную гибель в черной субстанции более эффективно, поскольку гибель нейронов составляла 18%, в то время как в контрольной группе МФТП+плацебо нейродегенерация составляла 41% по сравнению с относительным контролем (см. рис. 4а: A—C, б: A). При этом на фоне терапии никотином в дозе 0,2 мг/кг нейрональная гибель составляла 45% против 64% контрольной группы МФТП по сравнению с относительным контролем (см. рис. 4а: A, B, D; б: B). Интересно отметить, что подобного нейропротекторного действия не было обнаружено в стриатуме (или полосатом теле, striatum, ST) (второй по величине базе накопления и синтеза дофамина), причем ни в одной из исследуемых доз [10]. Таким образом, нейропротекция оказалась более эффективной при введении никотина в дозе 2 мг/кг, чем 0,2 мг/кг, при этом нейропротекция составила 50%. То есть, можно прийти к выводу о терапевтической эффективности никотина, причем именно в дозе 2 мг/кг, поскольку количество погибших нейронов на фоне нейротоксина МФТП сильно уменьшилось.
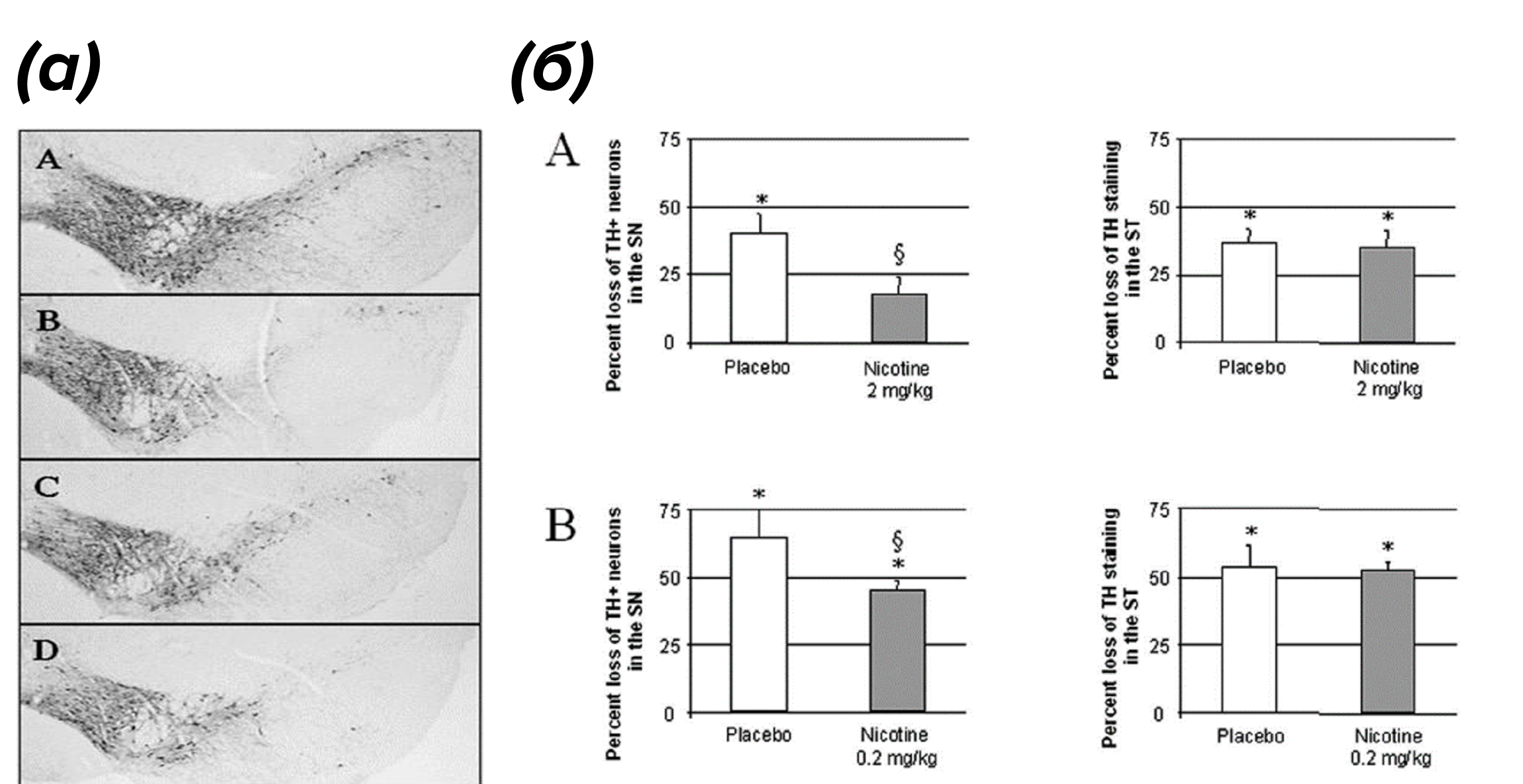
Рисунок 4. Относительный риск развития БП
(а) — макроскопические фотографии среднего мозга мышей: А — контрольные мыши (здоровые); B — мыши после введения МФТП; С – мыши после введения МФТП и никотина (2 мг/кг); D — мыши после введения МФТП и никотина (0,2 мг/кг).
(б) — количественный анализ тирозингидроксилаза-позитивных (tyrosine hydroxylase positive, TH+) нейронов в черной субстанции и в стриатуме (или, по-другому, полосатом теле, striatum, ST) мышей на фоне МФТП, которым вводили плацебо или никотин. Результаты выражены в процентах потери ТH+ клеток по сравнению с соответствующими контрольными группами. B — группа с введением МФТП, получавшая никотин в дозе 2 мг/кг. Символ * означает статистическую значимость между группой МФТП + плацебо и относительным контролем в каждом эксперименте, символ § - статистическую значимость между группой МФТП + плацебо и МФТП + никотин в разных дозах.
Дальше оценивали влияние табачного дыма при разном уровне воздействия на мышей. Было показано, что при сильном воздействии табачного дыма на фоне МФТП нейрональная гибель составляла 41% в черной субстанции и 47% в стриатуме по сравнению с относительным контролем, что было сопоставимо с группой МФТП + плацебо. То есть сильное воздействие табачного дыма не оказывало никакого нейропротекторного воздействия. А вот при слабом воздействии табачного дыма нейрональная гибель составляла 22% в черной субстанции и 58% в стриатуме по сравнению с относительным контролем, то есть вновь наблюдалось нейропротекторное воздействие табачного дыма на нейроны черной субстанции, но не стриатума (рис. 5) [12].
Пытаясь обосновать полученные результаты, авторы дискутируют по поводу механизма, лежащего в основе защитного действия никотина. Здесь стоит отметить такие потенциальные механизмы, как: влияние на поступление ионов кальция и снижение потребления энергии для поддержания ионного гомеостаза (хотя, с другой стороны, повышенный уровень кальция может приводить и к снижению выживаемости нейронов из-за активации различных белков апоптоза и некроза), возможная конкуренция никотина с МФТП за связывание с МАО-Б (прямое ингибирование МАО-Б никотином как нейропротекторная составляющая у курильщиков была опровергнута в опытах на мышиной МФТП модели паркинсонизма [13]) и индукция экспрессии нейротрофических факторов [14].
Что же касается положительного влияния табачного дыма, здесь полезный эффект именно от слабого воздействия табачного дыма мог возникнуть по причине нейропротекции за счет никотина и/или за счет влияния других компонентов табачного дыма, способных оказывать нейропротекторное воздействие (например, нафтохиноны, способные также ингибировать МАО-Б [15]). В свою очередь, высокая концентрация вредных (например, полициклических ароматических углеводородов, таких как бензопирен) составляющих табачного дыма при сильном воздействии на мышей могла маскировать положительные эффекты никотина. Подобные соединения обладают цитотоксичным действием.
Таким образом, на мышиной модели МТФП-индуцированного паркинсонизма было показано, что никотин и небольшое количество табачного дыма способны оказывать нейропротекторное воздействие на нейроны черной субстанции, но при этом никак не защищают дофаминергические нейрональные окончания в стриатуме [10]. Авторы предполагают, что некоторые соединения, присутствующие в сигаретном дыме в дополнение к никотину, могут защищать дофаминергические нейроны от нейродегенерации при БП.
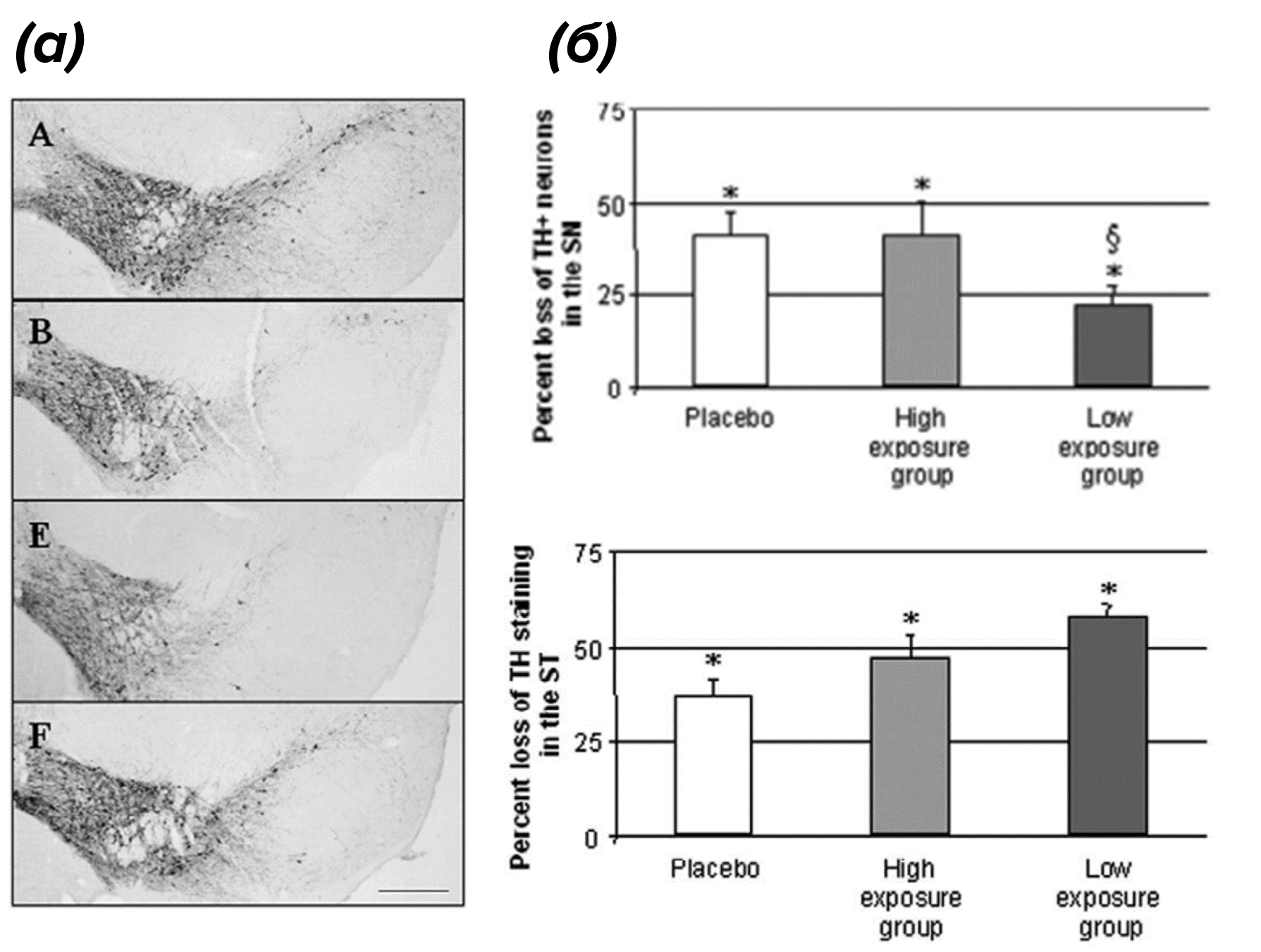
Рисунок 5. Эффекты воздействия табачного дыма на выживаемость нейронов в модели МФТП-индуцированного паркинсонизма.
(а) — макроскопические фотографии среднего мозга мышей: А — контрольные мыши (здоровые); B — мыши после введения МФТП; E — мыши после введения МФТП, которые подвергались сильному воздействию сигаретного дыма; F — мыши после введения МФТП, которые подвергались слабому воздействию сигаретного дыма.
(б) — количественный анализ тирозингидроксилаза-позитивных (tyrosine hydroxylase positive, TH+) нейронов в черной субстанции и в стриатуме мышей на фоне МФТП, которым вводили плацебо или подвергали воздействию табачного дыма. Результаты выражены в процентах потери ТH+ клеток по сравнению с соответствующими контрольными группами. Показаны: группы с введением МФТП, подвергавшиеся сильному или слабому воздействию табачного дыма. Символ * означает статистическую значимость между группой МФТП + плацебо и относительным контролем, символ § - статистическую значимость между группой МФТП + плацебо и МФТП + слабое воздействие табачного дыма.
адаптировано из [10]
Тем не менее, в доклинических исследованиях эффективности никотина использовались токсин-индуцированные модели БП, поэтому его влияние на нейродегенерацию в моделях с использованием α-синуклеина и нокаутных мышей все еще остается неизвестным.
Однако уже на основании вышеописанных данных можно предположить, что лекарства на основе никотина, при более тщательных исследованиях и хорошо подобранных формах доставки, могут быть протестированы на разных моделях БП. И, в случае успеха, и предотвращения гибели нейронов, в дальнейшем и на людях. Это позволит расширить спектр лекарственных препаратов от паркинсонизма.
Монооксид углерода — потенциальный нейропротектор?
Если продолжать разговор о других соединениях табачного дыма, ведутся исследования по поводу положительной роли монооксида углерода (CO) при нейродегенерации и других патологических состояниях. Так, например, кандидат в лекарственное средство HBI-002, представляющий собой жидкую композицию низких доз СО для приема внутрь, разрабатываемый компанией Hillhurst Biopharmaceuticals, уже прошел 1 этап клинических испытаний на здоровых добровольцах для лечения не нейродегенеративного, но, тем не менее, весьма серьезного заболевания — серповидноклеточной анемии.
Как известно, низкие уровни CO вырабатываются эндогенно, и при низких концентрациях CO снижает окислительный стресс и смещает выработку цитокинов в сторону тех, которые задействованы в противовоспалительном ответе [16]. Касательно БП было показано, что СО обеспечивает мощную нейропротекцию в токсин-индуцированных моделях ПС in vivo и в моделях апоптоза и окислительного повреждения in vitro. Например, в недавнем исследовании 2023 года [17] показано, что использование низких доз CO защищало дофаминергические нейроны на модели БП in vivo.
В нем крысам стереотаксически (то есть при помощи специального прибора, который предназначен для фиксирования головы животного и четкого определения внутричерепных анатомических структур для введения нужных веществ) вводили аденоассоциированный вирус с α-синукленом прямиком в черную субстанцию, после чего через 5 дней животным вводили перорально монооксид углерода в жидкой форме в дозе 10 мл/кг под кодовым названием HBI-002 ежедневно на протяжении 16 дней.
Введение CO уменьшало потерю с ипсилатеральной стороны черной субстанции (то есть со стороны введения вируса в стереотаксической установке) как TH-положительных нейронов в компактной части черной субстанции (рис. 6б), так и увеличивало уровни дофамина в стриатуме (рис. 6а) по сравнению с плацебо. Чтобы подтвердить, что эти эффекты были обусловлены усиленной нейропротекцией, а не изменением экспрессии тирозингидроксилазы, исследователи окрашивали нейрональный маркер NeuN. По сравнению с животными, получавшими плацебо, у опытных крыс было больше NeuN-положительных нейронов в ипсилатеральной компактной части черной субстанции (рис. 6г, д). В совокупности эти данные указывают на то, что лечение низкими дозами СО увеличивало выживаемость дофаминергических нейронов в прогрессирующей модели нейродегенерации при БП. Кроме того, вестерн-блот-анализом было показано, что введение СО привело к уменьшению количества альфа-синуклеин-содержащих иммунореактивных точек в соме нейронов, что также является показателем сниженной агрегации альфа-синуклеина, который, как указывалось выше, имеет важное значение в прогрессировании паркинсонизма. В свою очередь, определение дофамина производилось методом ВЭЖХ с изократической подачей подвижной фазы.
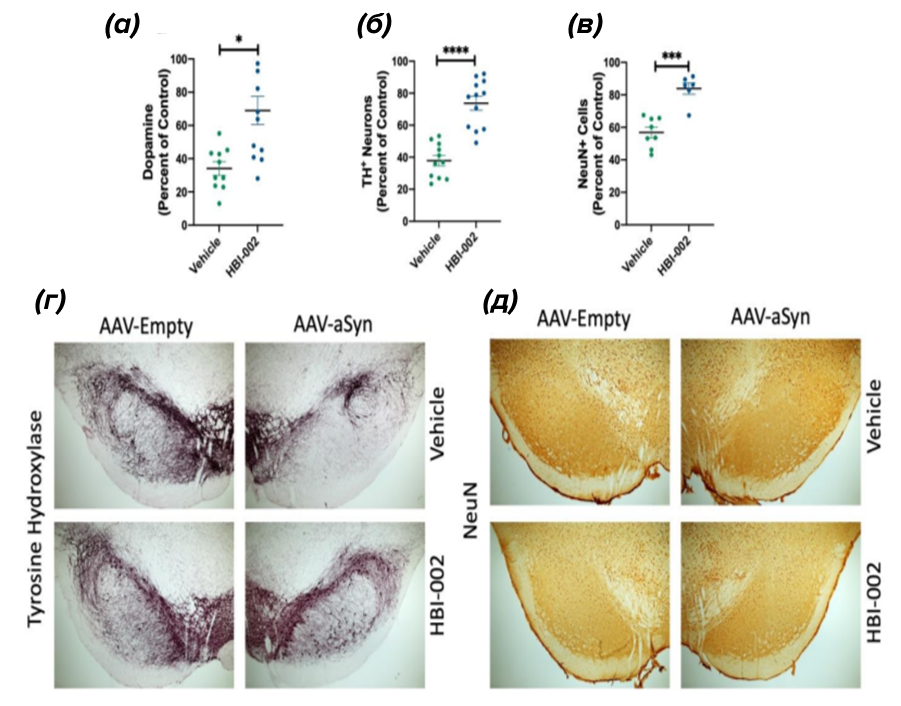
Рисунок 6. Изменения различных таргетов при введении угарного газа перорально. HBI-002, пероральный препарат CO, защищает от нейротоксичности человеческого мутантного альфа-синуклеина A53T (aSyn).
Левая сторона получала AAV1/2-CMV-пустой вектор-WPRE-BGH-polyA (контроль); правая сторона получала AAV1/2-CMV-человеческий 53T-альфа-синуклеин-WPRE-BGH-polyA. (а)
Также в этом же исследовании показано наличие нейропротекторных свойств низких доз СО на МФТП-индуцированной модели ПС у мышей. Через час после введения МФТП СО вводился в газовой форме в объеме 200 ppm со скоростью 1 л/мин, а в качестве плацебо аналогичным образом вводили воздух. Животных помещали в камеры с постоянным потоком газов на один час. Через пять дней после подобного воздействия СО животных умерщвляли, а их мозг забирался для дальнейшего изучения.
Важно отметить, что воздействие угарного газа, которое привело к повышению содержания карбоксигемоглобина (CO-Hb) на 19,4-23,3%, уменьшило вызванное MФТП снижение содержания дофамина в стриатуме (рис. 7в), при этом наблюдалось снижение потери TH+ (тирозингидроксилаза-позитивных) нейронов в черной субстанции после введения CO по сравнению с мышами, подвергшимися воздействию воздуха (рис. 7а, б).
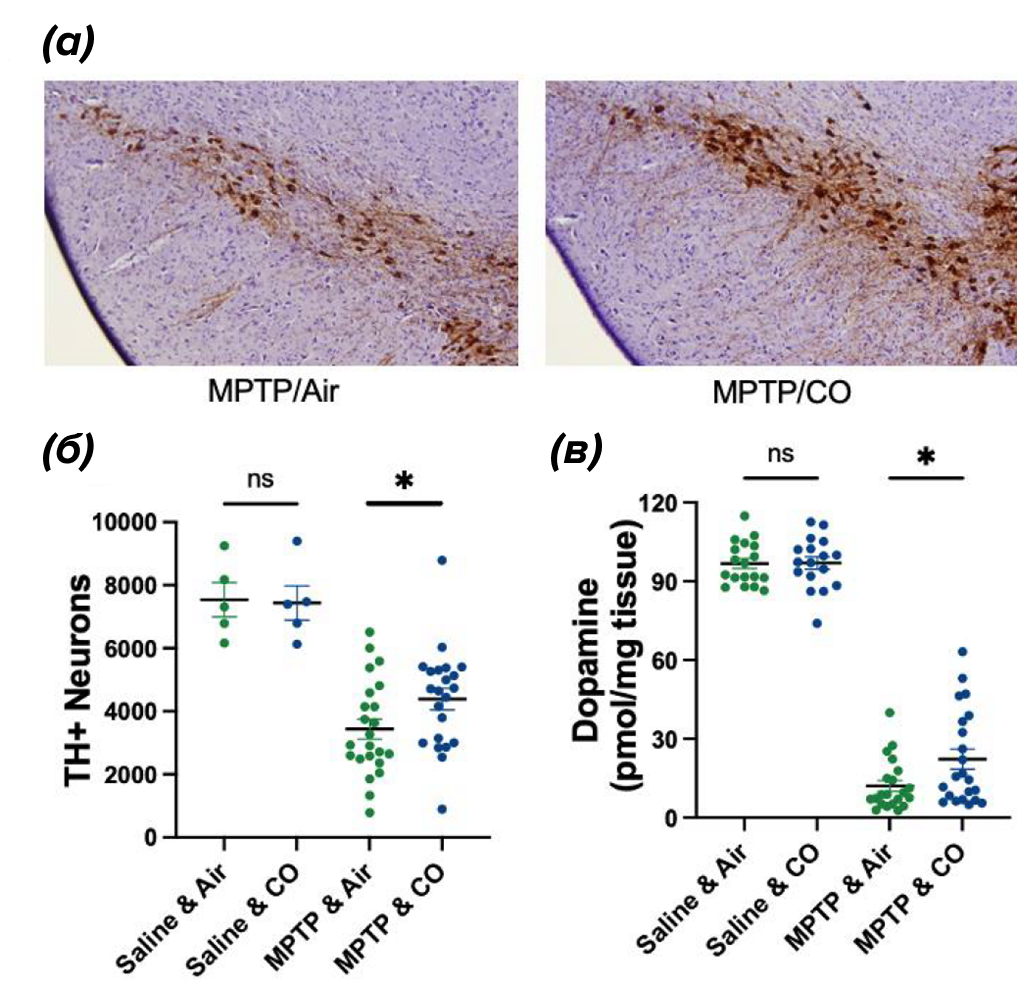
Рисунок 7. Монооксид углерода (CO) защищает от нейротоксичности, индуцированной нейротоксином MPTP в черной субстанции (SN). (а) — репрезентативные микрофотографии иммунореактивности в черной субстанции, окрашенные гематоксилином QS. (б) — количественное определение TH+ клеток в компактной части черной субстанции. (Физиологический раствор и воздух=18, физиологический раствор и CO=17, MPTP и воздух n=23, MPTP и CO n=22). (в) — количественное определение содержания дофамина в ST методом ВЭЖХ-ЭХД. Символ * означает статистическую значимость между сравниваемыми группами, ns — отсутствие статистической значимости между сравниваемыми группами.
адаптировано из clinicaltrials.gov
Важно отметить, что введение CO не имело эффекта у животных, получавших физиологический раствор вместо МФТП (т.е. у пассивного контроля), но уменьшало нейротоксичность, вызванную МФТП (т.е. у активного контроля), в нигростриарной дофаминовой системе (рис. 7б, в). В соответствии с этими наблюдениями, CO не оказывал влияния на уровень дофамина в стриатуме у животных группы пассивного контроля, но снова снижал вызванную MФТП потерю дофамина в этой области мозга.
Таким образом, исследователи пришли к выводу, что основная активность CO может заключаться в ограничении окислительного повреждения путем запуска цитопротекторных путей в ответ на окислительный стресс при БП. А это, в свою очередь, указывает на то, что низкие дозы СО могут замедлить появление симптомов и развитие нейродегенерации у пациентов с БП.
На основании этого исследования хотелось бы увидеть в дальнейшем будущем разработки в виде лекарственных форм, например, напиток, подобный простой содовой, но который мог бы направленно доставлять монооксид углерода в низких дозах прямиком в мозг. Использовать подобное снадобье можно было бы и в качестве профилактики, и возможно даже, средства лечения паркинсонизма.
Возможная защитная роль компонентов табачного дыма, являющихся ингибиторами МАО-Б
Несколько ингибиторов моноаминоксидазы Б (МАО-Б), включая нафтохиноны, 2-нафтиламин и норгарман, были обнаружены в табачном дыме и также рассматриваются в качестве потенциальных молекул-защитников, снижающих риск развития БП у курильщиков [15].
Клиническое применение ингибиторов МАО-Б при БП, когда они обеспечивают умеренное улучшение двигательных функций и отсрочивают применение леводопы (основного препарата для лечения БП), показывают их терапевтическую значимость в лечении паркинсонизма [18]. Так, например, в ретроспективном когортном исследовании на 181 пациенте с идиопатической (то есть с неустановленной причиной) БП , получавших терапию MAO-Б на долгосрочной основе в течение как минимум одного года, и на 121 пациенте с идиопатической БП, которые никогда не получали терапию данными препаратами, было установлено снижение риска дискинезии на 44,7%, при этом наибольшее снижение риска наблюдалось через два года лечения. Для определения степени ингибирования в группе сравнения применялся селективный ингибитор МАО-Б — L-депренил-D2 в дозировке 10 мг один раз в день в течение недели. Вторая же группа исследуемых курила сигареты. Уровни МАО-Б у курильщиков измерялись после 1,7–12 часов после выкуривания сигареты (столь большие временные рамки объясняются неизвестным временем восстановления ферментных систем у курильщиков после употребления табачных изделий) (рис. 8).
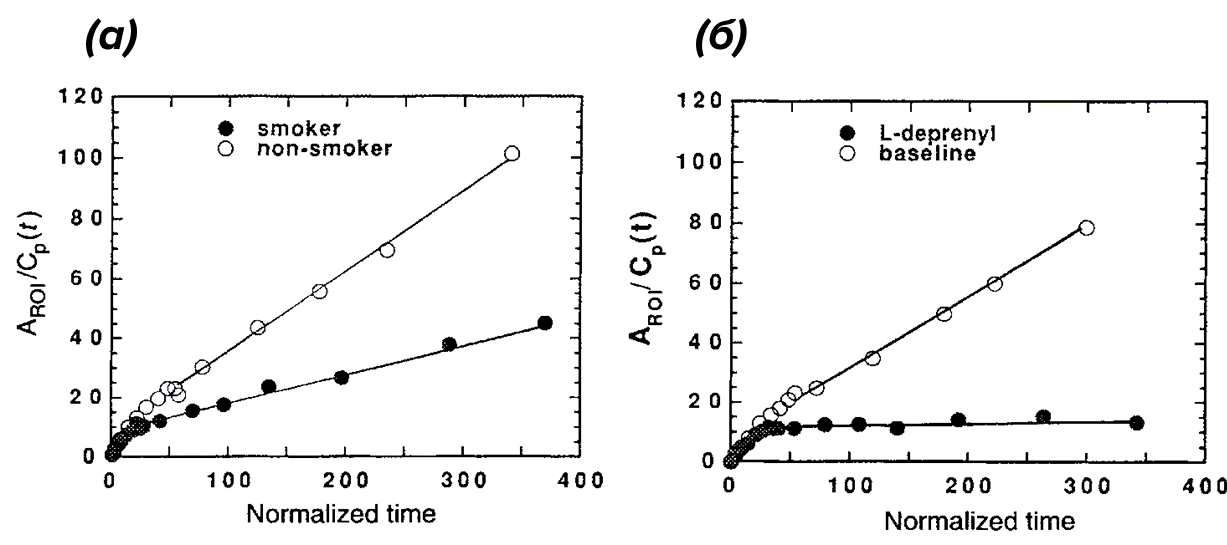
Рисунок 8. Уровни ингибирования МАО у курильщиков и некурящих, выраженные в соотношении пропускной способности ГЭБ. (a) — графический анализ результатов исследования таламуса у некурящего и курильщика. Aso/Cp(t) относится к соотношению концентраций 11C в интересующей области (ROI) от таламуса (A)) к концентрации индикатора (Cp) в плазме крови в момент времени (t). Нормализованное время — это отношение интеграла по времени концентрации артериальной плазмы к Cp.
Необходимо также отметить тот факт, что уровни МАО-Б у курильщиков и некурящих людей сильно различаются (средний коэффициент вариации 35% у курильщиков и 12,5% у некурящих), что объясняется большим количеством факторов, таких как тип табачных изделий, возраст, стаж курения, количество выкуренных сигарет, время последнего выкуривания перед ПЭТ-исследованием и т.д. Так как у курильщиков коэффициент вариации значительный; на практике это означает, что имеется большой разброс в данных. Поэтому на данный момент сложно сделать окончательные выводы об участии МАО-Б в возможном защитном воздействии табачного дыма на нейроны [15].
Кроме того, в прижизненных исследованиях позитронно-эмиссионной томографии (ПЭТ) головного мозга с использованием селективного лиганда MAO-Б [11C]L-депренила-D2 было показано, что у курильщиков значительно снижены сайты связывания MAO-Б в головном мозге по сравнению с некурящими (рис. 9). Таким образом, возможно, что ингибиторы МАО-Б, содержащиеся в табачном дыме, могут способствовать снижению риска БП при курении [15]. Одними из предполагаемых ингибиторов могут выступать, помимо нафтохинонов, формальдегид и цианиды, содержащиеся в табачном дыме.
Нельзя не отметить тот факт, что ингибирование МАО-Б не только увеличивает содержание дофамина в синаптической щели, но и увеличивает концентрацию других нейромедиаторов, таких как серотонин и норадреналин, которые также способны оказывать положительное воздействие на протекание БП.
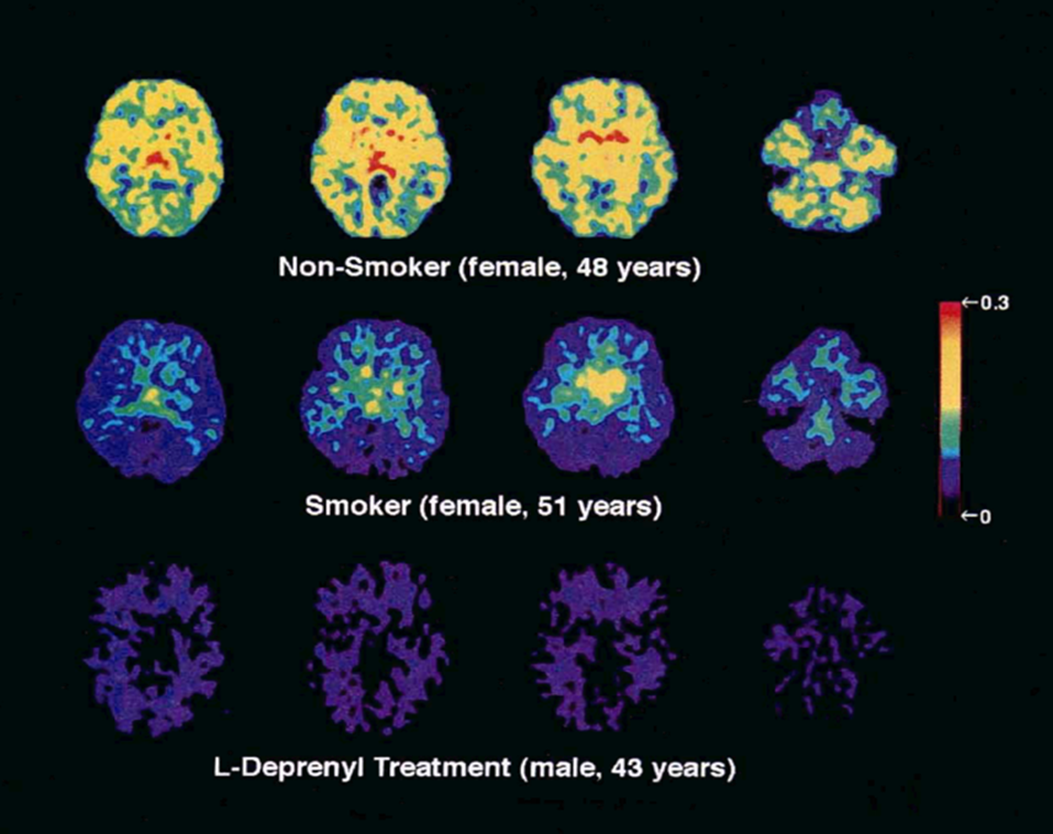
Рисунок 9. ПЭТ-исследование головного мозга у трех групп пациентов.
Заключение
В заключение нашей статьи хотелось бы сказать, что БП в последнее время встречается все чаще, средний возраст пациентов неуклонно уменьшается [19], а новых препаратов для борьбы с таким серьезным недугом появляется не так много, как хотелось бы. Вот тут и возникает потребность в поиске новых лекарственных веществ, способных помочь в лечении этого нейродегенеративного заболевания. Поэтому в данный момент поиск новых лекарств от БП остается актуальной задачей современной науки.
Необходимость ученым хвататься за любую возможность получить заветное лекарство от паркинсонизма породила исследования, рассмотренные в этой статье. Так что все не так мрачно, даже из сигарет можно извлечь лекарственные вещества для лечения паркинсонизма. Теплится надежда, что исследователи в области инновационных систем доставки лекарств смогут создать эффективные, безопасные и удобные для применения препараты на основе отдельных компонентов табачного дыма, например, никотина или монооксида углерода, для профилактики и лечения БП.
Ну и под конец маленький постскриптум: ни в коем случае не курение, а лишь отдельные компоненты табачного дыма, использованные в правильных лекарственных формах, могут способствовать снижению риска развития БП и выработке возможных новых тактик ее профилактики и лечения.
Литература
- Joseph Jankovic, Eng King Tan. (2020). Parkinson’s disease: etiopathogenesis and treatment. J Neurol Neurosurg Psychiatry. 91, 795-808;
- Csaba Váradi. (2020). Clinical Features of Parkinson’s Disease: The Evolution of Critical Symptoms. Biology. 9, 103;
- Joseph M. Ferrara, Mark Stacy. (2008). Impulse-Control Disorders in Parkinson's Disease. CNS spectr.. 13, 690-698;
- Белок альфа-синуклеин — важный участник проявления болезни Паркинсона?;
- Xiao Li, Weihua Li, Guixia Liu, Xu Shen, Yun Tang. (2015). Association between cigarette smoking and Parkinson’s disease: A meta-analysis. Archives of Gerontology and Geriatrics. 61, 510-516;
- Benjamin Mappin-Kasirer, Hongchao Pan, Sarah Lewington, Jennifer Kizza, Richard Gray, et. al.. (2020). Tobacco smoking and the risk of Parkinson disease. Neurology. 94;
- Никотин как алкалоид;
- J. William Langston. (2017). The MPTP Story. Journal of Parkinson’s Disease. 7, S11-S19;
- Przedborski S. et al. (2000). The parkinsonian toxin MPTP: action and mechanism. Restorative neurology and neuroscience. 16, 135–142;
- Karine Parain, Céline Hapdey, Estelle Rousselet, Véronique Marchand, Bernard Dumery, Etienne C Hirsch. (2003). Cigarette smoke and nicotine protect dopaminergic neurons against the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine Parkinsonian toxin. Brain Research. 984, 224-232;
- Mohammad A. Kaisar, Raja Reddy Kallem, Ravi K. Sajja, Ali Ehsan Sifat, Luca Cucullo. (2017). A convenient UHPLC-MS/MS method for routine monitoring of plasma and brain levels of nicotine and cotinine as a tool to validate newly developed preclinical smoking model in mouse. BMC Neurosci. 18;
- Karine Parain, Céline Hapdey, Estelle Rousselet, Véronique Marchand, Bernard Dumery, Etienne C Hirsch. (2003). Cigarette smoke and nicotine protect dopaminergic neurons against the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine Parkinsonian toxin. Brain Research. 984, 224-232;
- B. Ferger, Chris Spratt, Chris D. Earl, Peter Teismann, Wolfgang H. Oertel, Klaus Kuschinsky. (1998). Effects of nicotine on hydroxyl free radical formation in vitro and on MPTP-induced neurotoxicity in vivo. Naunyn-Schmiedeberg's Arch Pharmacol. 358, 351-359;
- R. Maggio, M. Riva, F. Vaglini, F. Fornai, G. Racagni, G. U. Corsini. (1997). Striatal increase of neurotrophic factors as a mechanism of nicotine protection in experimental parkinsonism. J. Neural Transmission. 104, 1113-1123;
- J. S. Fowler, N. D. Volkow, G.-J. Wang, N. Pappas, J. Logan, et. al.. (1996). Inhibition of monoamine oxidase B in the brains of smokers. Nature. 379, 733-736;
- Weronika Adach, Mateusz Błaszczyk, Beata Olas. (2020). Carbon monoxide and its donors - Chemical and biological properties. Chemico-Biological Interactions. 318, 108973;
- Stephen Gomperts, Kenneth Rose, Zorlu Musab, Xiaofan Xue, Waijiao Cai, et. al.. (2023). Low Dose Carbon Monoxide Is Neuroprotective in Models of Parkinson’s Disease (S42.008). Neurology. 100;
- N. V. Titova, A. A. Portupeev. (2021). Practical aspects of prescribing antiparkinsonian drugs. The place of amantadines in the management of Parkinson’s disease. Medicinskij sovet. 63-74;
- Yoav Ben-Shlomo, Sirwan Darweesh, Jorge Llibre-Guerra, Connie Marras, Marta San Luciano, Caroline Tanner. (2024). The epidemiology of Parkinson's disease. The Lancet. 403, 283-292.