
Никотин как алкалоид
04 декабря 2016
Никотин как алкалоид
- 35691
- 10
- 28
Теперь столько пишут о вреде курения, что я твердо решил бросить читать.
Джозеф Каттен.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Алкалоид, прошедший путь от шаманских обрядов индейцев до мигреней королев, от звания лекарства до канцерогена — никотин. Какими эффектами и свойствами он обладает помимо присутствия в «раковых палочках» в руках курильщиков — этому и посвящен обзор. Никотин как алкалоид — ничего личного.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Сергей Коваленко.
Испокон веков ведутся споры о пользе и вреде никотина, которые не утихают и по сей день. Несмотря на усилия антитабачной коалиции, в мире продолжает курить около миллиарда человек [1]... Однако нельзя отождествлять понятия «сигарета» и «никотин»! У сигареты более 100 продуктов горения, а рассказ мы собираемся вести о никотине как алкалоиде — ни больше, ни меньше. Мы с предельной степенью объективности рассмотрим максимально возможное количество вызываемых им эффектов. И начнем, пожалуй, со знакомства с никотином исключительно как с химическим соединением.
Кто виноват?
Никотин — обладающее биологической активностью вещество, которое содержится в табаке и в некоторых других растениях, но в меньших концентрациях. Он прошел путь от Америки времен Колумба до наших лет, заслужив самые противоречивые оценки населения планеты. Не без труда было установлено, что никотин, как и все алкалоиды, — высокоактивное вещество и, как любой из них в высокой концентрации, способен вызвать много нежелательных последствий. В низких же концентрациях многие алкалоиды эффективно используются в медицинских целях. Однако всем нам с детства твердили, что капля никотина убивает лошадь (или нет?)... Чтобы достоверно разобраться, в чем его вина, необходимо понять, как и какие эффекты он оказывает на человеческий организм.
Что делает?
Все неподвластные нашему сознанию процессы в организме, такие как дыхание, пищеварение, артериальное давление, регулируются вегетативной нервной системой, которая состоит из системы «покоя» — парасимпатической, — и системы «бей или беги» — симпатической. Каждая из них состоит из двух нейронов, место сцепления которых называется ганглием. Соответственно, нейрон, отходящий от мозга, называют преганглионарным, а нейрон, подходящий к эффекторному органу, — постганглионарным.
Основной нейромедиатор, являющийся посредником передачи нервных импульсов, этакий стрелочник в парасимпатической нервной системе и нервно-мышечных синапсах, — ацетилхолин. Накапливаясь в цитоплазме аксонов в виде везикул, он высвобождается при стимуляции преганглионарного нейрона и изливается в синаптическую щель, где взаимодействует с рецептором на мембране постганглионарного нейрона, вызывая биологический ответ, который может выражаться в замедлении сердечных сокращений, расширении периферических кровеносных сосудов и понижении артериального давления, усилении перистальтики желудка и кишечника, сокращении мускулатуры бронхов, матки, желчного и мочевого пузыря, усилении секреции пищеварительных, бронхиальных, потовых и слезных желез, сужении зрачков.
Но это не все! Ацетилхолин — медиатор и в симпатической нервной системе, но только в преганглионарных нейронах (в то время как постганглионарный медиатор — норадреналин). Значит, он вызывает и все ответы, характерные для действия симпатики: учащение сердцебиения, повышение давления, увеличение уровня глюкозы в крови и интенсивности липолиза (распада жиров), а также угнетение центров голода.
Снова парадокс — вызываемые одним и тем же веществом эффекты почти полностью противоположны? О, да! В этом мы убедимся, когда рассмотрим работу молекулярных механизмов взаимодействия медиаторов с рецепторами.
«Никотиновый рецептор»
Рецепторы к ацетилхолину делят на два больших класса: мускариновые (М-холинорецепторы, mAChR) и никотиновые (N-холинорецепторы, nAChR). Названы они в честь своих агонистов (веществ, способных при взаимодействии с рецептором вызывать биологический ответ): мускарина, содержащегося в мухоморах, и никотина соответственно. Никотин имеет схожую с ацетилхолином структуру (рис. 1) и вызывает аналогичный ему эффект (рис. 2).
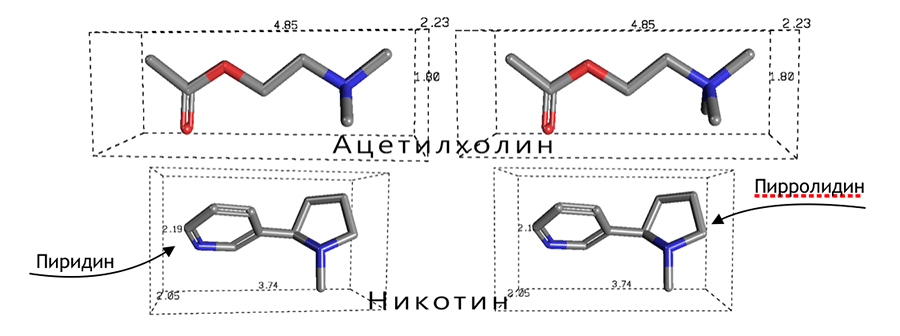
Рисунок 1. Сходство никотина с ацетилхолином.
рисунок автора статьи

Рисунок 2. Основные влияния никотина в периферической нервной системе.
рисунок автора статьи
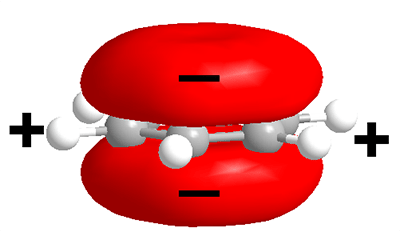
Рисунок 3. Распределение электронной плотности в ароматическом кольце триптофана.
рисунок автора статьи
Атом азота пирролидинового кольца (пятичленного гетероцикла) в никотине имитирует четвертичный атом азота в ацетилхолине, а атом азота пиридина (шестичленного гетероцикла) является донором электронных пар, как и кислород кетогруппы ацетилхолина. Внешне они, может быть, и не очень похожи, но тут важнее функционал: пространственное распределение электронной плотности обеспечивает практически одинаковый характер связи с рецептором и вызывает аналогичный биологический ответ.
Молекулярная основа
В активном центре рецептора ацетилхолина никотинового типа есть несколько петель, главная из которых — С-петля, содержащая триптофан (ароматическую аминокислоту). Он обладает большим отрицательным зарядом благодаря, во-первых, избытку электронной плотности (половина связей — двойные), во-вторых, циклической структуре. Дело в том, что в этой циклической структуре двойные (π) связи «делокализованы» (то есть некорректно говорить, что они находятся у 1, 3, 5 атомов углерода или у 2, 4, 6) — как бы «размазаны» по шестичленному кольцу и имеют электронную плотность в виде объемной восьмерки, поставленной перпендикулярно плоскости кольца, так что избыточная электронная плотность висит даже не одним колесом, а двумя — над и под плоскостью кольца (рис. 3)!
Само понятие «избыток электронной плотности» означает, что в этом участке пространства скапливается избыточный отрицательный заряд, попросту — «минус». Выше было упомянуто, что атом азота в никотине имеет недостаток электронной плотности, то бишь «плюс». А дальше действуют базовые законы физики: подчиняясь закону Кулона, «плюс» тянется к «минусу» и входит в кольцо, как ключ в замок (причем двойной), застревая между отрицательно заряженными «обкладками»! А после этого он оттуда не хочет выходить, следуя принципу минимума энергии, а минимум как раз достигается внутри «минусового кольца» (рис. 4).

Рисунок 4. С-петля никотинового рецептора (nAchR).
рисунок автора статьи
Это взаимодействие необычайно сильное, а связь крайне прочная и имеет собственное название: катион-π-связь. К тому же между углеродным скелетом триптофана пресловутой С-петли и азотом ароматического кольца никотина образуется водородная связь. Да, она не очень прочная, но дополнительно стабилизирует крепкую π-связь пространственно, и именно таким образом π-связь оказывается «железной» (рис. 5).
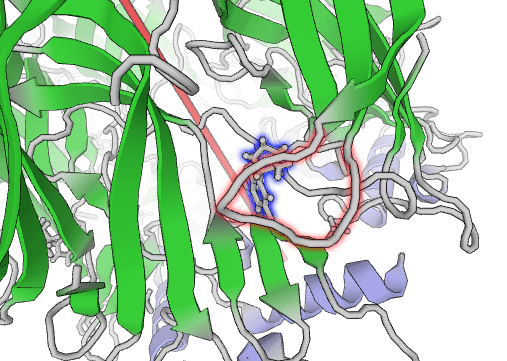
Рисунок 5. С-петля рецептора (красная) и никотин (синий).
рисунок автора статьи
Супрамолекулярные аспекты
Ацетилхолиновый рецептор по сути своей является трансмембранной белковой пóрой, состоящей из пяти субъединиц (рис. 6). Два самых распространенных типа рецептора — α3β2 и α2β3 (α и β — названия разных субъединиц). Есть исследование, показывающее, что α2β3 более чувствителен к никотину [2], и при постоянном поступлении никотина экспрессия этого рецептора возрастает, но зато со временем чувствительность снижается. Так вот, при связывании того или иного агониста конформация белка меняется, пóра открывается. Натрий, сосредоточенный, в основном, во внеклеточном пространстве и создававший до этого на поверхности клетки положительный заряд, бросается в открывшуюся пору, меняя заряд клетки. Собственно, это и есть нервный импульс со всеми вытекающими событиями: либо деполяризуется следующий нейрон, либо вызывается сокращение мышцы, деятельность железы, когнитивные процессы в ЦНС и великое множество иных процессов, которые запускаются действием ацетилхолина или другого агониста.

Рисунок 6. Один из подвидов nAchR.
рисунок автора статьи
Следует упомянуть о том, что на скелетные мышцы никотин не оказывает сколь-либо заметного действия — там пара аминокислот в белке рецептора ацетилхолина заменена другой, и не возникает стабилизирующая водородная связь (несмотря на то, что катион-π-связь также образуется, без водородной она оказывается слабее, чем в нейронных рецепторах).
Коротко о нашем мозге
Центральное действие (то есть на головной мозг) никотина обосновано активацией им α4β2-рецепторов нейронов мозга (например, дофаминергических нейронов). Эти рецепторы имеют настолько высокое сродство к никотину, что даже ацетилхолин в высокой дозе не способен стать ему конкурентом в данном случае. Таких рецепторов в мозге на долю всех N-холинорецепторов приходится более 80%. А значит, центральное действие никотина самое заметное. И это настолько же положительная, насколько и отрицательная новость для медицины. А дело вот в чем.
Никотиновые рецепторы α4β2 имеют преимущественно пресинаптическую локализацию и участвуют в выбросе большого спектра медиаторов (рис. 7): например, глутамата, дофамина и ГАМК (γ-аминомасляной кислоты). А никотин, эффективно активируя эти рецепторы, стимулирует взаимодействия, которые во многих случаях положительно влияют на те или иные мозговые процессы (например, запоминание). Вдобавок к этому существует связь взаимодействия никотина и рецептора с активацией экспрессии (синтеза) новых nAchR. Чем больше никотина — тем выше экспрессия. И здесь становится абсолютно неважно, имеют ли эти рецепторы достаточную чувствительность, потому что сам высокий уровень экспрессии приводит к активному метаболизму клеток и отсрочивает их апоптоз.
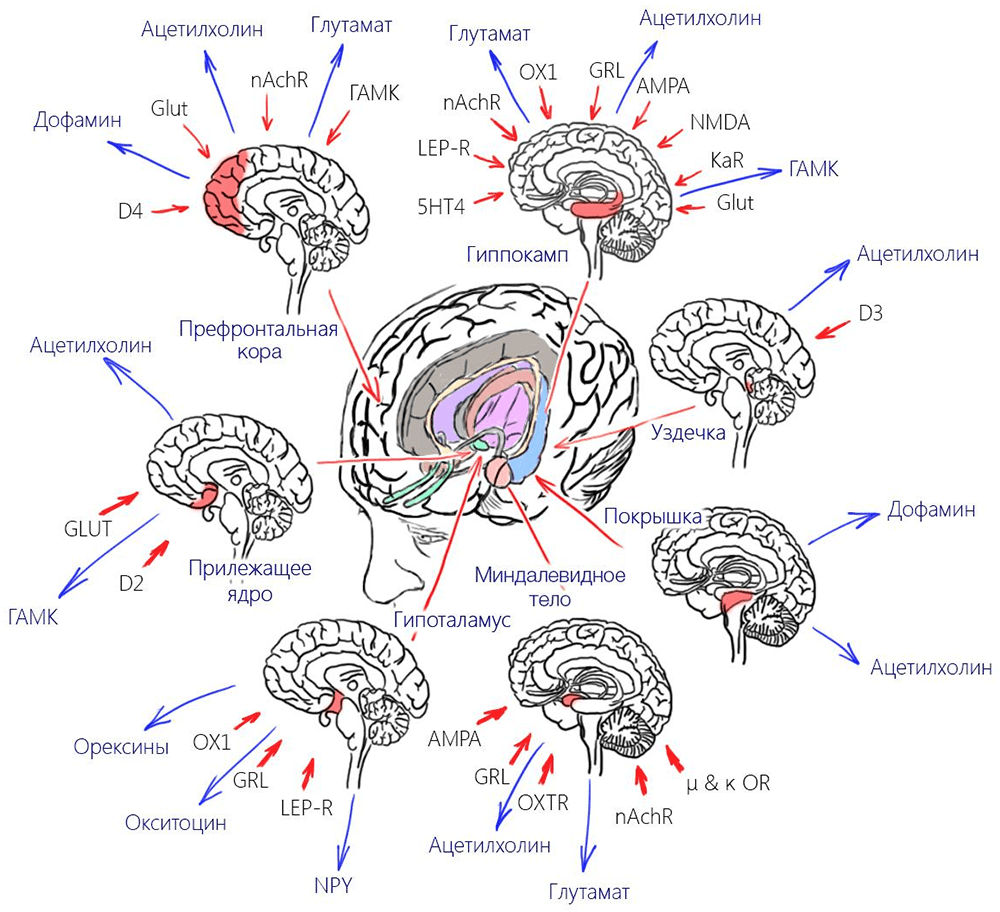
Рисунок 7. Выделяющиеся благодаря никотину медиаторы.
рисунок автора статьи
Эта находка натолкнула исследователей на идею профилактики болезни Альцгеймера и других дегенеративных заболеваний мозга с помощью никотина [3]. И исследования продемонстрировали очень интересную статистику. Среди пациентов с болезнью Альцгеймера около 26% курящих, из которых более половины начали курить позже 30 лет [4]. Но поведение никотина в ЦНС достаточно хорошо освещено, мы не будем на нем останавливаться. Краткая схема этих взаимодействии представлена на рис. 7, в данной же статье будут более подробно рассмотрены эффекты никотина вне черепной коробки.
А что дальше?
Что в принципе происходит с лигандом после связывания где бы то ни было? Он не остается там надолго в макроскопическом понимании времени: то, что эта связь крепкая и долгая, значит, что она долгая по сравнению со средним временем жизни молекулы. После того, как молекула никотина сделала свое дело, она «вымывается» из рецептора, затем с током крови переносится в печень, где метаболизируется посредством цитохрома Р450 (рис. 8) до своего «наследника» — котинина (анаграмма от слова «никотин») [5].

Рисунок 8. Метаболизм никотина.
рисунок автора статьи
В виде котинина выводится 70–80% никотина, 3–5% в виде гидроксиникотина, некоторое количество метаболизируется путем глюкуронирования и никотина, и котинина. Интересно, что котинин вызывает схожие с действием никотина эффекты, хотя и с меньшей интенсивностью: связывается с рецептором и активирует его, приводя к таким же полноценным биологическим ответам. Еще одна ощутимая разница между никотином и котинином в периодах полувыведения: половина никотина выводится из организма через 2 часа, а вот котинина — через 20 часов, вследствие чего котинин является ценным маркером активного потребления никотина.
Предварительные заключения
Как уже говорилось, никотин воздействует на один из типов ацетилхолиновых рецепторов — никотинового типа (nAchR). Важно то, что nAchR — ионотропный рецептор, то есть при действии агониста (ацетилхолина или никотина) начинает пропускать через себя поток ионов. Ацетилхолиновый рецептор N-типа позволяет проходить, в основном, ионам Na+, в меньшей степени — двухвалентным катионам, а вот анионы он не пропускает совсем. Все эти потоки ионов создаются с единственной целью — запустить каскад реакций (рис. 9), которые, в свою очередь, обеспечат соответствующий биологический ответ в любой структуре, которая восприимчива к такого типа сигналам. Отсюда и все эффекты действия никотина: он влияет не на определенную систему или анатомическую область нервной системы, а на один из самых распространенных в организме рецепторов, за счет чего имеет доступ к самым разным структурам организма. Немаловажную роль тут играет то, что никотин довольно легко проходит сквозь гемато-энцефалический барьер (через который легче проходят третичные амины, так как они менее полярны, чем четвертичные, а следовательно, более липофильны), так как атом азота в нем третичен. В отличие от никотина ацетилхолин содержит четвертичный атом азота и потому не в силах проникать через биологические барьеры.

Рисунок 9. Каскады, активируемые никотином, и их действие.
рисунок автора статьи
Обезболивание
Системное введение никотина вызывает высвобождение эндогенных опиоидов (эндорфинов, энкефалинов и динорфинов). Кроме того, системное введение никотина индуцирует высвобождение метионин-энкефалина в дорсальных рогах спинного мозга. Таким образом, никотин оказывает острое нейрофизиологическое воздействие, в том числе дает обезболивающий (антиноцицептивный) эффект, а также обладает возможностью активации гипоталамо-гипофизарно-надпочечниковой оси (ГГН оси). Участие эндогенной опиоидной системы в анальгезии опосредована α4β2 и α7 nAchRs, в то время как активация ГГН оси опосредована α4β2, но не α7. Это наводит исследователей на мысль о том, что эффекты никотина на эндогенные опиоидные системы опосредованы α7, а не α4β2. Антагонист опиоидных рецепторов — налоксон (NLX) — вызывает вывод никотина после его повторного введения. NLX-индуцированный вывод никотина ингибируется введением антагониста α7, но не антагониста α4β2. Обобщенные данные свидетельствуют о том, что NLX-индуцированное обезболивание и развитие физической зависимости опосредуют эндогенные опиоидные системы через α7 nAchRs [6].
Про циркадные ритмы и аппетит
Никотин активирует ПОМК-нейроны (нейроны, выделяющие проопиомеланокортин — биологически активное вещество, продукты расщепления которого гормонально-активны) в гипоталамусе, что, согласно статье в Science, снижает аппетит [7]. Также ПОМК-нейроны задействованы в обезболивающих реакциях, о которых было написано выше. Помимо этого, никотин усиливает секрецию нейропептида Y [8], однако здесь не все однозначно, как мы увидим ниже. Гипоталамус также экспрессирует рецепторы к лептину [9], к орексинам (OX2), и, более того, орексины он же и выделяет.
Орексины (они же — гипокретины 1 и 2) играют роль в регуляции аппетита, сна и привыкания к некоторым наркотическим веществам [10]. Их недостаток вызывает развитие нарколепсии и ожирения при том, что аппетит может и падать. Избыток, наоборот, — бессонницу и анорексию. Также деятельность орексинов связана с процессами метаболизма (липолиз), повышения давления и даже процессами регуляции менструального цикла и регуляции экспрессии генов в клетках Сертоли. Также, по-видимому, они реагируют на уровень глюкозы в крови.
В контексте данной статьи полезно знать, что регуляция сна осуществляется примерно следующим образом. В состоянии бодрствования орексиновые нейроны посылают возбуждающие сигналы моноаминным нейронам, а те посылают обратно (осуществляя обратную связь) тормозящие сигналы малой мощности. Моноаминные нейроны (никотин увеличивает их активность) возбуждают таламус и кору головного мозга и тем самым поддерживают бодрствование. При понижении уровня возбуждающих сигналов, поступающих в орексиновые нейроны из районов мозга, связанных с циркадными ритмами и балансом энергии, вентральная область покрышки (ВОП) и моноаминные нейроны тормозят орексиновые нейроны, а те в свою очередь перестают возбуждать моноаминные, уровень моноаминов падает и организм погружается в сон. В состоянии сна происходит постоянное подавление орексиновых нейронов центром ВОП.
Было показано, что хроническое поступление никотина увеличивает уровень орексинов, правда, не очень понятно как. Авторы ограничиваются мнением, что воздействие происходит через α4β2-зависимый механизм, что было выявлено не только методом иммуногистохимии, но и с помощью оценки уровня мРНК субъединиц никотинового рецептора. Лично я рискну предположить, что все это происходит благодаря банальной активации орексиновых нейронов (их, кстати, не так уж много, всего лишь несколько тысяч на весь мозг, однако они имеют проекции к другим важнейшим зонам) [11].
Сведения касательно гипокретинов изложены кратко в связи с тем, что мы тут говорим о никотине, но на самом деле тема животрепещущая — их рецепторы являются мишенью для многих фармокологических средств (например, антагониста суворексанта — от бессонницы), причем некоторые из них в данный момент в активной разработке. Они, как правило, связаны с лечением наркотической зависимости (ОХ рецепторы являются мишенями немалого числа наркотиков), нарушений циклов сна/бодрствования и метаболических расстройств. Лечение нарколепсии осуществляется сейчас, главным образом, подобными препаратами, и, что не может не радовать, самим никотином [12], хотя есть и более изощренные методы типа попыток пересадки орексиновых нейронов в экспериментах на крысах...
Что по поводу лептина, о котором было сказано выше? Лептин — это пептидный гормон, выделяемый адипоцитами, который играет роль в развитии инсулиннезависимого диабета, стимулирует симпатическую нервную систему, что, в свою очередь, ведет к повышению АД, увеличению ЧСС и усилению процессов термогенеза путем разобщения процессов окисления и фосфорилирования в митохондриях белой жировой ткани. В результате этих процессов большое количество энергии, которое запасается в жировой ткани в виде липидов, может быть преобразовано в тепло. К тому же лептин имеет отношение к регуляции менструального цикла (при его недостатке прекращаются овуляции и менструации). Считается, что он действует на гипоталамус, подавляя выработку нейропептида Y, что угнетает чувство голода, но еще примечательно, что нейропептид Y сам по себе является сложным модулятором глутаматных каналов. Никотин же усиливает выработку лептина и/или увеличивает количество его рецепторов в гипоталамусе, оказывая анорексигенный эффект, то есть снижает аппетит (рис. 10) [13].

Рисунок 10. Регуляция пищевого поведения.
рисунок автора статьи
Необходимо упомянуть, что поступление никотина вызывает высвобождение норадреналина из паравентрикулярного ядра гипоталамуса. Кстати, то же самое в этот момент произойдет в миндалине через потенциацию NMDA и посредством каскадов с участием окиси азота [14], [15]. Так как гипоталамус очень тесно связан с гипофизом, не будет лишней информация об опытах по взаимодействию гипофиза с никотином, где было, наконец, выяснено, что окситоцин выделяется отдельно от вазопрессина [16] и что никотин вызывает увеличение выделения именно последнего [17]. Такая информация была довольно важна для человечества — этим объяснились не очень понятные эффекты: внутрикаротидное или внутривенное введение никотина сопровождалось повышением давления, а интраспинальное введение малых доз сопровождалось его снижением. Мы еще вернемся к этим эффектам в следующей части статьи.
Иммунитет и воспаление
Помимо эффектов, упомянутых выше, никотин активирует симпатическую систему: высвобождение ацетилхолина — преганглионарного медиатора этой системы — влечет за собой секрецию адреналина, вызывая тем самым симпатические эффекты (рис. 2). И тут, в общем-то, всё предсказуемо: повышается АД, увеличивается ЧСС, повышается мобильность и тревожность за счет выработки глюкокортикоидов надпочечниками. Между тем, глюкокортикоиды обладают свойством регулировать воспаление и иммунный ответ — усиливают нейтрофилопоэз и, следовательно, повышают содержание нейтрофилов в крови. Они также усиливают ответ нейтрофильного ростка костного мозга на ростовые факторы G-CSF и GM-CSF и на интерлейкины, уменьшают повреждающее действие лучевой и химиотерапии злокачественных опухолей на костный мозг и степень вызываемой этими воздействиями нейтропении. Благодаря этому эффекту глюкокортикоиды широко применяются в медицине при нейтропениях, вызванных химиотерапией и радиотерапией, и при лейкозах и лимфопролиферативных заболеваниях.
Однако это еще не всё. Глюкокортикоиды снижают активность разрушающих ткани ферментов — протеаз и нуклеаз, матриксных металлопротеиназ, гиалуронидазы, фосфолипазы А2 и других, — тормозят синтез простагландинов, кининов, лейкотриенов и других медиаторов воспаления. Они также понижают проницаемость тканевых барьеров и стенок сосудов, тормозят экссудацию в очаг воспаления жидкости и белка, миграцию (хемотаксис) лейкоцитов в очаг и пролиферацию соединительной ткани в нём, стабилизируют клеточные мембраны, тормозят перекисное окисление липидов, образование в очаге воспаления свободных радикалов и многие другие процессы, участвующие в развитии воспаления. Один из механизмов такого действия связан с индуцированием выделения белков, ингибирующих фосфолипазу A2 и известных как аннексины (липокортины). Предполагают, что эти белки контролируют биосинтез таких сильнодействующих медиаторов воспаления, как простагландины и лейкотриены, путем торможения высвобождения их общего предшественника — арахидоновой кислоты. А вот арахидоновая кислота выделяется из мембранных фосфолипидов как раз под действием фосфолипазы A2. Следовательно, ее ингибирование оказывает противовоспалительное действие.
Так что же делают глюкокортикоиды — повышают или понижают иммунитет? Конкретного ответа мы никогда не узнаем: их эффекты на иммунную систему неоднозначны. Проявление иммуностимулирующего или иммуносупрессивного эффекта зависит от концентрации глюкокортикоидного гормона в крови. Дело в том, что субпопуляция T-супрессоров значительно более чувствительна к угнетающему действию низких концентраций глюкокортикоидов, чем B-клетки и субпопуляции T-хелперов и T-киллеров. Таким образом, в сравнительно низких концентрациях глюкокортикоиды оказывают скорее иммуностимулирующее действие, сдвигая соотношение T-хелпер/Т-супрессор в сторону преобладания Т-хелперной активности. В более высоких концентрациях глюкокортикоиды оказывают иммуносупрессивное действие, причем интенсивность иммуносупрессии прямо пропорциональна концентрации этих гормонов в крови и растет практически линейно до уровней, в 100 раз превышающих физиологические.
О наболевшем
Предугадывая некоторые вопросы, попробую заранее на них ответить.
Менструации и либидо
По поводу той части, где рассматривались влияние никотина на самок и связь с менструальным циклом: да, у овулирующих самок эффект никотина снижается, а прогестерон его положительно модулирует, отсюда повышается уровень тревожности. Но дело в том, что у самок по сравнению с самцами симпатическая система в фоновом режиме работает в принципе интенсивнее [18], поэтому кому в этом плане хуже — можно только предполагать. Женщины приспособлены к постоянной тревоге, так что, возможно, им это повышение аукается меньше.
По поводу мужских дел — никотин (и его метаболит котинин) оказывают токсическое влияние на семенники, угнетая продукцию тестостерона [19]. Вероятно, как раз из-за этого и считается, что курение вызывает импотенцию. Действительно, либидо угнетается, но не стоит забывать о том, что никотин — это не единственный фактор, способный влиять на гормональный фон и кровоснабжение половой системы в целом. Хотя в другой работе [20] даже при введении довольно высоких доз никотина не было отмечено изменений уровня тестостерона в крови, а вот уровень лютеинизирующего гормона был повышен. Так что, хоть клетки Лейдига и угнетаются никотином, в то же время активируется гипофиз, компенсирующий эти потери. У женщин же повышение лютеинизирующего гормона инициирует овуляцию. Поэтому, если женщина собралась рожать, к вопросу о том, чтобы бросить курить, стόит подойти более чем ответственно с точки зрения эндокринологии: без никотиновой стимуляции лютеинизирующего гормона может начать вырабатываться недостаточно.
Вазопрессин, кровотечения и тромбоз
Что касается вазопрессина, то тут всё очень тесно связано с симпатической нервной системой. По ее милости он выделяется и эффекты оказывает аналогичные: улучшая реабсорбцию мочи, вазопрессин сокращает выход натрия и воды из организма, разбавляя плазму и повышая давление, в том числе и путем сужения сосудов: хотя сосудодвигательная роль его совсем невелика, он, по всей видимости, больше действует опосредованно — повышая чувствительность к катехоламинам, которые в условиях стресса сделают свое дело.
Вазопрессин химически весьма сходен с окситоцином, поэтому может связываться с рецепторами к окситоцину и через них повышать тонус и стимулировать сокращения матки. Однако его аффинность к OT-рецепторам невелика, поэтому при физиологических концентрациях эти эффекты у вазопрессина гораздо слабее, чем у окситоцина [21].
К тому же (как можно пропустить сердечно-сосудистые заболевания, в развитии которых все кому не лень обвиняют никотин!), рецепторы к вазопрессину есть не только в почках и сосудах, но еще и в печени, которая, помимо прочего, занимается выработкой фактора Виллебранда и чувствительна к уровню плазмина. Так как вазопрессин предназначен для остановки кровотечений и компенсации других шоковых состояний, печень начинает усиленно вырабатывать агреганты. Вкупе с гипертензией получаем высокий риск тромбоза, ничего не попишешь. Но для таких уровней вазопрессина и риска в целом необходимо дымить как паровоз либо иметь сопутствующие проблемы, которые замкнут порочный круг. В результате пониженной секреции вазопрессина может развиться несахарный диабет. Что касается диабета сахарного (II типа), то, хотя сам никотин и вызывает уменьшение чувствительности мышц к инсулину [22], прямых доказательств зависимости диабета от поступления именно никотина — хотя курящих среди диабетиков много — пока что нет.
Будущие мамы
Насчет курения во время беременности — так ли это опасно? Конечно, возможные риски для плода несколько повышаются, ведь никотин достаточно свободно проходит сквозь плацентарный барьер. В этой статье рассматривается исключительно влияние никотина, поэтому оставим разговоры о гипоксии (да и возникает она у курящих матерей едва ли чаще, чем у некурящих) по причине проникновения через плаценту монооксида углерода, нитрозаминов и других соединений, о которых поговорим как-нибудь в другой раз — когда будем разбирать физиологию курения в целом. Тем не менее пара слов о курящих матерях просто необходима: никотин очень хорошо проникает в грудное молоко, причем настолько, что в молоке его содержание может быть в 2–3 раза выше, чем в крови матери [23]. Также стоит упомянуть, что раз никотин обладает сосудосуживающим действием, некоторые проблемы могут быть непосредственно связаны с недостаточным кровоснабжением плода.
Имеется корреляция между курением матери во время беременности и развитием ожирения у ребенка в среднем в 9 лет. Неизвестно, связано ли это с действием именно никотина на развивающийся гипоталамус, вследствие чего развиваются нарушения эндокринной системы, но пока эта гипотеза наиболее распространена [23]. Подтвержденным примером эндокринологического действия никотина на плод (во всех представленных опытах беременным/лактирующим самкам различными путями вводили соли никотина) может служить то, что он вызывает нарушения активности паратиреоидных клеток плода совместно с увеличением активности тиреоидных [24]. А это вкупе с активацией симпатики матери и плода может объяснить то, что дети матерей, принимающих никотин, часто бывают гиперактивными, капризными и раздражительными. Это влияние сохраняется у крыс очевидным в течение первого месяца жизни, однако дальнейшие исследования не проводились. Из-за гиперактивации в нежном возрасте появляется ряд проблем: извращается нейронная активность, возникает чрезмерный плач вперемешку с апатией и вялостью, бледность, а в тяжелых случаях — депривация сна и отсроченные проблемы с памятью и обучением [23]. Стόит отметить, что астму у детей, как и гиперактивность [25], причисляют к заболеваниям, вызываемым никотином [26]. Однако она встречается и у младенцев матерей, испытывавших стресс во время беременности [27], а у детей курящих возникает далеко не в 100% случаев. Тут не учтено то, что очень часто стресс и курение идут бок о бок, а эффекты могут оказывать отдельно друг от друга.
Также никотин вызывает увеличение числа дофаминергических нейронов и рецепторов к дофамину уже внутриутробно [28], что в отношении плода нельзя назвать положительным эффектом. После рождения рано или поздно поступление никотина прекратится (например, после завершения кормления содержащим никотин материнским молоком), сократится количество дофамина, и хорошо от этого никому не будет: нарушения будут касаться многих функций, от психических до моторных.
У подверженных действию никотина матерей рождаются дети с уменьшенной в той или иной мере массой тела, но это не так интересно, как то, что у них повышено содержание TGF-β и оксида азота — маркеров воспаления [29]. Оксид азота, предположительно, высвобождается по механизму, рассмотренному в статье [14]. Также к отсроченным последствиям можно отнести то, что у потомства «никотинщиков» с более высокой вероятностью формируется гипертензивный фенотип: пренатальная подверженность никотину активирует механизм метилирования ДНК, что регулирует экспрессию гена рецептора к ангиотензину-II (AT-1aR) [30]. И последнее, что стόит сказать о материнстве — курение матери повышает возможность того, что ребенок, повзрослев, тоже начнет курить.
Оксидативный стресс и апоптоз
Конечно, эти процессы относятся к курению вообще, сам же никотин в этом не виноват. Однако раз уж речь о них зашла, давайте разберемся. Да, окислительный стресс есть: в сигаретном дыме содержатся монооксиды азота и углерода, а также масса других веществ (вот среди них как раз есть «персонажи» из реестра канцерогенов) — вплоть до смол, которые просто не дают нормально осуществлять газообмен в легких. Конкретно же апоптоз происходит вследствие активации каспазы-3 активными формами кислорода. Кстати, этот каскад успешно блокируется аскорбиновой кислотой [31]. Сам же никотин не состоит в списке канцерогенных веществ и апоптоз мало того, что не вызывает — он его даже предотвращает. Он вообще оказывает больше цитопротекторное действие, особенно на нейроны. Курение само по себе является этаким иммуносупрессивным фактором, и, угнетая иммунный ответ, повышает вероятность развития различных опухолей [32]. Никотин же ему в этом... помогает (рис. 9). Оказывая цитопротекторный эффект, он защищает раковые клетки от гибели, а если опухоль уже образовалась — даже потенцирует ангиогенез. Протекторный эффект никотин оказывает на всех клеточных и субклеточный уровнях: к примеру, один из механизмов предотвращения апоптоза — проникновение никотина внутрь клетки, связывание с мембраной митохондрий и блокировка образования в ней пор, которые могли бы запустить апоптоз [33].
«Раковые палочки»
Всеми излюбленная тема о раке легких: да, да, да — риск высокий, но это благодаря тому, что смолы оседают на стенках бронхов, альвеол, затрудняется газообмен — и только тогда клетки начинают пролиферировать. Более того, одно исследование показало, что если человек продолжает курить во время химиотерапии/радиотерапии, то эффективность лечения заметно снижается в силу индуцированной никотином устойчивости [32]. Всем, наверное, очень интересно узнать про опухоли, но здесь даже не нужно делать отдельный абзац: подавляя иммунитет, никотин и другие продукты сгорания табака повышают риск разрастания и так всегда имеющихся раковых клеток, где бы они ни находились. К тому же опухолевые клетки живут преимущественно гликолизом, а вазоконстрикция приводит к гипоксии органа, нарушению его функций, в то время как раковые клетки там процветают. Самое частое онкологическое заболевание у курильщиков — рак легких, ведь именно в них оседают основные продукты сгорания, помимо никотина. Какие — можно узнать из статьи [34], содержащей наиболее полный список в той или иной степени опасных продуктов сгорания сигареты.
И еще про иммунитет
Большой интерес представляет воздействие никотина на иммунитет, помимо влияния на синтез глюкокортикоидов. Можно встретить различные утверждения на этот счет, в которых легко запутаться. Отделим зерна от плевел: никотин снижает системный иммунитет, с локальным же всё сложнее. Например, никотин оказывает защитный (то есть противовоспалительный) эффект в отношении толстой, но не подвздошной (!), кишки при язвенном колите и болезни Крона, а также при колите, вызванном токсином А Clostridium difficile, снижая уровень субстанции Р и других провоспалительных пептидов [35]. При ожогах он уменьшает количество провоспалительных цитокинов, которые при термических травмах образуются в избытке (имеются в виду контрольные группы с ожогами не менее 30% поверхности тела — тогда воспалительная реакция носит системный характер) [36]. В развитии сепсиса важнейшую роль играют Toll-подобные рецепторы. Путем интраперитонеального введения никотина (400 мкг/кг) было выяснено, что он ингибирует эти рецепторы посредством взаимодействия с α7 nAchR и активации фосфоинозитид-3-киназы, хотя хорошо это или плохо в условиях заражения, вопрос спорный [37].
Посредством тех же α7 nAchR, как ни удивительно, никотин облегчает течение ожирения. Как ни парадоксально, среди диабетиков много курящих, и, как мы уже знаем, никотин уменьшает чувствительность к инсулину, но... ожирение характеризуется хроническим воспалением в подкожной жировой клетчатке, которое никотин тоже подавляет. К тому же у курящих диабетиков и курящих людей с избыточной массой тела реже встречается язвенный колит, тоже связанный с локальным воспалением [38]. Тем же противовоспалительным путем, через α7 nAchR, он защищает почки от ишемии, уменьшая количество фактора некроза опухоли, различных хемокинов, а также предотвращая инфильтрацию нейтрофилами [39]. Несмотря на это, вопрос о рождении детей с повышенным содержанием маркеров воспаления остается открытым.
Вездесущие генетики
Современные данные свидетельствуют о том, что никотин может регулировать экспрессию различных генов, таких как ERK1/2, CREB и C-FOS, а также модулирует некоторые биохимические пути — например, пути митоген-активируемой протеинкиназы А (МАРК), фосфатидилинозитолфосфатазы (PTEN), некоторых факторов роста, а также убиквитин-протеасомный путь [40].
Три гена, связанные с никотиновой зависимостью, — ESR1 (эстрогеновый рецептор 1), ARRB1 (аррестин бета 1) и ARRB2. Продукт ESR1 в качестве специфического ядерного рецептора половых гормонов широко распространен в дофаминергических нейронах среднего мозга и способен модулировать высвобождение нейромедиаторов системы вознаграждения мозга [41]. К тому же этот рецептор играет важную роль в процессе апоптоза. ARRB1 и ARRB2 повсеместно используются как строительные белки. Они могут регулировать несколько внутриклеточных сигнальных белков, участвующих в пролиферации и дифференцировке клеток, и играют важную роль в митогенной и антиапоптотической функции никотина [42]. В одном из опытов крыс подвергали воздействию никотина (3,2 мг/кг/день, 14 дней), а затем прекращали его поступление. Сразу же после этого самки проявляли повышенную тревожность, и у них увеличивалась экспрессия генов CRF, UCN и DRD1. Во время получения никотина самки демонстрировали уменьшение экспрессии CRF-R1, CRF-R2, Drd3, Esr2 и увеличение CRF-BP. Этой картины не наблюдали у самок с овариоэктомией. Локализация этих процессов — прилежащее ядро. Другими словами, при прекращении поступления никотина в прилежащем ядре активировались гены, ассоциированные со стрессом [43].
Еще отношение к никотину довольно весомо определяется однонуклеотидным полиморфизмом гена rs16969968, кодирующего α5 субъединицу ацетилхолинового рецептора. Испытуемых просили курить обычные сигареты, содержащие никотин (0,60 мг), и плацебо (44].
А напоследок я скажу...
В сухом остатке мы имеем то, что никотин не так уж и плох, как о нём говорят. Оказывая ацетилхолиноподобное действие, он действует на мозг, активируя важнейшие его участки, усиливая когнитивные функции и оказывая влияние на гормональный фон. Более того, он имеет еще и клиническое значение в терапии заболеваний, связанных с нарушениями метаболизма, сна и бодрствования, а также имеет значение в профилактике нейродегенеративных заболеваний и регуляции иммунитета.
В настоящее время ведется активная научная дискуссия о том, является ли никотин канцерогеном, однако в список канцерогенов его никогда не включали. Интересной особенностью является то, что никотин не вызывает апоптоз, а наоборот, предотвращает его путем сложных внутриклеточных каскадов (и этим он может способствовать развитию злокачественной опухоли, тем не менее не индуцируя ее образование).
Напоследок немного отвлечемся и рассмотрим вопрос, который, скорее всего, возникал у читателей с самого начала: зачем же никотин вообще образуется в растениях? Особенно учитывая то, что на синтез такого сложного алкалоида тратится около 10% всей энергии, запасенной в результате фотосинтеза [45]. Такая трата вполне оправданна, поскольку транспортируясь в листья, алкалоид делает их несъедобными для колорадского жука. У ближайшего родственника табака, картофеля, тоже вырабатывается никотин, но его оказывается так мало, что эффективность практически нулевая, и в данном случае траты напрасны. Синтезируется никотин в растениях из орнитина или пролина и никотиновой кислоты.
В завершение статьи вернемся к тому, что нельзя забывать вот о чём: сейчас слово «курение» попросту отождествляют с никотином, а это в корне неверно, хоть курение и основной путь поступления никотина в организм человека. Продуктов сгорания сигареты гораздо больше, и никотин из них — наиболее безобидный. Так что многие упреки в сторону алкалоида, который является ядом разве что для насекомых, несправедливы. Спектр его эффектов очень широк, и среди них есть не только негативные. Это подтверждается многочисленными исследованиями и клиническим применением никотина — даже в большем количестве случаев, чем мы упомянули в обзоре. Главный вывод, который можно сделать на основе многочисленных данных, — то, что Парацельс был прав: Alle Dinge sind Gift, und nichts ist ohne Gift; allein die Dosis machts, dass ein Ding kein Gift sei («Всё есть яд, ничто не лишено ядовитости, одна лишь доза делает яд незаметным»).
Материал был частично опубликован на портале Medach.pro: «Никотин» и «Никотин и всё, что с ним связано» [46], [47].
Литература
- Количество курильщиков в мире приближается к миллиарду. BBC;
- Berger T.W., Hampson R.E., Song D., Goonawardena A., Marmarelis V.Z., Deadwyler S.A. (2011). A cortical neural prosthesis for restoring and enhancing memory. J. Neural. Eng. 8, 046017;
- Placzek A.N., Zhang T.A., Dani J.A. (2009). Nicotinic mechanisms influencing synaptic plasticity in the hippocampus. Acta Pharmacol. Sin. 30, 752–760;
- Kenney J.W. and Gould T.J. (2008). Modulation of hippocampus-dependent learning and synaptic plasticity by nicotine. Mol. Neurobiol. 38, 101–121;
- Wang Y., Wang Z., Wang J., Wang Y., Henderson Z., Wang X. et al. (2015). The modulation of nicotinic acetylcholine receptors on the neuronal network oscillations in rat hippocampal CA3 area. Sci. Rep. 5, 9493;
- Kishioka S., Kiguchi N., Kobayashi Y., Saika F. (2014). Nicotine effects and the endogenous opioid system. J. Pharmacol. Sci. 125, 117–124;
- Mineur Y.S., Abizaid A., Rao Y., Salas R., DiLeone R.J., Gündisch D. et al. (2011). Nicotine decreases food intake through activation of POMC neurons. Science. 332, 1330–1332;
- Picciotto M.R. and Mineur Y.S. (2013). Nicotine, food intake, and activation of POMC neurons. Neuropsychopharmacology. 38, 245;
- Tanida M., Yamamoto N., Morgan D.A., Kurata Y., Shibamoto T., Rahmouni K. (2015). Leptin receptor signaling in the hypothalamus regulates hepatic autonomic nerve activity via phosphatidylinositol 3-kinase and AMP-activated protein kinase. J. Neurosci. 35, 474–484;
- Plaza-Zabala A., Flores Á., Martín-García E., Saravia R., Maldonado R., Berrendero F. (2013). A role for hypocretin/orexin receptor-1 in cue-induced reinstatement of nicotine-seeking behavior. Neuropsychopharmacology. 38, 1724–1736;
- Pasumarthi R.K. and Fadel J. (2008). Activation of orexin/hypocretin projections to basal forebrain and paraventricular thalamus by acute nicotine. Brain Res. Bull. 77, 367–373;
- Browman C., Gujavarty K.S., Mitler M.M. (1984). Tobacco use by narcoleptics and daytime sleep tendency. Drug Alcohol Depend. 14, 23–26;
- Hodge A.M., Westerman R.A., de Courten M.P., Collier G.R., Zimmet P.Z., Alberti KG. (1997). Is leptin sensitivity the link between smoking cessation and weight gain? Int. J. Obes. Relat. Metab. Disord. 21, 50–53;
- Zhao R., Chen H., Sharp B.M. (2007). Nicotine-induced norepinephrine release in hypothalamic paraventricular nucleus and amygdala is mediated by N-methyl-D-aspartate receptors and nitric oxide in the nucleus tractus solitarius. J. Pharmacol. Exp. Ther. 320, 837–844;
- Hatton G.I. and Yang Q.Z. (2002). Synaptic potentials mediated by alpha 7 nicotinic acetylcholine receptors in supraoptic nucleus. J. Neurosci. 22, 29–37;
- Castro de Souza E. and Rocha E Silva M. Jr. (1977). The release of vasopressin by nicotine: further studies on its site of action. J. Physiol. 265, 297–311;
- Narayanaswami V., Somkuwar S.S., Horton D.B., Cassis L.A., Dwoskin L.P. (2013). Angiotensin AT1 and AT2 receptor antagonists modulate nicotine-evoked [³H]dopamine and [³H]norepinephrine release. Biochem. Pharmacol. 86, 656–665;
- Gangitano D., Salas R., Teng Y., Perez E., De Biasi M. (2009). Progesterone modulation of alpha5 nAChR subunits influences anxiety-related behavior during estrus cycle. Genes Brain Behav. 8, 398–406;
- Aydos K., Güven M.C., Can B., Ergün A. (2001). Nicotine toxicity to the ultrastructure of the testis in rats. BJU Int. 88, 622–626;
- Mendelson J.H., Sholar M.B., Mutschler N.H., Jaszyna-Gasior M., Goletiani N.V., Siegel A.J., Mello N.K. (2003). Effects of intravenous cocaine and cigarette smoking on luteinizing hormone, testosterone, and prolactin in men. J. Pharmacol. Exp. Ther. 307, 339–348;
- Welberg L. (2008). Neuropeptides: Vasopressin: not just for males. Nat. Rev. Neurosci. 9, 890–891;
- Tzatsos A. (2009). Raptor binds the SAIN (Shc and IRS-1 NPXY binding) domain of insulin receptor substrate-1 (IRS-1) and regulates the phosphorylation of IRS-1 at Ser-636/639 by mTOR. J. Biol. Chem. 284, 22525–22534;
- Banderali G., Martelli A., Landi M., Moretti F., Betti F., Radaelli G. et al. (2015). Short and long term health effects of parental tobacco smoking during pregnancy and lactation: a descriptive review. J. Transl. Med. 13, 327;
- Abdelhafez A.M., Eltony S.A., Abdelhameed S.Y., Elgayar S.A. (2014). Effect of maternal nicotine/thiocyanate exposure during gestational period upon pituitary, thyroid and parathyroid function/morphology of 1-month-old rat offspring. J. Endocrinol. Invest. 37, 455–465;
- Bronson S.L. and Bale T.L. (2014). Prenatal stress-induced increases in placental inflammation and offspring hyperactivity are male-specific and ameliorated by maternal antiinflammatory treatment. Endocrinology. 155, 2635–2646;
- Rehan V.K., Liu J., Sakurai R., Torday J.S. (2013). Perinatal nicotine-induced transgenerational asthma. Am. J. Physiol. Lung Cell Mol. Physiol. 305, L501–L507;
- Flanigan C., Sheikh A., Nwaru B.I. (2016). Prenatal maternal psychosocial stress and risk of asthma and allergy in their offspring: protocol for a systematic review and meta-analysis. NPJ Prim. Care Respir. Med. 26, 16021;
- Zhang D., Dragomir A., Akay Y.M., Akay M. (2014). Nicotine exposure increases the complexity of dopamine neurons in the parainterfascicular nucleus (PIF) sub-region of VTA. J. Neuroeng. Rehabil. 11, 103;
- Mohsenzadeh Y., Rahmani A., Cheraghi J., Pyrani M., Asadollahi K. (2014). Prenatal exposure to nicotine in pregnant rat increased inflammatory marker in newborn rat. Mediators Inflamm. 2014, 274048;
- Xiao D., Dasgupta C., Li Y., Huang X., Zhang L. (2014). Perinatal nicotine exposure increases angiotensin II receptor-mediated vascular contractility in adult offspring. PLoS One. 9, e108161;
- Rao P., Ande A., Sinha N., Kumar A., Kumar S. (2016). Effects of cigarette smoke condencate on oxidative stress, apoptotic cell death, and HIV replication in human monocytic cells. PLoS One. 11, e0155791;
- Czyżykowski R., Połowinczak-Przybyłek J., Potemski P. (2016). Nicotine-induced resistance of non-small cell lung cancer to treatment—possible mechanisms. Postepy Hig. Med. Dosw. (Online). 70, 186–193;
- Chernyavsky A.I., Shchepotin I.B., Galitovkiy V., Grando S.A. (2015). Mechanisms of tumor-promoting activities of nicotine in lung cancer: synergistic effects of cell membrane and mitochondrial nicotinic acetylcholine receptors. BMC Cancer. 15, 152;
- Talhout R., Schulz T., Florek E., van Benthem J., Wester P., Opperhuizen A. (2011). Hazardous compounds in tobacco smoke. Int. J. Environ. Res. Public. Health. 8, 613–628;
- Vigna S.R. (2016). Nicotine inhibits Clostridium difficile toxin A-induced colitis but not ileitis in rats. Int. J. Inflam. 2016, 4705065;
- Claassen L., Papst S., Reimers K., Stukenborg-Colsman C., Steinstraesser L., Vogt P.M. et al. (2014). Inflammatory response to burn trauma: nicotine attenuates proinflammatory cytokine levels. Eplasty. 14, e46;
- Kim T.H., Kim S.J., Lee S.M. (2014). Stimulation of the α7 nicotinic acetylcholine receptor protects against sepsis by inhibiting Toll-like receptor via phosphoinositide 3-kinase activation. J. Infect. Dis. 209, 1668–1677;
- Lakhan S.E. and Kirchgessner A. (2011). Anti-inflammatory effects of nicotine in obesity and ulcerative colitis. J. Transl. Med. 9, 129;
- Sadis C., Teske G., Stokman G., Kubjak C., Claessen N., Moore F. et al. (2007). Nicotine protects kidney from renal ischemia/reperfusion injury through the cholinergic anti-inflammatory pathway. PLoS One. 2, e469;
- Brunzell D.H., Russell D.S., Picciotto M.R. (2003). In vivo nicotine treatment regulates mesocorticolimbic CREB and ERK signaling in C57Bl/6J mice. J. Neurochem. 84, 1431–1441;
- Munafò M.R. and Johnstone E.C. (2008). Genes and cigarette smoking. Addiction. 103, 893–904;
- Dasgupta P., Rizwani W., Pillai S., Davis R., Banerjee S., Hug K. et al. (2011). ARRB1-mediated regulation of E2F target genes in nicotine-induced growth of lung tumors. J. Natl. Cancer Inst. 103, 317–333;
- Torres O.V., Pipkin J.A., Ferree P., Carcoba L.M., O’Dell L.E. (2015). Nicotine withdrawal increases stress-associated genes in the nucleus accumbens of female rats in a hormone-dependent manner. Nicotine Tob. Res. 17, 422–430;
- Macqueen D.A., Heckman B.W., Blank M.D., Janse Van Rensburg K., Park J.Y., Drobes D.J., Evans D.E. (2014). Variation in the α 5 nicotinic acetylcholine receptor subunit gene predicts cigarette smoking intensity as a function of nicotine content. Pharmacogenomics J. 14, 70–76;
- Dani J.A. and Bertrand D. (2007). Nicotinic acetylcholine receptors and nicotinic cholinergic mechanisms of the central nervous system. Annu. Rev. Pharmacol. Toxicol. 47, 699–729;
- Насаев Ш. и Тюльганова Д. (2016). «Никотин». Medach.pro;
- Тюльганова Д. и Насаев Ш. (2016). «Никотин и всё, что с ним связано». Medach.pro.







