Воспаленный рассудок
04 сентября 2018
Воспаленный рассудок
- 6363
- 0
- 9
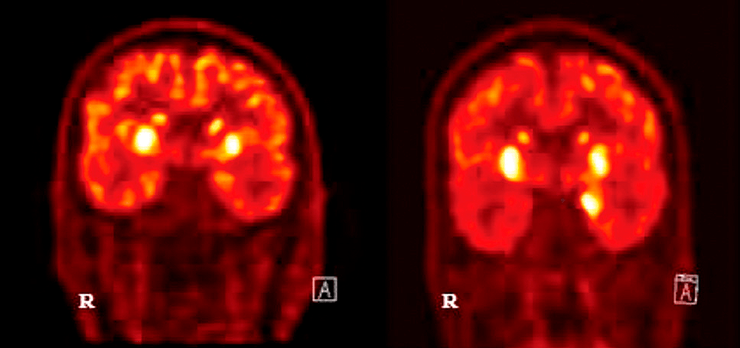
На изображении видны изменения в метаболизме базальных ганглиев и медиальных височных областей при одном из типов аутоиммунного энцефалита
-
Автор
-
Редакторы
В настоящее время все больше внимания уделяется тому, как иммунитет влияет на разные процессы в нашем организме. Обнаруженные в новых исследованиях нарушенные иммунные реакции становятся недостающим звеном патогенеза. Это стимулирует поиск новых лекарств и других профилактических и лечебных воздействий. В этом тексте мы обсудим особый иммунный статус мозга — его изолированность от системных процессов иммунитета. Кроме этого поговорим о расстройствах, которые нарушают иммунный суверенитет центральной нервной системы — об аутоиммунных энцефалитах.
Привилегированный орган
Мозг — это орган, примечательный во многих отношениях [1]. Бесконечная сложность устройства, его функциональные возможности и связь нашей жизни с его состоянием приковывают к мозгу внимание исследователей. Взаимоотношения мозга с иммунной системой нашего организма тоже носят особенный характер: мозг является иммуннопривилегированным органом. Иммунные реакции, которые легко развиваются в остальных тканях (клетках печени, мышцах, жировой клетчатке), в мозге возникают редко. Вместе с мозгом в таких особых отношениях с иммунной системой оказались щитовидная железа, яички и некоторые ткани глаза, в частности, роговица.
В сознании врачей второй половины ХХ века мозг представлял собой структуру, полностью изолированную от иммунных процессов остального организма. В начале прошлого века японские ученые проводили опыты по имплантации клеток саркомы (злокачественной опухоли мышечной ткани) в различные органы мышей [2]. Оказалось, что при помещении клеток саркомы в ткани мозга опухоль активно развивается, а в случае их имплантации под кожу грызунов или в мышечную ткань опухоль не развивалась. Исследователи предположили, что «центр» (мозг) изолирован от иммунных процессов, которые успешно побороли саркому «на периферии» (другие ткани). Дальнейшие исследования только подтверждали этот вывод. Мозг в представлениях ученых стал «чистой зоной», в которой не развивается иммунный ответ. В 1950-х годах возник термин «иммунологическая привилегия», введенный британскими учеными по фамилии Биллингэм и Босуэлл [3].
Преодолевая барьеры
Длительное время считалось, что основой иммунной привилегии головного мозга является наличие гемато-энцефалического барьера (ГЭБ). ГЭБ — это комплекс клеточных и внеклеточных структур, которые отделяют кровь, текущую в капиллярах, от нейронов паренхимы мозга. Клетки стенок сосудов, базальная мембрана, на которой они лежат, астроциты участвуют в формировании ГЭБ. Иммунная привилегированность частей центральной нервной системы хорошо согласовывалась с распространенностью ГЭБ внутри нее. Паренхима головного мозга надежно защищена ГЭБ, и в ней редко возникают воспалительный процессы (энцефалиты). Хориоидные сплетения, продуцирующие спинномозговую жидкость, и оболочки головного мозга не имеют такого прикрытия, и их воспаление (хориоидит, менингит) встречается гораздо чаще (рис. 1).
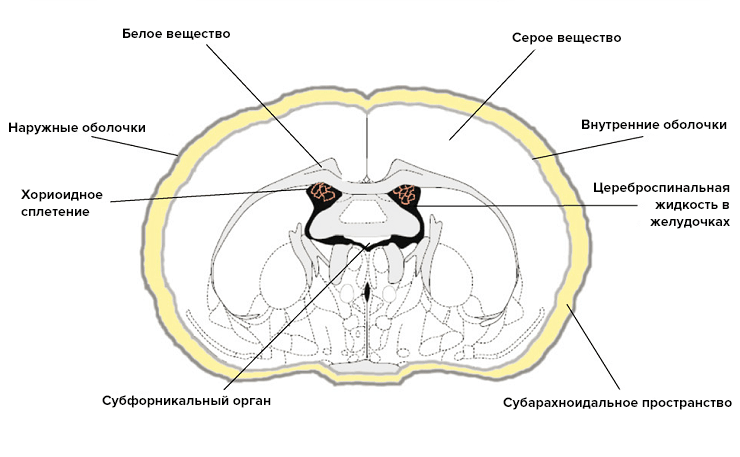
Рисунок 1. Строение центральной нервной системы. К частям, которые хорошо защищены ГЭБ, относятся серое и белое вещества. Другие компоненты не имеют такой защиты.
Есть случаи, в которых даже ГЭБ не спасает нервную систему, и в мозге возникают процессы воспаления. Однако важно ответить для себя на вопрос: протекают ли они так же, как во всем остальном организме? Может быть, мозг имеет особый способ иммунного реагирования, и иммунная привилегия имеет дополнительные объяснения? В лабораторных условиях иммунный ответ в тканях можно вызвать при помощи введения бактериального липополисахарида (ЛПС). Это структурный компонент клеточной стенки грамотрицательных бактерий, запускающий каскад иммунных реакций в нашем организме. При изучении реакции разных тканей организма на введение ЛПС выяснилось, что иммунный ответ в коже и хориодиных сплетениях ЦНС возникают на одну и ту же дозу ЛПС [4]. Это логично, ведь ни в одном, ни в другом случае нет специальной защиты в виде ГЭБ. В то же время, чтобы вызвать иммунную реакцию в паренхиме мозга, схожую с той, что происходит в коже, необходима доза в 100 раз больше, чем «кожная». При этом происходит компартментализация иммунного ответа — поражается преимущественно белое вещество (отростки нейронов), а не серое (их тела). Этот опыт указывает на еще одно объяснение иммунной привилегии — слабость собственного, «внутреннего» иммунного ответа нашего мозга. Паренхима мозга оказывается крайне пассивной в отношении бактериального вторжения: мозг как будто не хочет замечать чужеродные компоненты внутри себя. Дальше мы попробуем разобраться, в чем причина этой иммунной «невнимательности».
Слабое звено
Если мы говорим о слабости местного иммунного ответа, то необходимо разобраться, что «сломано» в нем. Это может быть нарушенное распознавание при нормальной способности иммунных клеток атаковать антигены (слабость афферентного звена). Другой вариант: нормальное распознавание антигена при нарушенной способности к его атаке (слабость эфферентного звена). Как показали исследования, эфферентная часть в мозге сохранена и работает нормально [2]. Тогда усилия сосредоточили на поиске нарушений в афферентном звене. Со временем стало ясно, что дело в распознавании антигена и дальнейшей работе с ним (рис. 2).
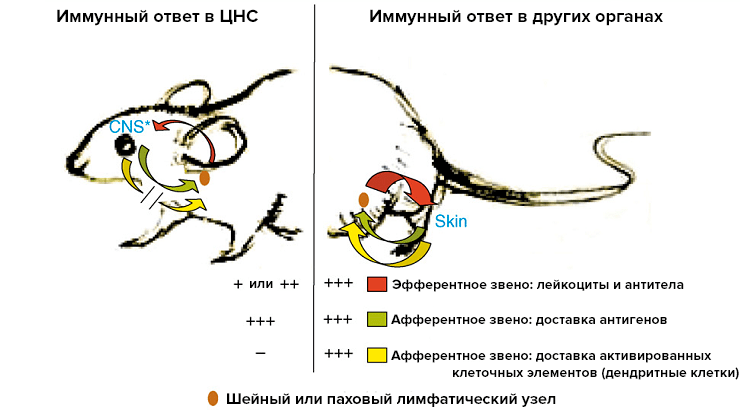
Рисунок 2. Иммунный ответ проходит в несколько этапов. Формирование реакции на антиген происходит двумя путями: в местные лимфоузлы информация об антигене доставляется в «жидком» (сами антигены) и «твердом» виде (ранее активированные клеточные элементы иммунной системы) . При иммунной реакции вне мозга работают оба пути. При реакции иммунной системы мозга на антиген до местных (шейных) лимфоузлов клеточные элементы не добираются. Это один из главных компонентов слабого иммунного ответа в мозге.
Подробнее об этих процессах можно прочитать в статье «Иммунитет: борьба с чужими и… своими» [5].
У мозга возникают сложности при доставке активированных клеток иммунитета в шейные лимфатические узлы. За работу с антигенами в головном мозге отвечают дендритные клетки. В других органах они распознают антиген, а затем предоставляют информацию о нем T- и B-лимфоцитам в лимфоузлах. При воспалении в мозге такого процесса не происходит: дендритные клетки не мигрируют в лимфоузлы и не представляют антиген. Иммунный ответ становится локальным, и дендритные клетки регулируют его в паренхиме головного мозга. Если в других органах клеточные элементы иммунитета после презентации антигена устремляются в место проникновения бактерий [6], то при развитии воспаления в паренхиме мозга этого не происходит. Мозгу приходится рассчитывать на самого себя. Подобная локальность иммунного ответа наблюдается в паренхиме, но не в хориодиных сплетениях и оболочках мозга.
Иммигранты в мозге
Если продолжить описание особого иммунного статуса мозга в нашем организме, то необходимо сказать несколько слов о микроглии. Микроглия — это основной тип клеток, отвечающих за врожденный иммунный ответ в мозге (рис. 3) [7]. Микроглия обладает фагоцитарной активностью, способна распознавать микроорганизмы и способствует развитию воспалительных реакций в паренхиме мозга, то есть ведет себя не как нейрон, а настоящая иммунная клетка [8]. Это объясняется тем, что микроглия в нашем мозге имеет гемопоэтическое происхождение [9]. Предшественники микроглии во внутриутробном периоде — это «братья» всех остальных иммунных клеток, которые оказались в центральной нервной системе. Они не утратили свои иммунные функции и начали осуществлять их местно. Получается, что клетки микроглии можно назвать эмигрантами иммунной системы.
Аутоиммунные энцефалиты
После разговора об особом иммунном статусе мозга мы перейдем к теме аутоиммунных энцефалитов — группе заболеваний, которые связаны с поражением мембранных и внутриклеточных структур нейронов собственным иммунитетом организма. В современной практике аутоиммунные энцефалиты диагностируются редко. Это объясняется тем, что первые случаи подробно описали только в 2005 году [10]. Можно предположить, что на самом деле случаев этого заболевания больше, чем регистрируется специалистами. Некоторым пациентам с аутоиммунным энцефалитом могут устанавливать диагноз других расстройств, например, шизофрении или инфекционного энцефалита. Это связано с тем, что врачи мало осведомлены об этом заболевании. Врачи диагностируют только те болезни, которые им известны. Чем больше арсенал диагнозов в запасе у врача, тем точнее диагностика и правильнее лечение.
Аутоиммунные энцефалиты можно разделить на две группы:
- заболевания, вызванные активированными T-клетками (нечто похожее происходит при рассеянном склерозе [11]);
- заболевания, которые возникают при воздействии антител на внутри- и внеклеточные компоненты нейрона, например, ионные каналы.
Для первой группы аутоиммунных энцефалитов характерно повреждение клеток антителами и активированными Т-лимфоцитами [12]. Эти энцефалиты носят более тяжелый характер и требуют интенсивных лечебных вмешательств в отличие от представителей второй группы.
Во второй группе энцефалитов поражение нейронов носит только «поверхностный» характер. Воздействие специфических антител на поверхностно расположенные структуры приводит к тому, что происходит «стягивание» рецепторов (по-английски это называется capping — «сшивание») и их последующая интернализация (захват) в цитоплазму (рис. 3) [13]. Кроме этого аутоантитела могут сами соединяться с рецепторами, блокируя их работу [14].

Рисунок 3. Изменения, которые происходят с рецепторами при аутоиммунных энцефалитах, схожи с изменениями в синапсах при миастении. В норме (левая часть рисунка) рецепторы свободны и легко взаимодействуют с нейромедиатором ацетилхолином. В случае болезни на рецепторы начинают воздействовать антитела, и нарушается их способность связываться с нейромедиатором. «Слипшиеся» рецепторы к ацетилхолину постепенно втягиваются в цитоплазму, где разрушаются.
сайт memorangapp.com
Антитела проникают снаружи, из-за пределов ГЭБ, или производятся проникшими в головной мозг и активированными B-лимфоцитами [15]. В тех случаях, когда антитела направлены против внутриклеточных структур, атаку на нейроны возглавляют цитотоксические T-лимфоциты. При помощи перфорина и гранзима B они повреждают мембрану нейронов, что приводит к их гибели [16], [17]. ГЭБ, о котором мы говорили выше, в этом свете представляется надежной крепостной стеной, защищающей тихий город, который отвык воевать. Если в стене возникнет брешь, то город быстро падет: нервные клетки окажутся слишком чувствительны к воздействию иммунных факторов.
В поисках флагов
Признаки аутоиммунных энцефалитов очень разнообразны, но можно выделить три типа симптомов.
- Психиатрические симптомы: психозы, агрессивные действия, сексуальная расторможенность, панические атаки, навязчивые действия, чувство эйфории или страха.
- Двигательные симптомы: повышение тонуса мышц и его неравномерность, мышечные подергивания и повторяющиеся движения конечностей.
- Припадки: генерализованные эпилептические припадки, эпилептический статус.
Начальными проявлениями аутоиммунного энцефалита могут быть симптомы психического расстройства: нарушение памяти, галлюцинации или появление бредовых идей. Например, при аутоиммунном поражении глутаматных NMDA-рецепторов у 80% пациентов были выявлены симптомы психических заболеваний, а больше 60% первоначально были госпитализированы в психиатрические отделения [18], [19]. Врачи-психиатры должны уметь выявлять пациентов с аутоиммунными энцефалитами или хотя бы заподозрить это заболевание, чтобы вовремя отправить пациента на соответствующие обследования и консультации к другим врачам.
Среди многообразия симптомов, которые могут быть вызваны разными причинами, легко потеряться. Врачу требуются хотя бы приблизительные ориентиры, чтобы заподозрить диагноз аутоиммунного энцефалита. В результате анализа множества случаев заболевания выявили признаки, которые с большой вероятностью указывают на этот диагноз — так называемые «красные флаги» аутоиммунного энцефалита [20]. К ним относятся:
- Лимфоцитарный плейоцитоз или появление олигоклональных полос при электрофорезе ЦСЖ.
- Эпилептические припадки.
- Фациобрахиальные дистонические припадки.
- Подозрение на злокачественный нейролептический синдром.
- Отклонения на МРТ.
- Отклонения на ЭЭГ.
Кроме того, исследователи определили и «желтые флаги» — признаки, которые должны насторожить врача и заставить его задуматься о возможном диагнозе аутоиммунного энцефалита [20]. «Желтыми флагами» аутоиммунного энцефалита являются:
- Сниженный уровень сознания.
- Нарушение позы и движений.
- Нестабильность вегетативной нервной системы.
- Очаговая неврологическая симптоматика.
- Нарушения речи (афазия и дизартрия).
- Быстрое, несмотря на лечение, прогрессирование психоза.
- Гипонатриемия.
- Кататония.
- Головные боли.
- Наличие других аутоиммунных заболеваний, в том числе тиреоидитов.
Если врач видит симптомы из группы «красных флагов» у пациента, то авторы исследования рекомендуют проведение анализов на специфические аутоантитела для своевременной диагностики аутоиммунного энцефалита. При наличии у пациента симптомов из списка «желтых флагов» врачу следует заподозрить возможность такого диагноза и более тщательно обследовать пациента для поиска более достоверных признаков аутоиммунного энцефалита.
Дополнительные аргументы
Кроме совокупности ранее описанных симптомов, диагноз аутоиммунного энцефалита должен быть подтвержден лабораторными исследованиями и другими диагностическими процедурами [21]. Например, можно выполнить анализ на антитела к конкретным рецепторам. При аутоиммунном энцефалите, поражающем глутаматные NMDA-рецепторы, можно обнаружить повышение титра антител к ним. Интересно, что при энцефалите увеличивается количество иммуноглобулинов класса G, а при шизофрении — классов А и М [22]. В настоящее время установлено соответствие между антителами, поражающими конкретные структуры нейрона, и симптоматикой энцефалита (табл. 1). При проведении магнитно-резонансной томографии (МРТ) могут быть обнаружены изменения в структуре головного мозга, а электроэнцефалографическое исследование (ЭЭГ) в случае аутоиммунного энцефалита может показать нарушение функционирования головного мозга.
| Структура, к которой вырабатывается антитело | Психиатрические симптомы | Другие симптомы | Типичный пациент |
|---|---|---|---|
| NMDA-рецептор | Психоз, шизофреноподобные расстройства, кататония, агрессия | Эпилептические припадки, дискинезия, вегетативная нестабильность, нарушение речи и сознания | Молодые женщины, частая связь с тератомой яичника |
| Caspr2 | Бессонница, панические атаки, депрессия, шизофреноподобные расстройства | Синдром Морвана, нейромиотония, мышечные спазмы, фасцикуляции | Пациенты среднего и старшего возраста, возможна связь с тимомой |
| LGI1 | Амнезия и другие нарушения памяти, спутанность, депрессия | Лимбический энцефалит, фациобрахиальные дистонические припадки, гипонатриемия | Пациенты среднего и старшего возраста, соотношение мужчин и женщин 2:1, возможна связь с тимомой |
| Глициновый рецептор | Поведенческие изменения, шизофреноподобный синдром | Синдром мышечной скованности, прогрессирующий энцефаломиелит с ригидностью, миоклонус, гиперэкплексия | Пациенты среднего и старшего возраста, возможна связь с тимомой и лимфомой |
| Синаптические антигены (GAD) | Шизофреноподобный синдром, аутизм, синдром дефицита внимания и гиперактивности | Лимбический энцефалит, синдром мышечной скованности, припадки, стволовая дисфункция, атаксия | Пациенты среднего и старшего возраста, возможна связь с мелкоклеточным раком легких |
| Онконевральные антигены (Yo, Hu, CV2, Ri, Ma2) | Поведенческие нарушения | Лимбический энцефалит, мозжечковая дегенерация, сенсорная нейропатия | Пожилые пациенты, часто со злокачественными опухолями |
В некоторых случаях аутоиммунное поражение центральной нервной системы вызвано развитием паранеопластического синдрома, который может сопровождать появление в организме злокачественной опухоли. При паранеопластическом синдроме опухоль может начать самостоятельно вырабатывать гормоны и гормоноподобные вещества, нарушая регуляцию различных процессов в организме. Кроме этого паранеопластический синдром может проявляться в виде аутоиммунного заболевания, например, аутоиммунного энцефалита.
Патогенез аутоиммунного энцефалита в рамках паранеопластического синдрома заключается в следующем. В злокачественной опухоли определенной ткани экспрессируются гены, типичные для нее, а также гены, которые обычно «молчат» в ней. Среди «молчащих» генов могут оказаться и те, которые в норме экспрессируются только в мозге, под защитой ГЭБ. Поэтому получающиеся белки носят название раково-нейрональных антигенов. За время созревания иммунной системы она знакомится почти со всеми белками организма, однако эти белки оказываются скрыты от нее и, соответственно, воспринимаются как чуждые. С точки зрения нашего иммунитета между ними и бактериальными антигенами нет никакой разницы. Опухоль начинает производить раково-нейрональные антигены, а иммунная система распознает их и вырабатывает специфичные к ним аутоантитела. Через минимальные бреши в ГЭБ аутоантитела проникают в центральную нервную систему и начинают атаковать нейроны [14].
По этой причине при диагностике аутоиммунных энцефалитов отдельное внимание уделяется поиску опухоли в организме пациента. Удаление опухоли в случаях паранеопластического генеза аутоиммунного энцефалита приведет к значительному улучшению состояния пациента. Пока же опухоль находится в организме человека, антитела продолжают вырабатываться, а состояние пациента ухудшаться.
Удар по иммунитету
В качестве препаратов первой линии лечения аутоиммунных энцефалитов используют стероиды и иммуноглобулины, вводимые внутривенно. Стероиды обладают мощным противовоспалительным эффектом. Они способны подавить иммунные реакции на самых разных уровнях. Применение стероидов приводит к уменьшению синтеза медиаторов воспаления, стабилизации мембран лизосом, выделяющих воспалительные факторы. Кроме этого под воздействием стероидных гормонов снижается миграция моноцитов. Также может помочь и плазмаферез, очищающий кровь от «лишних» антител.
Если терапия первой линии не работает, то переходят к использованию ритуксимаба и циклофосфамида. Ритуксимаб — это моноклональные антитела к рецептору CD20, который обнаруживается на поверхности B-лимфоцитов [23]. В-лимфоциты производят самые разные антитела, в том числе и аутоантитела против нервных клеток, и их уничтожение может привести к улучшению состояния. Рецептор CD20 появляется на поверхности нормальных B-лимфоцитов и B-лимфоцитов, которые прошли процесс малигнизации (озлокачествления). Благодаря этому свойству ритуксимаб эффективен при аутоиммунных заболеваниях и B-клеточных лимфомах. Лекарство присоединяется к рецептору CD20 на поверхности лимфоцита и дает возможность другим компонентам иммунной системы уничтожить клетку.
Циклофосфамид обладает иммуносупрессивным действием и способен подавить избыточный иммунный ответ организма. После прохождения через печень циклофосфамид превращается в несколько активных метаболитов, которые проникают в клетку и плотно соединяют между собой две нити ДНК. Это препятствует делению опухолевых или других быстро делящихся клеток (например, B- и Т-лимфоцитов). По этой причине циклофосфамид входит в схему лечения некоторых аутоиммунных заболеваний. Тонкость использования стероидов, циклофосфамида и ритуксимаба при аутоиммунных энцефалитах заключается в том, что эти препараты могут осложнить диагностику тех опухолей, которые связаны с появлением аутоантител. При лимфоме назначение этих лекарств способно временно улучшить состояние, но при отмене опухоль снова «возьмется за старое» и будет производить аутоантитела. Хотя лимфома не так часто осложняется аутоиммунным энцефалитом, эту особенность надо учитывать при терапии.
На примере аутоиммунных энцефалитов можно рассмотреть два важнейших тренда в современной медицине. Первый тренд — изучение влияния иммунных процессов на функционирование нервной системы человека и попытки вмешаться в этот процесс при лечении неврологических и психических заболеваний. Сейчас мы близки к пониманию того, что мозг — это не просто электрохимическая лаборатория под черепной коробкой, но и особый иммунный мир со своими правилами. В наших интересах изучить эти правила и начать играть по ним в свою пользу. Второй же тренд — это биологизация психиатрии, поиск конкретных биологических изменений в организме, которые приводят к нарушению психического здоровья. Психиатрия — это часть медицины, большой отрасли, где соединяются теоретические знания и их практическое применение. Без биологической основы медицина перестанет быть научной. Если игнорировать биологические законы и знания внутри одной из медицинских специальностей, то с ней произойдет то же самое. Психиатрия должна становиться биологической, чтобы оставаться научной и выполнять свои медицинские задачи.
Литература
- Хаос в мозге;
- Ian Galea, Ingo Bechmann, V. Hugh Perry. (2007). What is immune privilege (not)?. Trends in Immunology. 28, 12-18;
- R. E. Billingham, T. Boswell. (1953). Studies on the Problem of Corneal Homografts. Proceedings of the Royal Society B: Biological Sciences. 141, 392-406;
- P-B. Andersson, V.H. Perry, S. Gordon†. (1992). The acute inflammatory response to lipopolysaccharide in cns parenchyma differs from that in other body tissues. Neuroscience. 48, 169-186;
- Иммунитет: борьба с чужими и… своими;
- Т-лимфоциты: путешественники и домоседы;
- Иммунологическая Нобелевская премия (2011);
- Serge Rivest. (2009). Regulation of innate immune responses in the brain. Nat Rev Immunol. 9, 429-439;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- Beau M. Ances, Roberta Vitaliani, Robert A. Taylor, David S. Liebeskind, Alfredo Voloschin, et. al.. (2005). Treatment-responsive limbic encephalitis identified by neuropil antibodies: MRI and PET correlates. Brain. 128, 1764-1777;
- Рассеянный склероз: иммунная система против мозга;
- Frank Leypoldt, Klaus-Peter Wandinger, Christian G Bien, Josep Dalmau, Post doctoral Research Fellow, Catalan Institution for Research and Advanced Studies (ICREA), August Pi i Sunyer Biomedical Research Institute (IDIBAPS), Barcelona, Spain; Junior Attending Physician, Department of Neurology, University Medical Centre Hamburg-Eppendorf, Germany, et. al.. (2012). Autoimmune Encephalitis. European Neurological Review. 8, 31;
- E. G. Hughes, X. Peng, A. J. Gleichman, M. Lai, L. Zhou, et. al.. (2010). Cellular and Synaptic Mechanisms of Anti-NMDA Receptor Encephalitis. Journal of Neuroscience. 30, 5866-5875;
- Emilia H. Moscato, Ankit Jain, Xiaoyu Peng, Ethan G. Hughes, Josep Dalmau, Rita J. Balice-Gordon. (2010). Mechanisms underlying autoimmune synaptic encephalitis leading to disorders of memory, behavior and cognition: insights from molecular, cellular and synaptic studies. European Journal of Neuroscience. 32, 298-309;
- E. Martinez-Hernandez, J. Horvath, Y. Shiloh-Malawsky, N. Sangha, M. Martinez-Lage, J. Dalmau. (2011). Analysis of complement and plasma cells in the brain of patients with anti-NMDAR encephalitis. Neurology. 77, 589-593;
- C. G. Bien, A. Vincent, M. H. Barnett, A. J. Becker, I. Blumcke, et. al.. (2012). Immunopathology of autoantibody-associated encephalitides: clues for pathogenesis. Brain. 135, 1622-1638;
- D. T. Blumenthal, K. L. Salzman, K. B. Digre, R. L. Jensen, W. A. Dunson, J. Dalmau. (2006). Early pathologic findings and long-term improvement in anti-Ma2-associated encephalitis. Neurology. 67, 146-149;
- Очень нервное возбуждение;
- Peter Maat, Esther de Graaff, Nico M. van Beveren, Esther Hulsenboom, Robert M. Verdijk, et. al.. (2013). Psychiatric phenomena as initial manifestation of encephalitis by anti‐NMDAR antibodies. Acta Neuropsychiatr.. 1-9;
- Julia Herken, Harald Prüss. (2017). Red Flags: Clinical Signs for Identifying Autoimmune Encephalitis in Psychiatric Patients. Front. Psychiatry. 8;
- Eric Lancaster. (2016). The Diagnosis and Treatment of Autoimmune Encephalitis. J Clin Neurol. 12, 1;
- Eric Lancaster, Frank Leypoldt, Maarten J. Titulaer, Jérôme Honnorat, Patrick J. Waters, et. al.. (2015). Immunoglobulin G antibodies to the N-Methyl-D-aspartate receptor are distinct from immunoglobulin A and immunoglobulin M responses. Ann Neurol.. 77, 183-183;
- Спецагенты по борьбе с аутоиммунным воспалением: место моноклональных антител в современной ревматологии;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Болезнь Паркинсона: что изучать? как изучать?;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Timm Schlegelmilch, Katrin Henke, Francesca Peri. (2011). Microglia in the developing brain: from immunity to behaviour. Current Opinion in Neurobiology. 21, 5-10;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- K. L. Richard, M. Filali, P. Prefontaine, S. Rivest. (2008). Toll-Like Receptor 2 Acts as a Natural Innate Immune Receptor to Clear Amyloid 1-42 and Delay the Cognitive Decline in a Mouse Model of Alzheimer's Disease. Journal of Neuroscience. 28, 5784-5793;
- Sang Kun Lee, Soon-Tae Lee. (2016). The Laboratory Diagnosis of Autoimmune Encephalitis. J Epilepsy Res. 6, 45-50.