
Вирус везикулярного стоматита — угроза сельскому хозяйству, спасение для человечества
17 февраля 2025
Вирус везикулярного стоматита — угроза сельскому хозяйству, спасение для человечества
- 231
- 0
- 2
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Вирусы с самых давних пор приносили множество бед людям, из-за чего ассоциируются со «злом» по всему миру. Однако в последние годы становится ясно, что вирусы могут быть и «добром». В данном обзоре речь пойдет о вирусе везикулярного стоматита, малоизвестном в широких кругах, но хорошо знакомом фермерам с самой худшей стороны — ведь он поражает крупный рогатый скот, лошадей и свиней, что наносит непоправимый вред сельскому хозяйству. Несмотря на все это, данный вирус — отличный пример того, как в умелых руках проблема может стать помощником человека и спасти его не только от других, более «злых» врагов, но и от рака — одной из глобальных проблем современной цивилизации.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Вирус везикулярного стоматита, что ты такое?
Прежде чем перейти к вопросам спасения человечества, обозначим место вируса везикулярного стоматита в огромном мире вирусов.
Международный комитет по таксономии вирусов говорит нам о том, что вирус везикулярного стоматита (VSV) относится к роду Vesiculovirus семейства Rhabdoviridae отряда Mononegavirales. К этому же семейству относится всем известный вирус бешенства, который в основном передается через укусы зараженных животных и, если не получить вовремя вакцину, приводит к летальному исходу из-за поражения нервной системы [1], [2]. Но не стоит пугаться — вирус везикулярного стоматита не является настолько сильным патогеном даже в отношении животных, что уж говорить про человека [3].
Первое упоминание вируса везикулярного стоматита, а точнее, описание болезни, вызванной им, у лошадей было представлено в 1916 году, хотя есть данные о том, что этот патоген был распространен уже в начале XIX века [4], просто тогда никто и не догадывался о его существовании. Уже в 1925 году возбудитель был выделен [5], с чего и началось активное изучение данного вируса, в результате которого мы пришли к тому, что имеем на данный момент.
Что скрывается за маской?
Что же представляет из себя вирус везикулярного стоматита?
Со снимка электронной микроскопии (рис. 1) видно, что данный вирус имеет форму пули и обладает размером около 70 нм в ширину и 200 нм в длину. Спойлер: размер вирусной частицы может меняться при создании рекомбинантного вируса.
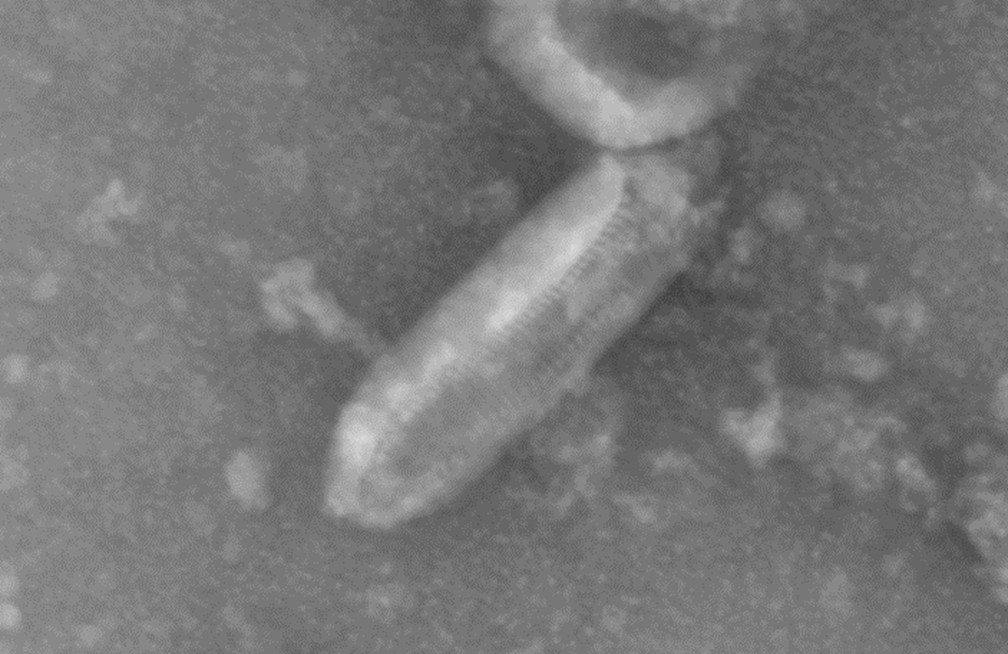
Рисунок 1. Снимок вируса везикулярного стоматита, полученный методом просвечивающей электронной микроскопии.
из магистерской работы автора статьи
Форма пули необычна для мира вирусов, но те, кто знают греческий язык, могли сразу догадаться, как будет выглядеть данный возбудитель, ведь с греческого Rhabdos означает «палочка». А раз в год и палка стреляет.
Как следует из названия его отряда, геном VSV представлен одноцепочечной РНК с отрицательным смыслом длиной около 11 тысяч нуклеотидов [6], что практически равно усредненной длине всех —РНК-вирусов [7]. Основное отличие РНК с негативной полярностью от положительной заключается в том, что с последней вирусные белки могут быть синтезированы сразу без каких-либо превращений. А в случае —РНК для начала необходимо получить ее положительную копию, с которой уже будет осуществляться наработка белков вируса, что делает весь этот процесс более сложным.
Геном, представленный отрицательной одноцепочечной РНК, в каком-то смысле затормозил развитие методов, позволяющих использовать вирус везикулярного стоматита в качестве терапии или профилактики. В то время, как технология обратной генетики (получения вируса, обладающего всеми функциями природного, из его генетического материала) для вирусов с положительной одноцепочечной РНК была разработана еще на рубеже 70-х г. XX века, получение рекомбинантных вирусов с отрицательной РНК-цепью стало возможным только к середине 90-х г. XX века благодаря плотной работе ученых всего мира [8]. Позднее вы поймете, что их стоит очень сильно поблагодарить за труды.
Геном самого вируса везикулярного стоматита кодирует всего пять необходимых для репликации белков: нуклеопротеин (N), фосфопротеин (P), матричный белок (M), гликопротеин (G) и большой белок РНК-зависимой РНК-полимеразы (L) [6]. Каждый из белков обладает определенными функциями (рис. 2), которые позволяют вирусу атаковать клетки организма хозяина и успешно проходить через все стадии вирусного цикла.
Ограничивающие геном лидерная последовательность (Le) и терминальная последовательность (Tr), хоть и являются совсем небольшими относительно длины генома (47 и 54 нуклеотида, соответственно), выполняют такие важные функции, как репликация, транскрипция и упаковка генома в вирусные частицы [9], [10].
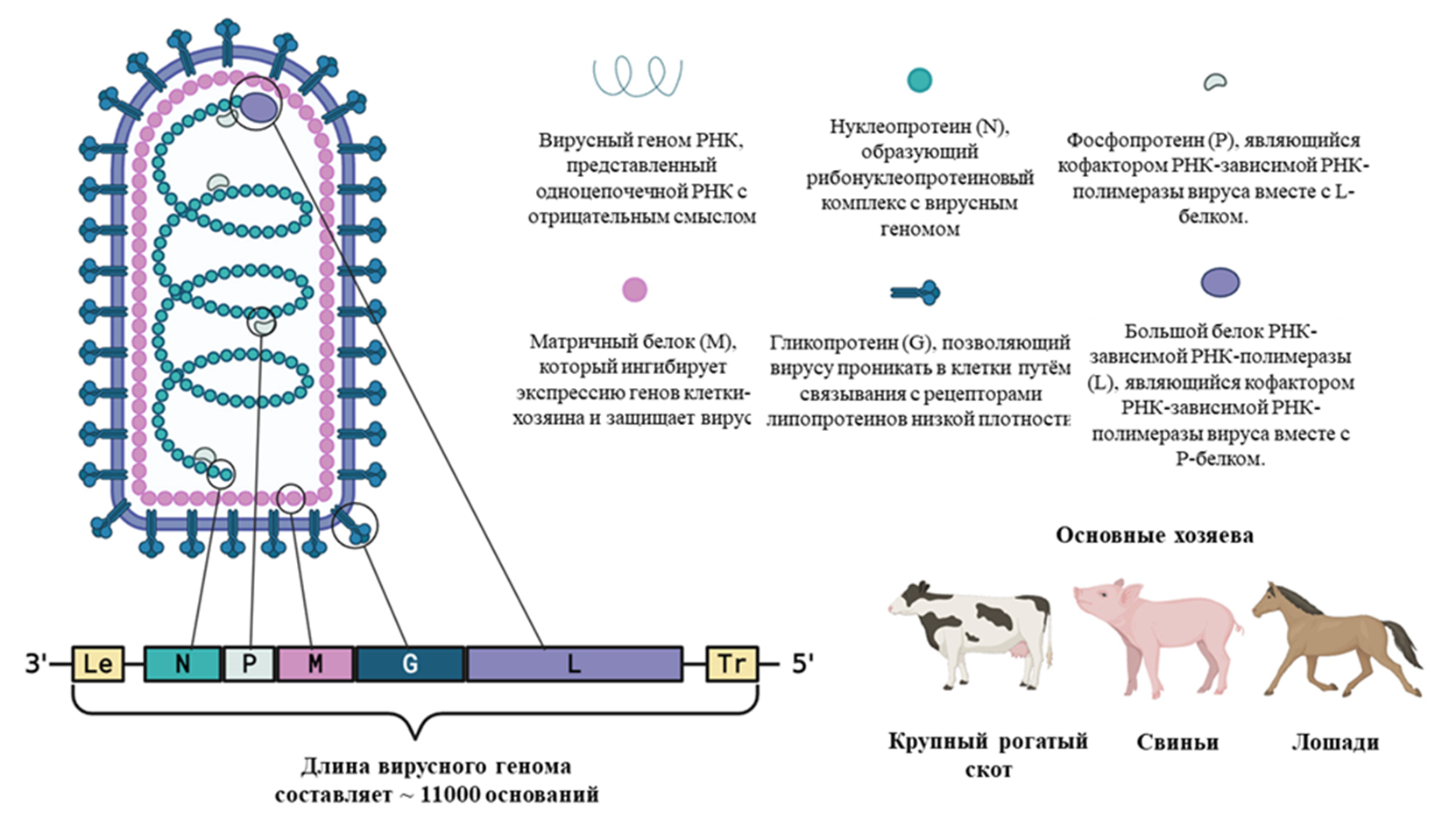
Рисунок 2. Схематическое представление структуры вируса везикулярного стоматита.
Вирус внутри, а что дальше?
Для успешного накопления вируса везикулярного стоматита в организме он должен каким-то образом попасть внутрь клетки и совершить свой вирусный цикл. Еще в 70-е годы XX века вопрос вирусного цикла данного патогена вызывал множество вопросов у ученых [11], но, к счастью, оказалось, что VSV обладает циклом репликации, типичным для всех одноцепочечных РНК-вирусов с отрицательным смыслом. Понимать, как работают вирусы, необходимо, чтобы в случае их мутаций ученые могли успешно с ними бороться. Никто не дает гарантий, что этот или какой-то другой вирус однажды не станет новым COVID-19, поэтому нужно держать ухо востро.
Основные стадии вирусного цикла представлены на рисунке 3 [12]. Вирус проникает в клетку при взаимодействии поверхностного гликопротеина и рецептора путем актин-зависимого клатрин-опосредованного эндоцитоза, после чего начинается синтез мРНК целевых вирусных белков с матрицы геномной РНК. Далее идет процесс трансляции необходимых патогену белков с полученных мРНК, репликации геномной -РНК и сборка вирионов. На данном этапе в дело вступает отрицательная одноцепочечная РНК. Для синтеза вирусного генома с нее прежде необходимо синтезировать полногеномную последовательность РНК с положительным смыслом, а уже потом — сам геном. После выхода из клетки-хозяина в результате почкования полученная вирусная частица готова поражать другие клетки организма и причинять дальнейший вред (но не всегда, и вы убедитесь в этом).
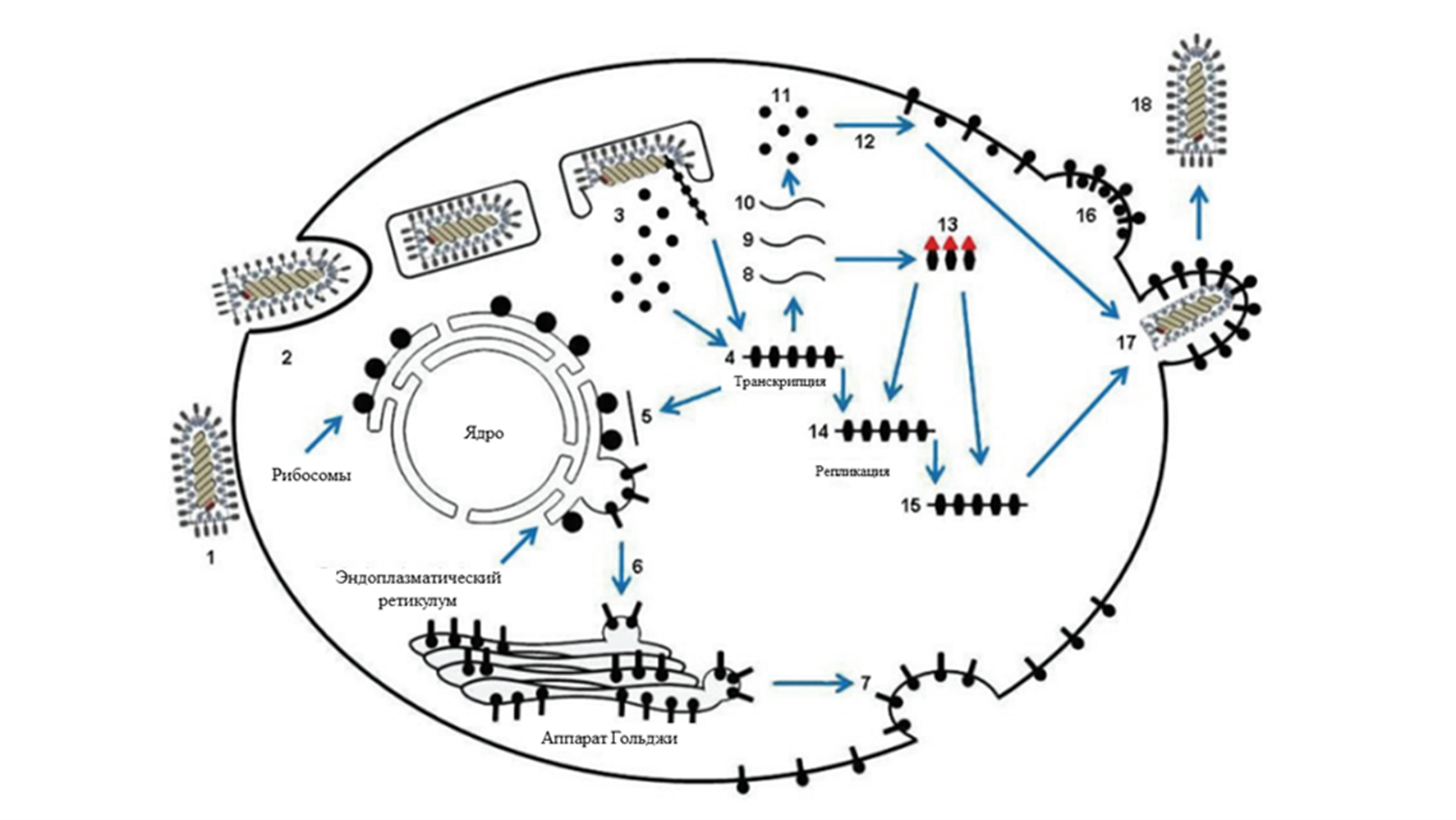
Рисунок 3. Схема жизненного цикла вируса везикулярного стоматита.
1 — прикрепление вируса к поверхности клетки через вирусный гликопротеин и рецептор липопротеинов низкой плотности (есть и другие рецепторы, но это уже совсем другая история);
2 — вход вируса в клетку путем актин-зависимого клатрин-опосредованного эндоцитоза;
3 — слияние с мембраной эндосомы и «раздевание» вируса;
4 — транскрипция мРНК отдельных вирусных белков с матрицы геномной РНК;
5 — образование мРНК гликопротеина;
6 — гликозилирование гликопротеина в аппарате Гольджи;
7 — выход гликозилированного гликопротеина на поверхность цитоплазматической мембраны зараженной клетки;
8 — образование мРНК нуклеопротеина;
9 — образование мРНК фосфопротеина;
10 — образование мРНК матричного белка. Также идет образование мРНК большого белка РНК-зависимой РНК-полимеразы (на схеме не представлено);
11 — трансляция вирусных белков с матрицы полученных мРНК;
12 — укладывание матричного белка с внутренней стороны цитоплазматической мембраны в области закрепленного гликозилированного гликопротеина;
13 — образование комплекса, состоящего из нуклеопротеина и фосфопротеина;
14 — синтез полногеномной последовательности РНК с положительным смыслом;
15 — синтез геномной одноцепочечной РНК с отрицательным смыслом;
16 — формирование почки на поверхности цитоплазматической мембраны;
17 — почкование вирусной частицы с кражей липидной оболочки зараженной клетки;
18 — выход вириона из клетки.
Берегитесь, фермеры, вирус везикулярного стоматита идет к вам!
Как бы ни прискорбно было это сообщать, в первую очередь вирус везикулярного стоматита поражает домашних животных — крупный рогатый скот, свиней и лошадей [3], то есть основных животных, которых массово разводят на фермах. Это приводит к экономическим кризисам внутри сельскохозяйственной отрасли. Так, например, издержки из-за поражения одной коровы вирусом везикулярного стоматита на ранчо в США составляют в среднем около 150 долларов, или около 16 тысяч рублей [13]. Если учесть, что для домашнего скота данный вирус является довольно-таки заразным, то экономический ущерб представляет собой кругленькую сумму.
В настоящий момент ситуация с вирусом везикулярного стоматита начинает меняться не в самую лучшую сторону. Изначально считалось, что заболевание, вызываемое этим патогеном, распространено в отдельных регионах США и иногда задевает Канаду, а его вспышки возникают редко — примерно раз в 10 лет [14]. Однако на данный момент стало ясно, что почти по всей Южной Америке вирус уже заражал животных, причем эволюция серотипов оказалась довольно-таки сильна, а частоту вспышек очень тяжело определить — они не столь редки, как казалось ранее [12].
Контрольным выстрелом стало то, что данный вирус способен поражать не только домашних животных, но и диких, таких как олени, лоси, медведи, белки и мелкие грызуны [15].
Однако среди всего этого негатива отчетливо прослеживается луч света — вирус везикулярного стоматита практически не поражает людей, живущих обычной жизнью, только фермеров, которые работают с зараженными животными. Но даже в случае возникновения сама инфекция в большинстве случаев проходит бессимптомно [16]. Именно этот факт и используют ученые для того, чтобы сделать из врага друга, способного спасти человечество.
Предупрежден — значит вооружен
В этой части статьи хотелось бы подробно описать, каким образом происходит заражение, кто является природным хозяином и как вообще сам вирус циркулирует в природе, однако в случае вируса везикулярного стоматита, несмотря на долгую историю его изучения, всё еще остается много нерешенных вопросов.
Но не стоит отчаиваться. Ученые всего мира выдвигают свои предположения, а изучение видов, обитающих в местах наиболее частого возникновения инфекции, постепенно проясняет настоящую картину. И об этом действительно интересно упомянуть, ведь неизвестно, вдруг вирус везикулярного стоматита по мере глобальных изменений климата когда-нибудь дойдет и до России?
Истинный природный резервуар вируса везикулярного стоматита на данный момент неизвестен, однако известно точно, что переносчиками заболевания являются различные членистоногие: комары, песчаные и черные мухи, мокрецы, кузнечики и некоторые другие [17]. Также известно, что важную роль в поддержании циркуляции вируса играют летучие мыши, олени, обезьяны и мелкие травоядные грызуны, поэтому потенциально они могут являться природными резервуарами.
Распространение вируса может осуществляться двумя путями:
- Механический. В процессе жизнедеятельности зараженного животного вирус попадает в окружающую среду вместе со слюной или выделениями из носа, что позволяет ему поражать других животных напрямую или при взаимодействии с зараженной поверхностью. Например, кузнечики способны заражаться вирусом везикулярного стоматита при поедании травы с пастбищ, где находился зараженный рогатый скот [18].
- Биологический. Среди переносчиков вируса везикулярного стоматита немало гематофагических (кровососущих) насекомых (комары, москиты, песчаные мухи и т.д.). Предполагается, что они могут быть инфицированы при поглощении крови зараженного животного и передавать вирус другому при укусе. Кроме того, для песчаных мух отмечен трансовариальный путь передачи (передача вируса своему потомству при кладке яиц) — в этом пока что состоит их уникальность как переносчиков.
Основная собранная за годы изучения информация о путях передачи кратко представлена на рисунке 4.
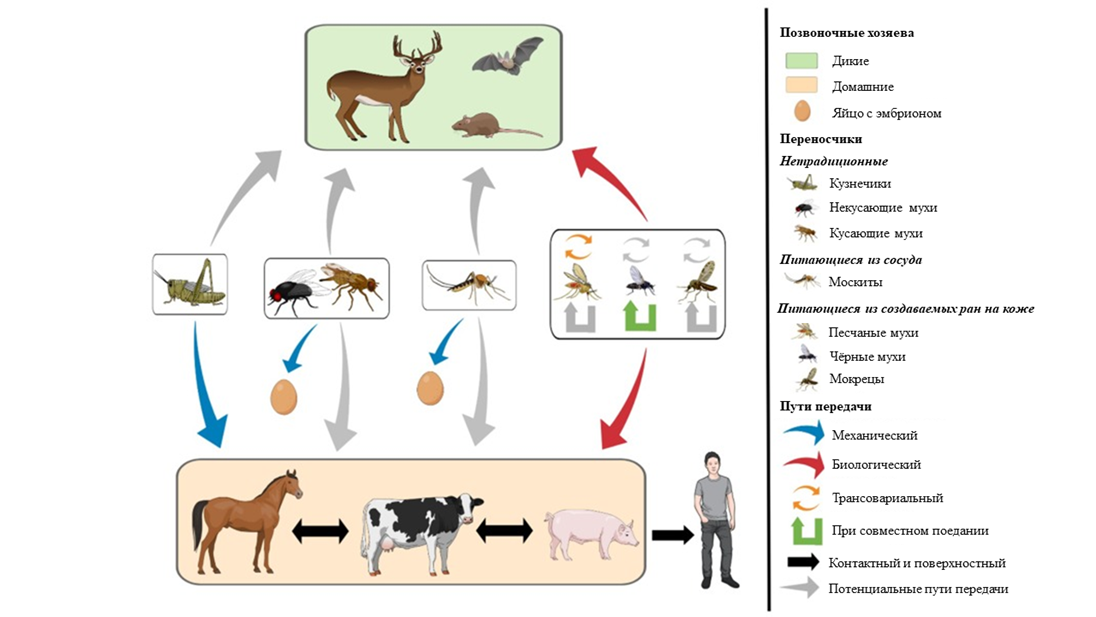
Рисунок 4. Сети передачи вируса везикулярного стоматита.
По течению заболевания
Заражение вирусом везикулярного стоматита очень хорошо заметно внешне из-за возникновения везикул (пузырьков), эрозий и язв на морде и теле пораженных домашних животных. Собственно, из-за этого данный вирус и получил свое название.
Заболеваемость колеблется от 5 до 90%. Такой разброс связан с бессимптомным носительством, которое составляет около 80% стада. Однако здесь стоит добавить немного дегтя — в районах, не свойственных данному заболеванию, симптомы проявляются у 40–60% животных. В целом, инкубационный период составляет 3–7 дней, но по последним данным эти границы могут быть расширены до 1–9 дней.
Для основных хозяев — крупного рогатого скота, свиней и лошадей — характерны схожие, но несколько различные проявления. У коров везикулы в основном появляются на губах, языке, деснах и вымени или сосках, у свиней — на морде, губах, межпальчиковых промежутках, у лошадей — внутри ротовой полости, молочных железах или крайней плоти.
Помимо возникновения везикул, у животных при болезни развивается лихорадка с виремией (это значит, что вирус проникает в кровь). Из-за того, что чаще всего повреждается ротовая полость, животные резко теряют в весе, отказываются от еды и воды, а в случае коров — идет снижение продуктивности выделения молока [4].
Сами везикулы кардинально отличаются по размеру — от размера горошины до поверхности всего языка. Однако пузырьки не сохраняются на протяжении всего заболевания, обычно они быстро разрываются с образованием язв, поэтому не стоит удивляться, если в какой-то момент везикулы пропадут, но животное все еще будет болеть.
Чаще всего заболевание заканчивается через 2–3 недели без каких-либо последствий, но не всем так везет. В части случаев могут возникать вторичные бактериальные инфекции, хромота, а в самом негативном сценарии заболевание может привести к потере конечности.
Смертность от вируса везикулярного стоматита очень мала, однако все фермеры внимательно относятся к вспышкам заражения данным вирусом. Дело в том, что ранние симптомы этого заболевания похожи на ящур, крайне опасный для домашнего скота, хотя и очень редкий благодаря вакцинации [17].
Из-за схожести двух заболеваний появилась крайне эффективная диагностика вируса везикулярного стоматита при помощи серологических методов (например, иммуноферментного анализа [19] или полимеразной цепной реакции — ПЦР [20]), что позволяет дифференцировать разные вирусы и спокойно выдохнуть в случае обнаружения именно вируса везикулярного стоматита.
На данный момент ведутся работы по созданию вакцин от вируса везикулярного стоматита для домашних животных; несколько из них зарегистрированы в Южной Америке и уже показали свою эффективность [21], но всемирно признанной вакцины пока что не существует.
Рыцарь в железных доспехах
Как известно, вакцинация помогла спасти множество людей по всему миру и резко сократить заболеваемость такими опасными инфекциями, как корь [22], полиомиелит [23], гепатит B [24] и др. Среди всего разнообразия существующих вакцинных платформ нашлось место и вирусу везикулярного стоматита. Впервые он был использован в конце 90-х годов в качестве вектора для профилактики гриппа [25], после чего активно применялся в предупреждении и других заболеваний на различных моделях животных [26]. Интересно, что в то время, как вакцины против зоонозной инфекции только разрабатываются, сам вирус везикулярного стоматита уже успел стать основой для другого вакцинного препарата, который может спасать человеческие жизни.
Защита от смерти
Звездный час вируса наступил в 2013 году, когда началась крупнейшая на данный момент вспышка лихорадки Эбола [27]. За три неполных года она распространилась из Гвинеи во многие другие страны западной Африки и некоторые другие страны. В результате данной вспышки заразилось 28 652 человека, а 11 325 из них умерли [28], т.е. летальность составила 39,53%, что является крайне высоким показателем.
До этого момента ученые не обращали должного внимания на эболавирусы, а многие работы по созданию вакцин против них сворачивались за мнимой неактуальностью. Однако в тот самый момент появилось четкое осознание, что против эболавирусов необходимо создать вакцину, чтобы не допустить повторения такой вспышки вновь. Ведь к ней оказались не готовы ни страны, где она произошла, ни всё мировое сообщество.
И такая вакцина была создана на базе вируса везикулярного стоматита компанией Merck [29]. В 2014 году была проведена 1 фаза ее клинических исследований на здоровых добровольцах, в 2016 году в Гвинее были проведены 2 и 3 фазы, эта страна наиболее сильно пострадала от вспышки Эболы. Наконец, в 2019 году препарат под торговым названием ERVEBO® был зарегистрирован в Управлении по контролю качества пищевых продуктов и лекарственных средств (FDA) США. В 2016 году FDA назвала данную вакцину «прорывной терапией», поэтому Всемирная организация здравоохранения (ВОЗ) позволила применять ее во время эпидемий еще до регистрации [30]. Именно это и было осуществлено в 2018–2020 гг. во время вспышки лихорадки Эбола в Демократической Республике Конго, где ERVEBO® показала свою безопасность и эффективность в 97,5% [31].
Замечательные цифры для заболевания, которое уносит жизни около 40% заболевших, не правда ли? Рассмотрим теперь, как эта вакцина была получена и почему вирус везикулярного стоматита крайне хорош в качестве вакцинной платформы.
Итак, в упрощенном виде схема получения ERVEBO® представлена на рисунке 5. Она выглядит довольно просто, и для специалистов в области молекулярной биологии и генной инженерии здесь действительно нет ничего сложного. Для того, чтобы получить такую вакцину, необходимо лишь удалить ген собственного гликопротеина VSV и поместить на его место гликопротеин желаемого вируса (в случае ERVEBO® был вставлен гликопротеин эболавируса Заир — самого опасного из эболавирусов).
Таким образом, на базе вируса везикулярного стоматита может быть получена вакцина практически от любого вируса. Так как технология получения оказалась проста и перспективна, сейчас ею активно пользуются ученые по всему миру, например, для создания новых вакцин против SARS-CoV-2, который вызвал пандемию COVID-19.
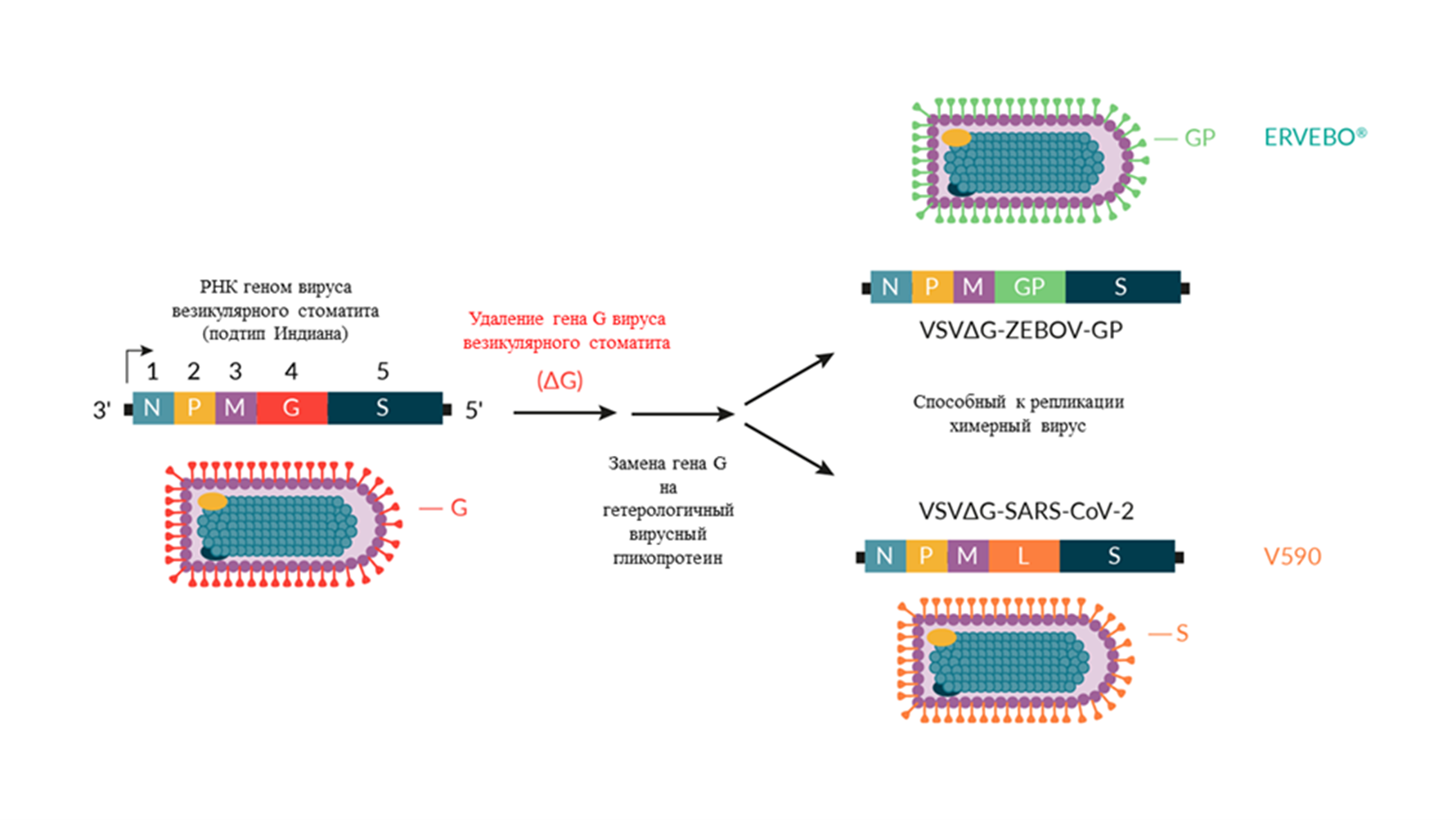
Рисунок 5. Платформа вакцины для разработки ERVEBO® и V590. ERVEBO® — вакцина против эболавируса Заир на базе вируса везикулярного стоматита, V590 — экспериментальная вакцина против SARS-CoV-2 на базе вируса везикулярного стоматита.
На пути к панацее
На волне успеха ERVEBO® вакцинная платформа на базе вируса везикулярного стоматита получила новую жизнь и наконец-то была оценена учеными по достоинству.
На данный момент клинические исследования эффективности вакцины ERVEBO® продолжаются в эндемичных районах и в группах профессионального риска. Также были проведены 1 фазы клинических исследований против вирусов Нипах и против ВИЧ, одной из глобальных мировых угроз .
Вирусу ВИЧ, его терапии и профилактике на «Биомолекуле» посвящено множество статей, например, «ВИЧ. Новая надежда» [32], «Битва века: CRISPR vs ВИЧ» [33], «Своими руками: человек против ВИЧ» [34] и др. — Ред.
Изучают эту платформу и на животных. Например, была доказана 100% эффективность вакцины против Крымской-Конго геморрагической лихорадки при использовании всего лишь однократной инъекции на мышиной модели [35]. Также ведутся исследования по созданию вакцин против вируса Марбург, вызывающего заболевание, подобное лихорадке Эбола, вируса Ласса, различных коронавирусов, а также против вируса Зика, который начал активно проявлять себя в последние годы в Южной Америке и приводит к самым неприятным последствиям для беременных женщин и их детей. Важно, что все перечисленные выше вирусы были включены в план приоритетных исследований и разработок ВОЗ [36]. Это показывает высокий уровень доверия мировых научных команд к вакцинной платформе на базе вируса везикулярного стоматита.
Несмотря на то, что большая часть из созданных вакцин так и не была испытана на людях из-за небольшой распространенности данных заболеваний, важно понимать, что каждое из них обладает высоким уровнем смертности, и наличие данных разработок, которые показали высочайшую эффективность и степень защиты на животных, в будущем превратится в миллионы спасенных жизней. Нет сомнений, что начатые клинические и доклинические исследования будут продолжены, а количество новых разработок на платформе вируса везикулярного стоматита будет только расти. И кто знает, может быть, этот вирус и правда станет панацеей по части борьбы с вирусными инфекциями людей.
Луч надежды в темном царстве, или последняя битва
На универсальности вируса везикулярного стоматита в качестве вакцинной платформы его чудесные способности не заканчиваются — он также имеет доказанную противоопухолевую активность.
Думаю, каждый из вас знает, насколько разрушителен рак и физически для самого пациента, и морально — для окружающих его близких людей. По статистике, по всему миру за 2022 год возникло более 19 миллионов новых случаев рака и около 10 миллионов смертей (!). Самое ужасающее в сложившейся ситуации то, что количество новых случаев, по всем прогнозам, будет только расти, а стандартные схемы терапии, которые включают в себя хирургическое удаление, химиотерапию, гормональную и лучевую терапию, уже не проявляют себя так хорошо, как раньше. К сожалению, рак изменяется так же быстро или даже быстрее, чем противораковая терапия. Несмотря на то, что появились новые схемы лечения, которые включают в себя иммунотерапию [37], клеточную терапию [38] и трансплантацию стволовых клеток [39], этого недостаточно, чтобы остановить развитие заболевания.
Однако надежда еще не потеряна! В ходе исследований было выяснено, что вирусы способны уничтожать раковые клетки, в результате чего появилась целая группа онколитических вирусов [39], способных заражать преимущественно раковые клетки, реплицироваться в них и уничтожать их, при этом не повреждая здоровые клетки организма [40]. Вирус везикулярного стоматита также признан онколитическим вирусом, наравне с вирусами простого герпеса 1 типа, аденовирусами, реовирусами, вирусом болезни Ньюкасла и некоторыми другими [41].
Есть несколько причин, по которым вирус везикулярного стоматита является действительно многообещающим вариантом [42]:
- Сам по себе он вызывает бессимптомную инфекцию у человека, а случаи заражения им в условиях обычной жизни крайне редки (если вы не фермер в США), из-за чего у человека нет антител, ингибирующих действие данного вируса. Это позволяет ему спокойно выполнять свою полезную для больного работу.
- Это РНК-вирус, поэтому его репликация происходит в цитоплазме, что исключает риск вставки вируса в геном и возникновения в нем изменений, что и так слишком характерно для раковых клеток. Кроме того, репликация в цитоплазме обеспечивает более быстрое уничтожение опухолей, так как вирусу не нужно тратить время на то, чтобы попасть в клеточное ядро.
- Он не нуждается в специфических рецепторах на поверхности раковых клеток для проникновения, что позволяет вирусу воздействовать на все виды опухолей (с разной эффективностью, конечно). Тут у вас может возникнуть вопрос: как тогда вирус везикулярного стоматита отличает здоровую клетку от раковой? Секрет — в особенности выработки раковыми клетками интерферонов I типа. Здоровые клетки в ответ на вирусную атаку оказывают сильное противодействие интерферонами, из-за чего человек и переносит заражение бессимптомно. Но опухолевые клетки имеют дефектную передачу сигналов, ответственных за выработку интерферонов, поэтому не могут помешать вирусу заразить себя.
Может звучать излишне красиво, однако всё это правда. При этом, хотя метод терапии рака вирусами изучается уже давно и берет начало в 2000-х гг., на практике его применение пока что ограничено несколькими препаратами. Однако это не повод для расстройства — эффективность именно вируса везикулярного стоматита была отмечена в отношении многих видов рака: на моделях меланомы, гепатоцеллюлярной карциномы, аденокарциномы протоков поджелудочной железы, злокачественного рака простаты, рака толстой кишки, глиобластомы, немелкоклеточного рака легких рака головы и шеи и др. Кроме того, сейчас активно ведутся работы по изменению генома вируса везикулярного стоматита, чтобы усилить противоопухолевый эффект или активировать иммунную систему человека и настроить ее против рака, который для нее незаметен из-за своих механизмов избегания иммунного ответа [10].
Эти работы заключаются, например, в модификации эндогенных белков вируса для стимуляции более эффективной выработки интерферона в чувствительных к вирусу клетках. Гликопротеин вируса заменяют на другие, более селективные и безопасные гликопротеины, или вносят в вирусный геном дополнительные гены (например, иммуностимулирующие гены, гены-супрессоры опухолей, гены опухолеассоциированных антигенов (TAA) и др.) [43].
Предполагаемые для терапии варианты введения вируса везикулярного стоматита, а также механизм воздействия самого вируса на опухолевые клетки отображены на рисунке 6. Как видно из схемы, проникновение вируса везикулярного стоматита хотя бы в одну раковую клетку ведет к постепенному заражению всей опухоли и активации сильного противоопухолевого иммунного клеточного ответа, что позволяет уничтожить рак в самом прямом смысле этого слова.
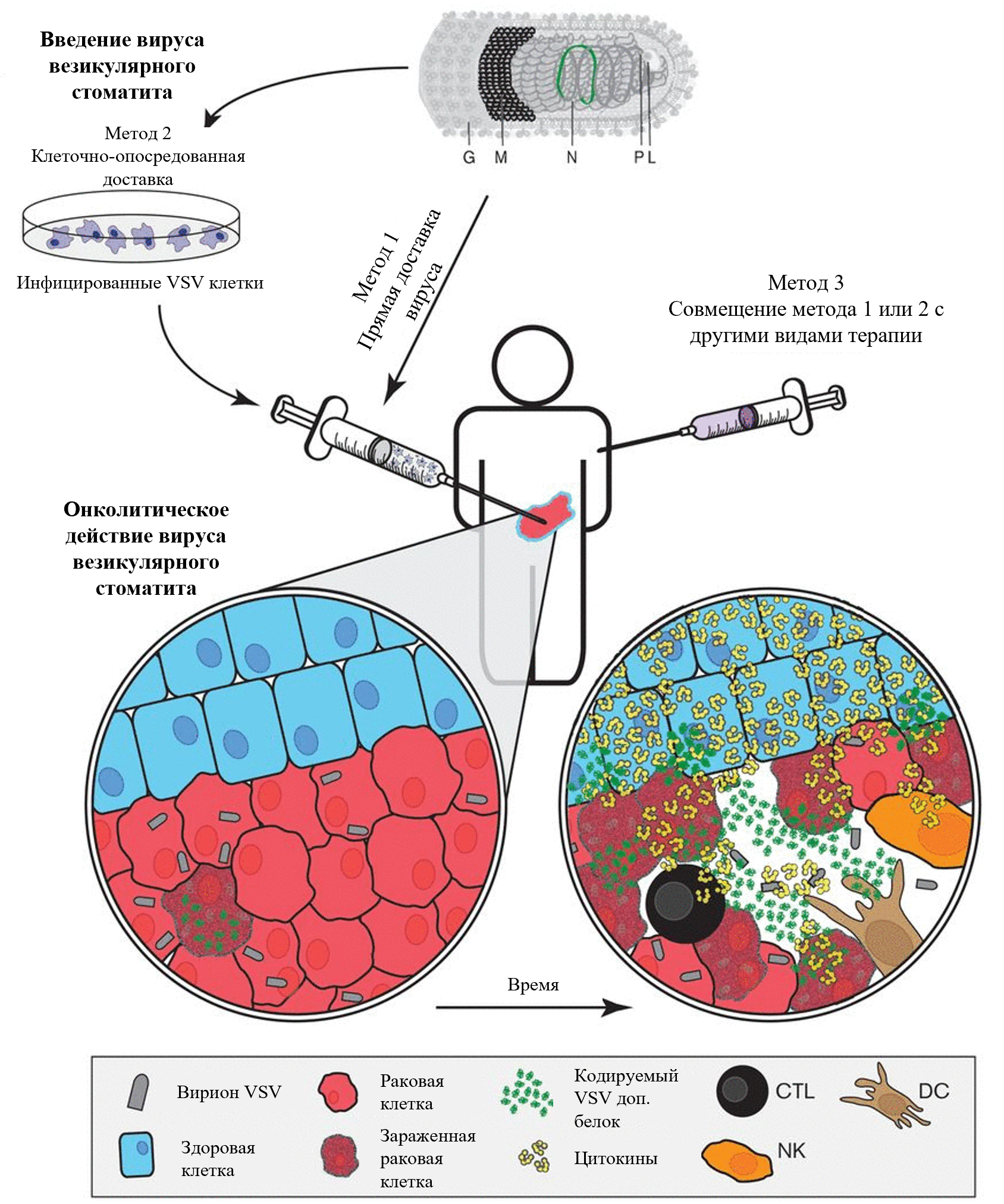
Рисунок 6. Схема терапии рака, основанной на вирусе везикулярного стоматита. VSV — вирус везикулярного стоматита, CTL — цитотоксические лимфоциты, NK — натуральные киллеры, DC — дендритные клетки.
Каково же на данный момент место вируса везикулярного стоматита в лечении рака? Для того, чтобы ответить на этот вопрос, стоит обратиться к ClinicalTrials.gov. На данный момент существует 12 клинических исследований, посвященных использованию этого вируса в качестве противоопухолевой терапии. Все они находятся на 1 или 1/2 фазе; кроме того, только лишь одно исследование завершено, что говорит о новизне описанного подхода. Среди основных видов рака, против которых направлены эти исследования: меланома, рак печени, рак эндометрия, множественная миелома, острые миелоидная лейкемия и лимфома, рак толстой кишки, рак головы и шеи и рак поджелудочной железы. Как видно, спектр заболеваний очень широкий, что вновь показывает, насколько разные раковые клетки может поражать всего один вирус.
Несмотря на то, что сейчас данных, подтверждающих эффективность этого вида терапии, мало, а многие из проводимых клинических исследований не закончены или находятся на стадии планирования, в испытаниях на животных вирус везикулярного стоматита показал себя наилучшим образом, зачастую приводя даже к полной регрессии опухоли. Кроме того, совсем недавно появились новости о том, что именно лечение вирусом везикулярного стоматита позволило ученой, которая работала с ним, спасти ее жизнь в критической ситуации. Поэтому надежда на то, что вирус везикулярного стоматита сможет стать тем самым ключиком к победе над раком, есть. Главное — не опускать руки.
Подведение итогов
В заключении хочется сказать о том, что изучение вируса везикулярного стоматита только набирает обороты, пусть он и был открыт более 100 лет назад. Ученые убедились в его практической значимости и активно исследуют подходы, где этот вирус выступает в качестве профилактического средства в борьбе с инфекциями и как лекарство — в борьбе с раком. Если проекты, посвященные вирусу везикулярного стоматита, будут продолжены, в будущем он вполне может стать бравым солдатом виротерапии.
Литература
- Вакцинация для взрослых. Как и зачем;
- Aswin Khairullah, Shendy Kurniawan, Abdullah Hasib, Otto Silaen, Agus Widodo, et. al.. (2023). Tracking lethal threat: In-depth review of rabies. Open Vet J. 13, 1385;
- Sébastien A. Felt, Valery Z. Grdzelishvili. (2017). Recent advances in vesicular stomatitis virus-based oncolytic virotherapy: a 5-year update. Journal of General Virology. 98, 2895-2911;
- Guodong Liu, Wenguang Cao, Abdjeleel Salawudeen, Wenjun Zhu, Karla Emeterio, et. al.. (2021). Vesicular Stomatitis Virus: From Agricultural Pathogen to Vaccine Vector. Pathogens. 10, 1092;
- Alaa A. Abdelmageed, Maureen C. Ferran. (2020). The Propagation, Quantification, and Storage of Vesicular Stomatitis Virus. CP Microbiology. 58;
- Luis L. Rodriguez, Steven J. Pauszek, Thomas A. Bunch, Kate R. Schumann. (2002). Full-length genome analysis of natural isolates of vesicular stomatitis virus (Indiana 1 serotype) from North, Central and South America. Journal of General Virology. 83, 2475-2483;
- Gita Mahmoudabadi, Rob Phillips. (2018). A comprehensive and quantitative exploration of thousands of viral genomes. eLife. 7;
- Christian K. Pfaller, Roberto Cattaneo, Matthias J. Schnell. (2015). Reverse genetics of Mononegavirales: How they work, new vaccines, and new cancer therapeutics. Virology. 479-480, 331-344;
- John Rose, Manfred Schubert. (1987). Rhabdovirus Genomes and Their Products. The Rhabdoviruses. 129-166;
- Margarita Zinovieva, Anastasia Ryapolova, Alexander Karabelsky, Ekaterina Minskaia. (2024). Oncolytic Vesicular Stomatitis Virus: Optimisation Strategies for Anti-Cancer Therapies. Front. Biosci. (Landmark Ed). 29;
- S. U. Emerson. (1976). Vesicular Stomatitis Virus: Structure and Function of Virion Components. Modern Aspects of Electrochemistry. 1-34;
- Reis J.L., Mead D.G., Rodriguez L.L., Brown C.C. (2009). Transmission and pathogenesis of vesicular stomatitis viruses. Brazilian Journal of Veterinary Pathology. 2, 49–58;
- Goodger W. J., Thurmond M., Nehay J., Mitchell J., Smith P. (1985). Economic impact of an epizootic of bovine vesicular stomatitis in California. Journal of the American Veterinary Medical Association. 186, 370–373;
- Luis L. Rodrı́guez. (2002). Emergence and re-emergence of vesicular stomatitis in the United States. Virus Research. 85, 211-219;
- G.J. LETCHWORTH, L.L. RODRIGUEZ, J. DEL CBARRERA. (1999). Vesicular Stomatitis. The Veterinary Journal. 157, 239-260;
- L. Liu. (2014). Fields Virology, 6th Edition. Clinical Infectious Diseases. 59, 613-613;
- Paula Rozo-Lopez, Barbara Drolet, Berlin Londoño-Renteria. (2018). Vesicular Stomatitis Virus Transmission: A Comparison of Incriminated Vectors. Insects. 9, 190;
- Barbara S. Drolet, Melissa A. Stuart, Justin D. Derner. (2009). Infection ofMelanoplus sanguinipesGrasshoppers following Ingestion of Rangeland Plant Species Harboring Vesicular Stomatitis Virus. Appl Environ Microbiol. 75, 3029-3033;
- 12 методов в картинках: иммунологические технологии;
- 12 методов в картинках: полимеразная цепная реакция;
- J HOUSE. (2003). Protective immunity in cattle vaccinated with a commercial scale, inactivated, bivalent vesicular stomatitis vaccine. Vaccine. 21, 1932-1937;
- Корь: война с детской чумой продолжается;
- Полиомиелит: убийца из XX века;
- Не дружите, дети, с гепатитом B;
- Anjeanette Roberts, Evelyne Kretzschmar, Archibald S. Perkins, John Forman, Ryan Price, et. al.. (1998). Vaccination with a Recombinant Vesicular Stomatitis Virus Expressing an Influenza Virus Hemagglutinin Provides Complete Protection from Influenza Virus Challenge. J Virol. 72, 4704-4711;
- Ian R. Humphreys, Sarah Sebastian. (2018). Novel viral vectors in infectious diseases. Immunology. 153, 1-9;
- Уколы от Эболы;
- Shevin T. Jacob, Ian Crozier, William A. Fischer, Angela Hewlett, Colleen S. Kraft, et. al.. (2020). Ebola virus disease. Nat Rev Dis Primers. 6;
- Amanda N Pinski, Ilhem Messaoudi. (2021). Therapeutic vaccination strategies against EBOV by rVSV-EBOV-GP: the role of innate immunity. Current Opinion in Virology. 51, 179-189;
- Jayanthi Wolf, Risat Jannat, Sheri Dubey, Sean Troth, Matthew T. Onorato, et. al.. (2021). Development of Pandemic Vaccines: ERVEBO Case Study. Vaccines. 9, 190;
- Christopher Ton, Michael A Winters, Raymond Ducoat, Douglas D Richardson, Kristine Fuller, Melissa Hughes. (2023). Development of recombinant vesicular stomatitis virus vaccine platform for rapid response to Ebola and COVID-19 outbreaks. Vaccine Insights. 02, 181-190;
- ВИЧ. Новая надежда;
- Битва века: CRISPR vs ВИЧ;
- Своими руками: человек против ВИЧ;
- Sergio E. Rodriguez, Robert W. Cross, Karla A. Fenton, Dennis A. Bente, Chad E. Mire, Thomas W. Geisbert. (2019). Vesicular Stomatitis Virus-Based Vaccine Protects Mice against Crimean-Congo Hemorrhagic Fever. Sci Rep. 9;
- Anahita Fathi, Christine Dahlke, Marylyn M. Addo. (2019). Recombinant vesicular stomatitis virus vector vaccines for WHO blueprint priority pathogens. Human Vaccines & Immunotherapeutics. 15, 2269-2285;
- Как развивалась иммунотерапия рака?;
- Прокариотический напарник для CAR-T-клеточной терапии;
- Вирусы против рака;
- Danni Lin, Yinan Shen, Tingbo Liang. (2023). Oncolytic virotherapy: basic principles, recent advances and future directions. Sig Transduct Target Ther. 8;
- Meijun Zheng, Jianhan Huang, Aiping Tong, Hui Yang. (2019). Oncolytic Viruses for Cancer Therapy: Barriers and Recent Advances. Molecular Therapy - Oncolytics. 15, 234-247;
- Eric Hastie, Valery Z. Grdzelishvili. (2012). Vesicular stomatitis virus as a flexible platform for oncolytic virotherapy against cancer. Journal of General Virology. 93, 2529-2545;
- Michael Melzer, Arturo Lopez-Martinez, Jennifer Altomonte. (2017). Oncolytic Vesicular Stomatitis Virus as a Viro-Immunotherapy: Defeating Cancer with a “Hammer” and “Anvil”. Biomedicines. 5, 8.







