
Вирусы против рака
13 марта 2021
Вирусы против рака
- 2952
- 0
- 5
Онколитические вирусы — новая стратегия лечения рака
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Вирусы проникают в клетку человека и размножаются внутри нее. В ответ на такое вторжение иммунная система отправляет клеток-солдат убивать зараженных вирусом соотечественников. А вот раковые клетки имеют свойство избегать надзора иммунной системы и бесконтрольно разрастаться внутри человека. Сложив эти два пазла вместе, ученое сообщество пришло к идее, что способность вирусной инфекции вызывать иммунный ответ может сыграть на руку в борьбе с онкологическими заболеваниями. Расскажем об онколитических — растворяющих рак — вирусах, и то, насколько успешна сейчас эта стратегия лечения опухолей.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Во благо, не во вред
Вирусы не пользуются особой любовью у человечества. Помимо коронавируса и гриппа, которые у всех на слуху, некоторые вирусы могут заложить настоящую смертельную бомбу замедленного действия в организме человека [1]. Такие вирусы, способные привести к раку, называют онкогенными. Так, в 2020 году, посреди пандемии COVID-19, комитет Нобелевской премии отметил наградой открытие другого немаловажного вируса — гепатита C [2], [3]. Инфекция гепатитом С может привести к лимфоме. Также вирусы гепатитов B и C отвечают за развитие рака печени в 80% случаев [4]. Другой потенциальный убийца — вирус папилломы человека (ВПЧ) — приводит к развитию рака половых органов, а также органов головы и шеи . В 2018 году ВПЧ унес жизни 311 000 женщин, больных раком шейки матки [5]. К сожалению, не существует никакого лечения ВПЧ. Но есть и хорошие новости — уже несколько десятилетий существуют эффективные и безопасные вакцины против вируса гепатита B и ВПЧ [6]. Вакцина против ВПЧ, по оценкам экспертов, уже после 11 лет наблюдения за участниками исследования снизила на 88% заболеваемость раком шейки матки у девочек, вакцинированных до достижения 17 лет, по сравнению с теми, кто не был вакцинирован [7].
Подробнее об истории открытия вируса папилломы человека — в статье «Увидевший вирусы в раке. Харальд цур Хаузен» [8]. — Ред.
Мы не можем уничтожить все вирусы мира и предотвратить все вирусные инфекции. Но в наших силах приручить некоторые вирусы для работы НА, а не ПРОТИВ человека. Так как иммунная система играет ключевую роль в контроле и подавлении раковых клеток (иммунный надзор), то любое вмешательство в ее работу может усилить или остановить рост опухоли. Если «плохие» онкогенные вирусы помогают возникновению опухоли, то, оказывается, есть и другие «хорошие» вирусы, которые могут помочь иммунитету опухоль подавить. Иными словами, вирусная инфекция может играть роль в усилении противоопухолевого иммунитета. Такая выгодная дополнительная активация иммунитета возможна благодаря общим молекулярным путям иммунного ответа для защиты от инфекций и от рака. Так, заражение вирусом может создать частичный перекрестный неспецифический иммунитет против раковых клеток. Именно с целью уничтожения раковых клеток стали использовать онколитические вирусы (рис. 1) [9].

Рисунок 1. Объяснение определения слова «онколитический». Вопреки тому, что вирусы в широких массах принято считать «злыми», некоторые их них можно использовать во благо: например, для уничтожения (растворения) опухолей.
рисунок автора статьи
Молекулярные изменения, помогающие раковым клеткам избегать иммунного надзора, также ослабляют и их противовирусную защиту, делая опухоли более чувствительными к заражению вирусами. Онколитический вирус избирательно поражает и уничтожает раковые клетки, не нанося вред здоровым (рис. 2). Более того, он использует раковые клетки как заводы для производства еще большего количества вирусных частиц для заражения соседних раковых клеток. Таким образом, заставляя саму раковую клетку производить оружие против себе подобных, онколитический вирус может убить обширную опухолевую массу всего за несколько дней (о более ранних обещаниях успеха онколитической терапии можно прочитать в статье 2007 года «Вирус против рака: кто кого?» [10]). Онколитическими вирусами могут быть как естественные природные вирусы, так и продукты генной инженерии [11], [12].
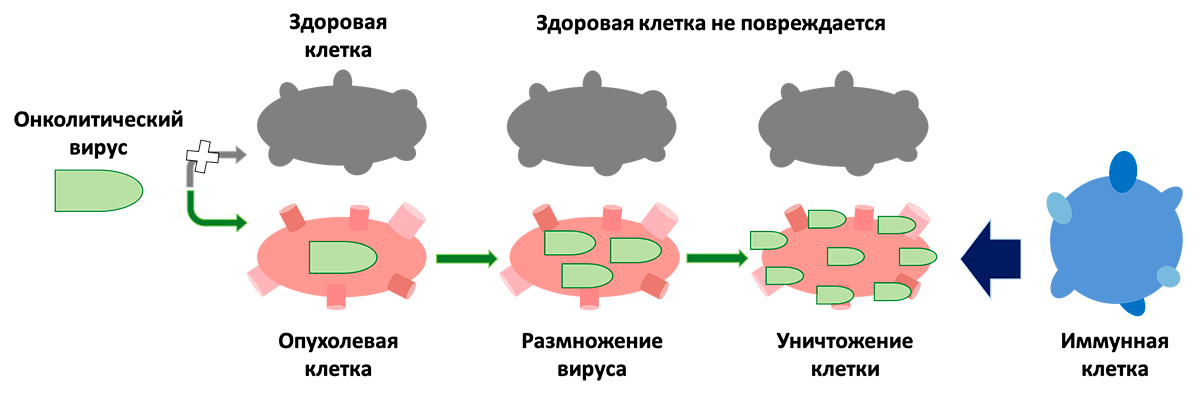
Рисунок 2. Схема действия онколитического вируса. Онколитический вирус инфицирует опухолевую клетку, а затем размножается в ней. В итоге это приводит к уничтожению опухолевой клетки, что привлекает внимание иммунных клеток. При этом онколитический вирус не трогает здоровую клетку.
рисунок автора статьи
Случайное не случайно
Немалое количество научных открытий, изменивших мир, произошло по счастливой неслучайности. Падение яблока около Ньютона подарило миру понятие о гравитации, а открытое окно в лаборатории Флеминга — антибиотики. Так, еще в 1897 году врач в Мичигане отметил, что одна из пациенток с лейкемией вышла в долгую ремиссию после того, как переболела гриппом. А в 1971 году в Уганде ребенок, больной лимфомой, излечился от рака, когда заболел корью. С конца 1990-х ученые уже в лабораторных экспериментах стали наблюдать, что обычные вирусы способны уничтожать раковые клетки. С тех пор начались попытки приручить дикие вирусы и заставить их работать для лечения рака.
Первый онколитический препарат на основе вируса герпеса, талимоген лагерпарепвек (T-VEC), был одобрен уже в 2015 году для неоперабельных пациентов с поздней стадией меланомы. Этот препарат представляет собой генетически модифицированный вирус простого герпеса I типа. Для безопасного использования препарата с помощью генной инженерии из вируса убрали белки, мешающие иммунитету распознавать инфекцию. За 49 месяцев наблюдения 17% пациентов полностью ответили на терапию [13], то есть у них не осталось никакого следа от опухоли. Для клинического испытания в онкологии это впечатляющий результат. Что еще важнее, среди полностью ответивших на терапию был очень высокий процент выживаемости — по расчетам, 88,5% остались живы спустя 5 лет после терапии (рис. 3).
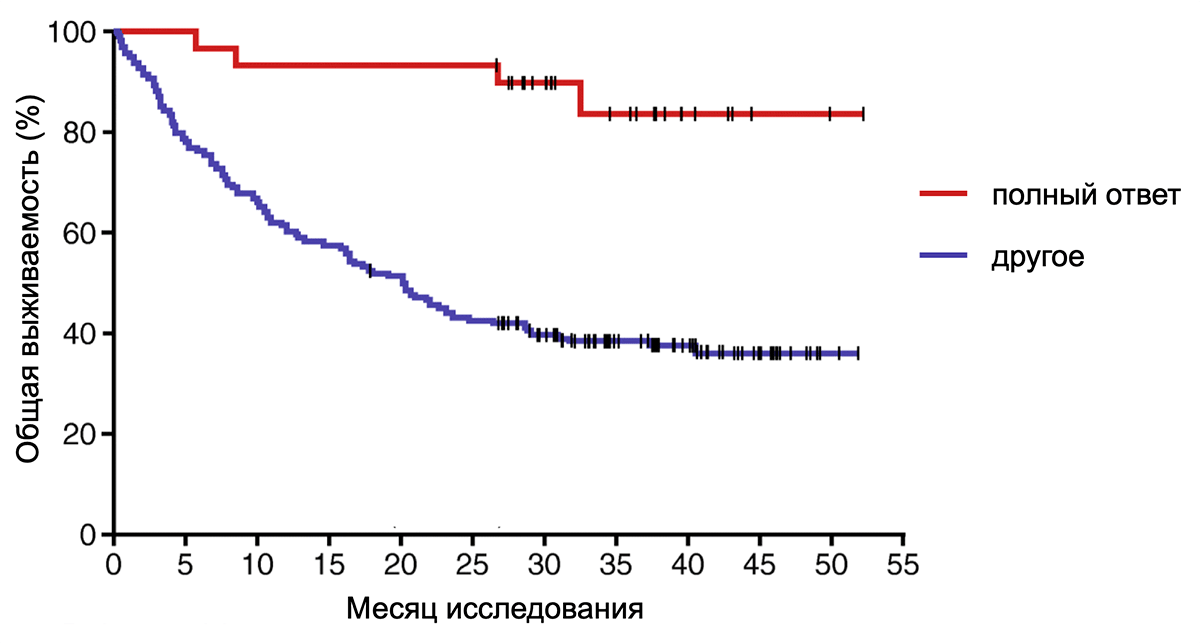
Рисунок 3. График Каплана—Мейера показывает общую выживаемость пациентов с меланомой, которые полностью ответили (красный) или ответили не полностью (синий) на терапию онколитическим вирусом после девяти месяцев от начала исследования. Вертикальная координата показывает процент пациентов, оставшихся в живых. Горизонтальная — месяцы спустя терапии. Из графика ясно видно, что две кривые, красная и синяя, расходятся. При этом красная кривая даже спустя 55 месяцев остается на высоком уровне, что говорит о высокой выживаемость пациентов, которые ответили на терапию онколитическим вирусом.
[13], рисунок адаптирован
Как это работает?
Инъекции онколитических вирусов могут вводиться как системно внутривенно, так и непосредственно внутрь опухоли, если есть такая возможность. На поверхности раковой клетки есть белки-мишени, с помощью которых вирус проникает внутрь. Онколитические вирусы быстро активируют врожденный противовирусный иммунитет человека — тот самый, что действует быстрее адаптивного, но менее разборчиво. То есть иммунитет сначала разбирается с зараженными вирусом раковыми клетками как с рядовой инфекцией «чужого», пока не понимая, что на самом деле имеет дело с опухолью. Активация врожденного противовирусного иммунитета включает в борьбу антигенпрезентирующие клетки (АПК), такие как дендритные. АПК лично знакомятся с зараженной клеткой и на своей поверхности представляют «фотороботы» — частицы пораженных вирусом клеток. Далее АПК спешат в лимфоузлы, где передают эти фотороботы лимфоцитам. Помимо этого, АПК выпускают специальные молекулы цитокины, дополнительно призывающие лимфоциты к атаке. Лимфоциты теперь знают врага «в лицо» и готовы к его уничтожению. Этот этап передачи информации от АПК к лимфоцитам играет ключевую роль в активации адаптивного, более специфичного, противовирусного иммунитета.
Тем временем вирус не сидит без дела. Он размножается внутри опухолевой клетки, а потом «подрывает» ее изнутри, расчищая дорогу к полю боя для еще большего количества солдат иммунной системы. Механически после «подрыва» клеткам иммунитета легче проникнуть в центр опухолевой массы, подчищая ее остатки.
Звучит уже неплохо, но вирусная терапия приятно удивила ученых другим бонусом. Оказывается, из «холодной» опухоли онколитический вирус делает «горячую» — подогревает к ней интерес адаптивного противоопухолевого иммунитета. «Подорванная» опухолевая клетка, как плохой партизан, выдает всех своих сообщников — других раковых клеток, генетически сломанных, как и она. Специальный противоопухолевый отряд иммунологической армии знакомится с «фотороботом» раковой клетки и приступает к уничтожению врага. Эти активированные солдаты иммунной системы видят уже не просто инфекцию вирусом, а точно знают, что имеют дело с раковыми клетками. Это делает их способными атаковать не только пораженные вирусом раковые клетки, но и остальные похожие раковые клетки, к которым вирус не добрался. Таким образом, онколитический вирус активирует сразу два вида иммунного ответа, противовирусный и противоопухолевый, и уничтожает не только зараженные раковые клетки, но и другие молекулярно схожие клетки опухоли.
Безусловно, любая вирусная терапия должна создаваться на основе безопасных для человека вирусов. Отличными кандидатами являются, например, аденовирусы, а также специальный штамм вирус кори, используемый в вакцинах , [14]. В процессе выращивания клеточной культуры ослабленного вируса кори для вакцинации ученым удалось «научить» вирус цепляться за молекулу CD46 (мембранный кофакторный белок, рецептор на поверхности всех клеток, кроме эритроцитов). По сравнению со здоровыми клетками, на поверхности раковых клеток может находиться гораздо больше молекул CD46, что позволяет вирусу гораздо легче проникать в опухоли [15]. Инъекции такого штамма вируса позволили достигнуть долгой ремиссии у пациента с миеломой, которому ранее не помогал никакой другой вид лечения [16].
Подробнее о производстве вакцины против кори можно прочитать в статье «Корь: война с детской чумой продолжается» [17]. — Ред.
Праздновать победу рано
На протяжении прошлого века оценка вирусотерапии напоминала американские горки: от неистового восторга надежды до полного разочарования. Изначально эксперименты с дикими вирусами на людях в 1950-х годах были довольно опасными и почти убили интерес к вирусной терапии. Из-за невозможности тогда контролировать способность вирусов избегать иммунного ответа и размножаться, начальные эксперименты приводили к серьезным нежелательным инфекциям. К счастью, изобретение полимеразной цепной реакции (ПЦР) [18] и открытие генной рекомбинации в 1980-х позволило сделать использование вирусов более безопасным для людей. Генная рекомбинация позволила создавать онколитические вирусы, более избирательно поражающие опухолевые клетки и способные лучше вызывать иммунный ответ.
К сожалению, эффект онколитических вирусов может быть временным из-за роста раковых клеткой, которые вирус изначально не инфицировал. Клинические испытания показывают, что лишь небольшой процент пациентов полностью отвечают на терапию существующими онколитическими вирусами.
Уже ясно, что не все виды опухолей отвечают на онколитическую вирусную терапию. Наибольшего успеха удалось добиться в лечении меланомы и опухолей желудочно-кишечного тракта [9]. Ученым еще предстоит научиться персонализировать вирусную онколитическую терапию — подбирать вирусы для конкретного пациента и его опухоли с индивидуальным набором молекулярных черт.
Будущее онколитической вирусной терапии
Современная противоопухолевая медикаментозная терапия стоит на трех китах: химиотерапия, таргетная и иммунотерапия. Главная цель любой из них — убить раковые клетки, но не трогать здоровые. Каждая разновидность лечения справляется с этой задачей с разной долей успеха. Препараты, которые, в отличие от химиотерапии, избегают угнетения иммунитета и, наоборот, усиливают собственный противоопухолевый иммунитет человека, стали новой надеждой терапии рака. Оказалось, что вирусы способны вызывать такой противоопухолевый ответ. В отличие от таргетной терапии, мишень которой — определенная генетическая мутация, вирусная терапия эффективна против раковых клеток с разным набором генетических изменений. Эти качества однозначно делают онколитическую терапию привлекательной. Более того, доклинические исследования показывают, что лучевая и химиотерапия могут синергично работать вместе с вирусной терапией, улучшая результаты одиночной работы [19], [20].
Пожалуй, самой перспективной комбинацией с точки зрения эффективности станет комбинация онколитических вирусов и ингибиторов контрольных точек иммунного ответа или других новых иммуномодулирующих препаратов. Ингибиторы контрольных точек иммунного ответа — это препараты, которые убирают тормоза иммунного ответа, заставляя их вновь уничтожать врага. Комбинация таких препаратов с вирусной терапией может значительно повысить эффективность иммунного надзора: полицейские будут знать все фотороботы врагов и без всяких тормозов будут отлавливать и уничтожать их.
Подробнее о контрольных точках иммунитета в статье «Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль» [21]. — Ред.
Так, посмотрев на обе стороны медали, можно перестать видеть в вирусах исключительно врагов и разглядеть в них возможного союзника в борьбе против рака.
Литература
- Заразный рак: правило или исключение?;
- Press release: The Nobel Prize in Physiology or Medicine 2020. (2020). Nobel Prize organisation;
- Гепатит C: решенная проблема?;
- Delphine Maucort-Boulch, Catherine de Martel, Silvia Franceschi, Martyn Plummer. (2018). Fraction and incidence of liver cancer attributable to hepatitis B and C viruses worldwide. Int. J. Cancer. 142, 2471-2477;
- Marc Arbyn, Elisabete Weiderpass, Laia Bruni, Silvia de Sanjosé, Mona Saraiya, et. al.. (2020). Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. The Lancet Global Health. 8, e191-e203;
- Обласова А. и Савинова Е. Прививки от рака. «Спид.Центр»;
- Jiayao Lei, Alexander Ploner, K. Miriam Elfström, Jiangrong Wang, Adam Roth, et. al.. (2020). HPV Vaccination and the Risk of Invasive Cervical Cancer. N Engl J Med. 383, 1340-1348;
- Увидевший вирусы в раке. Харальд цур Хаузен;
- Otto Hemminki, João Manuel dos Santos, Akseli Hemminki. (2020). Oncolytic viruses for cancer immunotherapy. J Hematol Oncol. 13;
- Вирус против рака: кто кого?;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Биотехнология. Генная инженерия;
- Robert H. I. Andtbacka, Frances Collichio, Kevin J. Harrington, Mark R. Middleton, Gerald Downey, et. al.. (2019). Final analyses of OPTiM: a randomized phase III trial of talimogene laherparepvec versus granulocyte-macrophage colony-stimulating factor in unresectable stage III–IV melanoma. j. immunotherapy cancer. 7;
- Meijun Zheng, Jianhan Huang, Aiping Tong, Hui Yang. (2019). Oncolytic Viruses for Cancer Therapy: Barriers and Recent Advances. Molecular Therapy - Oncolytics. 15, 234-247;
- Hooi Tin Ong, Michael M. Timm, Philip R. Greipp, Thomas E. Witzig, Angela Dispenzieri, et. al.. (2006). Oncolytic measles virus targets high CD46 expression on multiple myeloma cells. Experimental Hematology. 34, 713-720;
- A Dispenzieri, C Tong, B LaPlant, M Q Lacy, K Laumann, et. al.. (2017). Phase I trial of systemic administration of Edmonston strain of measles virus genetically engineered to express the sodium iodide symporter in patients with recurrent or refractory multiple myeloma. Leukemia. 31, 2791-2798;
- Корь: война с детской чумой продолжается;
- 12 методов в картинках: полимеразная цепная реакция;
- Sean M. O’Cathail, Tzveta D. Pokrovska, Timothy S. Maughan, Kerry D. Fisher, Leonard W. Seymour, Maria A. Hawkins. (2017). Combining Oncolytic Adenovirus with Radiation—A Paradigm for the Future of Radiosensitization. Front. Oncol.. 7;
- Lukasz Kuryk, Elina Haavisto, Mariangela Garofalo, Cristian Capasso, Mari Hirvinen, et. al.. (2016). Synergistic anti-tumor efficacy of immunogenic adenovirus ONCOS-102 (Ad5/3-D24-GM-CSF) and standard of care chemotherapy in preclinical mesothelioma model. Int. J. Cancer. 139, 1883-1893;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль.







