Вирус, дарующий зрение
29 марта 2021
Вирус, дарующий зрение
- 1254
- 2
- 0
Viruses, pathogens and germs, oh my!, рисунок с изменениями
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Слепота — не всегда приговор, ведь вирусы могут помочь восстановить утраченное зрение. Но какие это вирусы, как их применять? О том, что такое вирусные векторы и как именно они участвуют в восстановлении зрения, вы узнаете в этой статье.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Люди всегда боялись различных вирусов, а с появлением нового SARS-CoV-2 этот страх только усилился. Однако не все вирусы оказывают отрицательное воздействие на организм человека, а учитывая свойства и особенности некоторых из них, можно даже вылечить заболевания. В этой статье речь пойдет про аденоассоциированные вирусы и их применение в офтальмологии.
Знакомство с аденоассоциированными вирусами
Геном вирусов
Аденоассоциированные вирусы (AAV) — это небольшие, безоболочечные вирусы, принадлежащие к роду Dependovirus семейства Parvoviridae. Первый аденоассоциированный вирус был открыт в 1965 году как загрязнитель препаратов аденовируса (Ad) [1]. Вирусные частицы выявили случайно во время микроскопии лабораторных препаратов аденовируса, исходно полученных от обезьян (макак резус) с целью производства вакцины.
Первоначально считалось, что это клеточный мусор, однако впоследствии было доказано, что AAV является отдельным вирусом, который по многим структурным, иммунологическим и генетическим показателям отличается от аденовируса.
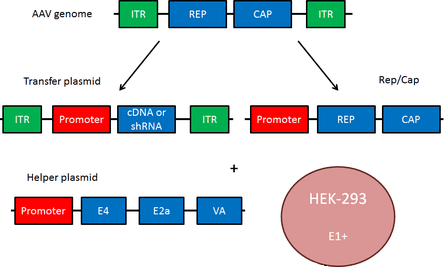
Рисунок 1. Плазмидная система на основе AAV
Геном аденоассоциированного вируса (рис. 1, вверху) представлен линейной одноцепочечной ДНК с двумя инвертированными концевыми повторами (ITR), которые в основном необходимы для репликации и служат сигналом упаковки. AA-вирусы имеют три гена. Первый ген rep с помощью двух промоторов и альтернативного сплайсинга кодирует четыре регуляторных белка, которые получили названия Rep78, Rep68, Rep52 и Rep40 [1]. Цифры соответствуют их молекулярной массе в кДа. Эти белки участвуют в репликации генома AAV. Также было доказано, что эти четыре Rep-белка обладают хеликазной активностью и способностью связывать АТФ.
Ген cap посредством альтернативного сплайсинга и инициации трансляции дает три капсидных белка: VP1 (белок вириона 1), VP2 и VP3 с молекулярной массой 87, 72 и 62 кДа соответственно. Эти капсидные белки образуют белковую оболочку вируса из 60 субъединиц в соотношении 1:1:10 (VP1:VP2:VP3). VР3 также активирует сборку новых вирионов [1].
На сегодняшний день выявлено 11 серотипов аденоассоциированных вирусов, из которых наиболее хорошо изучен серотип AAV2. Он обладает высоким уровнем тропизма по отношению к клеткам скелетных мышц, нейронам, гладкомышечным клеткам сосудов и гепатоцитам. До 1990-х годов геном AA-вирусов изучали на примере AAV2. Структура генома данного серотипа представлена на рисунке 2.
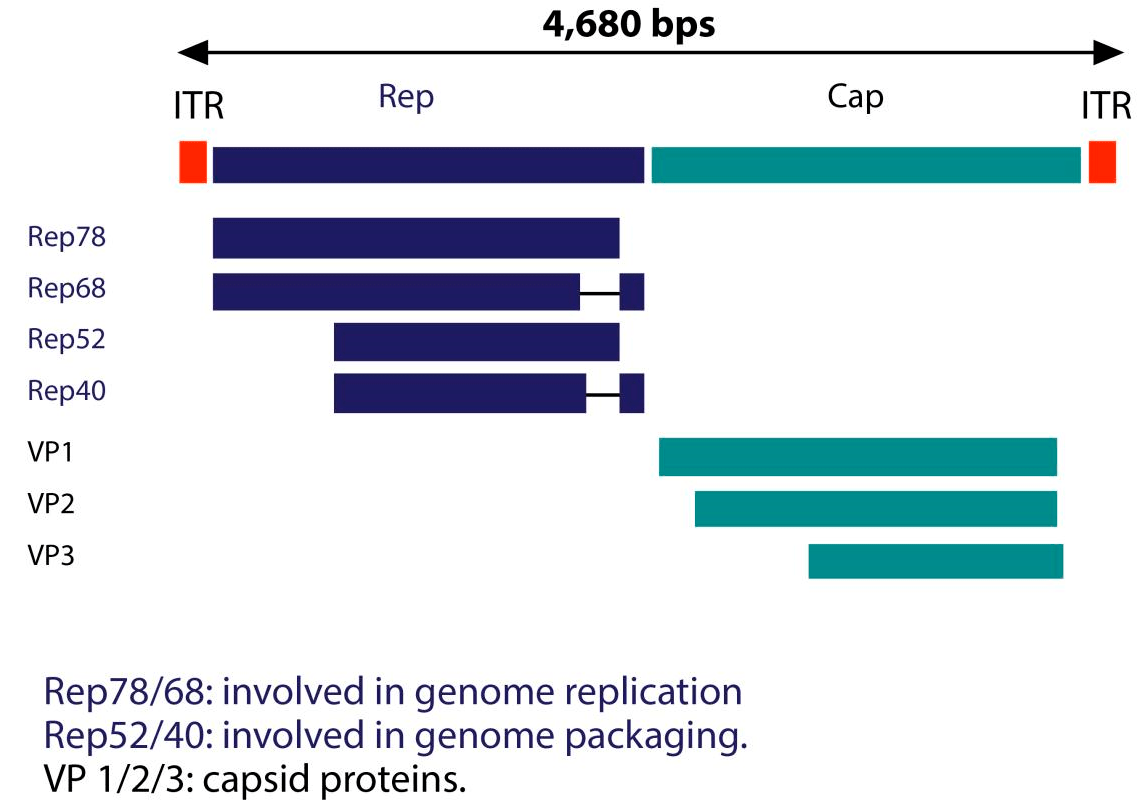
Рисунок 2. Структура генома AAV2
Жизненный цикл вируса
AAV связываются с клеткой хозяина за счет использования гепарансульфатных протеогликанов в качестве сайтов для стыковки. Благодаря тому, что аденоассоциированные вирусы используют достаточно распространенный фактор передачи инфекции, они имеют широкий круг хозяев и могут инфицировать клетки самых разных типов. Вирус проникает внутрь клетки через плазматическую мембрану посредством эндоцитоза, после чего попадает в цитозоль и захватывается эндосомой. Механизм транспортировки AAV в ядро до сих пор полностью не изучен. Однако недавно благодаря визуализации молекул AVV флуоресцентными метками удалось отследить траекторию движения вирусных вирионов в клетке. Выяснили, что в активном внутриклеточном транспорте вирусов участвуют микротрубочки и моторные белки.
После проникновения через ядерные поры в ядро клетки-хозяина, данный вирус может следовать по одному из двух путей своего цикла: литическому или лизогенному. Первый развивается в клетках, инфицированных вспомогательным вирусом, например, таким как аденовирус или вирус простого герпеса (ВПГ), тогда как второй — при их отсутствии. Если инфицированная клетка содержит в себе вспомогательные вирусы, активизируется программа экспрессии генов AAV, что дает возможность вирусам реплицироваться с использованием полимеразы клетки-хозяина.
В процессе жизненного цикла по лизогенному пути AA-вирус интегрируется в геном хозяина в конкретном месте — сайте AAVS1 на 19 хромосоме человека. Это сайт-специфическая интеграция, которая происходит с участием ITR AAV и белков Rep (Rep78, Rep68). Сборка капсида происходит в ядре инфицированных клеток. Процессы образования капсида генома пока малоизвестны. Однако установлено, что их образование происходит в результате взаимодействия белка, активирующего сборку (VP3), и капсидных белков. После сборки капсидов в нуклеоплазме происходит упаковка сформированной ДНК.
Когда вирус-помощник вызывает лизис клетки-хозяина, высвобождаются новые собранные вирионы AAV.
Жизненый цикл и трансдукция AA-вирусов на примере рекомбинантного AAV (rAAV), который используется в качестве вектора в генной терапии, представлен на рисунке 3.
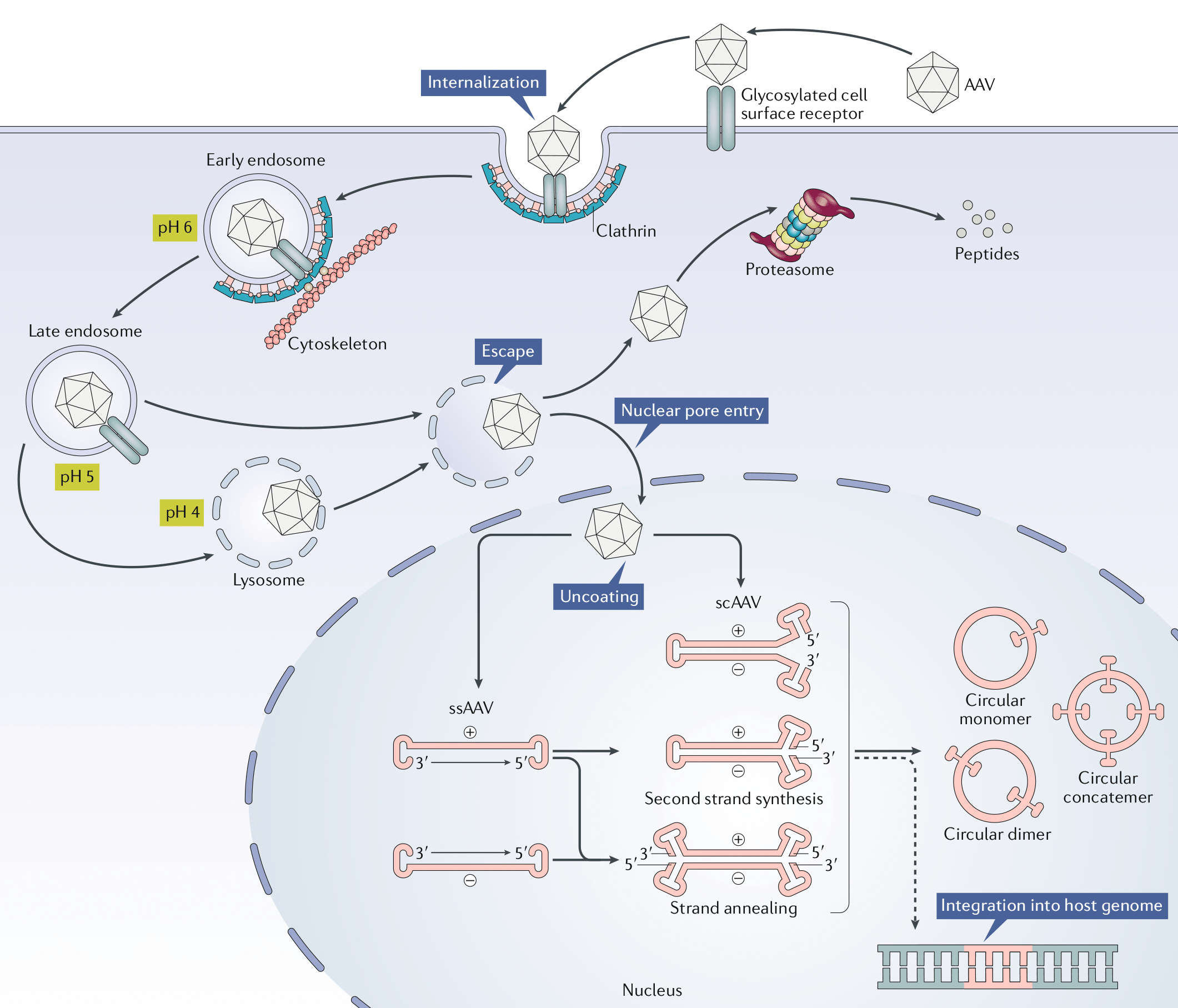
Рисунок 3. Трансдукция AAV на примере рекомбинантного AAV (rAVV)
Процесс осуществления зрения
Зрительный аппарат состоит из глазного яблока и вспомогательного аппарата, который включает в себя веки, ресницы, слезные железы и мышцы глазного яблока.
Важные зрительные процессы, а именно преобразование фотонов в энергию (которая затем используется в качестве импульса зрительного сигнала) и построение изображения, происходят в сетчатке глаза.
Сетчатка состоит из фоторецепторов и нервных клеток. Нервные клетки представлены биполярными нейронами и ганглиозными клетками, которые образуют зрительный нерв (рис. 4).
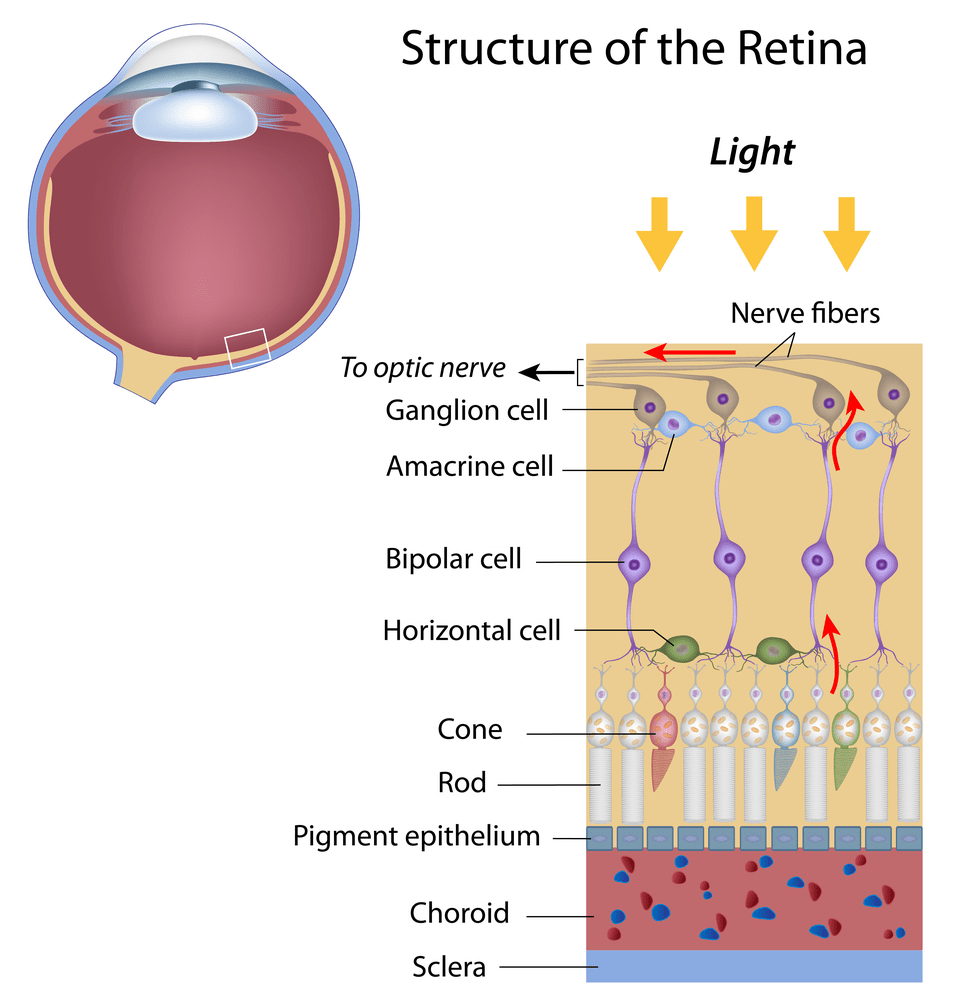
Рисунок 4. Строение сетчатки
Фоторецепторы представлены палочками и колбочками. Палочки обладают высокой светочувствительностью и позволяют видеть при плохом освещении. Эти клетки содержат вещество родопсин, благодаря которому они быстро возбуждаются слабым светом, но при этом воспринимать цвет не могут. Подробнее про молекулярную основу зрения и действие родопсина написано в статье «Зрительный родопсин — рецептор, реагирующий на свет» [2].
Механизм работы родопсина
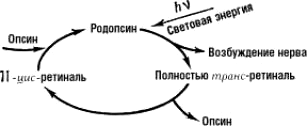
При поглощении света происходит процесс фотолиза родопсина, в ходе которого 11-цис-ретиналь полностью изомеризуется в транс-форму, что меняет ионный транспорт в фоторецепторе. Цикл преобразования родопсина представлен на рисунке 5.
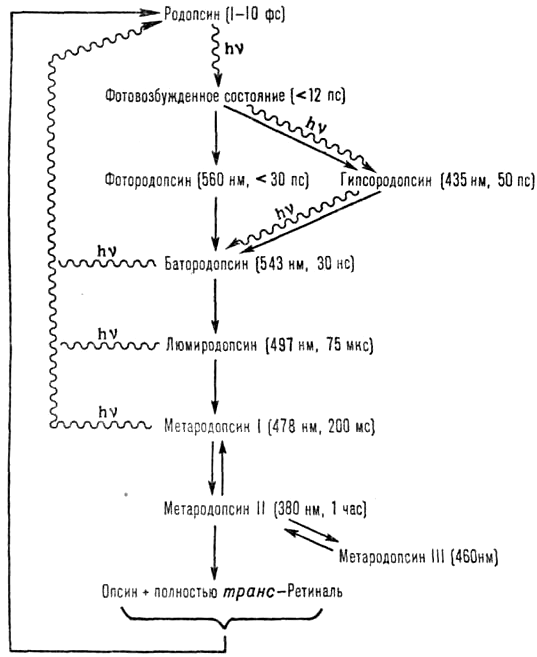
Рисунок 5. Цикл преобразования родопсина
«Родопсин»
Под действием света меняется конфигурация белковой части родопсина и происходит активация G-белка трансдуцина, который активирует фермент цГМФ-фосфодиэстеразу. В результате активации этого фермента в клетке снижается концентрация цГМФ и закрываются цГМФ-зависимые натриевые каналы. Так как ионы натрия постоянно вытесняются из клетки АТФазой, их концентрация внутри клетки падает, что, в свою очередь, приводит к ее гиперполяризации. В результате фоторецептор выделяет меньше тормозного медиатора глутамата, а в биполярной нервной клетке возникают нервные импульсы (рис. 6).
Колбочки обеспечивают нам цветное зрение. Причем есть три вида колбочек, которые отвечают за красный, синий и зеленый цвета. При их взаимодействии глаз воспринимает всевозможные цвета. Зрительный пигмент колбочек — иодопсин — также содержит остаток ретиналя. Однако его белковый компонент отличается от опсина палочек. Процесс превращения иодопсина схож с превращениями родопсина. Электрические сигналы, которые производят колбочки и палочки, прежде чем они попадут в мозг по зрительному нерву, обрабатываются сначала другими клетками сетчатки — биполярными и ганглиозными клетками. Существуют еще два дополнительных слоя промежуточных нейронов. Горизонтальные клетки передают сигналы туда и обратно между клетками фоторецепторов, биполярным клеткам и друг другу. Амакриновые клетки (клетки сетчатки) взаимодействуют с биполярными клетками, ганглиозными клетками, а также друг с другом. Оба вида таких промежуточных нейронов играют главную роль в обработке визуальной информации на уровне сетчатки перед тем, как она передается в мозг для конечной обработки.
Большие шаги науки
В этой части статьи я хочу поведать про достижения генной инженерии в области офтальмологии.
Согласно статистике, которую приводит Всемирная организация здравоохранения, около 1,3 млрд человек в мире живут с той или иной формой нарушения зрения, тогда как 36 млн человек поражены слепотой [3]. Одной из причин слепоты является дегенерация сетчатки в силу возраста или в результате каких-то врожденных мутаций. Эти нарушения часто приводят к гибели светочувствительных клеток (палочек и колбочек), при этом другие клетки (ганглионарные и биполярные), которые принимают и передают сигналы от светочувствительных клеток, повреждаются редко. Такая вот интересная особенность. Ученые с помощью генной инженерии пытаются придать оставшимся клеткам дополнительно функции светочувствительных клеток, чтобы компенсировать потерю последних. Вирусные векторы активно используют также и для лечения других заболеваний, таких как гемофилия, анемия, спинальная мышечная атрофия и рак: об этом можно подробнее почитать на «Биомолекуле» в статьях «Генная терапия против рака» [4] и «Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии» [5].
Слепые тоже смогут видеть
Наука не стоит на месте. Разрабатываются разные способы, с помощью которых пусть даже частично, но можно вернуть утраченное зрение людям. Пока единственным доступным вариантом является установка зрительных имплантов. Но, возможно, скоро появится еще один способ благодаря генной терапии. Среди всех вирусных векторов, которые рассматриваются для применения в офтальмологии, векторы на основе AAV являются наиболее эффективными и стабильными для переноса генов. Кроме того, AAV не обладают патогенностью и имеют низкую иммуногенность. Однако есть у них и свои недостатки: например, AA-вирус имеет небольшую вместимость, а это значит, что он не может переносить крупные гены .
Подробнее об особенностях препаратов для генной терапии на основе вирусных векторов можно прочитать в статье «Генная терапия: познакомьтесь с лекарствами будущего» [6].
Последние исследования и клинические испытания подтверждают терапевтическую эффективность вирусных векторов в лечении дегенеративных процессов в сетчатке у людей. Например, недавно Европейская медицинская ассоциация одобрила препарат Luxturna на основе AAV2-вектора [7], который предназначен для лечения редкой формы аутосомно-рецессивной слепоты, вызванной мутациями в гене RPE65.
Как разрабатываются новые генные терапии в офтальмологии
Изменения в RPE65 — далеко не единственно возможная причина проблем с сетчаткой. К прогрессирующей потере зрения может приводить и нарушение синтеза опсина, вызванное мутацией в гене PDE. Чтобы найти решение этой проблемы ученые недавно провели эксперимент на мышах, в ходе которого инактивированный AA-вирус использовали в качестве вектора для доставки гена опсина в ДНК светочувствительных клеток, содержащихся в колбочках.
Подробнее о том, как можно встроить в вирусный вектор нужный ген, описано в статье спецпроекта «12 методов в картинках»: «Генная инженерия. Часть II: инструменты и техники» [8].
Тут важно отметить, что все новые методы терапии отрабатывают на разных лабораторных животных, а затем успешный препарат может выйти в клинические испытания на людях. Так что работа ученых весьма многообещающая!
Что же делали в этом исследовании? Эксперимент проводили с мышами, у которых была мутация в гене PDE6β [9]. Из-за мутаций гена нарушается синтез опсина средней длины волны (MW-опсин), в результате чего фоторецепторные клетки теряют свою зрительную способность. Ген MW-опсина с флуоресцентной (YFP) C-концевой меткой для отслеживания экспрессии был упакован в AAV2 и введен интравитреально (в стекловидное тело глаза) на 45–60 сутки после рождения мышей. Модифицированный вирус избирательно связывается с ганглионарными клетками сетчатки, за счет своего тропизма к нейронам. Закрепившись на поверхности, он вносит внутрь клетки ДНК, кодирующую ген опсина. В результате ганглионарные клетки получают способность синтезировать чувствительный белок, начинают регистрировать свет и снова передавать зрительные сигналы дальше по цепочке.
Для оценки результатов подопытных мышей через 8 часов после введения AAV поместили в коробку, где находились два объекта. Мышь оставляли у стены, достаточно далеко от объектов, которые также находились на некотором удалении друг от друга. Движения мышей отслеживали в течение 10 минут при выходе на арену. На рисунке 7 вы можете видеть, как изменилось поведение мышей в незнакомой клетке после введения гена.

Рисунок 7. Перемещение мыши в незнакомой клетке. а — Мышь слепая от рождения. б — Мышь с восстановленным зрением. в — Клинически здоровая мышь.
Животные, которым ввели ген опсина, двигались в 1,6 раз дальше и в 1,59 раза быстрее, чем слепые мыши.
Для дальнейшего анализа проводили оценку исследовательского поведения животных в новой клетке. Инъецированные мыши и мыши, синтезирующие родопсин, действовали аналогично. Однако мыши с MW-опсином проходили более короткие пути и достигали первого и второго объекта быстрее по сравнению с мышами, не получавшими лечения. Эти результаты предполагают, что MW-опсин восстанавливает фоторецепторные клетки и обеспечивает ранее слепым животным различение объектов при естественном освещении.
На мышах уже тестировали модели лечения и других глазных заболеваний, таких как врожденный амавроз Лебера и дегенерация желтого пятна [10]. Интересно и другое исследование, где изучали мутации в гене ABCA4 [10], которые вызывают болезнь Штаргардта — форму аутосомно-рецессивной ювенильной дегенерации желтого пятна. Субретинальная инъекция вектора AAV2/5, несущего ABCA4, привела у мышей к снижению содержания липофусцина и улучшению морфологии и функции сетчатки на срок до пяти месяцев.
Благодаря позитивным результатам лечения на мышиных моделях, уже начаты клинические испытания на людях. Пациентам с тем или иным недугом субретинальным путем вводят вирусные векторы для проверки переносимости и безопасности. Побочных эффектов со стороны иммунной системы пока не наблюдалось [11], и у трех из семи пациентов отмечалось повышение остроты зрения в течение 12-месячного испытательного периода.
Заключение
Благодаря этим опытам мы видим, что применение AAV-векторов хорошо зарекомендовало себя в решении целого ряда нарушений зрительных функций. Они позволяют точно доставлять гены в клетки-мишени, не вызывая побочных действий у пациента в большинстве случаев. Вирусные векторы — это одно из перспективных направлений генной инженерии. Конечно, необходимо провести еще ряд клинических исследований, чтобы окончательно удостовериться в безопасности и эффективности векторной терапии. Но, возможно, уже в скором времени для лечения слепоты разной этиологии мы будем использовать вирусы.
Литература
- Dan Wang, Phillip W. L. Tai, Guangping Gao. (2019). Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18, 358-378;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Rupert R A Bourne, Seth R Flaxman, Tasanee Braithwaite, Maria V Cicinelli, Aditi Das, et. al.. (2017). Magnitude, temporal trends, and projections of the global prevalence of blindness and distance and near vision impairment: a systematic review and meta-analysis. The Lancet Global Health. 5, e888-e897;
- Генная терапия против рака;
- Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Katherine A. High, Maria G. Roncarolo. (2019). Gene Therapy. N Engl J Med. 381, 455-464;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Michael H. Berry, Amy Holt, Autoosa Salari, Julia Veit, Meike Visel, et. al.. (2019). Restoration of high-sensitivity and adapting vision with a cone opsin. Nat Commun. 10;
- Ziccardi, Cordeddu, Gaddini, Matteucci, Parravano, et. al.. (2019). Gene Therapy in Retinal Dystrophies. IJMS. 20, 5722;
- Steven D Schwartz, Carl D Regillo, Byron L Lam, Dean Eliott, Philip J Rosenfeld, et. al.. (2015). Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. The Lancet. 385, 509-516;
- Kenneth I. Berns. (1974). Molecular Biology of the Adeno-Associated Viruses. Modern Aspects of Electrochemistry. 1-20;
- Manuel AFV Gonçalves. (2005). Adeno-associated virus: from defective virus to effective vector. Virol J. 2, 43;
- Candace Summerford, Richard Jude Samulski. (1998). Membrane-Associated Heparan Sulfate Proteoglycan Is a Receptor for Adeno-Associated Virus Type 2 Virions. J. Virol.. 72, 1438-1445;
- Juliana L. Dreyfuss, Caio V. Regatieri, Thais R. Jarrouge, Renan P. Cavalheiro, Lucia O. Sampaio, Helena B. Nader. (2009). Heparan sulfate proteoglycans: structure, protein interactions and cell signaling. An. Acad. Bras. Ciênc.. 81, 409-429;
- F. Sonntag, K. Kother, K. Schmidt, M. Weghofer, C. Raupp, et. al.. (2011). The Assembly-Activating Protein Promotes Capsid Assembly of Different Adeno-Associated Virus Serotypes. Journal of Virology. 85, 12686-12697;
- Steven D Schwartz, Carl D Regillo, Byron L Lam, Dean Eliott, Philip J Rosenfeld, et. al.. (2015). Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. The Lancet. 385, 509-516.