Цвет, 3D и сверхвысокое разрешение: новая разработка в микроскопии
30 марта 2020
Цвет, 3D и сверхвысокое разрешение: новая разработка в микроскопии
- 2393
- 0
- 5
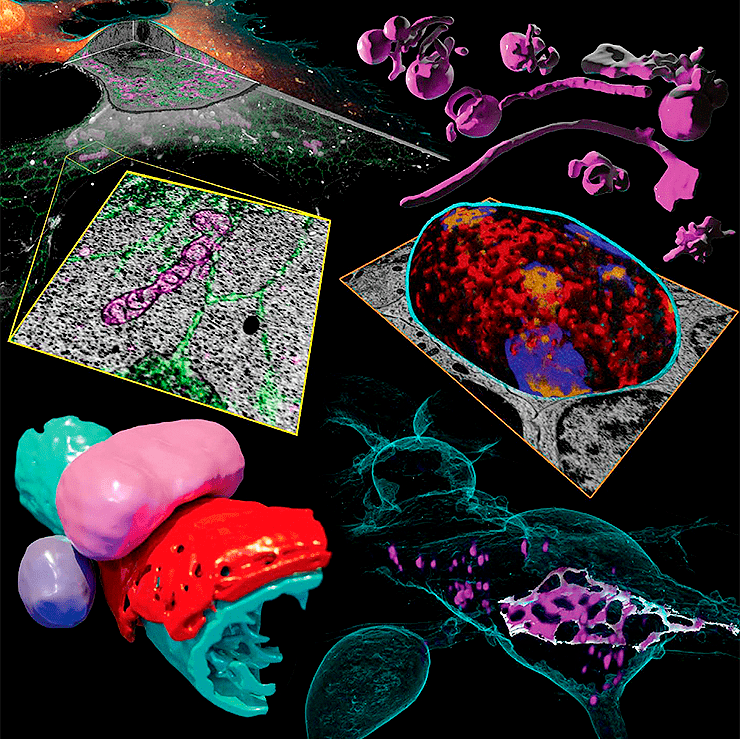
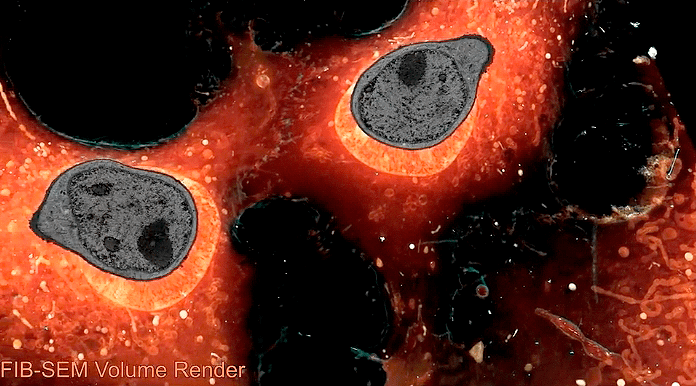
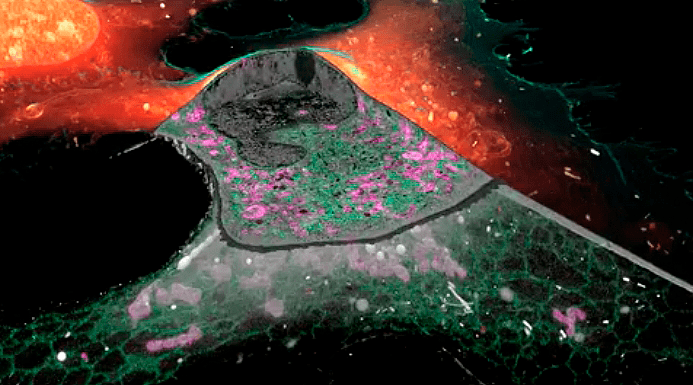
Заглавная иллюстрация из обсуждаемой статьи — коллаж из изображений, полученных авторами при помощи новой методики. По часовой стрелке, начиная с верхнего левого угла:
- срез клетки в 3D и его фрагмент;
- эндосомы и лизосомы различной морфологии;
- домены гетерохроматина, «подсвеченные» маркерами активности генов;
- структура межклеточного контакта между нейронами, напоминающая пчелиные соты;
- пероксисома прилегает к эндоплазматическому ретикулуму и митохондрии.
-
Автор
-
Редакторы
Недавно научный и околонаучный мир «взорвало» видео со сверхдетальным цветным трехмерным изображением межклеточных контактов в развивающихся нейронах. Такие контакты позволяют нейронам в процессе развития находить друг друга и организовываться в сети, благодаря которым мы испытываем радость, сочиняем стихи... или занимаемся наукой! В журнале Science ученые описали технологию получения таких изображений: как водится, в основу лег синтез. Исследователи соединили две самые передовые методики с помощью компьютерных технологий.
— Пусть они думают до утра. Пойдем к нам во двор.
У нас там все совсем другое. Будем гонять мяч,
настоящий, круглый, а не плоский.
И кошки у нас пушистые и мягкие.
<...>
— Я очень хочу играть в круглый мяч, — вздохнула
Анка. — Я очень хочу погладить пушистую кошку.
Но я не понимаю, что такое «круглый».
Наверное, я никогда не смогу увидеть круглое и пушистое!
Е. Велтистов. Приключения Электроника
Введение
Все, кто когда-нибудь смотрел в обычный световой микроскоп, представляют себе эту картину: клетки выглядят плоскими, их можно рассмотреть лишь в общих чертах. Не видно митохондрий и лизосом, знакомых из школьных учебников, и даже деление клетки выглядит как череда размытых пятен и нитей (рис. 1).
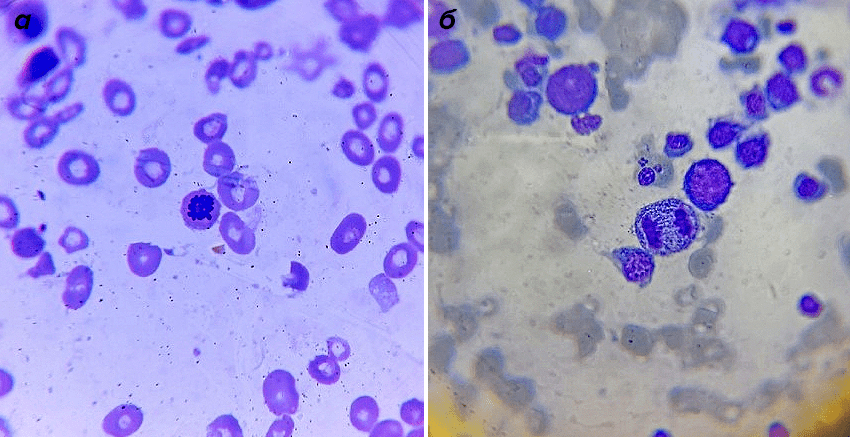
Рисунок 1. Клетка костного мозга в профазе (а) и анафазе (б) митоза. Фотографии сделаны под световым микроскопом. Клетки человека сами прозрачны, цвета придают красители, которыми окрашен препарат.
собственное фото автора статьи
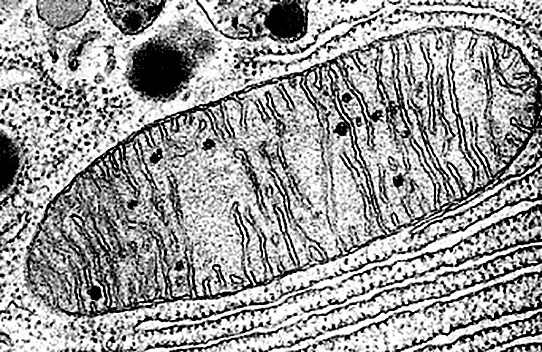
Электронная микроскопия позволяет рассмотреть куда более мелкие структуры... но при этом изображение всегда черно-белое (рис. 2а и 2б), иногда попадаются лишь искусственно раскрашенные картинки (рис. 2в).
А авторы недавно вышедшей статьи в Science представили научному миру потрясающую детализацию в цвете и 3D-формате [1]. Примеры их изображений можно увидеть на заглавной иллюстрации. Кстати, вот то самое видео — на нем можно в полной мере насладиться 3D-HD-микромиром:
Видео 1. Зернистые клетки мозжечка мыши, изображение которых получено с помощью новой методики. Вслед за авторами статьи заглядываем внутрь клеток и рассматриваем структуру контакта между ними – в цвете! Каждый цвет соответствует определенному белку.
Разработать такую технологию было совсем не просто — на пути у исследователей стояли фундаментальные физические ограничения. Обмануть физику стало возможно путем соединения в одной методике сразу нескольких передовых разработок, за две из которых даже была получена Нобелевская премия: в 2014 [2] и 2017 году [3].
Скучный черно-белый мир
Но почему так сложно? Почему нельзя просто увеличить изображение в обычном микроскопе с помощью очень сильных линз, чтобы разглядеть все до молекулы? Это невозможно в силу законов распространения света: в световом микроскопе любые две точки на расстоянии менее 0,2 мкм будут сливаться в одну. Такое ограничение и называется дифракционным пределом (физика этого явления рассмотрена в статье «12 методов в картинках: микроскопия» [4]).
Если использовать поток электронов вместо луча фотонов, то дифракционный предел будет намного меньше: на этом и основана электронная микроскопия. Но и она не панацея: слишком высоки требования к подготовке образца. Для электронного луча нужен вакуум, а значит, в вакууме должен быть и образец. А в вакууме вода вскипает при комнатной температуре (снова неумолимая физика!). Это означало бы моментальное разрушение образца — ведь цитоплазма клеток и содержимое органелл состоит большей частью из воды...
Чтобы этого избежать, для электронной микроскопии образцы обезвоживают, помещают в смолу и окрашивают... тяжелыми металлами! Да, я забыл сказать, что любые красители из нашего «фотонного» мира в «электронном» свете будут абсолютно блеклыми или вовсе прозрачными. Поэтому остаются только тяжелые металлы. И, раз «краска» только одна, то и картинка получается монохромной. И вдобавок сильно искаженной обезвоживанием и тяжелыми металлами. Серый скучный безжизненный мир.
Чтобы избежать искажений, был придуман метод криоэлектронной микроскопии [3], [5], за который в 2017 году вручили Нобелевскую премию по химии. Чтобы внутриклеточная вода не испарилась, ее замораживают. А чтобы получившиеся при заморозке кристаллы льда не разорвали мембраны, заморозку проводят очень быстро — так резко, что молекулы воды не успевают «построиться». Каждая молекула «замирает» на своем месте, и получается твердое, но некристаллическое вещество. Такое агрегатное состояние в физике называют аморфным — это нечто среднее между жидкостью и твердым телом. А замороженную таким образом воду называют аморфным льдом. А так как самое известное аморфное вещество нашего «обыденного» мира — стекло, то второе название такого состояния — стеклообразный лед (забегая вперед: именно его имели ввиду авторы обсуждаемой статьи [1], говоря о vitreously frozen cells — «стеклообразно замороженных клетках»).
А еще «остекление» внутриклеточной воды используют для консервации эмбрионов — об этом читайте в статье «Витрификация — контролируемая пауза развития в стеклоподобном состоянии» [6].
Но, как ни замораживай, изображение останется серым. А в современной молекулярной биологии, наоборот, все больше нужны «цветные» методики: она все активнее использует флуоресцентные красители. Таких красителей существует огромное множество: от зеленого флуоресцентного белка [7], за открытие которого тоже была вручена Нобелевская премия по химии, до «флуоресцентных репортеров» [8]. А флуоресцентные красители требуют световой микроскопии и цветного изображения.
Мир цветной... но все же скучный
А что, если совместить в одном изображении два вида микроскопии — световую и электронную? Получится коррелятивная свето-электронная микроскопия, или КСЭМ (correlative light-electron microscory, CLEM). В таком случае одни и те же структуры вначале фотографируются в световом и электронном микроскопах, а затем изображения совмещаются с помощью компьютера. Здесь мы вступаем в «продвинутую» микроскопию, когда сами не смотрим в окуляр микроскопа — изображение формируется методами компьютерной обработки данных.
Но при всей своей красоте метод полностью проблемы не решает — он лишь окрашивает детализированные структуры размытой «радугой», отражающей распределение флуоресцентной метки (рис. 3) [9]. Это позволяет изучить молекулярные особенности на уровне области клетки, но не специфично «подсветить» микроструктуры. Мир по-прежнему серый. Просто на него пролили полупрозрачную краску.

Рисунок 3. Коррелятивная свето-электронная микроскопия. На левом изображении — одноцветное фото элементов цитосклетета, на которое наложена цветовая «шкала» натяжения белка талина (сам белок при этом не виден в таком масштабе). На изображении справа внизу, где увеличение больше, цвета вновь исчезают. Таким образом, максимум, на что способна обычная КСЭМ, — изобразить в цветовой «кодировке» какую-либо величину, но она не придает изображению истинную цветность.
Тем не менее авторы статьи в Science взяли на вооружение именно идею коррелятивной микроскопии: совмещения двух видов микроскопии в одном изображении с помощью компьютера [1]. Просто «световое» изображение у них изначально было со сверхвысоким разрешением. Как же они его получили? С помощью тех же компьютеров!
Структурируем свет и зажигаем одиночные молекулы
Сфотографировать клетку с разрешением выше дифракционного предела нельзя. Но можно, используя различные ухищрения, «собрать» на экране компьютера одно изображение из множества снимков, получив гораздо большее разрешение. Такой подход называется микроскопией сверхвысокого разрешения, или СР-микроскопией (super-resolution microscopy, SR-microscopy). А конкретных методик довольно много — краткий их обзор представлен в статье «Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения» [10]. Так что на выбор у авторов обсуждаемой статьи было несколько «прототипов».
Первый из них — микроскопия структурированного освещения (structured illumination microscopy, SIM). В ней образец окрашивается флуоресцентным красителем. Но возбуждающий свет фокусируется таким образом, чтобы в фокусе микроскопа получилась тонкая решетка из света. Она постоянно перемещается, и флуоресценция молекул, находящихся в фокусе, меняется. Объект не в фокусе продолжают светиться равномерно, что позволяет компьютерному алгоритму вычислить и «отсечь» его. Остается большой набор данных об изменении флуоресценции, по которому рассчитывается изображение с высоким разрешением (рис. 4). К сожалению, такой подход позволяет увеличить разрешение максимум в два раза [10]. Нет ли чего-нибудь еще?
Коллектив исследователей тоже не остановился на SIM и в качестве второй отправной точки воспользовался одномолекулярной микроскопией, или микроскопией локализации одной молекулы (single-molecule localization microscopy, SMLM) [1]. За ее создание в 2014 году вручили Нобелевскую премию [2].
В этой методике флуоресценция красителя запускается слабым лазерным лучом — таким слабым, что лишь малая часть молекул начинает флуоресцировать. Какие именно молекулы засветятся — зависит только от случая, поэтому такой подход в микроскопии сверхвысокого разрешения называется стохастическим. Интенсивность луча подбирается таким образом, чтобы среднее расстояние между одиночными «засветившимися» молекулами было равно дифракционному пределу. Благодаря этому, каждое сфотографированное микроскопом светящееся пятно представляет собой одиночную молекулу (рис. 5а).
Далее компьютер точно вычисляет координаты молекулы, образовавшей каждое пятно, с помощью так называемой функции рассеяния точки (рис. 5б). А тем временем на образец подается другой лазерный луч определенной длины волны, который гасит флуоресценцию молекул. Затем снова включается «зажигающий» лазер. За счет случайности множество молекул, «вспыхнувших» во второй раз, не будет тем же самым (рис. 5в). И после компьютерной обработки появятся новые светящиеся точки (рис. 5г).
Цикл повторяется много раз, и на последнем этапе компьютер складывает все картинки со «светящимися точками». В итоге получается изображение, сложенное отдельными точечными источниками флуоресценции, расстояние между которыми намного меньше 0,2 мкм (рис. 5д). А это и есть сверхвысокое разрешение.
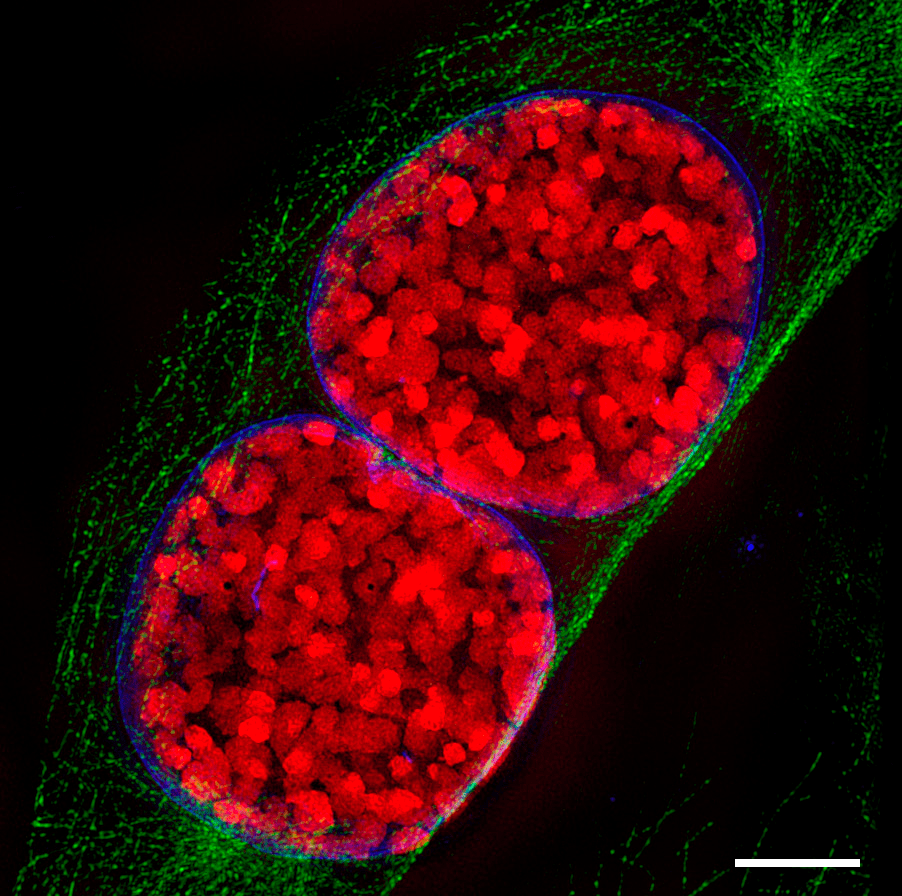
Помимо высокой детализации, еще одно преимущество микроскопии сверхвысокого разрешения (как SIM, так и SMLM) в том, что используемые функции позволяют «вычислить» на компьютере координаты каждой флуоресцирующей молекулы не только на плоскости, но и в пространстве. Поэтому у сверхразрешающей микроскопии есть 3D-модификации. Именно такой «разновидностью» SIM созданы изображения клеток в профазе и телофазе митоза на рисунках 4а и 4б. И именно такие методики использовали авторы статьи в Science [1]. Микромир наконец стал цветным и трехмерным. Что же к этому еще можно добавить?
Он живой и светится! А теперь сотрем его в пыль!
Так как в распоряжении ученых имеются методы с таким высоким разрешением, возникает резонный вопрос: а что, если вернуться к идее коррелятивной микроскопии, только теперь объединять изображения микроскопии высокого разрешения и электронной микроскопии? Именно это сделали авторы статьи в Science — и в этом основная новизна их методики [1]. Они соединили в одной технологии электронную микроскопию и световую 3D-микроскопию высокого разрешения.
Проблема в том, что классическая электронная микроскопия дает плоское изображение (сканирующая дает перспективное, но не может заглянуть внутрь объекта). Поэтому авторам статьи пришлось искать трехмерную методику электронной микроскопии.
К счастью, такая тоже существует и называется ФИЛ-СЭМ (англ. FIB-SEM) — сканирующая электронная микроскопия с фокусированным ионным лучом. К сожалению, она относится к деструктивным видам анализа — то есть при ее проведении образец разрушается.
Вначале образец бомбардируется направленным пучком ионов, снимающим с него верхний слой. Обнажившаяся поверхность подвергается обычной сканирующей электронной микроскопии и получается срез клетки. Затем ионным лучом «снимается» еще один слой, и сканируется следующий срез. Цикл повторяется много раз, и в итоге — снова компьютерная обработка: компьютер объединяет все полученные срезы в одну трехмерную модель клетки. Это все, что от нее осталось — к концу опыта ионный луч буквально стирает образец в пыль (рис. 6, 7).

Рисунок 6. Принцип микроскопии сверхвысокого разрешения ФИЛ-СЭМ. Клетка помещается в блок из смолы, «лишние» части которого удаляются. Затем фокусированный ионный луч (ФИЛ) снимает с образца слой за слоем, а каждый срез фотографируется сканирующим электронными микроскопом (СЭМ). Получаются черно-белые срезы клетки в большом количестве (на рисунке их приведено 5, но в реальной микроскопии гораздо больше). Затем срезы объединяются на компьютере в одно трехмерное изображение — получается объемная, но, к сожалению, одноцветная модель. Мир приобрел объем, но он пока что черно-белый.
рисунок автора статьи с использованием фото EONexperience
Разрушение образца ионным лучом при исследовании методом ФИЛ-СЭМ, само собой, лишает способности рассмотреть его методами высокого разрешения. Клетка, которую стерли в молекулярную пыль, не может выглядеть как живая и светиться. Поэтому исследователи сначала рассматривали образец методами СР-микроскопии, а потом использовали методику ФИЛ-СЭМ. Получались трехмерные модели, которые впоследствии с помощью компьютера объединялись в одну.
Такая технология, как отмечают исследователи, позволяет убить сразу еще одного «зайца» — справиться с проблемой искажения структур клетки при фиксации образца в смоле и окраске тяжелыми металлами. На самом деле: если флуоресцентную методику провести сначала, дальше над образцом можно уже «издеваться» как угодно.
В методику СР-микроскопии авторы тоже внесли усовершенствования. Обычно для замораживания образца в СР-микроскопии используется жидкий азот, где уверенно достигается температура лишь около 77 градусов выше абсолютного нуля температуры (77 K, или около −196 °C). Это адски низкие температуры, но ученые при подготовке образца достигли еще меньших! Они использовали жидкий гелий, который позволил заморозить образец до 8 градусов выше абсолютного нуля (−265 °C) и даже до более низких температур. Таким образом клетки были моментально заморожены до состояния аморфного льда, находившегося почти у самого предела холода.
При таких условиях физика (наконец-то!) сыграла на руку исследователям. В этом адском холоде среднее время пребывания флуоресцентного красителя в «погашенном» состоянии существенно выше, чем при −196 °C, что позволяет располагать молекулы флуорофора ближе друг к другу. Поэтому у авторов «светящиеся точки» на реконструируемом изображении были ближе, и само изображение получалось детальнее и контрастнее (рис. 8).

Рисунок 8. Те же клетки, что и на рисунках 7а и 7б, и на видео во введении, только изображение получено одномолекулярной микроскопией (SMLM). Зеленый флуорофор (ER3) окрашивает эндоплазматический ретикулум (ЭПР) — сеть канальцев внутри клетки. На рисунке хорошо видно, насколько он разветвлен и как плотно заполняет всю клетку. Ядра зеленые, потому что межмембранное пространство ядра — по сути, начало ЭПР. Фиолетовый флуорофор (TOMM20) окрашивает митохондрии, и большинство фиолетовых «колбасок» в клетках среди зеленых разветвлений ЭПР — это именно они. Но — сюрприз — исследователи обнаружили, что этот «митохондриальный» краситель окрасил не только их. Об этом — чуть ниже.
кадр видео из [1]
Следует отметить, что авторы также использовали два типа микроскопии сверхвысокого разрешения — SIM и SMLM. В общем, основательно подготовились к покорению дифракционного барьера. На последней стадии, как и в любой корреляционной микроскопии, трехмерные изображения клеток из ФИЛ-СЭМ и SMLM/SIM совмещались с помощью компьютерной техники. В итоге получилось трехмерное изображение, одновременно и детализированное, и цветное. Микромир наконец стал объемным и ярким (рис. 9).
Но что способна дать миру новая микроскопия, помимо объема и яркости? Что нового увидели исследователи в свой микроскоп? Спойлер: им удалось сделать сразу три небольших открытия в ультраструктуре клетки — и это только начало!
Пузырьки, трубочки и красители не на своем месте
Эукариотические клетки, в том числе клетки человека и животных, изобилуют различными мембранными структурами — везикулами и сетью ЭПР, и это не считая митохондрий и пластид. Примером того, как они пронизывают всю клетку, могут послужить рисунки 8, 9а и 9б. И именно их труднее всего рассмотреть под микроскопом. В «серой и безжизненной» электронной микроскопии они могут быть недостаточно контрастны, а при криоэлектронной томографии (метод аналогичен компьютерной томографии для человека, только здесь томография делается клетке в просвечивающем электронном микроскопе) могут быть пропущены, оказавшись между срезами. Особенно это касается везикул (пузырьков) небольшого объема — поэтому мы сейчас не так много знаем об их форме, размерах и разновидностях.
Новый метод микроскопии позволил рассмотреть эти структуры как никогда ранее детально. Оказалось, что мелкие трубочки ЭПР усеяны вздутиями-пузырьками, которые раньше увидеть было затруднительно. Но это еще не самое интересное...
Для рассмотрения мембранных структур внутри клетки исследователи пользовались теми же двумя светящимися красителями, как для клетки целиком — ER3 для эндоплазматического ретикулума и TOMM20 для митохондрий. Сюрпризом стало обнаружение внутри ядра клетки везикул, которые окрашиваются ER3 (рис. 10). Откуда они там, если эндоплазматический ретикулум находится в цитоплазме и уж точно не внутри ядра? Ученые предположили, что эти везикулы происходят из эндоплазматического ретикулума, попадая в ядро во время митоза, когда ядерная оболочка временно распадается.

Рисунок 10. Так выглядит ER3-позитивная везикула в ядре — ярким зеленым пятном. Не очень четко, но загадочно: откуда она там взялась?
кадр видео из [1]
Краситель TOMM20, как оказалось, тоже окрашивал не только митохондрии, но и какие-то пузырьки в цитоплазме (рис. 11). Исследователи резонно предположили, что эти пузырьки — везикулы митохондриального происхождения (mitochondria-derived vesicles, MDVs). Об их функции пока мало что известно, но есть предположения, что они участвуют в «контроле качества» белков митохондрии, транспортируя поврежденные и ошибочно свернутые в эндосомы — к местам расщепления. Правда, неясно, почему другие белки они несут в пероксисомы... [13] Так или иначе, с новой методикой их стало гораздо легче изучать и рассматривать. Обсуждаемая статья напомнила, что в клетке больше, чем три вида везикул (эндосомы, лизосомы, пероксисомы), и мы еще не всё знаем о мире пузырьков и трубок, пронизывающих каждую клетку.

Рисунок 11. В цитоплазме клетки обнаружены пузырьки, которые окрашиваются красителем для митохондрий. Вопрос — что они там делают? Возможно, они уносят из митохондрий поврежденные белки на утилизацию. Так сказать, вывоз митохондриального мусора.
кадр видео из [1]
Еще авторы показали, что и хорошо известные нам везикулы — вовсе не скучные шарики. Шариками являются лишь небольшие пузырьки — и то лишь за счет поверхностного натяжения. А при увеличении размера они могут принимать причудливые формы. Пероксисомы в виде чашек, блюдец и полых сфер с отверстием, вытянутые эндосомы с расширением (рис. 12). Пока можно лишь предполагать, зачем клетке весь этот «сервиз». Например, изменчивость формы может пригодиться для регуляции скорости реакций, которые проходят в этих пузырьках, но как именно это происходит? С помощью своей технологии исследователи сформулировали несколько загадок для научного мира.
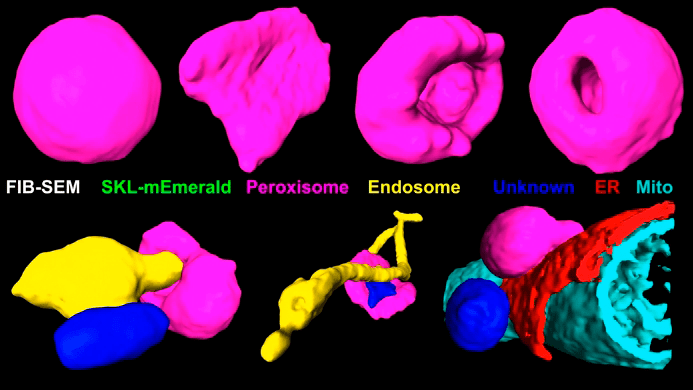
Рисунок 12. Варианты форм пероксисом и эндосом. Розовым обозначены пероксисомы, желтым — эндосомы, красным — эндоплазматический ретикулум, изумрудно-голубым — митохондрии, синим — неизвестные органеллы (да, исследователям и такие попались!).
кадр видео из [1]
Нейроны: идем на контакт!
С помощью новой методики исследователи рассмотрели некоторые детали зернистых нейронов мозжечка мыши и их клеток-предшественников. Зернистые клетки расположены в коре мозжечка, являясь участницами сложной нейронной сети для обработки сигналов о положении и равновесии и двигательного научения. Они являются самыми многочисленными в коре мозжечка.
В процессе созревания нейроны преодолевают огромные по меркам мозга расстояния, но безошибочно находят свое место, «подключаются» к нейронным сетям, учатся реагировать на входные сигналы, «взрослеют» и послушно умирают, если оказались лишними. Безошибочно найти свое место им помогают межклеточные контакты друг с другом, а процесс созревания сопряжен с изменением структуры хроматина в ядре. Эти две структуры и изучили исследователи.
Существует несколько видов межклеточных контактов. Здесь ученые рассматривали тот, который называется плотным соединением — участки мембран соседних клеток, крепко сшитых друг с другом определенными белками. Сюрпризом для ученых оказалось то, что мембраны нейронов сшиваются не на всем протяжении — плотные контакты образуют структуру, напоминающую паутину или швейцарский сыр [1], [14]. Такой причудливый рисунок прекрасно виден как с помощью методики крио-SIM, так и с помощью FIB-SEM, и становится еще более впечатляющим при совмещении изображений (рис. 13).

Рисунок 13. Слева — не полярное сияние, а справа — не сыр. Это все «сшивки» между мембранами соседних нейронов, изображенные в разном «свете»: слева SIM, где разными цветами помечены белки межклеточных контактов, а справа FIB-SEM.
кадр видео из [1]
Нейроны: «детский» и «взрослый» хроматин
Рассмотрев эту мембранную «вышивку» из белков межклеточного контакта, ученые заглянули в ядро этих же самых нейронов и их клеток-предшественников, незрелых форм. Новая технология предоставила потрясающую возможность рассмотреть в деталях хроматин клетки (современные представления об устройстве хроматина можно почерпнуть в статье «Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра» [15]).
Можно предположить, что при созревании нейрона меняется набор генов, которые он «считывает» и делает по ним белки (это называется экспрессией генов). Одни гены «запаковываются» плотнее и делаются неактивными, а другие, наоборот, «разматываются» и начинают активно функционировать.
Вначале авторы получили трехмерное изображение хроматина нейронов методом ФИЛ-СЭМ. Но само по себе оно мало что дает: в таком варианте хроматин выглядит как серая каша (эухроматин) с комками (гетерохроматин). Единственное различие между нейронами-«малышами» и «взрослыми» нейронами, которое заметили авторы на таких изображениях, в том, что у «взрослого» хроматин более «жидкий»: эухроматина больше.
Но микроскопия сверхвысокого разрешения позволила авторам изучить распределение в этой «каше» двух важных белков хроматина — гетерохроматинового белка 1α (HP1α) и гистона H3.3 (который является ни чем иным, как вариантом гистона H3, составной части нуклеосомной «катушки»). Первый из них обычно обнаруживается в составе гетерохроматина (плотно упакованных неактивных частей ДНК), а второй — наоборот, присутствует в регионах, где с ДНК происходит активное «считывание».
Технология обеспечила потрясающе детальный моментальный снимок состояния ядра нейрона до и после дифференцировки.
Когда хроматин обрел цвет, оказалось, что он значительно различается у молодых и зрелых нейронов. В «черно-белом мире» два этих типа клеток не особо отличались друг от друга по количеству гетерохроматина в ядрах. Но «в цвете» стало заметно, что в процессе созревания нейрона количество гетерохроматина, содержащего HP1α, увеличивается почти вдвое (рис. 14, 15). Кроме того, этот гетерохроматин стал гораздо более компактным.

Рисунок 14. Срез ядер нейронов при микроскопии сверхвысокого разрешения. Слева — ядро клетки-предшественника зернистых клеток мозжечка в форме сердца. Справа — ядро зрелой зернистой клетки мозжечка (округлое). Розовым окрашен гистон H3.3, зеленым — белок HP1α. Заметно различное распределение этих двух маркеров в молодых и зрелых клетках.
кадр видео из [1]

Рисунок 15. Трехмерные модели ядер нейронов, полученные при коррелятивной микроскопии. Цветная масса внутри каждой из них представляет собой эу- или гетерохроматин, меченый одним из маркеров. Слева — ядра клеток-предшественников (в виде сердца), справа — округлые ядра зрелых клеток. Обратите внимание на:
- Модели зеленого цвета, справа вверху. На них показан гетерохроматин, содержащий HP1α. В зрелых клетках его гораздо больше (примерно вдвое).
- Модели красного цвета, изображающие гетерохроматин, содержащий гистон H3.3. В зрелой клетке его тоже больше и расположен он гуще. Это вызвало удивление исследователей и новые вопросы — ведь гистон H3.3 характерен для активно транскрибируемой ДНК. Зачем его так много в гетерохроматине, да еще в зрелом нейроне?
кадр видео из [1]
Накопление HP1α в гетерохроматине — это еще классика жанра. Ведь, как я писал выше, HP1α — характерный для неактивного хроматина компонент. Но микроскопия сверхвысокого разрешения показала также... накопление гистона H3.3 в процессе созревания, что было неожиданным для исследователей. Этот гистон характерен для активно транскрибируемых («считываемых») участков ДНК. В гетерохроматине его до этого находили лишь в эмбриональных стволовых клетках, что понятно — они готовы к активации почти любого участка ДНК. Но в зрелых клетках, да еще в нейронах? Тем не менее он не только накапливается, но и, как классический HP1α-гетерохроматин, становится более компактным. Давая исследователям понять, что об укладке мы знаем еще далеко не все.
Заключение
Новый метод микроскопии оказался технически удачным: впервые мельчайшие детали строения и развития клеток предстали перед исследователями в цвете, в трехмерном виде, в высоком разрешении. Это то, чего так давно не хватало исследователям — увидеть внутренний мир клетки не плоским и скучным, а «круглым и пушистым».
Но, с другой стороны, увиденное пока принесло не столько ответы, сколько вопросы. Что за пузырьки, красящиеся митохондриальным красителем? Точно ли они происходят из митохондрий? Почему пероксисомы и эндосомы так различаются по форме, а в хроматине при созревании нейрона накапливаются неожиданные белки? Всего три дополнительных «мини-исследования» в статье показали, что наши знания о клетке пока крайне неполны. Это отмечают и сами исследователи:
Еще предстоит проделать так много экспериментов — изучить целый мир где-то там в клетках.
Между строк в статье [1] и пресс-релизе [14] читается удивление исследователей и желание поскорее во всем разобраться. Изучить цветной и объемный мир, о котором мы пока так мало знаем...
Литература
- David P. Hoffman, Gleb Shtengel, C. Shan Xu, Kirby R. Campbell, Melanie Freeman, et. al.. (2020). Correlative three-dimensional super-resolution and block-face electron microscopy of whole vitreously frozen cells. Science. 367, eaaz5357;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Крупные подробности микроскопического мира: Нобелевская премия по химии 2017;
- 12 методов в картинках: микроскопия;
- 12 методов в картинках: структурная биология;
- Витрификация — контролируемая пауза развития в стеклоподобном состоянии;
- Флуоресцирующая Нобелевская премия по химии;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Abhishek Kumar, Karen L. Anderson, Mark F. Swift, Dorit Hanein, Niels Volkmann, Martin A. Schwartz. (2018). Local Tension on Talin in Focal Adhesions Correlates with F-Actin Alignment at the Nanometer Scale. Biophysical Journal. 115, 1569-1579;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Я б в биоинформатики пошёл, пусть меня научат!;
- 12 методов в картинках: «сухая» биология;
- Ayumu Sugiura, Gian‐Luca McLelland, Edward A Fon, Heidi M McBride. (2014). A new pathway for mitochondrial quality control: mitochondrial‐derived vesicles. EMBO J. 33, 2142-2156;
- Hughes H. (2020). Microscopy technique reveals cells’ 3-D ultrastructure in new detail. ScienceBulletin;
- Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра.