
Темнота — друг или враг для опухолевой компании?
22 января 2024
Темнота — друг или враг для опухолевой компании?
- 401
- 1
- 3
Предупреждение: изображение переводит читателя на частоту неравнодушия к проблемам онкологии или хронобиологии. Зависит от предпочтений!
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Представьте: вращение нашей планеты вокруг себя и Солнца подчинило живую природу следовать и не перечить законам неживой составляющей природы. Человек в курсе своих ритмичных изменений, привычек и необходимостей. Более того, каждая система организма, каждая клетка тоже знает, когда и что ей лучше включить, чтобы функционировать грамотно. Феноменально! Но есть один недостаток — вывод биологических хронометров из равновесия приводит к нежелательным последствиям. Например, к развитию опухолевых заболеваний. Собственно, о чем сейчас и пойдет речь.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Хронобиология разделяет биоритмы человека в зависимости от многих факторов. Для нас же в данный момент интересна классификация по длине периода — отрезка времени, по окончании которого состояние организма повторяется. Если еще точнее, в этой классификации мы извлекаем циркадные (суточные) ритмы и рассматриваем их ассоциацию с опухолевым процессом. Детальный физиологический механизм функционирования циркадной системы великолепно изложен в ряде статей моих коллег [1–3], поэтому позволю себе вольность не заострять внимание на этом вопросе. Хотя... некоторые моменты все же следует повторить прямо сейчас.
Циркадная система состоит из центрального и периферического звена. Первое расположено в гипоталамусе, в супрахиазматическом ядре, а его функция как главаря заключается в координации периферического отдела, который «разбросан» по всему телу [4]. Упорядочивать наш внутренний мир нужно как минимум для того, чтобы предотвратить негативное (или уловить позитивное) воздействие факторов окружающей среды и наших привычек (рис. 1) [5].
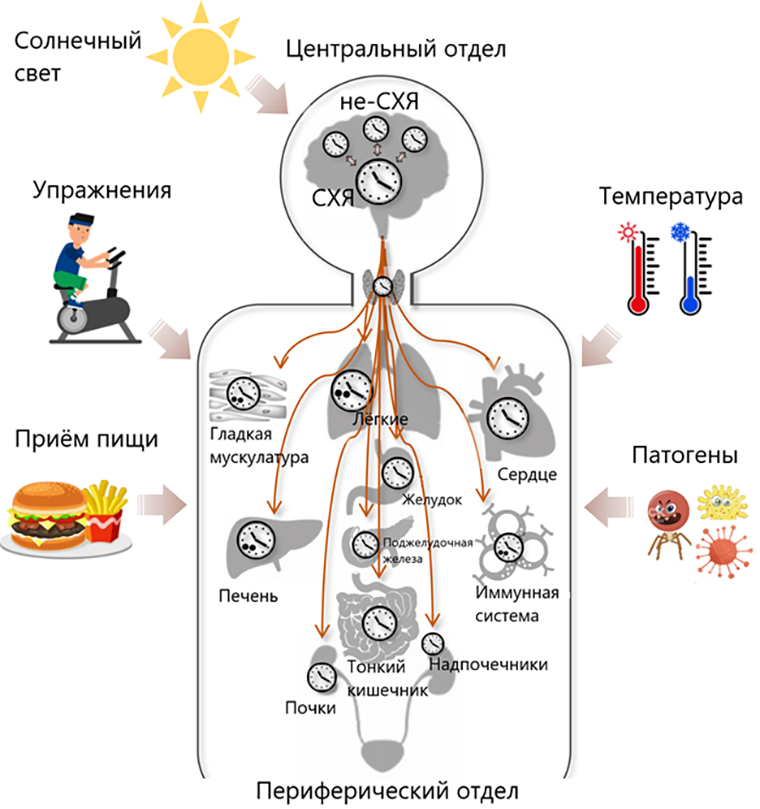
Рисунок 1. Работа циркадной системы. Центральный отдел, зависимый от света, — дирижер оркестра, который дает концерты во всех органах. Дирижерской палочкой служат биологически активные вещества (например, гормоны или нейротрансмиттеры). Более того, он должен подстроиться сам и увлечь за собой всю компанию под воздействие других внешних сигналов (изменение температуры или физические упражнения), что наверняка поможет организму в приспособлении к новым условиям.
СХЯ — супрахиазматическое ядро.
Молекулярная составляющая их обоих практически идентична и формирует, можно сказать, целую фабрику по улавливанию и трансформации света. Генеральным отделом в ней является петля обратной связи транскрипции–трансляции (TTFLs). Прилежными работниками в этом отделе являются белки с очень витиеватым названием, которые в молекулярно-биологическом простонародье называются BMAL1 и CLOCK. Они работают в тандеме днем, формируя фактор транскрипции, который вызывает на производство негативных (не по характеру!) коллег, или репрессоров — криптохромы CRY1 и CRY2 и белки PER, которые работают в темное время суток. Они останавливают работу комплекса BMAL1-CLOCK, чтобы дать последним право на отдых от бесперебойной работы [6]. Основная транскрипционная петля также регулируется двумя ядерными рецепторами, в бытовом приближении — отделами поменьше по масштабу, но не по значимости, — ROR и REV-ERB α/β, которые регулируют экспрессию BMAL1 и CLOCK. Первый — усиливает, второй — подавляет [7].
Такая дружная команда есть во всех клетках организма. Ее «поклонники» (например, гены клеточного цикла, ДНК-репарации или метаболические гены) беспрекословно следуют своему идолу и подстраивают активность своих продуктов — белков — под длину светового дня (рис. 2).

Рисунок 2. Молекулярные моменты циркадной системы. CCGs — гены, которые контролируются циркадным механизмом. Остальные участники уже известны. Тупиковая стрелочка — угнетение работы, привычная стрелочка — активация, пологий зигзаг — световая волна.
Такая невероятная забота организма о себе позволяет нам быть бодро-производительными днем, в идеале — иметь здоровый крепкий сон ночью, а по жизни идти с искренней улыбкой от осознания, что жизнь прекрасна! Но...
Бывают моменты, когда все идет не по правилам
Итак, память освежили, ключевых игроков ввели. Теперь поговорим вот о чем: что же происходит, когда каким-то образом нарушается привычный механизм в контексте опухолевых заболеваний? Подтолкнуть исследователей к мысли, что на самом деле взаимосвязь циркадных ритмов с опухолевой прогрессией колоссальная, помогла прекрасная наука эпидемиология. Она, вооружившись статистическими методами, выявила весьма интересную закономерность: люди, работающие в ночное время в течение длительного периода, входят в группу риска по гормон-зависимым типам опухоли, в частности, опухолям молочной и предстательной желез [8]. Первоначально основное внимание в отношении сменной работы уделялось взаимосвязи между светом, мелатонином [9] и опухолью. Мелатонин связан с регуляцией антиоксидантной системы, в частности, системы обмена глутатиона (это такой трипептид, который благодаря своим физико-химическим свойствам способен обезвреживать вредные молекулы в организме), что очень важно в контексте опухолевых заболеваний. Искусственное увеличение светового дня, которое совершенно точно сопровождает людей, работающих ночами, вызывает снижение уровня гормона и, соответственно, усиление образования свободных радикалов. Отсюда возникает риск развития опухолей [10]. Сейчас же спектр циркадно-опухолевых изысканий не ограничивается только мелатонином, а включает генетику и даже эпигенетику наряду с классическими биохимией и физиологией. По экспериментам: исследовали медсестер в Норвегии, которые работали в ночную смену. Оказалось, что чем больше смен, тем вероятней развитие опухоли молочной железы. Есть предположение, что при таком режиме работы полностью меняется эпигенетический ландшафт циркадных генов: у когорты женщин из Дании, работающих по ночам (профессия в статье не указана), обнаружили изменения в метилировании генов рецептора эстрогена α, clock и криптохрома 2 [11]. Вот и служи на благо человечеству! На этом грустная нотка продолжается: оказывается, что поздний, после 21:30, прием пищи усиливает риск развития этих же типов опухоли даже у людей, работающих днем [12]. Ну, это так, печальная лирика для тех, кто находит себя в списках «поздних едоков» (рис. 3).

Рисунок 3. Чувство, когда с детства живешь неправильно. Уверена, что «поздние едоки» после прочитанной информации изменились в лице примерно так же. По крайней мере, мое состояние души и ее внешнее проявление — точно!
На основании анамнеза эпидемиологических данных и некоторых экспериментальных результатов в 2007 году Международное агентство по изучению рака, которое в том числе занимается классификацией канцерогенов, дополнило список «Вероятных канцерогенов для человека» (группа 2А) заголовком «Работа в ночное время». Отмечу, что исследований по взаимосвязи этого фактора с риском возникновения опухолей именно у человека пока недостаточно, и сейчас известны лишь немногочисленные механизмы, показанные на мышиных моделях. Дело осложняется тем, что роль и поведение игроков циркадной команды отличается, например, от типа опухоли или от ее стадии. Давайте сделаем скидку, что это направление в науке — пока еще молодое, и неизведанного здесь гораздо больше, чем изведанного.
Кого винить?
На сегодняшний день известно, что циркадные репрессоры являются репрессорами и для начала канцерогенеза. Так, мыши-мутанты по гену mPer2 (его белковый продукт, белок PER2, — один из осцилляторов и репрессоров в циркадной системе), которых подвергли ионизирующему излучению, впоследствии «зарабатывают» опухоль, а метаанализ 36 исследований по разным типам опухоли (рак молочной железы, колоректальный рак, рак желудка, немелкоклеточная карцинома легких, рак яичников и др.) показал, что если экспрессия белков-репрессоров сильно снижена, формируется агрессивный фенотип опухолевых клеток и, соответственно, уменьшается общая выживаемость пациентов [13]. Казалось бы, белки PER — супермены в мире опухолевого процесса, но не стоит слишком радоваться — в микроокружении они, скорее всего, дружат с «плохими героями», иными словами, поддерживают воспаление, характерное для опухоли; формируют резистентность к химиотерапии; обеспечивают сокрытие опухоли от иммунного надзора организма [14]. Вообще, опухолевые клетки — это клетки, любящие и ценящие окружающее их пространство. Оно, это пространство, модифицируется опухолью под свои же нужды так, чтобы она могла «процветать» и метастазировать в еще неповрежденные ткани. Микроокружение состоит из внеклеточного матрикса, в котором расположены клетки иммунной системы, фибробласты и эндотелиальные клетки [15]. И здесь, равно как и в самом эпицентре, весомую роль играет нарушение циркадных ритмов, о котором можно написать целый блок научно-популярных статей. В качестве «затравки» приведу такой пример: исследование от 2020 года показало, что потеря гена Per2 в микроокружении не способствует прогрессии опухоли, а, наоборот, ее подавляет [16]. С белком CRY чуть сложнее — он точно участвует в подавлении роста опухоли, но не всегда: повышенная экспрессия CRY1 в клетках колоректального рака коррелирует с прогрессированием заболевания [17]. Скажу больше: недавно выдвинули предположение, что CRY1 является даже помощником злокачественного перерождения: он участвует в репарации ДНК опухолевых клеток так, чтобы они не подумывали о своей смерти. Также ученые обнаружили, что этот белок усиливает деградацию опухолевого супрессора р53 в клетках рака мочевого пузыря [18]. Вот такие неутешительные новости из рубрики «Молекулярная онкология»!
Роль позитивных циркадных регуляторов, в принципе, вполне однозначна: при нормальной экспрессии они действуют как ингибиторы опухолевого роста. Высокий уровень BMAL1 связан с усиленным патрулированием Т-клеток в опухолевом микроокружении (о котором упоминалось чуть выше) — значимых стражников иммунитета на предмет «чужаков». Это увеличивает выживаемость пациентов при метастатической меланоме [19]. Когда же, например, белка BMAL1 недостаточно, создаются благоприятные условия для опухолевой прогрессии при аденокарциноме поджелудочной железы, колоректальном раке и этой же самой меланоме [20]. Здесь интересным наблюдением является и то, что чрезмерная экспрессия этого белка НЕ приводит к росту опухоли, как мы обычно привыкли читать, а наоборот: чем больше белка, тем меньше возможностей для роста, например, гепатоцеллюлярной карциномы, остеосаркомы и некоторых гематологических опухолей. В данном случае подключаются некоторые механизмы остановки клеточного цикла и р53-зависимого апоптоза [21], [22]. Получается, не всегда хорошего должно быть в меру, иногда можно довольствоваться всем сразу и побольше!
Аналогичная защитная роль и у белка CLOCK. Его уровни изучали на клетках опухоли Вильмса (нефробластома), и оказалось, что, в общем-то, количество матричной РНК гена clock при данном заболевании сопоставимо с таковым в нормальной ткани почки. Видимо, в создании разницы в количестве уже белковых продуктов подключается регуляция на посттранскрипционном уровне [23].
К сожалению, если бы все было так однозначно при всех типах опухоли, люди, наверное, говорили бы «Спасибо!» нашим циркадным героям за то, что не дают опухоли прогрессировать. Но при остром миелоидном лейкозе позитивный комплекс CLOCK-BMAL1 раскрывает свою темную сторону: он поддерживает рост лейкозных стволовых клеток. Небольшая порция статистики: «молчащий» из-за метилирования своего промотора ген Bmal1 встречается в 20% случаев диффузных крупноклеточных лимфом, 33% острых лимфо- и 19% миелоидных лейкозов [24]. Есть сведения, что эти белки также участвуют в прогрессии, например, мезотелиомы плевры, а сверхэкспрессия BMAL1 помогает метастазированию клеток опухоли молочной железы, подготавливая благоприятную для этого процесса среду [25], [26]. Ген Clock также не отстает от своих коллег. Когда белка CLOCK много, он ингибирует работу иммунной системы, чтобы та не препятствовала глиобластоме метастазировать [27]. Возможно, наши циркадные герои не знают, что не всем нужно помогать; что благими намерениями вымощена дорога в ад. И от этого становится как-то особенно грустно — понимать, что добро не всегда влечет добро... Ну, опять мысли не в ту науку помчались, бывает. Продолжаем разговор!
Жить на полную катушку
Циркадные белки служат «эталонами» правильной во времени экспрессии генов метаболического профиля, клеточного цикла или ДНК-репарации. И этим пользуются хитрые опухолевые клетки! Например, они переключаются на анаэробное дыхание, или гликолиз, усиливая синтез гликолитических ферментов, которые в норме разумно подчиняются ритмам клетки. Или они увеличивают пул окисленной формы никотинамидадениндинуклеотида (НАД+) — очень ценного сотрудника, который отвечает за генерацию энергии, регуляцию цикла «сон—бодрствование» и правильной работы молекулярных спасателей от различных повреждений ДНК (рис. 4) [28].
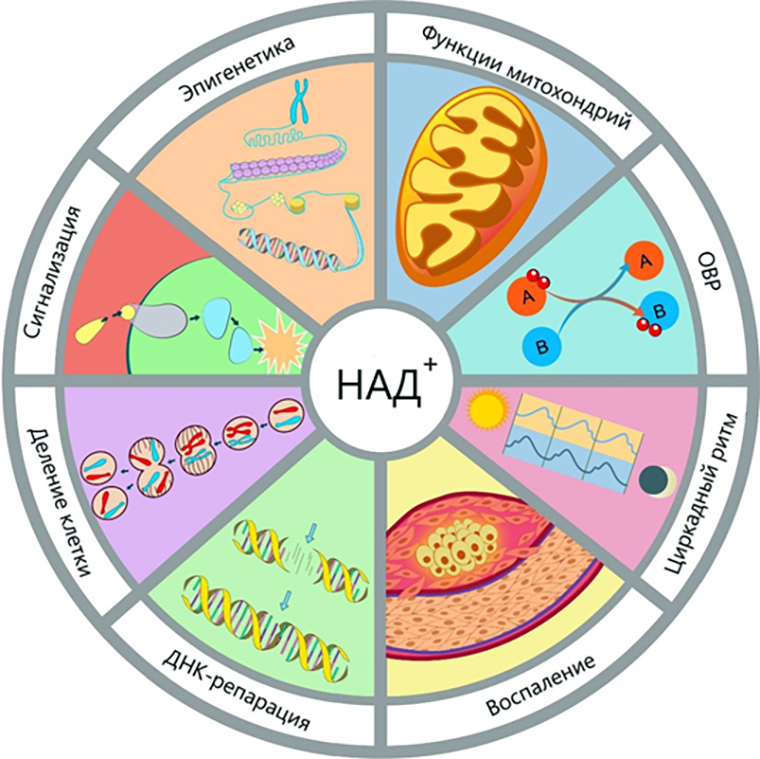
Рисунок 4. Основные функции НАД+. Эта молекула, наводящая страх неподготовленным читателям своим громоздким названием, критически нужна организму для бесчисленного количества процессов. Предлагаю в дань уважения простить ее за причиненные негативные эмоции ввиду ее имени! В конце концов, она его не выбирала.
ОВР — окислительно-восстановительные реакции.
Высокие уровни НАД+ способствуют, опять же, созданию гликолитических условий. Преимущества гликолиза для опухолевых клеток в том, что, во-первых, это быстрый источник энергии. Во-вторых, это закисление окружения, которое является барьером для иммунной системы хозяина. В-третьих, это производство «строительных блоков» для нужд роста, быстрого деления и прогрессирования. При «опухолевом» гликолизе образуется лактат, который закисляет окружающую среду, и пируват. Последний после декарбоксилирования входит в цикл Кребса (тот, где щука съела ацетат) для захвата некоторых соединений в качестве предшественников, например, цитрата для синтеза жирных кислот (рис. 5). Промежуточные продукты гликолиза идут на биохимический путь со звучным названием «пентозофосфатный», который поставляет клетке углеводы для синтеза нуклеотидов.

Рисунок 5. Еще одна прибаутка для цикла Кребса. Не знаю, помогают ли такие вещи действительно что-то запомнить, но оригинально. И красочно.
Чтобы взять от этой жизни все, опухоль активно практикует НАД+-зависимый путь синтеза аминокислоты серина. В одной из реакций гликолиза образуется 3-фосфоглицерат, который под гнетом агрессоров уходит на реакции образования серина. Он является предшественником других аминокислот — глицина, цистеина, метионина и триптофана. Серин также незаменим в метаболизме фолиевой кислоты, транспорте аминокислот, метилировании ДНК и гистонов и окислительно-восстановительном балансе [29].
Этот клеточный узурпатор все нужное обязательно приберет к «рукам»! Остается только позавидовать такой целеустремленности и... мобилизовать все силы для нейтрализации несчастья пациентов!
Как опухоль это делает? Если вы заинтересованы темой старения клетки, то наверняка слышали про семейство белков сиртуинов (SIRTs). Так вот, SIRT1 работает с комплексом CLOCK:BMAL1 и регулирует ритмическую экспрессию (внимание: снова шокирующее название) фермента никотинамидфосфорибозилтрансферазы (NAMPT). Этот фермент фактически синтезирует НАД+ по «пути спасения», или реутилизации азотистых оснований, которые образуются при распаде нуклеиновых кислот, когда по каким-то причинам НАД+ становится мало. Этот фермент является мощным онкогеном, cпособствующим делению и росту опухолевых клеток. Прямая корреляция его экспрессии со степенью злокачественности опухоли показана на глиомах, колоректальном раке и раке желудка [30]. Еще один герой здесь — популярный онкоген Myc, который нарушает экспрессию циркадных генов и стимулирует метаболические пути, приводящие к усиленному потреблению глюкозы и глутамина [31]. Чтобы не быть голословной, расскажу про эксперимент от 2016 года: с помощью модели мышей, у которых активировали онкоген Kras и инактивировали опухолевый репрессор p53, генные инженеры удалили ещt и Bmal1 и скрестили их с этой же линией, у которых Bmal1 остался нетронутым. У мышей с удаленным геном, естественно, нарушался циркадный ритм, но наблюдалось и чрезмерное потребление глюкозы (на анаэробный гликолиз) и глутамина по сравнению с «нормальными» животными. Ученые сделали вывод, что нарушение хронометрического равновесия для опухолевых клеток является необходимым, чтобы поддерживать метаболизм так, как они хотят. Виной тому, скорее всего, то, что BMAL1 и MYC имеют практически идентичный домен, позволяющий им узнавать определенную последовательность в регуляторных областях генов-мишеней. И слишком соблазнительной становится мысль, что во время онкогенеза происходит переключение на передачу сигналов именно от MYC [32]. Но остаются вечные вопросы: почему, зачем и как?
Двоякий финал
Первый тезис: выше были латентно затронуты проблемы метастазирования опухоли, в которых оказались завязаны и циркадные белки. Второй тезис такой: в заключительной главе обычно подводятся итоги повествования, рассматриваются дальнейшие перспективы и нынешние неурядицы. Третий тезис (длинный): хочется миновать привычный устой и рассказать о свежем исследовании, которое меня в свое время очень удивило! В 2022 году в Nature вышла статья, в которой рассказывалось о «сне и бодрствовании» циркулирующих опухолевых клеток (ЦОК). ЦОКи — это гетерогенная популяция клеток опухоли, которая попала в кровяное русло для продвижения к пока еще здоровым органам с целью формирования там метастазов [33]. Исследователи забрали кровь у женщин с опухолью молочной железы разных стадий во время активной фазы (10 утра) и в фазе покоя (4 утра) и обнаружили, что ЦОКи предпочитают выходить в кровоток, когда человек находится в фазе покоя. Чтобы подтвердить свои наблюдения, они проделали опыт на мышиных моделях, которым сдвинули суточный ритм. Вывод один: ЦОКи — «совы» в мире клеток, они очень активны именно ночью, так как преимущественно в темное время суток синтезируются гормоны, необходимые опухоли для усиленного деления и роста этих ЦОКов [34]. Сейчас появляется все больше статей про этот феномен на различных, необязательно гормон-зависимых, типах опухолей. Однако на данном этапе остаются нерешенными вопросы: вовлечен ли сон и/или циркадный ритм в распространение опухоли; если да, то с помощью каких механизмов; и на какой из фаз сна это происходит? Как и всегда: вопросов много, ответов пока недостаточно. Но разве это ли не счастье — находиться в вечном поиске?
Литература
- Тик-так по-шведски. Нобелевская премия за циркадные ритмы;
- Молекулярные часы работают не так, как мы думали;
- Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни;
- Carrie L. Partch, Carla B. Green, Joseph S. Takahashi. (2014). Molecular architecture of the mammalian circadian clock. Trends in Cell Biology. 24, 90-99;
- Yool Lee. (2021). Roles of circadian clocks in cancer pathogenesis and treatment. Exp Mol Med. 53, 1529-1538;
- Wenjing Xuan, Fatima Khan, Charles David James, Amy B. Heimberger, Maciej S. Lesniak, Peiwen Chen. (2021). Circadian regulation of cancer cell and tumor microenvironment crosstalk. Trends in Cell Biology. 31, 940-950;
- Michael W. Greene. (2012). Circadian rhythms and tumor growth. Cancer Letters. 318, 115-123;
- Kyriaki Papantoniou, Gemma Castaño‐Vinyals, Ana Espinosa, Nuria Aragonés, Beatriz Pérez‐Gómez, et. al.. (2015). Night shift work, chronotype and prostate cancer risk in the MCC‐
S pain case‐control study. Intl Journal of Cancer. 137, 1147-1157; - Снова о циркадных ритмах;
- Ya Li, Sha Li, Yue Zhou, Xiao Meng, Jiao-Jiao Zhang, et. al.. (2017). Melatonin for the prevention and treatment of cancer. Oncotarget. 8, 39896-39921;
- E. S. Schernhammer, F. Laden, F. E. Speizer, W. C. Willett, D. J. Hunter, et. al.. (2001). Rotating Night Shifts and Risk of Breast Cancer in Women Participating in the Nurses' Health Study. JNCI Journal of the National Cancer Institute. 93, 1563-1568;
- Bernard Srour, Sabine Plancoulaine, Valentina A Andreeva, Philippine Fassier, Chantal Julia, et. al.. (2018). Circadian nutritional behaviours and cancer risk: New insights from the NutriNet‐santé prospective cohort study: Disclaimers. Intl Journal of Cancer. 143, 2369-2379;
- Jiangguo Zhang, Hong Lv, Mingzhu Ji, Zhimo Wang, Wenqing Wu. (2020). Low circadian clock genes expression in cancers: A meta-analysis of its association with clinicopathological features and prognosis. PLoS ONE. 15, e0233508;
- Yanyan Yang, Laura A. Lindsey-Boltz, Courtney M. Vaughn, Christopher P. Selby, Xuemei Cao, et. al.. (2021). Circadian clock, carcinogenesis, chronochemotherapy connections. Journal of Biological Chemistry. 297, 101068;
- Метастазирование опухолей;
- Lee Shaashua, Shimrit Mayer, Chen Lior, Hagar Lavon, Alexander Novoselsky, Ruth Scherz-Shouval. (2020). Stromal Expression of the Core Clock Gene Period 2 Is Essential for Tumor Initiation and Metastatic Colonization. Front. Cell Dev. Biol.. 8;
- Hongyan Yu, Xiangqi Meng, Jiangxue Wu, Changchuan Pan, Xiaofang Ying, et. al.. (2013). Cryptochrome 1 Overexpression Correlates with Tumor Progression and Poor Prognosis in Patients with Colorectal Cancer. PLoS ONE. 8, e61679;
- Min Jia, Bijia Su, Lijun Mo, Wen Qiu, Jiaxu Ying, et. al.. (2020). Circadian clock protein CRY1 prevents paclitaxel‑induced senescence of bladder cancer cells by promoting p53 degradation. Oncol Rep. 45, 1033-1043;
- Leonardo de Assis, Maria Moraes, Keila Magalhães-Marques, Gabriela Kinker, Sanseray da Silveira Cruz-Machado, Ana de Lauro Castrucci. (2018). Non-Metastatic Cutaneous Melanoma Induces Chronodisruption in Central and Peripheral Circadian Clocks. IJMS. 19, 1065;
- G. Mazzoccoli, A. Panza, M. R. Valvano, O. Palumbo, M. Carella, et. al.. (2011). Clock Gene Expression Levels and Relationship With Clinical and Pathological Features in Colorectal Cancer Patients. Chronobiology International. 28, 841-851;
- Shuju Zhang, Jiaming Zhang, Zhiyuan Deng, Huadie Liu, Wei Mao, et. al.. (2016). Circadian clock components RORα and Bmal1 mediate the anti-proliferative effect of MLN4924 in osteosarcoma cells. Oncotarget. 7, 66087-66099;
- Baharan Fekry, Aleix Ribas-Latre, Corrine Baumgartner, Jonathan R. Deans, Christopher Kwok, et. al.. (2018). Incompatibility of the circadian protein BMAL1 and HNF4α in hepatocellular carcinoma. Nat Commun. 9;
- Munehiro Ohashi, Yasuhiro Umemura, Nobuya Koike, Yoshiki Tsuchiya, Yutaka Inada, et. al.. (2018). Disruption of circadian clockwork in in vivo reprogramming‐induced mouse kidney tumors. Genes to Cells. 23, 60-69;
- Hiroaki Taniguchi, Agustin F. Fernández, Fernando Setién, Santiago Ropero, Esteban Ballestar, et. al.. (2009). Epigenetic Inactivation of the Circadian Clock Gene BMAL1 in Hematologic Malignancies. Cancer Research. 69, 8447-8454;
- Jian Wang, Shujing Li, Xiahui Li, Bowen Li, Yanan Li, et. al.. (2019). Circadian protein BMAL1 promotes breast cancer cell invasion and metastasis by up-regulating matrix metalloproteinase9 expression. Cancer Cell Int. 19;
- Amber Louw, Arash Badiei, Jenette Creaney, Ming S. Chai, Y.C. Gary Lee. (2019). Advances in pathological diagnosis of mesothelioma. Current Opinion in Pulmonary Medicine. 25, 354-361;
- Wenjing Xuan, Wen-Hao Hsu, Fatima Khan, Madeline Dunterman, Lizhi Pang, et. al.. (2022). Circadian Regulator CLOCK Drives Immunosuppression in Glioblastoma. Cancer Immunology Research. 10, 770-784;
- Luis Rajman, Karolina Chwalek, David A. Sinclair. (2018). Therapeutic Potential of NAD-Boosting Molecules: The In Vivo Evidence. Cell Metabolism. 27, 529-547;
- Lola E. Navas, Amancio Carnero. (2021). NAD+ metabolism, stemness, the immune response, and cancer. Sig Transduct Target Ther. 6;
- Selma Masri, Paolo Sassone-Corsi. (2018). The emerging link between cancer, metabolism, and circadian rhythms. Nat Med. 24, 1795-1803;
- Brian J. Altman, Annie L. Hsieh, Arjun Sengupta, Saikumari Y. Krishnanaiah, Zachary E. Stine, et. al.. (2015). MYC Disrupts the Circadian Clock and Metabolism in Cancer Cells. Cell Metabolism. 22, 1009-1019;
- Thales Papagiannakopoulos, Matthew R. Bauer, Shawn M. Davidson, Megan Heimann, Lakshmipriya Subbaraj, et. al.. (2016). Circadian Rhythm Disruption Promotes Lung Tumorigenesis. Cell Metabolism. 24, 324-331;
- Ненахова Ю.Н., Лядов В.К., Поддубная И.В. (2016). Циркулирующие опухолевые клетки: биология, методы выделения, клиническое значение при раке молочной железы. Современная онкология. 18, 76–83;
- Zoi Diamantopoulou, Francesc Castro-Giner, Fabienne Dominique Schwab, Christiane Foerster, Massimo Saini, et. al.. (2022). The metastatic spread of breast cancer accelerates during sleep. Nature. 607, 156-162.







